白藜芦醇通过Ca2+/Caspase-3 途径减轻内质网应激诱导的神经细胞凋亡
成秀梅,杨 雅,魏楚蓉,高红英,肖 凤,李梦军,杨留才*
1江苏医药职业学院基础医学部,江苏 盐城 224005;2井冈山大学医学部神经退行性疾病和衰老研究中心,江西 吉安 343009
内质网是细胞内蛋白质合成、折叠、组装以及钙离子(Ca2+)储存的主要场所,内质网中大量未折叠或错误折叠的蛋白质会导致内质网应激(endoplasmic reticulum stress,ERS),ERS是导致细胞凋亡的一个重要机制。研究显示,ERS 诱导剂毒胡萝卜素(thapsigargin,TG)可引起PC12细胞凋亡[1]。内质网是储存Ca2+并维持细胞钙平衡的重要器官,ERS可使胞浆钙失衡,引起钙超载,是细胞凋亡的重要病理生理因素[2]。钙超载可损伤线粒体功能,释放细胞色素C,从而激活Caspase-3、磷脂酶、蛋白酶和内切酶,引起细胞凋亡[3]。
白藜芦醇(resveratrol,RES)是一种存在于葡萄皮和葡萄酒中的非黄酮类多酚有机化合物,具有抑制血管平滑肌细胞增殖与迁移[4]、抗炎抗凋亡[5]等作用。众多研究报道,RES可通过抗氧化、抗炎对蛛网膜下腔出血发挥神经保护作用[6];通过调节线粒体动态平衡减轻脑缺血再灌注损伤[7];能够以浓度依赖性方式逆转H2O2诱导的Caspase-3表达增加、活性氧(reactive oxygen species,ROS)的产生以及线粒体膜电位(mitochondrial membrane potential,MMP)的降低,从而保护视网膜神经节细胞免受H2O2诱导的凋亡[8];可通过抑制1-甲基-4-苯基吡啶诱导的小鼠海马神经元内ROS升高和钙超载,降低Caspase-3表达和凋亡,表明RES可抑制氧化应激发挥神经保护作用[9]。另外,RES 可抑制乙醇诱导的内质网特征蛋白GRP78 的过表达,表明RES 可抑制ERS[10]。然而,RES 能否通过抑制ERS 诱导的钙超载,阻止Caspase-3 的激活,从而减轻神经细胞凋亡,目前仍未阐明。
1 材料和方法
1.1 材料
TG、BAPTA/AM(Sigma 公司,美国);Fluo-3/AM和胰蛋白酶(Invitrogen 公司,美国);DMEM 和FBS购自GIBCO 公司;β-actin、GRP78 和一抗(Abcam 公司,美国);离子霉素(ionomycin),CCK-8和碘化丙啶(南京碧云天);PC12细胞来自中国科学院培养物保藏中心。
1.2 方法
1.2.1 细胞培养和处理
PC12细胞采用含有10%FBS,100 U/mL青霉素和100 μg/mL 链霉素的DMEM 培养基于37 ℃95%空气和5%CO2混合气体中进行传代培养,构建ERS细胞模型[1],即RES 预处理PC12 细胞24 h 后,用ERS诱导剂(TG,400 nmol/L)处理PC12细胞24 h。
1.2.2 免疫印迹
采用蛋白质定量试剂盒(BCA 法)测定蛋白质浓度,通过10%SDS-聚丙烯酰胺凝胶电泳分离蛋白质,并将其转移到PVDF膜上。用5%脱脂奶粉溶液封闭后,将膜分别与一抗[GRP78(1∶500),β-actin(1∶1 000)]于4 ℃杂交过夜,然后用TBST洗涤2 次,每次15 min,并在室温下与HRP标记的二抗(1∶3 000)孵育1 h,用TBST 洗涤2 次,ECL 显色,使用Bio-Rad成像系统检测蛋白条带。
1.2.3 胞浆Ca2+浓度测定
采用Fluo-3/AM和共聚焦系统测定细胞内游离Ca2+(intracellular free Ca2+,[Ca2+]i)浓度。处理后,将PC12细胞与3 μmol/L Fluo-3/AM孵育50 min,然后用EBSS 洗涤3 次,随机选择3 个视野采用激光共聚焦显微镜拍摄,运用LAS AF 2.5.1.6757 软件分析荧光强度,荧光的强弱表示[Ca2+]i的高低。
1.2.4 Caspase-3活性的测定
PC12 细胞处理后,采用比色法测定Caspase-3的活性[11]。将30 μL 细胞裂解液加入含60 μL 缓冲液的96 孔板中,再将10 μL Caspase-3 催化底物Ac-DEVD-pNA(终浓度为200 μmol/L)。反应混合物37 ℃孵育90 min,并在405 nm处读取吸光度值表示Caspase-3的活性。
1.2.5 凋亡率的检测
采用流式细胞术检测PC12 细胞凋亡率[12]。处理结束后,细胞(1×106)用pH7.4 的PBS 洗涤2 次,2 000 r/min离心5 min。然后将细胞重悬于pH7.4的结合缓冲液中,该缓冲液含有140 mmol/L NaCl、10 mmol/L HEPES和2.5 mmol/L CaCl2,另含50 μg/mL碘化丙啶,常温避光孵育30 min,上机检测。
1.3 统计学方法
2 结果
2.1 RES抑制TG诱导的ERS
为了评估RES对ERS的影响,采用12.5 μmol/L、25.0 μmol/L RES 预处理PC12 细胞24 h 后,再用400 nmol/L TG 处理24 h。采用免疫印迹检测GRP78 蛋白的表达以反映ERS 情况(图1)。TG 处理使PC12 细胞GRP78 蛋白表达升高到对照组的(2.36±0.14)倍(P<0.01),25.0 μmol/L RES 预处理组GRP78 表达为对照组的(1.49 ± 0.58)倍(P<0.05),明显低于TG处理组(P<0.05)。上述结果表明,TG可诱导ERS,25.0 μmol/L RES抑制TG诱导的ERS。

图1 RES抑制ERS诱导PC12细胞GRP 78的过度表达Figure 1 RES inhibited GRP 78 overexpression induced by ERS in PC12 cells
2.2 RES阻止ERS诱导PC12细胞钙超载
为了探讨RES 对ERS 诱导[Ca2+]i变化的影响,用Ca2+荧光探针Fluo-3 和共聚焦系统检测PC12 细胞Fluo-3 荧光值以表示[Ca2+]i(图2)。为评估此系统能否检测出[Ca2+]i的变化,采用离子霉素(一种Ca2+载体)作为阳性对照,结果显示离子霉素处理后,PC12 细胞[Ca2+]i显著升高,表明采用的系统能检测出[Ca2+]i的变化。400 nmol/L TG 处理24 h,PC12细胞Fluo-3荧光值由对照组的48.8 ± 5.8 上升至105.6 ± 10.3(P<0.01),而25.0 μmol/L RES 预处理后,PC12细胞Fluo-3荧光值为74.2±7.2,显著低于TG 组(P<0.01)。上述结果表明,ERS 引起PC12细胞[Ca2+]i升高,而RES抑制ERS诱导的钙超载。
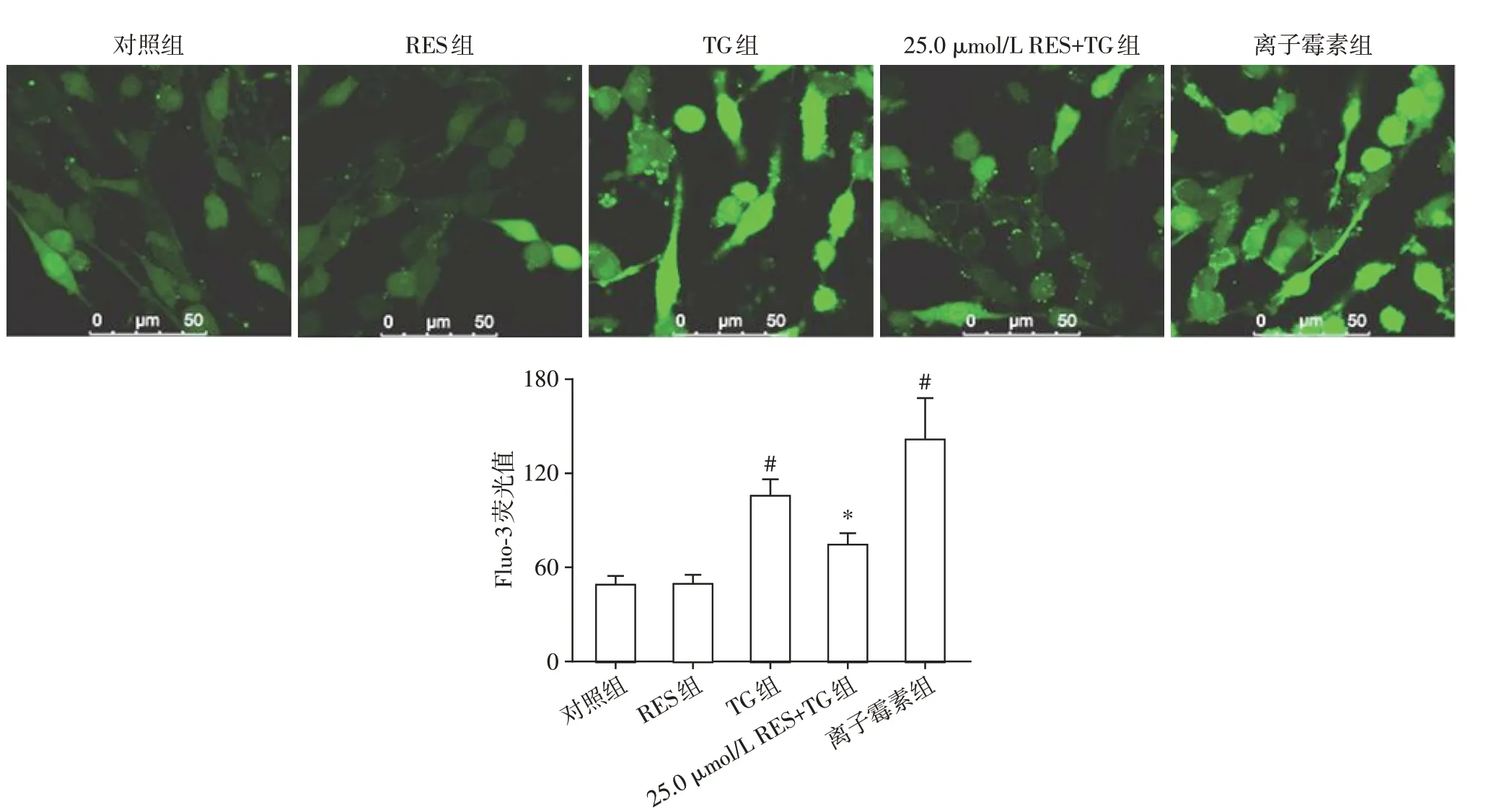
图2 RES对内质网应激诱导[Ca2+]i变化的影响(×630)Figure 2 The effects of RES on the change of[Ca2+]i induced by ERS(×630)
2.3 RES 对ERS 诱导Caspase-3 活化的影响以及钙超载在其中的作用
如图3A 所示,TG 处理使PC12 细胞D(405 nm)由对照组的0.074±0.012 上升至0.199±0.072(P<0.01),RES+TG、DEVD-CHO(阴性对照)+TG 组D(405 nm)分别为0.129 ± 0.024、0.085 ± 0.027,显著低于TG组(P<0.01)。这些结果表明ERS可激活Caspase-3,而RES可以减轻ERS对Caspase-3的激活。
为明确钙超载在ERS诱导Caspase-3活性升高中的作用,在ERS处理之前采用BAPTA(一种Ca2+螯合剂)预处理PC12细胞30 min,结果发现D(405 nm)值由TG 组 的0.234 ± 0.043 降 至0.137 ± 0.029(P<0.01),但仍高于对照组的0.067±0.018(P<0.01,图3B)。结合前面的结果,提示RES 通过抑制ERS 诱导的钙超载减轻Caspase-3的激活。

图3 RES对ERS诱导Caspase-3活化的影响以及钙超载在内质网应激诱导Caspase-3激活中的作用Figure 3 Effects of RES on caspase-3 activity induced by ERS and the role of Ca2+overload in the ERS-induced caspase-3 activation
2.4 RES 对ERS 诱导神经细胞凋亡的影响及钙超载在其中的作用
为了研究RES 对ERS 诱导神经细胞凋亡的影响,采用流式细胞术检测细胞凋亡率。TG 使PC12细胞凋亡率由对照组的(1.31 ± 2.23)%升高至(16.07±11.76)%(P<0.01,n=7),而RES 预处理后PC12细胞的凋亡率下降至(8.65±6.25)%,与TG组相比明显降低(P<0.05,n=7),说明RES 减轻ERS诱导PC12 细胞的凋亡。为进一步明确钙超载是否介导ERS 诱导的细胞凋亡,使用BAPTA 螯合Ca2+,阻止钙超载,结果发现PC12 细胞的凋亡率下降至(9.02± 7.15)%,明显低于TG 组(P<0.05,n=7,图4),提示ERS 通过钙超载导致PC12 细胞凋亡。

图4 RES对内质网诱导神经细胞凋亡的影响以及钙超载在其中的作用Figure 4 Effects of RES on ERS-induced apoptosis and the role of Ca2+overload in the ERS-induced apoptosis
3 讨论
ERS 已被证明参与缺血性脑卒中[13]、糖尿病脑病[14]、阿尔兹海默症[15]等多种疾病引起的神经损伤,可通过触发多种促凋亡机制,对神经细胞产生有害作用,而靶向抑制ERS可有效改善实验性神经损伤[16]。
RES可通过抑制ERS发挥神经保护作用。研究发现,RES 可以减轻ERS 特征蛋白GRP78 基因表达,从而改善小鼠术后认知功能障碍[17];也可以通过抑制ERS,减轻氧化损伤和神经炎症,发挥神经保护作用[18];还可以显著降低实验大鼠神经元GRP78和凋亡蛋白的表达,改善ERS介导的神经元凋亡[19]。本研究为了探究RES 在ERS 诱导神经细胞凋亡中的影响及其机制,采用ERS诱导剂TG处理细胞,构建ERS模型,检测ERS特征蛋白GRP78蛋白的表达以明确ERS 模型是否构建成功。采用400 nmol/L TG处理PC12细胞24 h,GRP78表达明显升高,说明ERS 模型构建成功;采用12.5 μmol/L和25.0 μmol/L RES预处理,发现25.0 μmol/L RES明显抑制TG引起的GRP78高表达,结果表明RES抑制ERS,与文献报道一致。
Ca2+信号通路被认为在凋亡中起着重要作用。研究发现,高糖可诱导心房肌细胞ERS,并上调细胞内和线粒体Ca2+浓度[20]。内质网钙过度转移到线粒体是一种促凋亡信号,对细胞命运有重要影响[21]。ERS时内质网中的Ca2+不仅释放到细胞质中导致胞浆钙超载,还通过线粒体相关内质网膜Ca2+通道流入线粒体,损伤线粒体功能,从而引起细胞能量代谢障碍,导致细胞凋亡,而抑制钙超载可以减轻ERS诱导的细胞凋亡[22]。本研究采用共聚焦和钙荧光探针Fluo-3 检测[Ca2+]i,利用这一系统发现ERS 可引起钙超载,BAPTA 能阻止钙超载,抑制钙超载后细胞凋亡率也明显下降。上述研究表明钙超载介导了ERS 诱导的细胞凋亡,这提供了一个减轻ERS诱导凋亡性细胞损伤的可能方向。另外,Singh等[23]研究发现RES 可以抑制ERS 引起的钙超载。为探讨RES 对ERS 诱导[Ca2+]i变化的影响,本研究采用25.0 μmol/L RES 对TG 处理的PC12 细胞进行干预,结果ERS 引起的钙超载和细胞凋亡都被明显抑制,表明RES 可抑制ERS 诱导的钙超载和细胞凋亡。
在凋亡信号通路中Caspase-3 常常参与激活核酸内切酶的最后阶段,在DNA 片段化中起关键作用。Gong 等[24]研究发现,ERS 激活Caspase-3,诱导细胞凋亡。Gaballah等[25]在评估RES对帕金森大鼠影响的研究中发现,接受RES治疗可抑制ERS诱导Caspase-3活性的升高,发挥神经保护作用。本研究也观察到ERS引起Caspase-3活性升高,而RES逆转这一升高,与文献报道一致。另外,Chen 等[22]研究发现,ERS时内质网Ca2+释放,引起胞浆和线粒体钙超载,通过线粒体释放细胞色素C 和MMP 改变,激活Caspase-3,引起细胞凋亡。Xu 等[26]研究认为,刺梨黄酮类化合物通过调控Bcl-2(Ca2+)/Caspase-3/PARP-1 通路可以发挥抗凋亡作用。但RES 能否通过抑制ERS诱导Ca2+/Caspase-3信号通路的活化,从而减少神经细胞凋亡尚未明确。为此,本研究采用钙离子螯合剂BAPTA 预处理PC12 细胞,阻止钙超载。观察到ERS 诱导的Caspase-3 激活和细胞凋亡被明显抑制,说明RES可通过抑制ERS诱导的钙超载,减轻Caspase-3的激活和细胞凋亡。
综上所述,本研究证实RES抑制ERS诱导的钙超载、Caspase-3激活以及神经细胞凋亡,Ca2+螯合剂BAPTA 明显逆转ERS 诱导的Caspase-3 激活和神经细胞凋亡,表明RES可通过调控Ca2+/Caspase-3途径抑制ERS诱导的神经细胞凋亡,为RES在ERS所致神经损伤中的保护作用提供了理论依据。

