酶解肠膜蛋白粉在珍珠龙胆石斑鱼饲料中的应用
植心妍,杨烜懿,王光辉,赵旭民,迟淑艳,4,谭北平
( 1.广东海洋大学 水产学院,广东 湛江 524088; 2.南方海洋科学与工程广东省实验室,广东 湛江 524013; 3.宜昌华太生物科技有限公司,湖北 宜昌 443500; 4.广东省水产动物精准营养高效饲料工程研究中心,广东 湛江 524088 )
2019年,我国水产品养殖产量达5079.07万t,同比增长1.76%,渔获量1401.29万t,同比下降4.45%[1]。由于近年来养殖业规模的不断扩大和渔获量的骤降,我国对鱼粉的需求量不断攀升,约为150万t[2-3],而鱼粉的价格也在不断上涨。鱼粉具有蛋白质含量高、富含必需氨基酸和必需脂肪酸、抗营养因子少且容易被消化吸收等优点,是水产养殖动物饲料中首选的优质蛋白源[4]。但鱼粉的磷含量较高(1.7%~3.6%)[5],且以磷酸三钙复合物的形式存在,大部分养殖鱼类很难利用[6],致使磷元素随尿液排入养殖水体,影响水体磷元素的循环,加重养殖水体代谢的负担[7]。同时,饲料蛋白源的结构已由传统的鱼粉-豆粕型向多元化原料组成发展,鱼类对饲料中蛋白质的消化能力受到关注,若饲料消化率下降,会导致部分氮元素流失于养殖水体中,且在有机物作用下转换为氨氮,从而加快水体恶化。因此,寻找优质的蛋白源以降低饲料中鱼粉的使用量是当今水产动物营养研究的重要任务之一。
大部分动物蛋白源的蛋白质含量较高,氨基酸含量丰富,抗营养因子较少,且含有一些未知的功能性因子[8],可以促进水产动物的生长发育[9]。如蝇蛆粉替代20%鱼粉对锦鲤(Cyprinuscarpio)的生长具有促进作用[10],南极磷虾粉替代9%鱼粉能够促进大口黑鲈(Micropterussalmoides)的生长[11]。肠膜蛋白粉是一种新型功能营养性动物蛋白原料,源于猪小肠黏膜[12],含有小肽和游离氨基酸,且水溶性较好[13],经过酶解处理后,小肽和游离氨基酸的含量更为丰富,且具有一些特殊功能的生物活性肽,能够对鱼体的健康和生长产生积极的影响[14-15]。
珍珠龙胆石斑鱼(Epinephelusfuscoguttatus♀×E.lanceolatu♂)生长快速,肉质鲜美,抗病力强,营养价值和经济价值高[16]。笔者通过研究酶解肠膜蛋白粉替代鱼粉对珍珠龙胆石斑鱼的生长性能、营养物质表观消化率及养殖水体氨氮的影响,以探究饲料中酶解肠膜蛋白粉替代鱼粉的最适水平,从而为配制珍珠龙胆石斑鱼精准配合饲料提供理论基础。
1 材料与方法
1.1 试验饲料与试验设计
以酶解肠膜蛋白粉分别替代饲料中0%、9%、18%、27%和36%的鱼粉,配制5种等氮等脂的试验饲料。所有原料经粉碎后过60目筛,根据表1精准称取,混合后(V型立式混合机JS-14S型,浙江正泰电器股份有限公司)用双螺杆膨化机(TSE 65,北京现代洋工机械科技发展有限公司)加工成直径为3.0 mm的颗粒状饲料,室内晾干后,密封储存于-20 ℃冰箱中。鱼粉和酶解肠膜蛋白粉的营养成分含量见表2,酶解肠膜蛋白粉的肽分子量分布见图1。
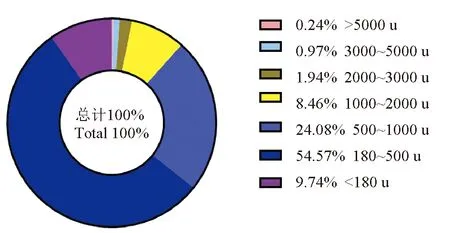
图1 酶解肠膜蛋白粉的肽分子量分布Fig.1 The molecular weight distribution of peptide in powder of enzyme-digested hydrolyzed porcine mucosa

表1 试验饲料的配方和近似组成(干物质) %Tab.1 Ingredient and proximate composition of the experimental diets (dry matter)

表2 鱼粉和酶解肠膜蛋白粉的养分分析(干物质) %Tab.2 Proximate composition of the fish meal and enzyme-digested hydrolyzed porcine mucosa (dry matter)
1.2 试验用鱼与饲养管理
试验用珍珠龙胆石斑鱼幼鱼取自湛江东海岛石斑鱼苗场。养殖试验于湛江海洋高新科技园进行。养殖试验前,将鱼苗在室外的水泥池中暂养且投喂商品饲料(广东粤海饲料集团股份有限公司,粗蛋白质50.0%),养殖14 d后挑选规格一致、健康的珍珠龙胆石斑鱼[(7.50±0.02) g]随机分为5组,每组3个平行,每个平行30尾。每日8:00和16:00投喂试验饲料,养殖周期为8周。试验用水为经过沉淀、砂滤的天然海水,养殖水温(31.2±0.7) ℃,光照周期12 h∶12 h,pH 7.05±0.25,养殖水体的氨氮质量浓度≤2.5 mg/L,溶解氧质量浓度≥5 mg/L。
1.3 样品采集和分析
饲料原料、饲料和粪便中营养成分含量测定参照文献[17]的方法。水分含量测定采用105 ℃烘干恒质量法;粗蛋白质含量的测定采用凯氏定氮法;粗脂肪含量的测定采用索氏抽提法;粗灰分含量的测定采用箱式电阻炉550 ℃灼烧恒质量法。钙和磷含量的测定参考JYT 015—1996《感耦等离子体原子发射光谱方法通则》[18]。
于养殖试验第4周开始收集粪便,直至养殖试验结束。在珍珠龙胆石斑鱼摄食后4 h收集粪便,用滤纸吸干水分并置于50 mL离心管中,保存于-20 ℃的冰箱中备用。粪便冷冻干燥(CHRIST,Alpha 2-4 LDplus,德国)后粉碎并过60目筛,测定粪便养分含量和Y2O3含量(上海微谱化工技术服务有限公司,上海),用于计算饲料干物质表观消化率、粗蛋白质表观消化率、钙表观消化率和磷表观消化率。
于养殖试验第7周第1天,在8:00珍珠龙胆石斑鱼摄食后1、5、9、13、17、21 h用虹吸法,于同一个位置采集水样,密封避光的环境下保存,根据JY/T 015—1996《海洋监测规范》[19]于24 h内测定水体氨氮和亚硝态氮的质量浓度。
养殖试验结束后禁食24 h,称量质量,计算成活率(RS,%)、质量增加率(wWGR,%)、特定生长率(RSG,%/d)、饲料系数(RFC)、蛋白质效率(RPE)和摄食率(RF,%)。
1.4 指标计算
RS=nt/n0×100%
wWGR=(mt-m0)/m0×100%
RSG=(lnmt-lnm0)/t×100%
RFC=mf/(mt-m0)
RPE=(mt-m0)/mfp
RF=md/[t×(m0+mt)/2]×100%
ADCDM=(1-wsy/wfy)×100%
ADCN=(1-wfi/wsi)×(wsy/wfy)×100%
式中,n0为试验鱼初始数量(尾),nt为试验鱼终末数量(尾),m0为初始均质量(g),mt为终末均质量(g),t为饲养天数(d),mf为饲料摄入量(g),mfp为饲料蛋白质摄入量(g),md为饲料摄入干物质量(g),ADCDM为干物质表观消化率(%),ADCN为营养物质表观消化率(%),wsy为饲料中Y2O3的质量分数(%),wfy为粪便中Y2O3的质量分数(%),wfi为粪便中营养物质的质量分数(%),wsi为饲料中营养物质的质量分数(%)。
1.5 数据处理
采用SPSS 22.0软件对试验数据进行单因素方差分析,若有显著性差异(P<0.05)则进行Tukey多重比较。试验数据采用平均值±标准误表示,P<0.05表示差异显著。
2 结 果
2.1 生长性能
本试验中使用的主要替代鱼粉的蛋白源是酶解肠膜蛋白粉,蛋白质含量较高,氨基酸较平衡,其主要优势在于含有较多的小肽。由于采用了酶解等预处理技术,原料中分子质量2000 u以下的小肽占96.85%(图1),有利于动物对原料蛋白质的利用。由表3可见,酶解肠膜蛋白粉替代0%和9%组的质量增加率和特定生长率差异不显著(P>0.05),但是显著高于其他各组(P<0.05)。酶解肠膜蛋白粉替代0%、9%、18%和27%组组间的蛋白质效率和饲料系数差异不显著(P>0.05);酶解肠膜蛋白粉替代36%组蛋白质效率显著低于替代0%和9%组(P<0.05),饲料系数则显著高于替代0%组(P<0.05)。各组摄食率和成活率受饲料影响不显著(P>0.05)。

表3 珍珠龙胆石斑鱼的生长性能Tab.3 Growth performance of hybrid grouper E. fuscoguttatus ♀×E. lanceolatus ♂
2.2 干物质及营养物质表观消化率
随着饲料中酶解肠膜蛋白粉替代水平的上升,珍珠龙胆石斑鱼的干物质表观消化率、粗蛋白质表观消化率、钙表观消化率和磷表观消化率呈下降趋势(表4)。酶解肠膜蛋白粉替代9%、18%、27%和36%组中的干物质表观消化率、粗蛋白质表观消化率、钙表观消化率和磷表观消化率差异不显著(P>0.05),但显著低于替代0%(P<0.05)。酶解肠膜蛋白粉替代18%和27%组的干物质表观消化率间及替代9%和18%组的粗蛋白质表观消化率间差异不显著(P>0.05)。
表4 珍珠龙胆石斑鱼表观消化率 %Tab.4 Apparent digestibility coefficients of hybrid grouper E. fuscoguttatus ♀×E. lanceolatus ♂
2.3 养殖水体氨氮及亚硝态氮含量变化
2.3.1 氨氮
酶解肠膜蛋白粉替代0%和9%组养殖水体氨氮含量在摄食后1~5 h显著低于摄食后13~21 h(P<0.05),摄食后13~21 h差异不显著(P>0.05)(表5)。酶解肠膜蛋白粉替代18%组和酶解肠膜蛋白粉替代27%组养殖水体氨氮含量在摄食后1~13 h显著低于摄食后17~21 h(P<0.05),摄食后17 h和21 h差异不显著(P>0.05)。酶解肠膜蛋白粉替代36%组养殖水体氨氮含量在摄食后1~5 h差异不显著(P>0.05),但显著低于摄食后9~21 h(P<0.05)。

表5 养殖水体氨氮质量浓度的变化 mg/LTab.5 Changes in ammonia nitrogen concentration in aquaculture water
在摄食后5 h时,酶解肠膜蛋白粉替代18%组养殖水体氨氮含量呈现最低值,显著低于酶解肠膜蛋白粉替代27%组和酶解肠膜蛋白粉替代36%组(P<0.05)。在摄食后13~17 h,各组间养殖水体氨氮含量差异不显著(P>0.05)。在摄食后21 h时,酶解肠膜蛋白粉替代0%组养殖水体氨氮含量与酶解肠膜蛋白粉替代9%组差异不显著(P>0.05),但显著低于其他各组(P<0.05)。
2.3.2 亚硝态氮
随着时间延长,各组养殖水体亚硝态氮质量浓度在摄食后1~13 h显著低于摄食后21 h(P<0.05)。各组养殖水体亚硝态氮质量浓度摄食后5 h和9 h差异不显著(P>0.05),摄食后13 h和17 h差异不显著(P>0.05)。
在摄食后1 h和21 h时,各组间的养殖水体亚硝态氮质量浓度差异不显著(P>0.05)。在摄食后13 h时,酶解肠膜蛋白粉替代0%、9%和36%组的养殖水体亚硝态氮质量浓度差异不显著(P>0.05),显著高于替代27%组(P<0.05)。在摄食后17 h时,酶解肠膜蛋白粉替代18%组养殖水体亚硝态氮含量显著低于替代0%和9%组(P<0.05),但与替代27%和36%组差异不显著(P>0.05)。

表6 养殖水体亚硝态氮质量浓度的变化 mg/LTab.6 Changes in nitrite nitrogen concentration in aquaculture water
3 讨 论
3.1 酶解肠膜蛋白粉替代鱼粉对珍珠龙胆石斑鱼的生长性能的影响
鸡肉粉替代30%的鱼粉时,未影响黄鳝(Mono-pterusalbus)的生长性能[20],表明动物蛋白源对鱼体的生长具有积极作用。动物蛋白源经过酶解后,含有更加丰富的小肽和游离氨基酸[21],鱼蛋白的酶解物可促进欧洲舌齿鲈(Dicentrarchuslabrax)[15]的生长性能,改善免疫能力。本试验结果表明,酶解肠膜蛋白粉替代饲料中的鱼粉,不会对珍珠龙胆石斑鱼的成活率造成负面影响,酶解肠膜蛋白粉替代鱼粉水平达27%时,珍珠龙胆石斑鱼的特定生长率和质量增加率高于替代0%时。有研究显示,酶解磷虾粉替代水平为30%时,可显著促进珍珠龙胆石斑鱼的特定生长率和质量增加率[21]。罗非鱼(Oreochromis)副产品酶解物替代水平为10%时,能显著提高真鲷(Pagrusmajor)幼鱼的特定生长率[22]。然而,当酶解肠膜蛋白粉替代鱼粉水平超过18%时,石斑鱼的质量增加率、特定生长率和蛋白质效率显著下降。当饲料中酶解磷虾粉和酶解鱼溶浆替代一定水平时也会导致珍珠龙胆石斑鱼和黄颡鱼(Pelteobagrusfulvidraco)的质量增加率和特定生长率降低,表明动物蛋白酶解物替代水平过高对鱼体生长性能会产生负面影响[21,23]。可能是因为饲料中小肽和游离氨基酸的含量过高,机体肠道转运能力超负荷,此外,快速涌入机体的小肽可能会加速氨基酸氧化和内因性排泄[24],从而影响氨基酸的转运,最终抑制鱼体对蛋白质的吸收[25]。本试验中,随着酶解肠膜蛋白粉替代鱼粉水平的增加,珍珠龙胆石斑鱼的摄食率显著上升,这与克林雷氏鲇(Rhamdiaquelen)[26]和异育银鲫(Carassiusauratusgibelio)[27]的研究结果一致,可能是因为动物蛋白源经过酶解生成的活性小肽具有诱食的功效,能够提高摄食率[28]。
3.2 酶解肠膜蛋白粉替代鱼粉对珍珠龙胆石斑鱼饲料营养物质表观消化率的影响
珍珠龙胆石斑鱼的干物质表观消化率和粗蛋白质表观消化率随着酶解肠膜蛋白粉替代鱼粉水平的升高呈下降趋势,表明饲料中添加较高水平的酶解肠膜蛋白粉会对营养素的利用产生负面影响。酶解肠膜蛋白粉相比鱼粉而言精氨酸含量稍高,又缺乏赖氨酸和含硫氨基酸等必需氨基酸,致使氨基酸不平衡,影响鱼类对蛋白质氨基酸的利用,对饲料产生消化吸收障碍而随粪便排出,影响饲料的消化率。同样,羽毛粉中精氨酸含量较高而含硫氨基酸和赖氨酸含量较低,大菱鲆(Scophthalmusmaximu)[29]、金头鲷(Sparusaurata)[30]和军曹鱼(Rachycentroncanadum)[31]对含有一定量酶解、酵解或水解的羽毛粉的饲料的干物质和蛋白质消化率均较低。随着酶解肠膜蛋白粉替代水平的增加,珍珠龙胆石斑鱼对饲料磷的表观消化率显著下降。有研究表明,随着低鱼粉饲料中肉骨粉含量上升,异育银鲫的磷表观消化率呈下降趋势[32]。在动物性原料中,肉骨粉的总磷含量较高,在军曹鱼的研究中发现,肉骨粉的磷表观消化率(62.44%)显著低于秘鲁鱼粉的磷表观消化率(71.22%)[33]。
3.3 酶解肠膜蛋白粉替代鱼粉对珍珠龙胆石斑鱼养殖水体氨氮及亚硝态氮的影响
养殖水体氮含量过多会造成富营养化,致使水生植物大量繁殖,使生物数量和多样性发生改变,破坏水体的生态平衡并引起水生生物种群结构的改变[34]。同时,这也会导致水产养殖动物代谢紊乱,生长速度缓慢,生殖力衰弱,从而导致养殖动物生产量低下[35]。水体的各种氮化合物中,氨氮对鱼类的直接危害最大。水体中氨氮的来源主要为水生动物的排泄物、施加的肥料、残饵和动植物尸体受池塘中微生物作用的分解产物。水体中氨氮含量过高会损伤水生动物的鳃组织,抑制呼吸作用,打破生物体内外气体交换的平衡,造成生物中毒的现象,使鱼类正常生命活动受阻甚至死亡[7,36-37]。混合植物蛋白替代鱼粉水平为30%时,杂交鲟(Acipenserschrenckii×A.baeri)幼鱼排氨率显著降低[38],表明饲料原料的选择对水体氨氮含量具有影响。本试验中,在摄食后1~21 h,酶解肠膜蛋白粉替代0%和9%组之间的氨氮含量差异不显著,表明酶解肠膜蛋白粉替代9%时并未加剧养殖水体的恶化,并且上述两组间鱼体的生长无显著差异。本试验中,随着酶解肠膜蛋白粉替代鱼粉水平的增加,各组饲料的消化率均低于对照组,养殖水体的氨氮含量呈上升趋势,可能是由摄食后的鱼体持续进行代谢所致。此外,可能是酶解肠膜蛋白粉替代水平的上升,使得游离氨基酸含量增多,氨基酸转运载体饱和导致氨基酸之间竞争失衡,影响氨基酸的转运,鱼类对氨基酸的吸收能力下降[25],较多的氮元素随着代谢废物流入养殖水体,加快了水体中氨氮含量上升的速度。
亚硝态氮由氨氮硝化形成,水体中亚硝态氮含量过高会导致鱼体血液中高铁血红蛋白的含量升高,载氧能力下降,造成组织缺氧,引发死亡[39]。较高含量的亚硝态氮会导致中华鳖(Pelodiscussinensis)稚鳖[40]养殖水体中病菌的大量繁殖,加剧养殖水体污染,使养殖的鳖死亡。本试验中,在摄食后1~21 h时,酶解肠膜蛋白粉替代0%组的亚硝态氮质量浓度与酶解肠膜蛋白粉替代9%和36%组差异不显著,摄食后21 h时,各组间的亚硝态氮质量浓度差异不显著,表明酶解肠膜蛋白粉替代水平的升高对水体亚硝态氮的影响较小。
4 结 论
综上所述,在本试验条件下,当基础饲料中含有33%的鱼粉时,添加3%酶解肠膜蛋白粉,可替代9%的鱼粉,对珍珠龙胆石斑鱼生长性能和养殖水体氨氮含量不会产生负面影响。

