陆川猪肉质相关基因的研究进展
吴 潇,黄继文,蒋 玮,朱丽慧,涂尾龙*
(1 上海市农业科学院生物技术研究所,上海 201106;2 上海市农业科学院畜牧兽医研究所,上海 201106;3浙江农林大学动物科技学院·动物医学院,杭州 311300)
猪肉品质是生产中重要的经济性状,肌肉的生长发育和脂肪沉积是猪肉品质的重要影响因素。 肌纤维作为肌肉组织的基本结构单位,其类型组成与pH、肉色、嫩度和肌内脂肪含量等密切相关,脂肪沉积则直接影响肉的多汁性和嫩度。 在肉质评价指标中,肌内脂肪(Intra muscular fat,IMF)是重要指标,不仅影响着肉的嫩度、系水力、剪切力、多汁性等,而且IMF 的组成含量及其氧化降解产物对肌肉风味形成具有重要影响[1]。 IMF 的调控机制比较复杂,常受到营养、环境和基因等多方面的共同调控。 其中,IMF 的调控基因主要包括脂肪前体细胞分化过程中的转录调控因子、脂肪合成与分解代谢途径中的调控基因以及肌纤维发育相关的基因等。 随着生物技术的迅猛发展,国内外学者已筛选出一些调控脂肪代谢和肌纤维发育的基因,如激素敏感脂酶、脂蛋白酯酶、心脏脂肪酸结合蛋白、甘油三酯脂酶、过氧化物酶体增殖物激活受体家族基因等,这些基因调控脂肪的合成与分解代谢[2],从而与猪肉IMF 的沉积相关。 对脂肪代谢、脂肪沉积相关候选基因开展分子生物学角度的研究,能够提供肉品质改善的分子理论支撑,也提供了加快猪肉品质遗传改良的新途径。
陆川猪因产于广西陆川县得名,是我国八大优良地方品种之一[3]。 研究者发现IMF 含量高是陆川猪肉质优良最重要的原因,其背最长肌中IMF 高达7.43%[4]。 由于陆川猪肉质性状的表现和相关基因的表达密切相关,因此对脂肪沉积相关基因遗传机制开展研究,在陆川猪种质资源利用方面具有重要意义。本研究主要对近年来陆川猪肉质相关基因研究领域的重要进展进行综述,为深入研究陆川猪基因功能和陆川猪的选育提供参考依据。
1 脂肪沉积相关基因
1.1 二脂酰甘油酰基转移酶2
二脂酰甘油酰基转移酶2(Acyl CoA:Diacyl gycerol Acyl transferase 2,DGAT2)是内质网细胞微粒体酶,它在二酰甘油通过共价键的形式和脂肪酸酰基辅酶A 结合形成三酰甘油(即三酰甘油合成反应的最后一步)过程中起到限速作用[5]。 不同动物DGAT2 基因的研究结果均表明,DGAT2 基因与脂类代谢及脂肪沉积密切相关,推测其可能是通过调节三酰甘油的合成来控制机体脂肪沉积。 研究发现,相对于DGAT1 基因,在金华猪脂肪沉积中DGAT2 基因发挥了更为重要的作用,可将它选作大白猪背膘厚性状的候选基因,DGAT2 基因表达量的高低很可能是造成中外猪种脂肪沉积能力差异的因素之一[6]。 邓章超等[7]对同日龄陆川猪与杜长大猪背最长肌中DGAT2 基因表达量相比,发现前者显著高于后者。 作为调控IMF 沉积的候选基因,DGAT2 基因可进一步深入研究。
1.2 FAM134B 基因
FAM134B基因是FAM134 基因家族(Family with sequence similarity 134,FAM134)成员之一,主要参与调控猪脂肪合成与分解代谢,促进IMF 细胞分化,提高脂肪合成速率,从而提高IMF 的沉积。 研究显示:过表达FAM134B可显著提高脂肪合成关键基因的表达量;而抑制FAM134B基因表达则可提高脂肪分解关键基因的表达量,同时抑制脂肪细胞分化及合成关键基因的表达量,使猪肉IMF 沉积显著降低[8]。
陆川猪FAM134B基因完整的编码区序列长度为1 107 bp,编码368 个氨基酸;金华猪FAM134B基因完整编码区序列长度为975 bp,编码325 个氨基酸,比陆川猪FAM134B基因少了43 个氨基酸,推测猪FAM134B基因可能存在多个剪切体,FAM134B基因在陆川猪和金华猪种表达的可能是不同的剪接体[1,8]。 同一基因不同的剪切体产生蛋白的多样性,不同蛋白发挥不同的功能,因此FAM134B基因不同的剪接体有可能在IMF 沉积中发挥不同的作用。
1.3 肥胖相关基因
肥胖相关基因(Fat mass and obesity associated gene,FTO)因其可调节脂肪细胞沉积从而调控肥胖发生而备受关注[9]。 猪的FTO基因位于6 号染色体上一个包含调控众多脂肪性状的QTL 区域[9],研究者分别克隆了乌金猪和苏钟猪的FTO基因,并发现同日龄金华猪肌肉和脂肪组织中FTO基因的表达量高于长白猪和长金杂交猪,FTO基因与脂肪代谢、IMF 沉积紧密相关[10]。 夏琴等[11]克隆了陆川猪FTO基因,发现在编码区序列的第1 050 位点存在单核苷酸多态性(Single nucleotide polymorphism,SNP),胞嘧啶(C)突变为鸟嘌呤(G),而且G 为陆川猪特有的,该位点突变引起编码氨基酸天冬氨酸突变为谷氨酸,这是否跟陆川猪IMF 含量高相关有待进一步研究。
1.4 G 蛋白偶联受体基因1
G 蛋白偶联受体1(G protein coupled receptor1,GPR1)基因是脂肪细胞因子Chemerin 的受体,属于G蛋白偶联受体超家族成员,G 蛋白偶联受体可以将激素、脂内、核苷酸等多种细胞外信号转导至细胞内,在各种生理代谢活动过程中起着重要调节作用。 在猪脂肪和肝脏等组织中GPR1 基因大量表达,且肝细胞中GPR1 能取代CMKLR1 介导Chemerin 信号起到调控肝脏脂肪代谢的作用,其表达量与机体脂肪沉积能力呈正相关[12]。 陆川猪GPR1 基因编码355 个氨基酸,存在13 处碱基突变,其中4 处为错义突变[13]。此外,谢婉等[14]发现陆川猪背最长肌中GPR1 基因相对表达量显著高于杜洛克猪,其启动子区存在一个CpG 岛,长度为103 bp,位于-1 031—-929 bp,CpG 岛在2 个品种猪背最长肌中的整体甲基化水平差异不显著,但在-126、 -116、 -64、 -10 位点甲基化水平差异显著,说明GPR1 基因启动子甲基化程度与IMF 沉积存在一定关联。
1.5 心型脂肪酸结合蛋白基因
心型脂肪酸结合蛋白(Heart-type fatty acid binding protein,H-FABP)基因是调控脂肪代谢的关键基因之一,编码细胞质蛋白在调节肝脏合成三酰甘油中有重要作用。H-FABP可促进细胞膜从血液中摄取游离的脂肪酸,达到增强脂肪酸转运的目的[15]。H-FABP基因多态性对IMF 含量影响显著,而且优势基因型个体具有较高的IMF 含量[16]。 与国外引进品种猪相比,我国地方猪种的IMF 含量更高,并且地方猪种H-FABP基因在某些突变位点的基因频率分布极为相似,以上研究结果说明H-FABP基因多态性与地方品种猪的IMF 含量较高有关。 因此,在猪的选育中H-FABP基因是提高猪IMF 含量的重要候选基因[16]。
陆川猪H-FABP基因编码133 个氨基酸,与GenBank 上的猪H-FABP基因序列比对发现,陆川猪在235 位的碱基A 突变为G,使精氨酸变为甘氨酸,该突变可能影响陆川猪脂肪沉积[17]。 因此,把H-FABP作为陆川猪脂肪沉积的重要候选基因。
1.6 丙酮酸脱氢激酶4
丙酮酸脱氢酶激酶(Pyruvate dehydrogenase kinase,PDK)是腺苷三磷酸酶家族成员,有4 个亚型,丙酮酸脱氢激酶4 是其中之一。PDK4 基因通过使丙酮酸脱氢酶复合体磷酸化来抑制丙酮酸脱羧转变为乙酰辅酶A,乙酰辅酶A 是合成脂肪酸、酮体等能源物质的前体物质,也是合成胆固醇及其衍生物等生理活性物质的前体物质,从而在脂肪代谢过程中发挥作用[18]。
PDK4 基因在猪脂肪组织中的表达量均显著高于其他组织,推测PDK4 可能通过表达量的改变调控脂肪代谢过程,从而影响猪肉IMF 的沉积和含量[19]。 陆川猪PDK4 基因编码407 个氨基酸,序列有2 处突变,其中1 处突变使第25 位氨基酸由酪氨酸变为组氨酸。PDK4 基因在陆川猪皮下脂肪中表达量最高,肝脏次之,在背最长肌中表达量最低,说明该基因不仅和脂肪沉积相关,与脂肪肝等相关疾病可能也存在一定关联[20]。
1.7 围脂滴蛋白5
围脂滴蛋白(Perilipin,PLIN)是一种重要的脂滴表面蛋白,在体内能量平衡和脂质代谢中发挥着关键作用。 因PLIN基因与肥胖相关,所以常作为猪生长肥育性状的候选基因,研究PLIN基因于不同物种间的遗传多态性分布,以期找到与生产性状相关的遗传标记,指导猪的育种和生产。 当前对PLIN 的研究主要集中于PLIN1 和PLIN5。
PLIN1 基因第2 外显子111 bp 处的胸腺嘧啶(T)突变为C,该突变与背膘厚、剪切力显著相关[21];第2 外显子3 519 bp 处的腺嘌呤(A)突变为G,该处错义突变与背膘厚、肌肉水分和IMF 含量存在显著相关[22];第4 外显子126 bp 处的G 突变为A,该突变与背膘厚、IMF 含量相关[21]。 这3 个位点可作为影响猪背膘厚、IMF 含量的分子辅助标记。PLIN2 多态性在杜洛克猪选育中作为分子辅助标记得到应用,在保证瘦肉率的前提下,可增加猪肉中IMF 含量[23]。
PLIN5 属于围脂滴蛋白超家族成员之一,对细胞脂滴内三酰甘油的储存和使用有关键性的调节作用[24]。 陆川猪PLIN5 基因编码458 个氨基酸,与美国国家生物技术信息中心(NCBI)上公布的野猪PLIN5 基因序列的编码区存在4 个碱基突变,均为错义突变:457 bp 处突变导致缬氨酸变为异亮氨酸;472 bp 处突变导致丝氨酸变为脯氨酸;708 bp 处突变导致谷氨酸变为天门冬氨酸;1 307 bp 处突变导致天门冬氨酸变为甘氨酸[25]。 作为陆川猪脂肪代谢的候选基因,PLIN5 基因这些突变与陆川猪脂肪沉积的相关性有待进一步研究。
1.8 黑素皮质素受体4
黑素皮质素受体4(Melano cortin-4 receptor,MC4R)为跨膜神经受体黑素皮质素受体家族的成员之一,也属于G 蛋白耦联受体超家族。 MC4R 是调节能量动态平衡的重要信号分子,通过与脑分泌的天然内源配体α-促黑激素结合,抑制体重增加,通过介导瘦素,在动物采食量、能量代谢和体重的调控中发挥重要作用,MC4R基因突变可导致肥胖。
MC4R基因作为猪生长肥育性状的候选基因被广泛研究。MC4R基因在猪肌肉中的表达量较高,而且显著影响着脂肪沉积效果[26]。 研究MC4R基因在不同猪种间的遗传多态性分布,找到与生产性状相关的遗传标记指导育种生产也是研究热点之一。MC4R基因298 bp 位点存在一处错义突变,天冬氨酸变为天冬酰胺,该突变与商品猪背膘厚相关,可作为背膘厚的分子标记[27];1 392 bp 处存在单核苷酸多态位点,G 突变为A,该位点可作为影响猪生长速度和背膘厚的分子标记。
陆川猪MC4R基因编码332 个氨基酸,通过与NCBI 上公布的猪MC4R基因序列(NM_214 173.1)进行比对分析,发现陆川猪的编码区4 个位点存在碱基差异,即第110 bp、175 bp、278 bp 和906 bp 位点。 其中第110 bp 和278 bp 的错义突变,使第37 位谷氨酸变为甘氨酸,第93 位缬氨酸变为丙氨酸[26]。 这两处位点的突变是否能用于陆川猪的分子辅助育种中有待进一步研究。
1.9 磷酸酪氨酸互作结构域1
磷酸酪氨酸互作结构域1(Phosphotyrosine Interaction Domain Containing 1,PID1)为脂质代谢相关的基因,可促进脂肪细胞增殖和细胞内脂滴形成,对脂肪代谢起着重要调节作用。PID1 基因的过表达可影响脂肪细胞对葡萄糖摄取功能,抑制葡萄糖转换,从而影响机体对胰岛素的敏感性,促进前体脂肪细胞增殖,增加脂肪沉积。
中国地方猪种中PID1 基因表达量极显著高于国外瘦肉型猪种,说明PID1 基因表达量确实与猪肉IMF 的沉积显著相关[28]。 陆川猪PID1 基因编码217 个氨基酸,对陆川猪PID1 蛋白质结构进行预测,发现其C 端含有1 个PTB(Phosphor tyrosine binding)结构域[4]。
猪脂肪沉积相关基因的功能、突变位点相关信息见表1。
2 肌肉发育相关基因
2.1 心肌锚蛋白重复域1
心肌锚蛋白重复域1(Ankyrin repeat domain 1,ANKRD1)属于肌肉锚蛋白重复蛋白(MARP)家族,在哺乳动物中高度保守。ANKRD1 基因是肉品质的候选基因之一。 陆川猪ANKRD1 基因在其心脏、肝脏、脾脏、肺脏、肾脏、背最长肌和皮下脂肪等7 个组织中均表达,且差异明显,尤其在心脏中,推测ANKRD1 基因在不同组织中发挥不同作用[29]。
2.2 胰岛素生长因子结合蛋白5
胰岛素生长因子结合蛋白5(Insulin-like growth factor binding protein 5,IGFBP5)属于胰岛素样生长因子结合蛋白家族成员,与肌肉生长发育密切相关,且受到诸多因子调控进而影响肌肉生长。
通过与NCBI 上IGFBP5 基因(NM_214099.1)比对分析,发现陆川猪存在3 处错义突变:419 bp 处A突变为G,导致组氨酸突变为精氨酸;468 bp 处A 突变为T,导致精氨酸突变为丝氨酸;533 bp 处T 突变为C,导致亮氨酸突变为丝氨酸[30]。IGFBP5 基因在肌肉中高表达,而且与肌肉增殖分化密切相关,因此IGFBP5 基因在不同猪种间的表达差异可能是导致猪肉瘦肉率差异的原因之一。
2.3 生肌调节因子5
生肌调节因子(Myogenic Regulatory Factors,MRFs)家族调控着肌肉的发生过程(如肌细胞的增殖、分化),因此与肌纤维的大小、数量密切相关。Myf5 是该家族最早表达的基因,作用于特化成肌细胞及增殖肌细胞,影响着猪肌纤维生长、瘦肉率、酮体背膘厚度及IMF 含量[31]。
陆川猪Myf5 基因在205 bp 处存在C 突变为A,导致亮氨酸突变为蛋氨酸[3]。 30 日龄时,陆川猪背最长肌Myf5 基因相对表达量最高,之后下降,但240—300 日龄又呈上升趋势,这不同于Myf5 基因在五指山猪、马身猪的发育性表达规律,差异原因可能是所选地方猪种骨骼肌生长发育规律不同导致的[31]。
2.4 肌球蛋白调节轻链9
肌球蛋白调节轻链9(Myosin light chain 9,MYL9,又称LC20 或MYRL2)由MYL9 或MLC2 基因编码,是肌球蛋白结构中调节肌球蛋白活性的调节性轻链,可利用ATP 水解产生的能量沿肌动蛋白运动[32]。猪的MYL9 基因位于第17 号染色体,含4 个外显子。 陆川猪MYL9 基因编码172 个氨基酸,存在2 处同义突变,第195 bp 处C 突变为A,第498 bp 处T 突变为C。 研究发现,陆川猪背最长肌中MYL9 基因相对表达量极显著低于杜洛克猪[32],这可能是陆川猪比杜洛克猪肌肉生长缓慢的影响因素之一。
猪脂肪沉积相关基因的功能、突变位点相关信息见表2。
3 脂肪沉积和肌肉发育相关的基因
3.1 细胞因子信号抑制因子3
细胞因子信号抑制因子(Suppressor of cytokine signaling,SOCS)家族是参与多种细胞因子、生长因子和激素信号调节的蛋白分子,对这些细胞因子信号通路起负反馈调节。 SOCS3 是SOCS 家族的主要成员之一,参与脂肪和肌肉组织中瘦素、胰岛素等多种细胞因子的信号传导。 SOCS3 能抑制瘦素(Leptin)信号通路,与肥胖的发生显著相关。
“一个不读书的民族是没有希望的民族。”同样,不读书的体育教师,很难提高自己的课堂效果,提升自己的科研能力,很难成为“专家研究型”体育教师。对农村中小学体育教师来说,阅读专业书籍更有必要性。体育教师经常进行阅读积累,特别是阅读专业书籍,既能开阔农村体育教师的视野,又能增加农村体育教师的知识储备,使课堂教学和教育科研都有很大的提升。
诸多研究证实,SOCS3 基因在猪肌肉生长发育、脂肪沉积等方面起重要调控作用。SOCS3 基因在瘦肉型猪大白猪肌肉中的表达量显著高于脂肪型八眉猪,其原因在于SOCS3 正调控IGF-I 信号通路,负调控Leptin 信号通路,SOCS3 基因表达量的高低显著影响猪个体脂肪沉积的能力[33]。
与GenBank 中公布的猪SOCS3 基因序列(NM_001123196,HM045422)比对发现,陆川猪SOCS3 基因第70 位点的A 突变为G,并且G 为陆川猪所特有,该处突变导致苏氨酸变为丙氨酸[34]。 陆川猪SOCS3基因的突变是否影响陆川猪脂肪沉积进而影响猪肉品质,还需要继续深入研究。
3.2 肌肉生长抑制素
肌肉生长抑制素(Myostatin,MSTN)是可调控成肌细胞增殖的一种糖蛋白,在骨骼肌中广泛表达,影响肌肉的生长与发育,MSTN 对脂肪沉积同样也有调节作用。 过度选择畜禽生长速度,会导致骨骼肌过快发育、增加脂肪含量、降低饲料转化率。 因此,深入研究MSTN基因功能,对通过调节MSTN基因表达来调控畜禽肌肉的增长速度、脂肪的沉积、改善猪肉品质具有重要的意义。 近年来,MSTN作为影响畜禽肉质性状的主要候选基因之一,在畜禽肉质方面的研究取得了一定进展。 在鲁莱黑猪、广西巴马小型猪、藏猪、通城猪、莱芜猪、五指山猪、长白猪、大白猪、杜长大中都发现MSTN基因存在多个多态位点,并且大部分和生长性状、肉质性状相关[35-36]。
对比GenBank 上约克夏、汉普夏、杜洛克、梅山猪、藏猪、广西巴马小型猪的基因同源性,均在99.8%以上。 陆川猪MSTN基因第294 位点存在特有碱基G,但未引起氨基酸改变。 猪MSTN基因高度保守,可用作研究陆川猪肌肉生长发育和脂肪沉积的候选基因之一[37]。
3.3 激素敏感性脂肪酶
激素敏感性脂肪酶(Hormone sensitive lipase,HSL)作为参与脂肪分解代谢过程的关键酶,可催化三酰甘油分解为甘油和脂肪酸以供机体组织的需要,在脂肪的合成和分解过程中发挥重要作用。
猪的HSL基因被定位在6 p1.1—1.2 上,相近区域分布了一些与猪肉质性状及生长发育相关的候选基因,因此有关HSL基因在猪脂肪沉积和代谢方面的研究已经成为近年的热点。 通过研究发现,HSL基因多态性和猪的平均背膘厚度、瘦肉率及眼肌面积等有着高度的相关性,可把它们作为猪胴体性状的候选基因[38]。 与长白猪、梅山猪相比,陆川猪HSL基因第1 044 位点C 突变为T,并发现T 为陆川猪所特有,但未引起氨基酸的改变。HSL基因如何影响陆川猪的肉质性状,如IMF 含量等,有待后续研究[39]。
3.4 瘦素
瘦素或瘦蛋白(Leptin)是一种脂肪细胞分泌因子,具有广泛的生物学效应,其作用于下丘脑的代谢调节中枢,抑制食欲,减少能量摄取,抑制脂肪的合成,促进分解,避免肥胖发生。Leptin基因在猪脂肪沉积、代谢调控及骨骼肌的生长发育等方面的研究获得了突出进展,可为中国地方品种猪优质肉质形成的分子机制奠定重要基础。Leptin基因在不同品种的猪脂肪组织中表达量存在差异,黄艳娜等[40]发现地方猪种脂肪组织中Leptin基因的表达量比外来猪种高1.21 倍,血清中Leptin基因的表达量则高3.23 倍。
3.5 解偶联蛋白受体3
解偶联蛋白受体3(Uncoupling protein 3,UCP3)基因属于线粒体内膜转运蛋白家族,使线粒体氧化与磷酸化解偶联,促进脂肪酸的氧化、代谢,UCP3 基因有负调控脂肪沉积的作用。 在畜禽育种研究领域,UCP3 基因作为影响IMF 的候选基因之一。 猪的UCP3 基因有6 个外显子,编码310 个氨基酸,与UCP2紧密连锁[41]。 研究发现,UCP3 基因的表达量较低是梅山猪肉品质优良的重要原因,此外,UCP3 的多态性和猪肉品质相关;和肉质性状中的系水力、失水率及IMF 含量显著相关;和能量代谢能力极显著相关[42]。
比较陆川猪和杜洛克猪×陆川猪正反交F1代猪的眼肌面积,发现三者在眼肌面积、IMF 含量和UCP3基因mRNA 表达量上均差异显著,UCP3 的表达量和IMF 含量为极显著正相关,和猪眼肌面积则表现为极显著负相关,而且F1代个体都遗传了杜洛克猪大体型、陆川猪高IMF 含量的优势,UCP3 基因可作为影响猪IMF 含量的主效基因[41-42]。
3.6 脂联素
脂联素(AdipoQ)是脂肪细胞分泌的一种内源性生物活性多肽或蛋白质,也是胰岛素增敏激素,在调节脂肪代谢、脂肪沉积等方面发挥着重要作用。 猪的AdipoQ基因包含3 个外显子和2 个内含子[43]。 陆川猪AdipoQ基因编码242 个氨基酸,编码的蛋白具有较强的亲水性[44]。 比较陆川猪、广西巴马小型猪、梅山猪、长白猪AdipoQ基因的核苷酸序列,发现陆川猪在292 bp 处存在由G 突变为A,引起甘氨酸突变为丝氨酸[44],AdipoQ基因的此突变或许是陆川猪优质肉质形成的一个关键因素。
3.7 酰基辅酶A 氧化酶1
酰基辅酶A 氧化酶(Acyl-coenzyme A oxidase,ACOX)基因是和过氧化物酶体中的脂肪酸氧化分解过程密切相关的一个基因家族,按不同催化底物被分为ACOX1、ACOX2 和ACOX3 三种亚型[45]。ACOX1 是脂肪酸β-氧化过程中脱氢反应的限速酶,能够在长链与极长链脂肪酸脱氢氧形成反式双键α,β-烯脂酰辅酶A 过程中起到特异性的催化作用。
猪ACOX1 基因和影响日增重、背膘厚、脂肪酸组成的数量性状位点有着紧密的联系[45]。ACOX1 基因有14 个外显子,我国地方猪种与3 个外来品种猪在第9 个内含子的多态位点的基因频率上表现出极显著差异,ACOX1 基因多态性在猪瘦肉率、平均背膘厚度等性状方面也显著相关,当ACOX1 基因为杂合子时表现出瘦肉率较高、背膘厚度以及脂肪率较低的特征。 陆川猪的ACOX1 基因编码了661 个氨基酸,有9处碱基突变,其中第129 bp、481 bp、938 bp 处发生错义突变[45],为今后研究ACOX1 基因与陆川猪脂肪沉积的相关性等提供了重要序列信息。
猪脂肪沉积和肌肉发育均相关的基因功能、突变位点相关信息见表3。

表3 猪脂肪沉积和肌肉发育均相关的基因Table 3 Gengs associated with fat deposition and muscle development
4 动物肉质相关基因与调控通路
为了进一步分析上述基因与猪肉质形成之间的关系,使用KOBAS(http:∕∕kobas.cbi.pku.edu.cn∕)对上述肉质相关基因进行KEGG 分析发现(表4),参与过氧化物酶体增殖物激活受体信号通路(PPAR signaling pathway,PPAR)、环磷酸腺苷信号通路(cAMP signaling pathway,cAMP)、腺苷酸激活蛋白激酶信号通路(AMPK signaling pathway,AMPK) 和脂肪细胞脂肪分解调控通路(Regulation of lipolysis in adipocytes)等24 个通路的基因有8 个,其中ACOX参与了其中10 个通路,HSL参与了7 个通路,AdipoQ参与了5 个通路、PLIN参与了4 个通路、MYL9 参与了3 个通路、DGAT2 参与了2 个通路、SOCS和H-FABP分别参与1 个通路,而归属于PPAR 通路中的基因最多,分别是ACOX、H-FABP、PLIN、AdipoQ。
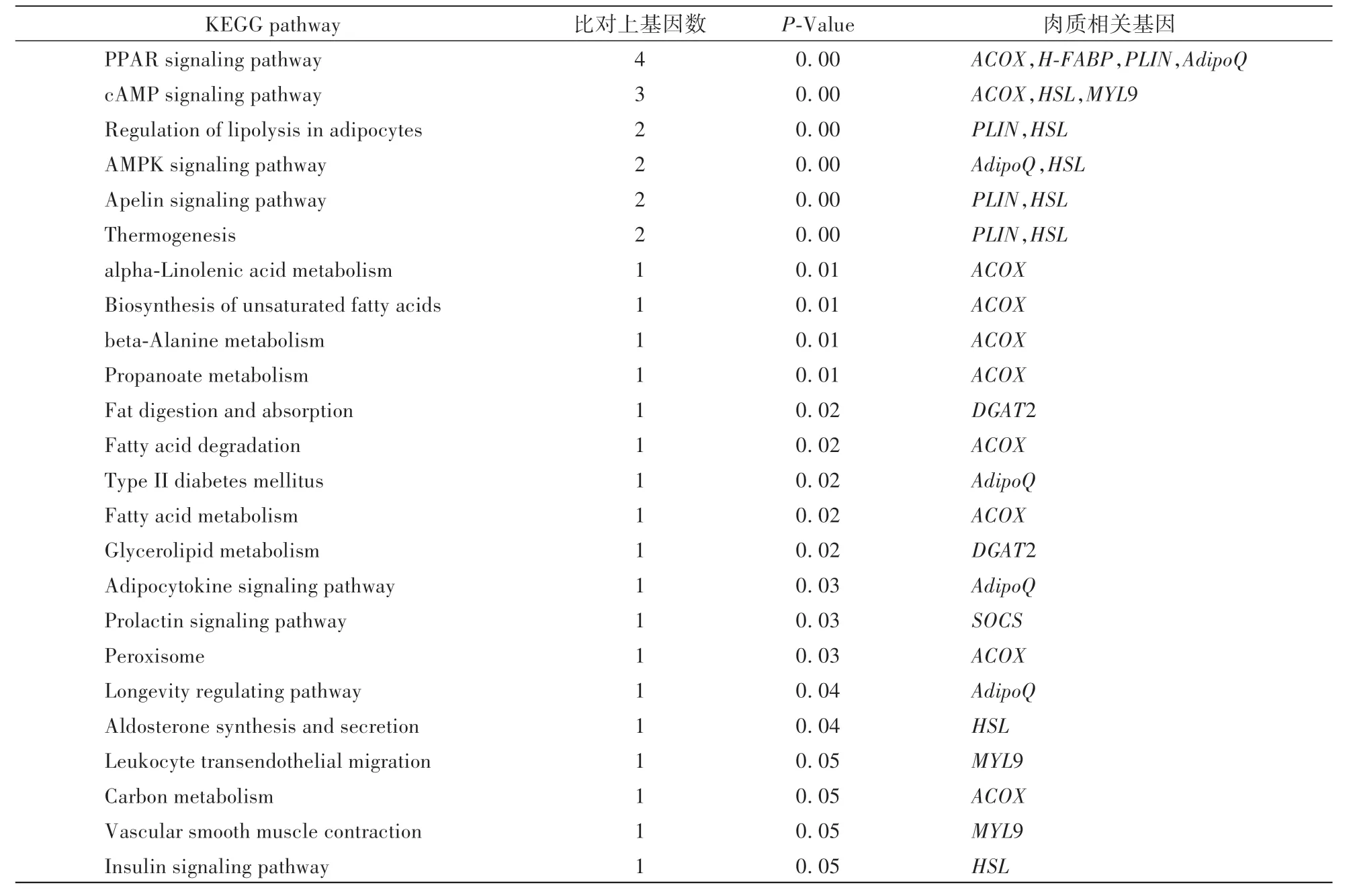
表4 肉质相关基因参与的代谢通路Table 4 Metabolic pathways involved in meat related genes
PPAR 通路能调控许多参与细胞内外脂类代谢基因的表达,以调节脂肪在合成代谢和氧化分解过程中的动态变化,从而维持脂肪组织的动态平衡,实现对脂肪沉积的影响作用[46]。PPARs是一类配体激活的核转录因子超家族成员,迄今已鉴定出PPARα、PPARγ和PPAR β∕δ这3 种亚型,PPARγ主要参与脂肪细胞分化及成脂作用,而PPARβ具有增加脂肪酸氧化的能力,与细胞的脂质代谢有关。 细胞内的第二信使cAMP 是一种非常重要的信号传递分子,很多通路的激活和抑制均受到cAMP 信号通路的调控[47]。 细胞内的能量感受器AMPK 是一种普遍存在于真核生物中的丝氨酸∕苏氨酸蛋白激酶,其活性受到一磷酸腺苷(AMP)、二磷酸腺苷(ADP)和三磷酸腺苷(ATP)的变构调节,在细胞的繁殖、能量平衡、代谢调控等多种生命活动中有着重要的调节作用[48]。 AMPK 作为能量代谢调控因子,可促进脂肪酸氧化及脂肪酸合成等生物学过程[49]。 丝氨酸∕苏氨酸蛋白激酶激活AMPK,通过磷酸化乙酰辅酶A 羧化酶2(ACC2)促进脂肪氧化,减少甘油三酯合成;通过FTO基因调控肌细胞中脂滴聚集;使PPAR γ下调,脂肪前体细胞的分化及脂肪沉积受到抑制,实现对肌肉中脂肪代谢及IMF 生成的调控[47]。 研究发现,AMPK 活性与IMF 含量呈负相关,与肌肉发达程度呈正相关[48]。 由此可见,这三个通路在脂肪代谢和沉积中发挥了重要作用,并且存在相互作用的关系,进一步揭示这些基因和通路在猪肉质形成过程中的机制将是今后的研究重点。
此外,还有12 个基因没有归属于任何一个通路,因为目前对这些基因的研究还不够深入,尚未揭示它们参与的代谢过程及相关的调控机制,但它们可作为猪肉质重要的候选基因进行深入研究。
5 结语
种质资源是农业发展的芯片,优良品种是影响畜牧业发展的首要影响因素。 随着国际竞争越来越激烈,尤其近年来中美经贸摩擦的加剧,为我国种业发展敲响了警钟。 加大我国畜禽遗传资源保护开发利用的力度,持续提升畜禽种业自主创新能力,是打赢畜禽种业“翻身仗”的唯一途径。
陆川猪始于汉而盛于唐,有着两千多年悠久历史。 因为陆川猪具有早熟易肥、产仔数多、肉味鲜美等特点,因此在汉代,陆川猪就被罗马帝国引入,育成了拿波利坦猪;18 世纪被英国引进育成巴克夏猪。 当前,由于陆川猪肉质鲜嫩的脂肪含量较高,口感好,味道醇香,因此受到消费者的青睐和育种者的重视。对陆川猪生长发育、脂肪沉积等方面的调控机理以及肉质形成的分子机制开展深入研究,有利于更好地实现对陆川猪开发利用。 虽然,已经陆续有学者对陆川猪肉质相关基因进行了研究,开展遗传多样性、表达量、蛋白功能预测等方面的研究,但是研究不够深入,缺乏系统性;而且,肉质相关的候选基因之间存在相互作用,因此后期研究可能需要把候选基因作为一个整体因素去考虑,在挖掘分子标记方面也不再只考虑单个多态位点对肉质性状的影响,而是同时考虑多个多态位点的综合效应;研究这些基因之间的调控网络,以及脂肪代谢相关通路之间的关系将对揭示猪肉质形成的机制具有关键性意义。

