小麦IQM基因家族鉴定及非生物胁迫下表达分析
梁婷, 左静红, 陆青, 杨东, 唐益苗, 郭春曼*,汪德州*, 王伟伟*
(1.长江大学农学院,湖北 荆州 434025; 2.北京市农林科学院杂交小麦研究所,北京 100097)
钙离子(Ca2+)是细胞内重要的第二信使之一,在植物生长发育、逆境胁迫等生物学过程中发挥重要作用[1]。植物主要通过钙离子传感器监测细胞质中Ca2+水平变化,进而调控一系列下游反应[2-3]。钙离子传感器分为4类:钙调素 (calmodulin,CaM)、钙调素类似蛋白 (calmodulin like protein,CML)、钙调神经磷酸酶B 样蛋白 (calmodulin B-like,CBL)和钙依赖型蛋白激酶 (calcium dependent protein kinase,CDPK)[4-5]。其中,钙调素是一种高度保守的小型酸性蛋白,自身没有酶活性,在结合Ca2+后产生构象变化,激活其下游靶蛋白-钙调素结合蛋白(calmodulin binding protein,CaMBP)行使其功能。CaM 与CaMBP 结合类型分为2 类,需要Ca2+参与的为Ca2+依赖型,不需要Ca2+参与的为Ca2+不依赖型[6]。Ca2+不依赖型中存在含有IQ 基序(IQxxxRGxxxR)的钙调素结合蛋白,根据结构域和所含IQ 基序数量的不同,将此种钙调素结合蛋白分为5类,分别是IQM (IQ motif containing protein)、CAMTA(calmodulin-binding transcription activator)、IQD (IQ67-domain containing protein)、CNGC(cyclic nucleotide-gated channel)和myosin。其中,IQM 只含有1 个能与钙调素结合的IQ 基序,且该基序位于氨基酸序列N端[7]。IQM 广泛存在于植物的根、茎、叶、花和果实等器官中,是钙调素结合蛋白家族基因中非常重要的一类,与其他钙调素结合蛋白家族相比,植物特异性IQM基因仅在拟南芥、水稻中进行了全面分析,其他物种中甚少报道。报道显示,IQM基因在各种不同组织及不同胁迫条件下的表达量有显著变化,其可能参与植物生长发育、逆境胁迫等多种生理调控过程[8]。
拟南芥中已鉴定出6 个IQM基因家族成员(IQM1~IQM6),其 蛋 白 质N 端均含有1 个IQ 基序[2]。AtIQM1与AtCaM5能在酵母和植物细胞中结合,并以Ca2+依赖型方式通过影响活性氧(reactive oxygen species,ROS)的含量来调节气孔运动[9],AtIQM1的突变体气孔开度显著减小,且不受外因(光照、黑暗等)诱导,过表达AtIQM1植株在光诱导气孔开放处理后气孔开放度明显增大[10]。此外,AtIQM1在调控根系生长、茉莉酸甲酯(methyl jasmonate,MeJA)生物合成及防御灰霉病过程中也发挥重要作用[2,11];AtIQM2参与拟南芥根的生长发育及开花调控,AtIQM2突变体成花时间推迟[12];AtIQM3通过调控拟南芥光周期途径进而影响开花时间[13];AtIQM4对植物生长发育起正调控作用,在种子休眠和萌发期发挥重要作用[14];AtIQM5通过参与调控年龄途径影响拟南芥开花时间[15];AtIQM6基因突变致使远轴面表皮毛的发生晚于野生型[16]。水稻中已报道7 个IQM基因家族成员,研究显示OsIQMs通过与OsCaMs相互作用参与多种通路调控,并且OsIQMs中的IQ 基序是OsIQMs与OsCaMs结合所必需的,几乎所有的OsIQMs基因都是ABA 和MeJA 响应基因,OsIQM1通过与OsWRKY24共同作用参与植物病害反应[7]。
小麦是最重要的粮食作物之一,提高小麦抗逆性、增加小麦产量,是解决粮食安全问题的关键因素。植物特异性IQM基因参与逆境胁迫调控,但小麦中IQM基因家族成员及功能尚未进行系统报道。本研究在小麦全基因组水平下共鉴定出23 个TaIQM基因家族成员,对其染色体位置、基因结构、系统发育关系、蛋白保守结构域、非生物胁迫下的基因表达模式等进行了系统分析,筛选得到了一些可能参与小麦逆境胁迫相关的候选基因,为深入研究小麦IQM基因的重要生物学功能提供依据。
1 材料与方法
1.1 试验材料
本研究选取小麦标准栽培品种中国春(Chinese spring, CS)为试验材料,将种子置于25 ℃的光照培养间水培,待长到2 叶1 心期,对小麦幼苗分别进行PEG-6000 溶液、低温(4 ℃)、高温(42 ℃)、NaCl (0.2 mol·L-1)和ABA(0.15 mol·L-1)胁迫处理,设3 次生物学重复,以0 h 未处理的地上部和地下部组织作为对照(CK),在处理1、3、6、12、24 h 后取地上部和地下部组织,液氮冷冻后,-80 ℃保存备用。
1.2 试验方法
1.2.1 小麦IQM基因家族鉴定 从Ensembl Plants (http://plants.ensembl.org/index.html)数据库中获取拟南芥、水稻IQM 家族蛋白序列及小麦全基因组CDS 和蛋白序列,利用HMMER 软件构建隐马尔可夫模型,使用SMART(http://smart.emblheidelberg)、Pfma(https://pfam.xfam.org/)确 认是否含有完整的IQ 结构域[17]。使用ExPASy(http://web.expasy.org/protparam/)在线网站获取小麦IQM 家族成员蛋白质氨基酸数、分子量等理化性质数据。使用Euk-mPLoc 2.0 server (http://www.csbio.sjtu.edu.cn/bioinf/euk-multi-2/)网站在线进行亚细胞定位预测分析。
1.2.2 小麦IQM基因家族系统进化树构建 运用MEGA X 中的Align by Clustal W 对小麦、水稻、拟南芥IQM 基因家族蛋白序列进行多序列比对,参数设置为默认值,Bootstrap 值设置为1 000,采用Neighbor-Joining 法构建系统进化树,构建所得进化树使用 Evolview(https://evolgenius. info//evolview-v2/#login)在线工具进行处理。
1.2.3 小麦IQM基因结构和蛋白保守基序分析使用GSDS 软件(http://gsds.gao-lab.org/)分析小麦IQM 基因家族成员基因结构,使用MEME(http://meme-suite.org/tools/meme)进行保守基序测定,最大Motif 数量设置为10,其他参数为默认值,利用TBtools 软件中的Gene Structure View 程序进行可视化。
1.2.4 小麦IQM基因启动子顺式作用元件预测从Ensembl Plants数据库中提取小麦IQM基因起始密码子上游2 000 bp 序列,使用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测启动子顺式作用元件[18],利用TBtools 软件中Gene Structure View程序进行可视化。
1.2.5 小麦IQM基因组织表达模式分析 利用WheatOmics 1.0(http://202.194.139.32/)查找并下载中国春不同组织不同时期的转录组测序数据,分析小麦IQM基因的组织表达特异性,使用TBtools软件中的HeatMap程序绘制表达模式热图。
1.2.6 小麦IQM基因成员非生物胁迫表达模式分析 依据数据库中下载的小麦IQM基因CDS序列,避开保守结构域设计qRT-PCR 引物(表1)。采用Trizol 法提取胁迫处理小麦材料总RNA 后,用1.5%琼脂糖凝胶电泳检测,同时测定OD260/280值。使用HiScriptⓇⅢ 1stStrand cDNA Synthesis Kit (诺唯赞生物科技股份有限公司)反转录合成cDNA,以反转录获得的cDNA 为模板进行qRT-PCR 分析。反应体系为20 μL,包括Taq Pro Universal SYBR Qpcr Master Mix(诺唯赞生物科技股份有限公司) 10 μL、上下游引物(10 μmol·L-1)各1 μL、cDNA 模板2 μL(100 ng),ddH2O 6 μL。qRT-PCR 反应程序为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,40 个循环后增加熔解曲线环节,95 ℃变性5 s,60 ℃退火30 s,95 ℃变性15 s,扩增曲线和熔解曲线鉴定引物特异性。3 次生物学重复,采用2-△△CT法[19]计算相对表达量。

表1 qRT-PCR引物Table 1 qRT-PCR primers 续表Continued

表1 qRT-PCR引物Table 1 qRT-PCR primers
2 结果与分析
2.1 TaIQM基因家族鉴定及序列分析
利用生物信息学方法获得23 个TaIQM基因家族成员。Pfam 分析表明,TaIQM 蛋白均含有IQ结构域。按照其在小麦染色体上的位置依次命名为TaIQM1~TaIQM23(表2)。染色体定位显示TaIQM基因不均匀的分布在18条染色体上,其中,5A、5B、5D、6B 和6D 染色体上均含有2 个IQM基因,其他染色体上均只含有1个IQM基因。对23个TaIQM 蛋白的氨基酸数目、相对分子量、等电点等蛋白质理化性质的分析结果显示,TaIQM基因家族成员编码的氨基酸数目在424~669 个之间,相对分子量在47 667.67~74 779.20 Da之间,等电点在6.14~9.67 之间,TaIQM 蛋白间氨基酸数目存在较大差异,相应的蛋白相对分子量、等电点也存在较大差异。亚细胞定位预测显示TaIQM家族基因主要存在于细胞核中。
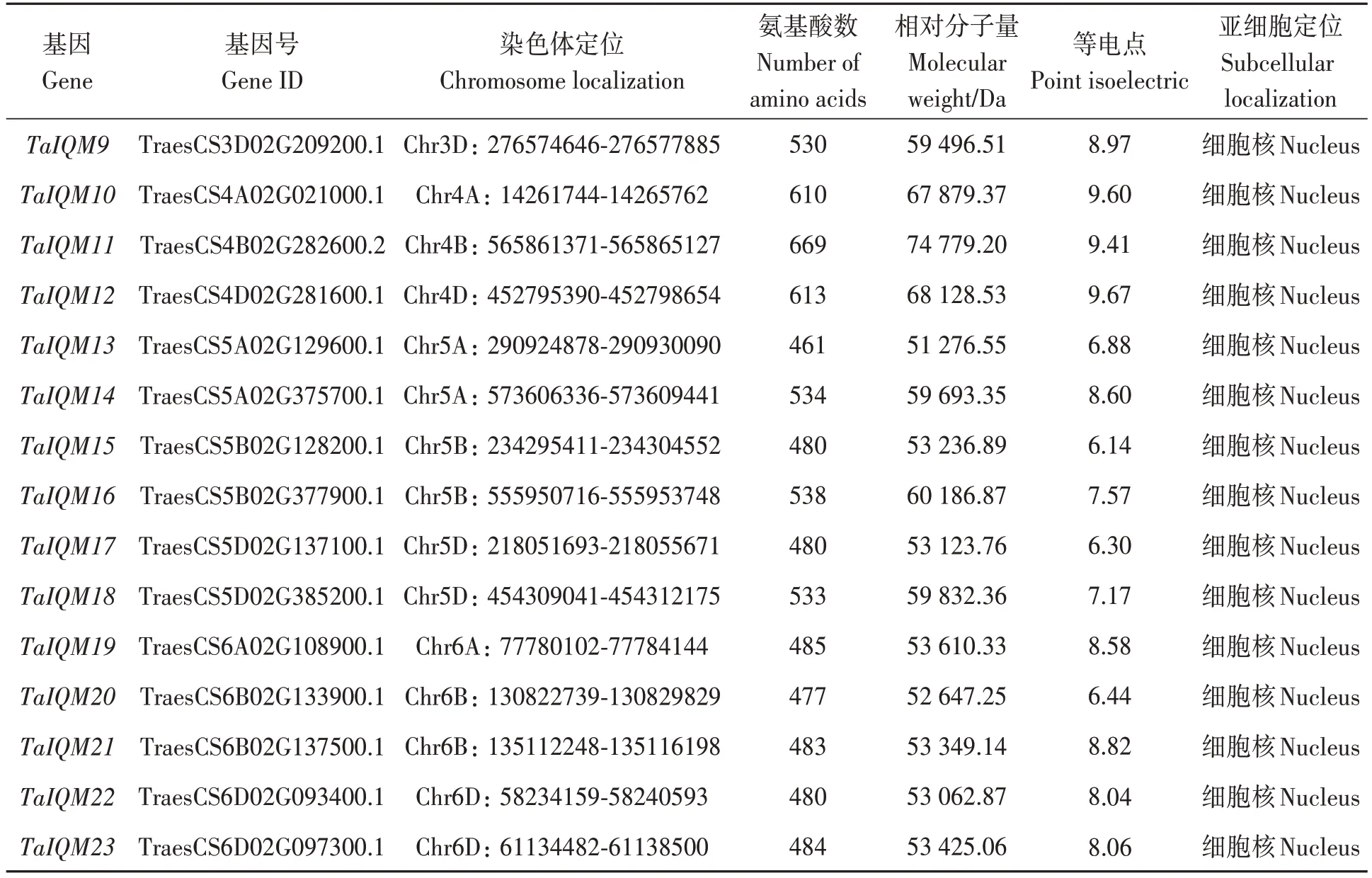
表2 小麦IQM基因家族蛋白理化性质及亚细胞定位Table 2 Characteristics and subcellular localization prediction of TaIQM genes 续表Continued
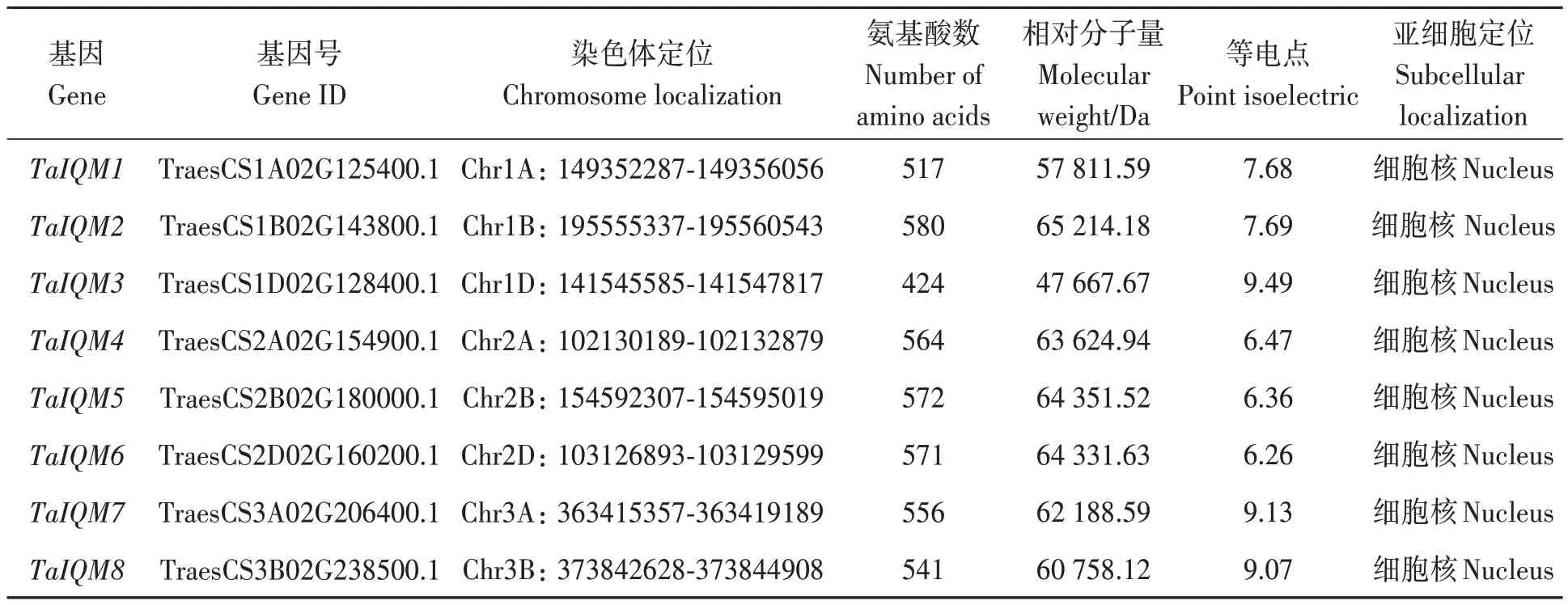
表2 小麦IQM基因家族蛋白理化性质及亚细胞定位Table 2 Characteristics and subcellular localization prediction of TaIQM genes
2.2 TaIQM基因家族蛋白系统进化分析
为研究小麦IQM基因与水稻、拟南芥的系统进化关系,将23 个小麦 (Triticum aestivumL.)、8 个水稻(Oryza sativa)和6 个拟南芥(Arabidopsis thaliana)的IQM蛋白序列进行多序列比对后构建系统进化树(图1)。结果显示,IQM基因家族成员可分为3个亚家族(Ⅰ、Ⅱ、Ⅲ),Ⅰ中共有15个IQM基因家族成员,其中小麦IQM基因9个,TaIQM4、TaIQM5、TaIQM6与OsIQM5在一个分支上,表明他们之间进 化 关 系 相 近;TaIQM10、TaIQM11、TaIQM12与OsIQM2、TaIQM6在 一 个 分 支 上;TaIQM14、TaIQM16、TaIQM18与OsIQM3在一个分支上,他们都与AtIQM2和AtIQM6属于同一亚家族。Ⅱ中含有11个IQM基因家族成员,其中小麦IQM基因6 个,TaIQM1、TaIQM2、TaIQM3与OsIQM4在同一分支上;TaIQM7、TaIQM8、TaIQM9与OsIQM1在同一分支上,他们都与AtIQM1、AtIQM4和AtIQM5属于同一亚家族。Ⅲ中含有11 个IQM基因家族成员,其中小麦IQM基因8个,TaIQM13、TaIQM15、TaIQM17、TaIQM19、TaIQM20、TaIQM21、TaIQM22、TaIQM23与OsIQM7、OsIQM8、AtIQM3属于同一亚家族。所有亚家族中小麦与水稻IQM家族成员进化关系较近,同源性较高,与拟南芥亲缘关系较远,表明IQM家族基因在单子叶植物和双子叶植物进化过程中发生了分离。
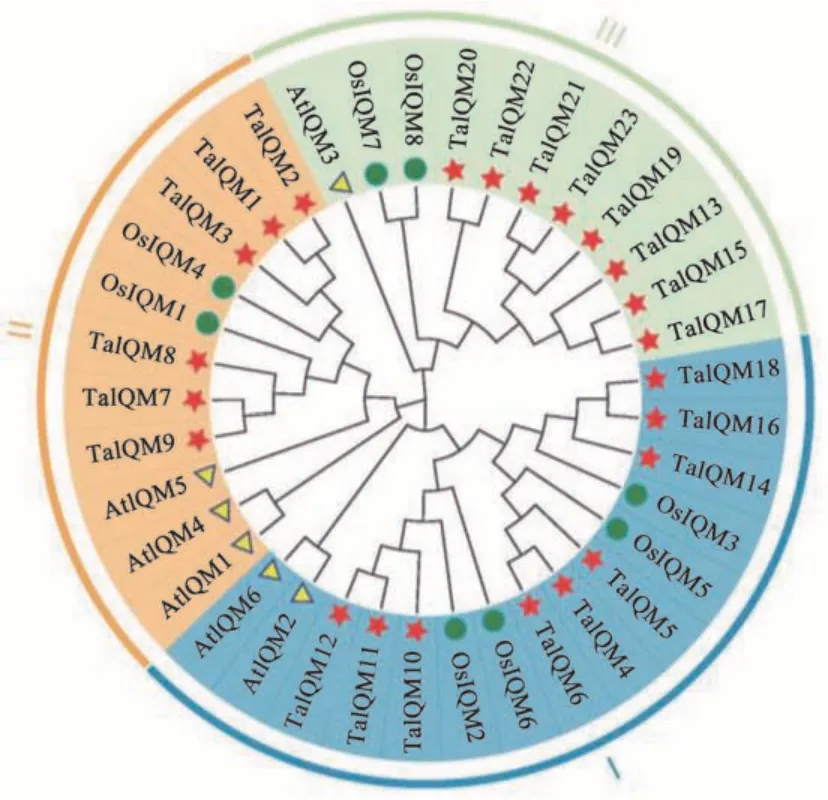
图1 IQM蛋白进化树分析Fig. 1 Phylogeny analysis of IQM proteins
2.3 TaIQM基因家族成员结构特性
TaIQM基因结构分析显示,所有TaIQM基因均含有内含子、外显子,家族成员间基因结构呈现多样性(图2A)。TaIQM基因含有外显子数量在5~10 个之间,其中,TaIQM3只含有5 个外显子;TaIQM4、TaIQM5等5 个 基 因 含 有7 个 外 显 子;TaIQM9、TaIQM11等5 个基因含有8 个外显子;TaIQM1、TaIQM10等11 个基因含有9 个外显子;TaIQM2含有11个外显子。除TaIQM2、TaIQM8和TaIQM20外,其他都含有3'UTR。蛋白基序分析显示(图2B),TaIQM基因家族中有16个基因均含有10 个相同基序;TaIQM1、TaIQM2、TaIQM7等5 个基因只含有9 个Motif,不含有Motif10;TaIQM3仅含有6个Motif;所有TaIQM基因都含有Motif6(IQM基因家族保守结构域)(图2C)。以上说明相似度较高的TaIQM基因间可能有相同进化方向。

图2 TaIQM家族成员结构特征和保守基序分析Fig. 2 Structure and conservative motif analysis of the TaIQM
2.4 TaIQM基因顺式作用元件
TaIQM基因包含多种胁迫响应顺式作用元件(图3),如干旱诱导(MBS)、厌氧(ARE)、低温(LTR)、防御与应激(TC-rich repeats)响应元件,还包含多种激素响应顺式作用元件,如脱落酸(ABRE)、生长 素(TGA-element)、赤 霉 素(GARE-motif、P-box、TATC-box)和水杨酸(TCA-element)响应元件,推测TaIQM可能参与胁迫响应和激素响应过程。此外,TaIQM基因还包含一些保守的顺式作用元件(如CAAT-box、TATA-box 等)和一些光响应(ACE、G-box)、分生组织表达调控(CAT-box)、昼夜节律调控(circadian)和胚乳表达调控(GCN4-motif)等元件,预示着TaIQM家族可能还参与其他多种生物学过程。
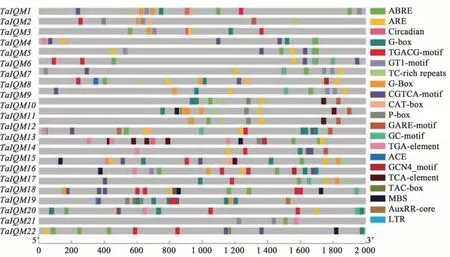
图3 TaIQM启动子顺式作用元件预测Fig. 3 Cis-acting elements analysis of TaIQM genes
2.5 TaIQM基因组织表达特性
根据网站中已有的转录组数据,绘制23 个TaIQM基因的组织表达量热图(图4)。结果显示,不同TaIQM基因间表达量差别明显,同一TaIQM基因在不同组织的不同时期间表达量也存在差别。其中,TaIQM2在不同组织中都有较高的表达量;TaIQM10、TaIQM11和TaIQM12在不同组织中表达量极低;TaIQM4和TaIQM5在拔节早期的茎中表达量较高;TaIQM7、TaIQM8和TaIQM9在分蘖早期和开花后2 d 的叶中表达量较高;TaIQM13在1 叶期的根中表达较高;TaIQM6、TaIQM15和TaIQM17在拔节早期的穗中表达量较高;TaIQM18在根的不同时期中表达较高;TaIQM19、TaIQM21和TaIQM23在开花后2 d 的籽粒中表达量较高。基因的表达量变化表明在不同的发育时期各个TaIQM基因功能各不相同。

图4 TaIQM基因在不同组织中的表达量热图Fig. 4 Heat map of relative expression level of TaIQM genes in different tissues
2.6 非生物胁迫下TaIQM基因qRT-PCR分析
TaIQM基因家族成员对非生物胁迫存在不同程度的响应,相对表达量存在明显差异(图5)。低温处理下,7 个TaIQM基因在地上部呈现下调表达趋势,如TaIQM10、TaIQM11和TaIQM12;3个TaIQM基因在地下部呈现下调表达趋势,如TaIQM1、TaIQM2、TaIQM3。高 温 处 理 下,2 个TaIQM基因在地上部呈现下调表达趋势,如TaIQM7和TaIQM9;全部TaIQM基因在地下部均呈现不同程度的上调表达趋势。NaCl 处理下,11个基因在地上部呈现上调表达趋势,如TaIQM4、TaIQM5和TaIQM6;9 个基因在地下部呈现上调表达趋势。ABA 处理下,2 个基因在地上部呈现上调表达趋势,如TaIQM11和TaIQM12;6 个基因在地下部呈现上调表达趋势,如TaIQM10、TaIQM13(图5A)。干旱处理下,17个TaIQM基因在地上部均呈现不同程度的上调表达趋势,如TaIQM10、TaIQM11和TaIQM12,其余6 个TaIQM基因在地上部呈下调表达趋势;所有TaIQM基因在地下部均呈现明显上调表达趋势(图5B)。推测在小麦苗期地下部,干旱胁迫对所有TaIQM基因的表达存在促进作用。
3 讨论
IQM基因广泛存在于植物中,参与调控众多生理生化过程,在拟南芥、水稻中已有系统研究,而在小麦中还未见报道。本研究在小麦全基因组中鉴定出23个IQM 基因家族成员,对获得的TaIQM基因染色体位置、蛋白理化性质、系统发育关系、基因结构、蛋白保守结构域、表达模式等进行全面分析。
根据系统发育关系,IQM基因家族被划分为3 个亚族。系统发育关系揭示了IQM 蛋白之间的进化关系,同一亚科中最近缘的成员在保守蛋白序列和基序结构上相似,每个亚家族的IQM 蛋白可能具有相似的功能[20]。保守蛋白序列分析显示,小麦IQM基因均存在6 个相同的Motif,其中Motif 6是位于蛋白序列N端且包含IQ基序的IQM基因家族保守结构域[7]。IQ 结构域与钙调蛋白结合结构域密切相关,报道显示,IQD 蛋白与玉米、毛竹和拟南芥中的CaMs 相互作用[21],拟南芥中,IQM 蛋白与CaMs 相互作用[2]。基因结构分析显示,多数基因的3'端和5'端都含有UTR,且都存在7~10个外显子。在Motif相同情况下,内含子/外显子结构差异是推动多基因家族演变的关键因素之一。顺式作用元件分析发现TaIQM基因存在大量与生长发育、胁迫应答、激素调节相关的顺式作用元件,推测TaIQM基因可能通过与干旱诱导、脱落酸、赤霉素等转录因子结合位点相互作用调控干旱应答,但还需相关试验进一步验证。钙调素信号转导途径是调控植物生长发育、逆境胁迫的重要信号组成部分,主要由钙离子、钙调素及钙调素结合蛋白组成[5]。目前,已报道的钙调素结合蛋白多达90 种以上,如MYB、NAC、WRKY、CBP60、CAMTA/SR 等转录因子[3],它们通过协同作用调控植物生长发育及胁迫反应,如OsWRKY24通过与OsIQM1协同作用应对植物病害反应。23个TaIQM基因在不同发育阶段和不同组织中表达差异显著,这些基因可能通过与其他转录因子协同作用参与调控小麦生长发育过程。
植物中的IQM基因在干旱、低温等非生物胁迫应答中起重要作用[22],且在不同时空条件下参与调节不同的胁迫反应[21]。报道显示,AtIQM1介导CaM、光和部分非生物胁迫信号的转导[2],AtIQM4在拟南芥中与AtIQM1协同参与光和ABA对气孔运动的调控[23],盐和渗透胁迫均可降低拟南芥苗期AtIQM1和AtIQM4的表达水平,脱水、低温处理均能提高AtIQM4的表达水平,AtIQM4在植物非生物胁迫响应中起重要作用[14]。水稻中7 个IQM基因在重金属盐CdCl2和Pd(NO3)2处理下的拟南芥幼苗中全部显示上调表达。OsIQM3和OsIQM5在PEG 胁迫反应中显示较高的转录水 平[7]。TaIQM7、TaIQM8和TaIQM9与AtIQM1、AtIQM4进化关系相近,干旱胁迫下TaIQM7、TaIQM8和TaIQM9在地下部显著上调表达,与AtIQM4的表达模式相似,基因表达模式为研究基因功能提供重要依据,这些基因在小麦干旱胁迫应答反应地下部中均呈现正向调控,结合组织表达数据中TaIQM7、TaIQM8和TaIQM9在根和叶组织中偏好表达,表明TaIQM7、TaIQM8和TaIQM9可能参与调控小麦苗期地下部抗旱反应。这些基因可作为抗旱候选基因进一步深入研究。
本研究在小麦全基因组水平上系统鉴定和分析了23 个小麦IQM基因,对其生物信息学及非生物胁迫下表达模式进行了系统分析。进化树分析表明小麦IQM基因分为3 个亚家族(I~III),基因结构和蛋白质序列分析表明这些基因在每个亚家族中都相对保守。非生物胁迫下的表达模式分析表明绝大多数IQM基因对PEG、NaCl、冷和 ABA 处理有反应,说明它们参与植物响应非生物胁迫调控过程。本研究结果为深入探究小麦IQM家族各成员的生物学功能及非生物胁迫作用机制和小麦抗逆分子育种提供一定参考。

