tva受体基因起始密码子突变对鸡感染A亚群禽白血病病毒的影响
陈伟国,邝智祥,张翔宇,李文雪,徐慧娟,朱学凤,谢青梅
(1华南农业大学动物科学学院/广东省畜禽健康养殖与环境控制重点实验室,广东 广州 510642;2广东爱健康生物科技有限公司,广东 清远 511800)
禽白血病是由禽白血病病毒(Avian leukemia virus,ALV)引起的一类禽免疫抑制性肿瘤性传染病。可自然感染鸡群的禽白血病病毒包括ALVA~E、J和K 7个亚群,其中ALV-A是引起我国鸡群发生禽白血病的主要病原[1-2]。ALV-A可使感染鸡群产生免疫抑制、生产性能下降,乃至发生特征性肿瘤而死亡,给养禽业造成巨大的经济损失[3-4]。目前,该病鲜有商品化疫苗和有效的治疗方法,主要通过净化种群和生物安全措施进行预防[5]。然而,近年来禽白血病的流行病学调查研究发现,ALV-A在我国地方鸡种[6-7]、商品肉鸡[8]、蛋鸡[9]及野生鸟类[10]中普遍存在。可见,现有措施并不能完全控制A亚群禽白血病在中国的发生与流行,该病已成为威胁我国养鸡业(尤其是种鸡业)可持续健康发展的重大疾病之一。因此,研发更适合防控我国A亚群禽白血病的新策略已迫在眉睫。国外已有研究证实,提高宿主对A亚群禽白血病的遗传抗性,开展A亚群禽白血病的抗病育种可成为防控该病的有效策略[11-13]。
ALV-A由tva受体基因编码的细胞表面特异性受体Tva介导侵入宿主细胞,继而发生感染[14]。tva受体基因的遗传突变会导致Tva受体蛋白的完全缺失或表达一个不适宜作为ALV-A受体的缺陷型Tva受体蛋白,从而引起宿主细胞对ALV-A的感染产生遗传抗性[15]。在国外白来航近交品系tva受体基因中已经鉴定了tvar1、tvar2、tvar3和tvar44个ALV-A遗传抗性位点[16-17]。Chen等[18]首次从中国鸡种中成功鉴定了tvar5和tvar62个ALV-A遗传抗性位点。另外,我们前期研究(未发表)发现中国鸡种tva受体基因存在新的自然突变位点:tva基因编码区第3位碱基由G突变为A,推测该突变引起tva基因起始密码子序列由ATG突变为ATA,将该tva基因自然突变命名为tva c.3G>A,但其对宿主感染A亚群禽白血病病毒的影响尚不清楚。因此,本研究拟通过ALV-A体外感染试验和体内攻毒试验,从体外、体内2个层面验证tva c.3G>A突变是否引起宿主对ALV-A的感染产生遗传抗性,以期鉴定新的ALV-A遗传抗性位点。
1 材料与方法
1.1 试验动物、病毒、细胞株及质粒
黄羽肉鸡品系CB01~CB15[19]抗凝血样采自于温氏食品集团股份有限公司,每个品系随机采取36~60份血样,共670份血液样品。1日龄无特定病原(Specific pathogen free,SPF)鸡苗购自广东大华农有限公司。ALV-A GD08株、DF-1细胞系为广东省畜禽健康养殖与环境控制重点实验室保存。RCASBP(A)-GFP重组质粒为广东省畜禽健康养殖与环境控制重点实验室前期构建并保存[18]。
1.2 主要试剂
血液/细胞/组织基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;质粒小量提取试剂盒、无内毒素质粒大量提取试剂盒、凝胶DNA回收试剂盒均购自OMEGA公司;ReverTra Ace®qPCR RT Kit、KOD-FX购自Toyobo公司;FastStart SYBR Green Master(Rox)购自Roche公司;反转录试剂盒、pMD19-T、PrimeScript®One Step RT-PCR Kit购自Takara公司;Opti-DM EM无血清培养基、DMEM细胞培养基、胎牛血清、胰蛋白酶、青链霉素均购自Gibco公司;TRIZOL reagent、Lipofectamine 3000转染试剂购自Invitrogen公司。
1.3 黄羽肉鸡品系tva基因的遗传变异分析
参考NCBI数据库中鸡tva基因的DNA序列(GenBank登录号:AY531262.1),应用Primer 5.0软件设计3对引物,分3个片段(1、2和3段)PCR扩增tva基因全长序列3 607 bp,引物信息见表1。提取黄羽肉鸡品系CB01~CB15血液样品的基因组DNA,用该3对引物PCR扩增tva基因全长序列。将PCR扩增产物送生工生物工程(上海)股份有限公司测序,应用DNAstar和Mutation Surveyor基因序列分析软件比对tva基因序列和测序序列,分析黄羽肉鸡品系tva基因的遗传变异,对tva c.3G>A突变位点进行基因分型。

表1 tva受体基因全长序列PCR扩增引物信息Table 1 Primers used to amplify the whole sequence of tva receptor gene
1.4 tva基因mRNA的RT-PCR扩增
采用Trizol法提取tva c.3G>A突变位点野生型tva c.3G/G和纯合突变型tva c.3A/A种鸡血液的总RNA,参考反转录试剂盒说明书反转录成cDNA。参考文献[18]中的引物序列和PCR反应体系、扩增条件,利用KOD-FX高保真酶RTPCR扩增tva基因整个编码序列。回收、纯化的RT-PCR产物克隆入pMD 19-T,送生工生物工程(上海)股份有限公司测序,测序结果应用Lasergene 7.1软件进行分析。
1.5 鸡胚成纤维细胞分离与培养
采集10日龄鸡胚消毒后,用镊子打开气室和壳膜,夹起鸡胚,用眼科剪刀和镊子剔除头、爪、骨头和内脏,把鸡胚组织块置于平皿中,用PBS液漂洗去除血污。将漂洗好的组织块放入5 m L离心管,用眼科剪刀剪至肉糜状,用0.25%(w)的胰酶在37℃水浴箱中消化15~20min,加入适量的小牛血清终止消化。使用200目细胞滤膜过滤后,1 000 r/min离心5min,弃掉上清液,用完全培养基对细胞进行重悬,分装入无菌培养皿中,获取纯化的鸡胚成纤维细胞(Chicken embryo fibroblast,CEF),细胞置于CO2体积分数为5%、37℃的培养箱内培养。
1.6 流式细胞术检测RCASBP(A)-GFP报告病毒感染
将重组质粒RCASBP(A)-EGFP转染入DF-1细胞中,转染后第7天,拯救并收集DF-1细胞上清液中表达绿色荧光蛋白的重组病毒RCASBP(A)-GFP,测定病毒感染单位(IU)后,分装保存于−80℃备用。分离与培养tva c.3G>A突变位点野生型tva c.3G/G、杂合突变型tva c.3G/A和纯合突变型tva c.3A/A CEF,分别接种于24孔板中,每孔接种5×104个细胞,培养24 h后,每孔接种5×105IU/m L的RCASBP(A)-GFP病毒液。孵育2 h后,弃掉病毒液,用含1%(φ)胎牛血清的维持液继续培养。感染后第1、2、3、7天,使用Cytomics FC 500分析仪(Beckman Coulter,USA)通过荧光激活细胞分选(Fluorescence-activated cell sorting,FACS)定量tva c.3G>A突变位点不同基因型CEF的GFP阳性细胞百分比。
1.7 ALV-A体内感染试验
前期研究发现tva c.3G>A突变主要存在于CB06品系。从CB06品系随机挑选75只1日龄雏鸡随机分为3组,每组25只商品鸡和3只SPF鸡作为对照,饲养于3个隔离器,并随意提供饲料和水。1日龄时,每只雏鸡腹腔接种ALV-A GD08株病毒液(S/P=2.1)0.2m L,5日龄时,再攻毒1次。攻毒后1周,采集每只雏鸡抗凝血样,抽取全基因组DNA,通过直接测序方法对每只雏鸡tva c.3G>A突变位点进行基因分型。攻毒后1个月,采集雏鸡的血样,利用Trizol试剂盒抽提血样总RNA,利用ALV-A GD08株特异性检测引物,RT-PCR检测每只雏鸡的病毒血症情况,确定tva c.3G>A突变不同基因型雏鸡对ALV-A GD08株的感染状态[18]。
1.8 统计分析
所有数据均使用GraphPad Prism 7.0软件进行绘图和数据统计分析,2组数据比较采用独立样本t检验分析,数据结果以平均值±标准差表示。利用Popgene软件分析tva c.3G>A突变位点在我国黄羽肉鸡品系中的基因型频率分布。
2 结果与分析
2.1 黄羽肉鸡品系中tva c.3G>A突变位点的鉴定
为了剖析中国黄羽肉鸡品系tva受体基因的遗传变异,分3个片段PCR扩增每只鸡tva受体基因的基因组区域。如图1所示,PCR扩增出tva基因的1、2和3片段的目的条带,片段大小与预期结果相符。将PCR产物进行Sanger测序,发现中国黄羽肉鸡品系tva基因DNA序列第260位碱基存在由G突变为A的自然突变(图2),进一步分析推测该突变致使tva基因编码区第3位碱基由G突变为A,引起tva基因起始密码子序列由ATG突变为ATA,将该tva基因自然突变命名为tva c.3G>A。为了证实纯合突变型tva c.3A/A转录本存在G>A突变,RT-PCR扩增野生型tva c.3G/G和纯合突变型tva c.3A/A血液tva基因整个编码序列。结果如图3所示,tva c.3G/G和tva c.3A/A基因型血样均扩增出566和420 bp的条带,表明tva c.3G>A突变位点在不同基因型血样均可扩增出tva基因长、短2个转录本。RT-PCR产物的克隆测序结果表明,与野生型tva c.3G/G相比,纯合突变型tva c.3A/A基因型2个tva cDNA序列第3位碱基均由G突变为A,引起Tva受体蛋白氨基酸序列第1个氨基酸由甲硫氨酸(M)改变为异亮氨酸(I)。
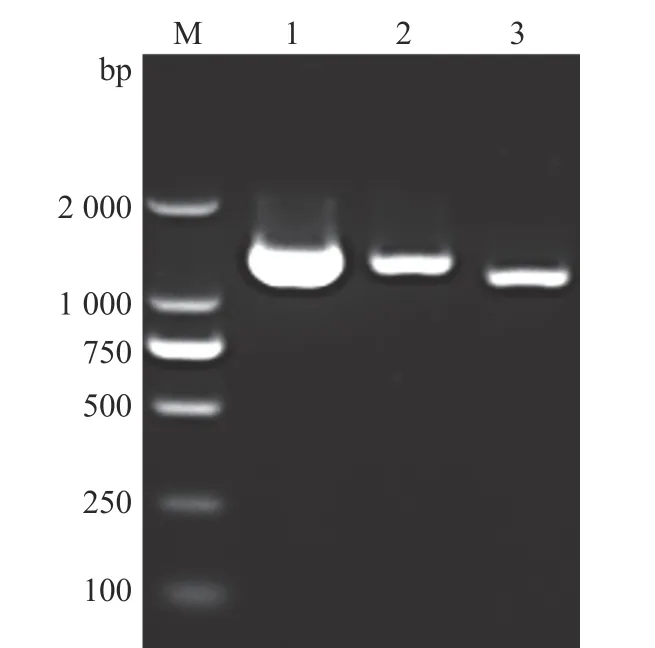
图1 tva基因3个片段的PCR扩增结果Fig.1 PCR amplified results of three fragments of tva gene
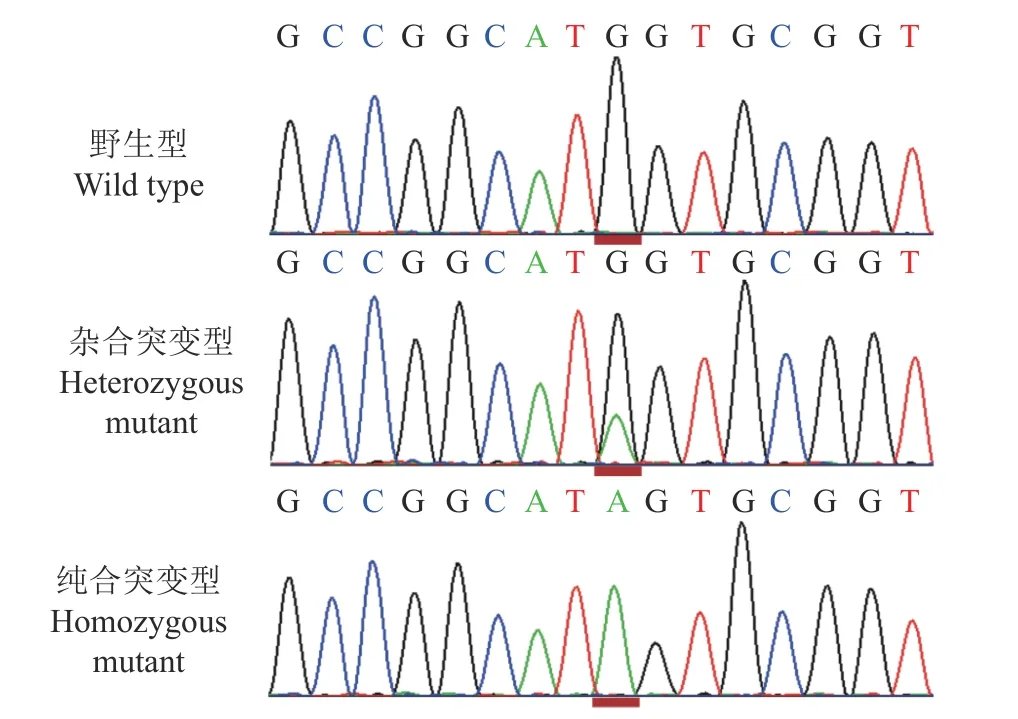
图2 tva c.3G>A突变位点不同基因型测序图Fig.2 Sequence traces for tva c.3G>A mutation sites of different genotypes
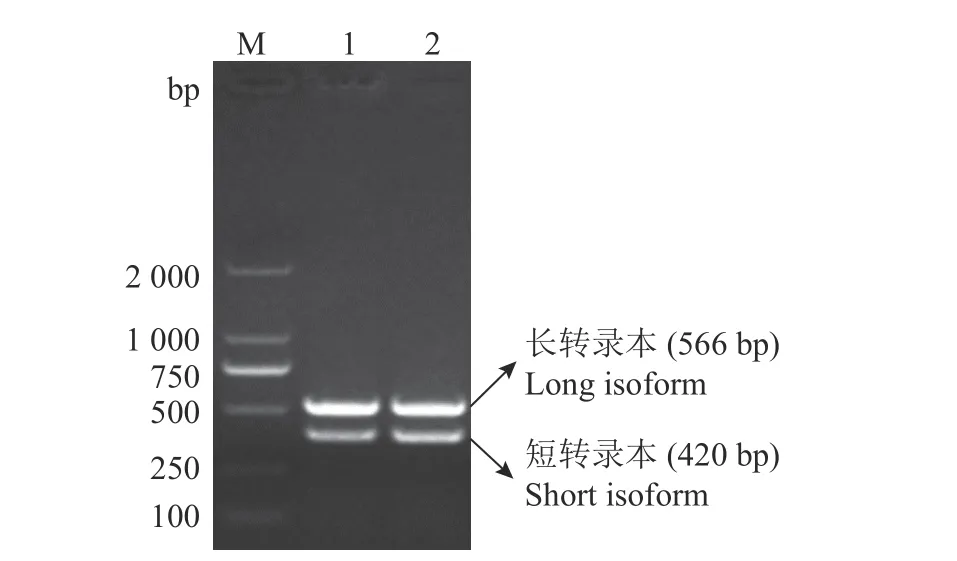
图3 tva c.3G>A突变位点不同基因型血样全长tva编码序列的RT-PCR扩增结果Fig.3 RT-PCR amplified results of the full-length tva coding sequences for blood samples from different genotypes of tva c.3G>A mutation site
2.2 tva c.3G>A突变致宿主体外抗ALV-A感染
RCASBP(A)-EGFP重组质粒转染DF-1细胞48 h后,用倒置荧光显微镜观察到GFP荧光标记蛋白表达,表明成功拯救了RCASBP(A)-GFP荧光报告病毒(图4)。为探究tva c.3G>A突变对宿主细胞体外感染ALV-A的影响,利用拯救的RCASBP(A)-GFP荧光报告病毒分别感染tva c.3G/G、tva c.3G/A和tva c.3A/A CEF,感染后不同时间点利用流式细胞术检测RCASBP(A)-GFP对tva c.3G>A突变位点不同基因型CEF的感染情况,结果如图5和6所示。野生型tva c.3G/G CEF和杂合突变型tva c.3G/A CEF对RCASBP(A)-GFP病毒易感,而纯合突变型tva c.3A/A CEF抗RCASBP(A)-GFP的感染,表明tva c.3G>A突变导致宿主体外抗RCASBP(A)-GFP的感染。

图4 RCASBP(A)-EGFP质粒转染DF-1细胞48 h后的绿色荧光蛋白表达Fig.4 Expression of green fluorescent protein in DF-1 cells after transfection with RCASBP(A)-EGFP plasmid for 48 h
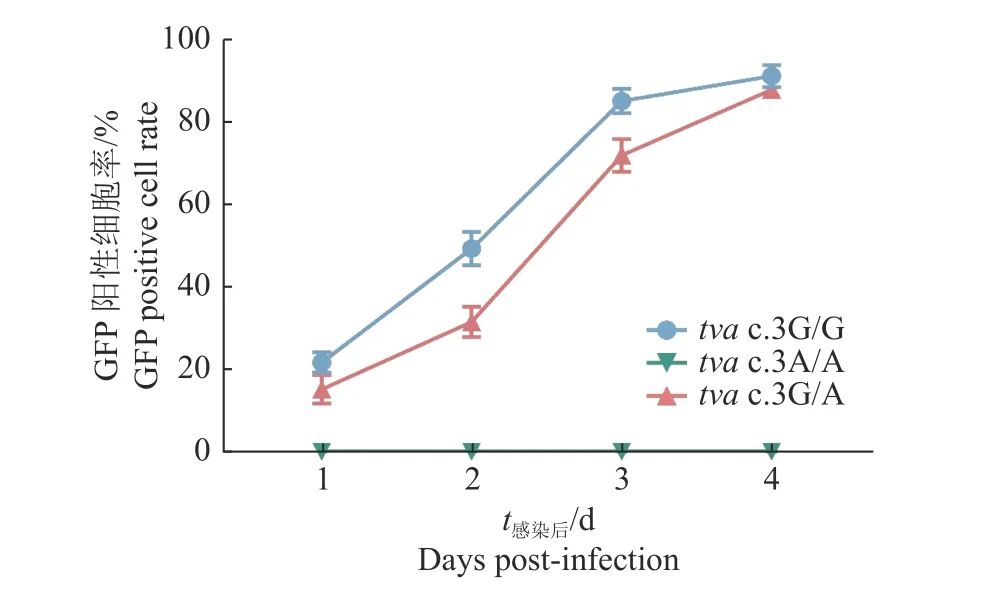
图5 tva c.3G/G、tva c.3G/A和tva c.3A/A CEF感染RCASBP(A)-EGFP的过程Fig.5 Time course of infection of tva c.3G/G,tva c.3G/A and tva c.3A/A CEFs with RCASBP(A)-EGFP
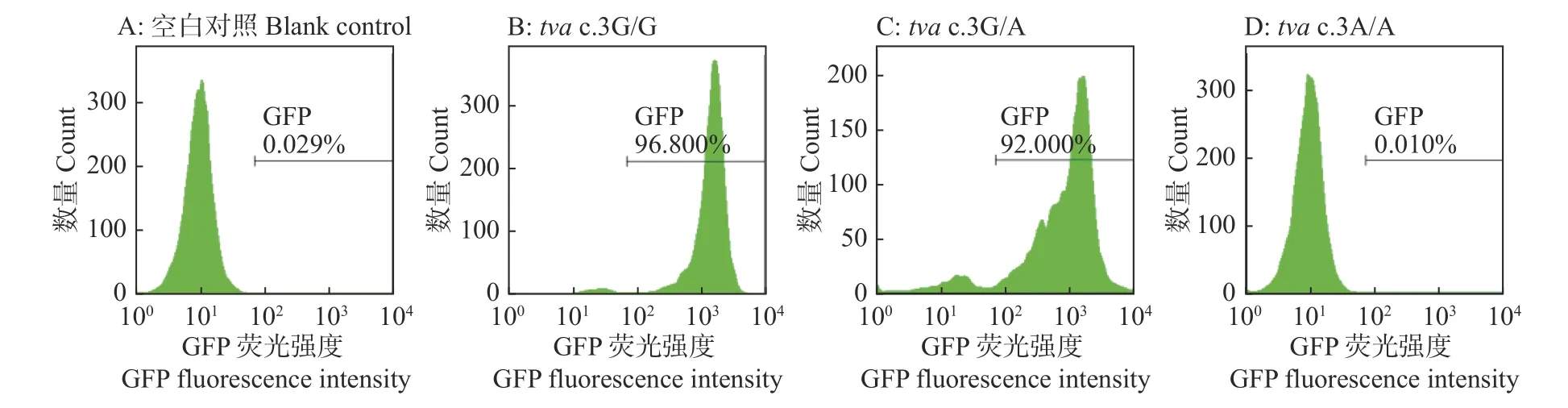
图6 流式细胞术检测tva c.3G>A突变位点不同基因型CEF感染RCASBP(A)-GFP 7 d后的GFP阳性细胞率Fig.6 GFP positive cell rates for CEFs of different genotypes of tva c.3G>A mutation site seven days after infection with RCASBP(A)-GFP detected by flow cytometry
2.3 tva c.3G>A突变致宿主体内抗ALV-A感染
为探究tva c.3G>A突变对宿主体内感染ALVA的影响,利用ALV-A野毒感染tva c.3G>A突变野生型、杂合突变型、纯合突变型雏鸡。作为阳性对照,9只SPF雏鸡攻ALV-A野毒后均为ALVA阳性,说明ALV-A体内攻毒试验成立。ALVA攻毒试验结果显示,野生型tva c.3G/G雏鸡(25只)攻ALV-A野毒后均为ALV-A阳性,杂合突变型tva c.3G/A雏鸡(28只)攻ALV-A野毒后病毒血症阳性率为75%,而纯合突变型tva c.3A/A雏鸡(22只)攻ALV-A野毒后均为ALV-A阴性(表2)。结果表明,tva c.3G>A突变导致宿主体内抗ALVA的感染,ALV-A体内攻毒试验结果与ALV-A体外感染试验结果一致,证实tva c.3G>A突变位点为ALV-A的遗传抗性位点。
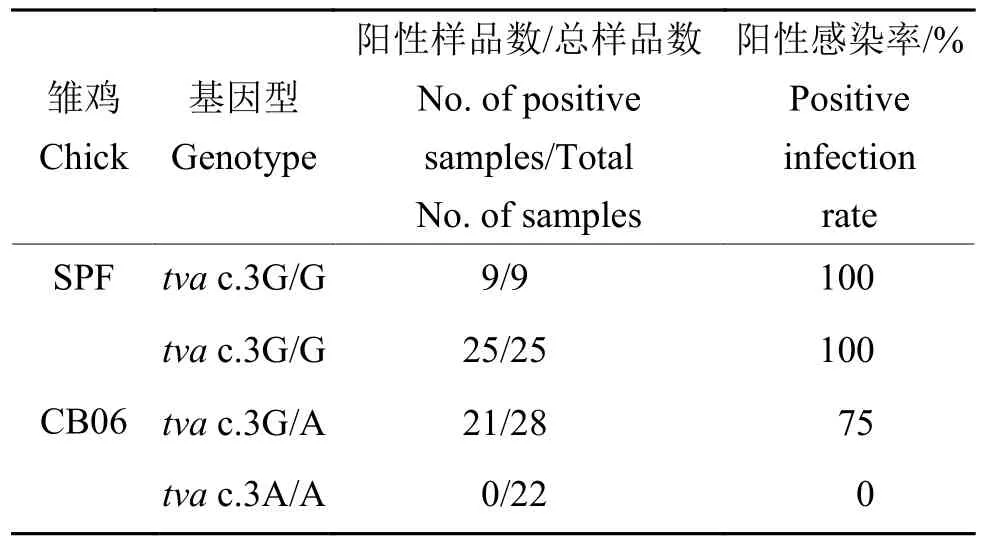
表2 ALV-A攻毒后雏鸡病毒血症阳性率Table 2 Positive infection rate of viremia in chicks infected by ALV-A
2.4 tva c.3G>A抗性位点在不同黄羽肉鸡品系的基因型频率分布
不同黄羽肉鸡品系tva c.3G>A抗性位点的基因分型结果如表3所示。CB01、CB08、CB10和CB15品系中检测到tva c.3G>A抗性位点的杂合基因型tva c.3G/A,其频率分别为0.05、0.05、0.10和0.14,在CB01、CB08、CB10和CB15品系中检测到纯合抗性基因型tva c.3A/A,其频率分别为0.10、0.15、0.23和0.08,其余黄羽肉鸡品系所检样品均为野生型tva c.3G/G。
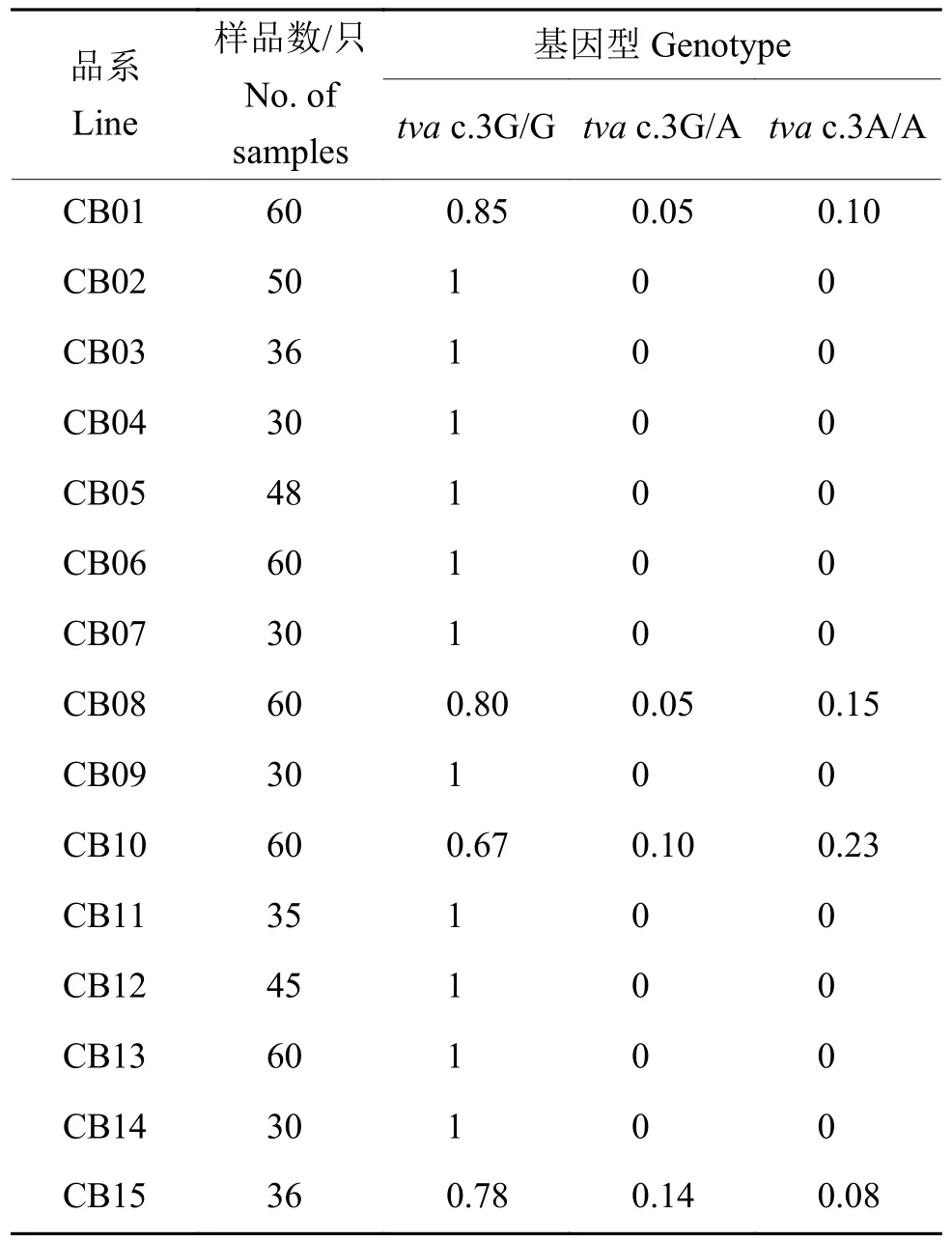
表3 我国黄羽肉鸡品系tva c.3G>A抗性位点的基因型频率分布Table 3 Genotypic frequency of tva c.3G>A resistance locus in Chinese yellow-feathered broiler lines
3 讨论与结论
本研究鉴定了中国黄羽肉鸡品系tva受体基因中存在1种自然突变位点,即tva基因编码区第3位碱基由G突变为A,引起tva基因起始密码子序列由ATG突变为ATA,致使宿主对ALV-A体外、体内的感染产生遗传抗性,证实tva c.3G>A突变位点为ALV-A的遗传抗性位点。据我们所知,本研究首次报道了受体基因起始密码子序列突变可以引起宿主遗传性抗特定ALV亚群的感染,这增强了我们对ALV-A宿主共同进化的理解。
尽管种鸡群净化策略和生物安全措施已用来控制禽白血病[20],但这些传统方法并不能完全消除禽白血病在中国和东南亚国家的发生与流行[21-22]。ALV在鸡群中的流行,致使暴露于ALV的宿主可能会受到选择性压力而对ALV的感染产生完全抗性或者至少降低了对ALV感染的易感性。tva、tvb、tvc和chNEH1受体基因分别编码Tva、Tvb、Tvc和NHE1受体蛋白,分别介导宿主细胞对ALV-A、ALV-B/D/E、ALV-C和ALV-J的感染[14,23-25]。受体基因的遗传突变会导致受体蛋白的完全缺失或表达一个缺陷型受体蛋白,从而引起宿主对ALV的感染产生遗传抗性。目前,已在国外某些白来航近交品系和中国肉鸡品系中鉴定了致使宿主细胞对ALV-A、ALV-B/D/E和ALV-C感染产生遗传抗性的受体基因遗传突变[16,24,26]。Elleder等[16]在白来航品系C中发现tva基因第619碱基由C变为G(tvar1),引起编码的氨基酸由Cys改变为Trp,大大降低ALV-A囊膜糖蛋白与Tva受体的亲和力,从而对A LV-A的感染产生遗传抗性。Elleder等[16]在白来航品系72中发现tva基因碱基序列第305—306位点插入CTCG 4个碱基(tvar2),导致Tva受体蛋白缺失表达,从而产生对ALVA的抗性。Chen等[18]研究发现中国鸡种存在tvar3、tvar4、tvar5和tvar6ALV-A遗传抗性位点,其为位于tva受体基因内含子1破裂点信号保守区域的4种缺失突变,tvar3为tva基因第507—516碱基(序列为ACCCCGCCCC)缺失、tvar4为tva基因第507—511碱基(序列为ACCCC)缺失、tvar5为tva基因第502—511碱基(序列为CGCTCACC CC)缺失、tvar6为tva基因第502—516碱基(序列为CGCTCACCCCGCCCC)缺失,这4种tva受体基因遗传突变均影响tva基因mRNA的剪切,降低了ALV-A囊膜糖蛋白与Tva受体蛋白结合的亲和力,从而降低宿主细胞对ALV-A的易感性。本研究在我国黄羽肉鸡品系中发现tva受体基因始密码子序列由ATG突变为ATA,引起Tva受体蛋白氨基酸序列第1个氨基酸由甲硫氨酸(M)改变为异亮氨酸(I),推测该突变导致Tva受体蛋白的表达完全缺失,从而引起宿主抗ALV-A的感染。
抗病育种是控制禽白血病的有效策略和重要途径,为评估不同黄羽肉鸡品系对ALV-A的遗传抗性,本研究对15个黄羽肉鸡品系tva c.3G>A抗性位点进行了基因分型,结果发现CB01、CB08、CB10和CB15品系存在tva c.3G>A抗性位点,其纯合抗性基因型tva c.3A/A的频率分别为0.10、0.15、0.23和0.08,提示这些黄羽肉鸡品系具有良好的抗ALV-A遗传改良潜力,可从这些鸡品系中筛选出培育抗ALV-A感染的育种素材,并运用于ALV-A遗传抗性鸡品种的选育,为实现A亚群禽白血病抗病育种提供理论依据和技术支撑。

