MicroRNA-1285及其靶标DDX3X对猪塞内卡病毒感染PK-15细胞的调控作用
孙 媛,唐晓钰,白 杨,陈雨琪,郑瑶瑶,吴佼玲,蓝 天,马静云
(华南农业大学动物科学学院,广东 广州 510642)
MicroRNA(miRNA)是一类长度为20~24 bp的内源性非编码小RNA,广泛参与各种生理和病理过程,包括抗病毒天然免疫反应[1]等。对大多数细胞来说,干扰素(Interferon,IFN)免疫反应是宿主抵御病毒感染的第1道防线。许多研究指出,miRNA可以靶向抗病毒天然免疫反应的关键信号分子,以调节IFN的表达[2-3]。miRNA-1285(miR-1285)于2008年首次在人类胚胎干细胞中被发现[4],并于2014年在猪的1号染色体中被记录[5]。目前,关于miR-1285的研究主要集中在肿瘤方面。如在肺鳞状细胞癌[6]和甲状腺肿瘤[7]中,miR-1285可以作为潜在的生物标记物;在肝细胞癌[8]和胰腺癌[9]中,miR-1285具有抑癌作用。除了肿瘤方面,最近的1项研究还发现,在暴露于铜离子环境的空肠上皮细胞中,线粒体定位的miR-1285具有调控线粒体功能障碍和有丝分裂吞噬的重要作用[10]。X染色体编码的DDX3X属于DEAD-box RNA解旋酶超家族2成员,在各种组织中广泛表达[11]。DDX3X参与众多细胞生理过程,包括细胞周期调节[12]、先天免疫反应[13]、凋亡[14]和肿瘤发生[15]等。在抗病毒先天免疫中,DDX3X可以与RIG-I/MDA5、NF-κB等信号通路的许多重要信号分子相互作用,以诱导IFN表达[16-19]。
猪A型塞内卡病毒(Senecavirus A,SVA)隶属于小RNA病毒科Picornaviridae塞内卡病毒属Senecavirus,是该属唯一成员[20]。SVA是一种新近出现的传染性病原,能引发猪特发性水疱病,临床表现与口蹄疫症状极为相似[21-24]。自2015年巴西[25]报道SVA感染导致大规模仔猪死亡以来,美国[26]、加拿大[27]、中国[28]、泰国[29]、哥伦比亚[30]、越南[31]等多个国家陆续出现了SVA疫情,给全球养猪业造成了巨大的经济损失。SVA感染在我国华南[32]、华中[33]、东南[34]、东北[35]等多个地区的猪场均有报道。上述SVA的研究主要集中于临床症状、传播途径、检测方法、分子流行病学等内容,有关SVA与宿主miRNAs互作的研究鲜见报道。因此,本研究拟从miRNA s角度,探究miR-1285及其靶标DDX3X在抗SVA感染天然免疫应答中的作用,为SVA感染的诊断和防控提供重要依据。
1 材料与方法
1.1 材料
1.1.1 细胞、病毒株、质粒及菌种 本研究涉及的猪传代肾细胞PK-15由华南农业大学健康养殖与生物安全研究室(本实验室)保存,SVA CH-01-2015分离株(KT321458)由本实验室分离鉴定并保存。pmiRGLO载体、pET-32a(+)载体、大肠埃希菌感受态细胞DH5α、BL21(DE3)由本实验室保存,pMD®19-T载体购自广州瑞真生物技术有限公司。
1.1.2 主要试剂与用品 细胞与病毒培养相关试剂:胎牛血清、DMEM、0.25%(w)胰蛋白酶购自GIBCO公司,转染试剂jetPRIME®购自Polyplus公司,miRNA mimics及inhibitor、siRNA由上海吉玛公司合成。
分子生物学相关试剂:RNAiso Plus、PrimeScript™RT reagent Kit with gDNA Eraser(Perfect Real Time)、2×Ex Taq®、dNTP Mixture、10×Loading Buffer、T4 DNA连接酶、蛋白Marker等购自TaKaRa公司;限制性内切酶Xho I、Sal I、EcoR I等购自NEB公司;Dual-G lo®Luciferase Assay System、GoTaq®Probe qPCR Master Mix 2×购自Promega公司;E.Z.N.A.®Gel Extraction Kit、E.Z.N.A.®Plasmid mini Kit I购自Omega公司;ReverTra Ace®qPCR RT Kit购自TOYOBO公司;Zero Background TA TOPO Cloning Kit 为Clone Smarter 产品,购自中美泰和生物技术公司;Ni-NTA Beads购自常州天地人和生物科技有限公司;2×RealStar Green Fast Mixture、RIPA细胞裂解液和BCA法总蛋白测定试剂盒购自北京GenStar公司;SDS-PAGE凝胶配制试剂盒、细胞周期与细胞凋亡检测试剂盒购自碧云天生物技术有限公司;Bulge-LoopTMmiRNA qRT-PCR Starter Kit、Bulge-LoopTMmiRNA Forward Primer购自广州锐博生物科技有限公司。
蛋白抗体与IFN-β检测试剂盒−Anti-His(mouse)、Anti-β-actin(rabbit)单克隆抗体、Goatanti-mouse(HRP)酶标二抗购自Proteintech公司,Goat-anti-mouse(Alexa Fluor 594)荧光二抗购自abcam公司,Anti-DDX3X(pig)多克隆抗体购自上海优宁维生物科技股份有限公司。
1.2 方法
1.2.1 细胞培养以每孔1×106个细胞的密度将PK-15细胞接种至适合的培养皿中,在含10%(φ)胎牛血清的DM EM培养液中于37℃、5%(φ)CO2条件下培养。当PK-15细胞聚合密度大于90%时进行传代,吸出培养液后用无菌、pH 7.2的PBS缓冲液清洗2遍,加入含0.25%(w)胰蛋白酶的EDTA,放置培养箱中消化2 min左右,在显微镜下观察,细胞变圆、分散时弃去胰蛋白酶终止消化,加入含10%(φ)胎牛血清的细胞培养液继续培养。
1.2.2 SVA感染取细胞聚合密度大于80%~90%、生长状态良好的细胞,吸出培养液,PBS缓冲液清洗2遍,SVA CH-01-2015病毒液接毒,感染复数(Multiplicity of infection,MOI)=1.5,2 h后用PBS缓冲液清洗并更换为含有2%(φ)胎牛血清的培养液,在不同时间点分别收取细胞RNA与细胞培养上清液,设未感染SVA组为阴性对照组(CK),每组3次重复,3个平行,装入2 m L离心管于−80℃保存。
1.2.3 转染以每孔1×106个细胞的密度将PK-15细胞接种至6孔细胞培养板,在含10%(φ)胎牛血清的DMEM培养液中于37℃、5%(φ)CO2条件下培养,当细胞聚合密度达50%~60%时转染100 pmol miR-1285mimics、inhibitor或pEGFP-DDX3Xp、si-DDX3X质粒至PK-15细胞,转染24 h后以1MOI剂量SVA接种PK-15细胞,24 h后收集细胞总RNA,48 h收集细胞总蛋白,72 h收集病毒液。所用寡核苷酸序列分别为:miR‐1285 mimics正链5′‐CUGGGCAACAUAGCGAGA CCCCGU‐3′、负链5′‐GGGGUCUCGCUAUG UUGCCCAGUU‐3′及miR‐1285 inhibitor 5′‐ACGGGGUCUCGCUAUGUUGCCCAG‐3′;DDX3X正链5′‐ACAGCAGTTTTGGATCC CGT‐3′、负链5′‐GTCACTTCGTCCACGGT CA T‐3′及si-DDX3X正链5′‐GCUGAU GGAUGUUGGAUATT‐3′、负链5′‐UAUCCA ACAUCCGAUCAGCTT‐3′。
1.2.4 RNA提取及qRT-PCR采用RNAiso Plus抽提PK-15细胞样品中总RNA。弃去培养液,用PBS缓冲液清洗细胞,按0.1~0.2m L/cm2的剂量加入RNAiso Plus后轻微晃动,将内含细胞的裂解液转移至离心管中,室温静置5min后依次加入三氯甲烷等,具体方法参照RNAiso Plus RNA提取试剂说明书。将抽提出的RNA白色沉淀用30 μL DEPC水溶解,用核酸蛋白测定仪测定总RNA质量浓度,记录RNA质量浓度和D260 nm/D280 nm、D260 nm/D230nm,分装后−80℃保存或直接用于反转录。miRNA qRT-PCR反应参照miRNA 1st Strand cDNA Synthesis Kit (加尾法)说明书,具体反应程序:95℃预变性10min,以95℃变性2 s、60℃退火20 s、70℃延伸10 s进行40个循环。每个反应设置3次重复,并设立阴性对照(CK)。mRNA qRTPCR 反应:参照HiScript®III 1st Strand cDNA Synthesis Kit(+gDNA wiper)说明书进行。qRTPCR反应程序:95℃预变性2 min,以95℃变性15 s、各温度退火20 s、72℃延伸30 s进行40个循环。每个反应设置3次重复,并设立阴性对照(CK)。各基因引物序列见表1。

表1 基因引物序列Table 1 Primer sequences of genes
1.2.5 双荧光素酶活性检测在6孔细胞培养板中培养细胞,待细胞聚合密度达到60%~80%时进行转染试验。根据试验需要在1.5m L离心管中加入2μg DNA和80 pmol miR-1285 mimics或者inhibitor以及200μL jetPRIME®buffer,涡旋震荡混匀。在混合试剂中加入4~6μL jetPRIME®,涡旋震荡10 s,室温孵育10min。将转染混合物逐滴加入含2%(φ)胎牛血清细胞培养基的细胞培养6孔板中,轻柔摇匀,根据需要在转染4 h后进行换液。将5×Passive Lysis Buffer(PLB)用双蒸水稀释为1×PLB,4℃条件下储存。细胞转染24 h后,观察细胞状态是否良好,用预冷的PBS清洗细胞3遍,吸尽PBS加入500μL PLB。室温下在摇床上裂解细胞15min。在96孔板中每孔加入20μL PLB裂解液,随后加入100μL LAR II,检测萤火虫荧光素酶活性。检测结束后,加入100 μL Stop&G lo®Reagent,测量海肾荧光素酶活性。
1.2.6 Western blot转染48 h后提取细胞总蛋白,具体步骤参照RIPA强裂解液说明书进行。使用BCA法测定蛋白质质量浓度,然后将样品分装,−20℃条件下保存。组装电泳装置,加入电泳液,以70 V电泳40min,再以恒压140 V电泳,使蛋白充分分离。裂解产物通过100 g/L十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,并转移到Immobilon-P膜(EMD Millipore,USA)上。在含0.1%(φ)吐温20的TBST(10mmol/L Tris-HCl、pH 8.0、150mmol/L NaCl)中用50 g/L脱脂奶粉封闭2 h。封闭后使用稀释好的一抗孵育1 h后使用TBST缓冲液洗涤5次,每次5min。将PVDF膜放入稀释好的二抗中孵育30 min后洗涤3次,每次5min。避光配制发光液,将发光液加至PVDF膜表面后放入化学发光仪中显影。1.2.7 数据统计分析试验所得数据使用统计软件SPSS 19.0进行分析。针对干扰试验中的3组数据进行单因素方差分析,若差异显著,则对组间进行Duncan’s多重比较;其他数据之间进行独立样本t检验,P <0.05视为差异显著,数据用平均值±标准误表示。
2 结果与分析
2.1 SVA感染PK-15细胞后miR-1285表达显著上调
本研究前期转录组学分析发现,SVA感染PK-15细胞后miR-1285显著上调。为了确定miR-1285在SVA感染中的潜在作用,本研究首先利用qRT-PCR检测了miR-1285在SVA感染的PK-15细胞中的表达。如图1A所示,1.5MOISVA感染PK-15细胞后,miR-1285的表达随着时间的延长逐渐增加,在感染24 h时极显著增加(P<0.01)。当SVA分别以0.1 MO I、1.0 MOI、5.0 MOI和10.0MOI的剂量感染PK-15细胞后,miR-1285基因拷贝数在1.0MOI时达到最高水平;之后,随着病毒接毒剂量的增加,miR-1285的表达逐渐减少,但当SVA感染量为5.0MOI时,差异仍然显著(P<0.05)(图1B)。上述结果表明,在SVA感染的PK-15细胞中miR-1285的表达上调,并且其表达在一定范围内随着病毒剂量和感染时间的增加而增加。
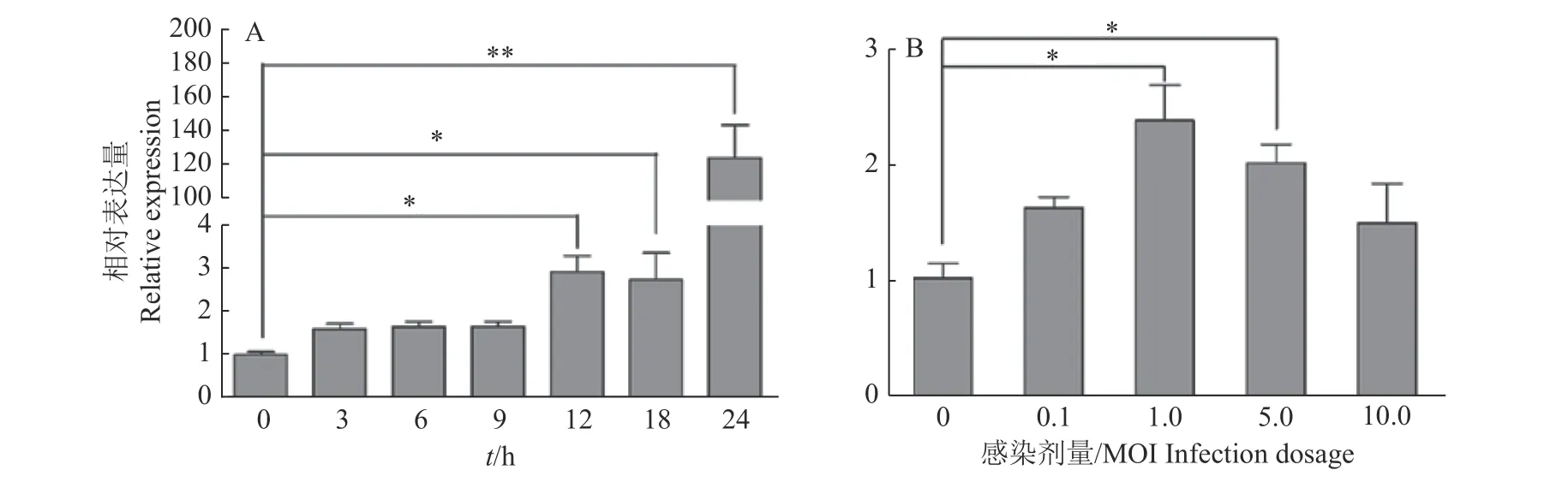
图1 不同SVA感染时间(A)和感染剂量(B)条件下PK-15细胞中miR-1285的表达量Fig.1 Expression of miR-1285 in PK-15 cells infected by SVA at different infection time (A)and dosages(B)
2.2 miR-1285靶基因预测及验证
为了进一步探讨miR-1285在SVA感染中的作用,利用miRanda软件预测PK-15细胞中miR-1285的潜在靶点。基于生物信息学分析,miR-1285在DDX3X的3'-UTR中具有靶向位点(图2)。为了验证预测结果,将miR-1285mimics、inhibitor分别转染PK-15细胞,检测细胞中DDX3X的mRNA和蛋白表达。Western blot结果显示,转染miR-1285 mimics的细胞与阴性对照组相比,DDX3X蛋白的表达没有变化;但转染miR-1285 inhibitor的PK-15细胞中,DDX3X蛋白的表达显著增加(图3),且与荧光定量检测结果(P < 0.01)(图4)一致。为了进一步确定miR-1285和DDX3X之间的靶向关系,将DDX3X野生型质粒、缺失及突变质粒分别转染到PK-15细胞。双荧光素酶分析显示,与对照组相比,在含有DDX3X野生型质粒的细胞中,miR-1285mimics的相对荧光素酶活性被显著抑制(P <0.05)(图5)。上述结果说明,miR-1285通过结合PK-15细胞中的3'-UTR靶向DDX3X,并且miR-1285和DDX3X之间存在负靶向关系。

图2 miR-1285与DDX3X的靶向结合位点Fig.2 Targeted binding site between miR-1285 and DDX3X
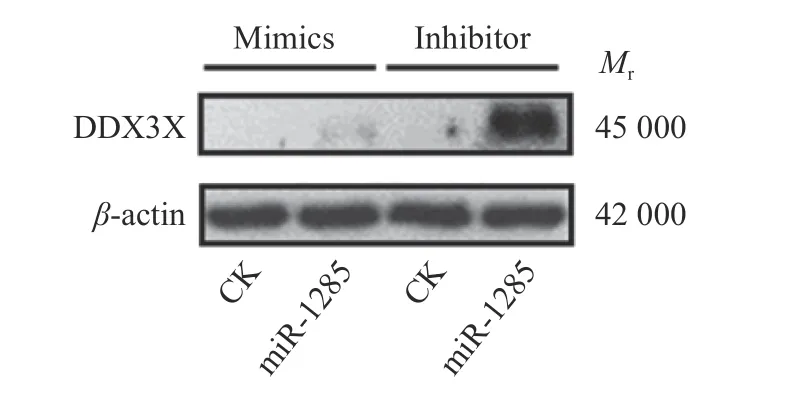
图3 转染miR-1285mimics、inhibitor至PK-15细胞后DDX3X蛋白的表达Fig.3 DDX3X protein expression after the transfection of miR-1285mimics,inhibitor into PK-15 cells

图4 转染miR-1285mimics、inhibitor至PK-15细胞后DDX3X的m RNA相对表达量Fig.4 The relative expression of DDX3X mRNA after transfection of miR-1285 mimics and inhibitor into PK-15 cells

图5 转染不同DDX3X重组载体质粒至PK-15细胞后miR-1285双荧光素酶活性Fig.5 The relative dual-luciferase activity of miR-1285 after transfection of different DDX3X recombinant vector plasmids into PK-15 cells
2.3 miR-1285及其靶标DDX3X促进IFN-β表达
为了探究miR-1285与SVA、IFN-β的关系,将miR-1285mimics、inhibitor转染至PK-15细胞,24 h后感染1 MOI SVA。qRT-PCR结果如图6A所示,与对照组相比,过表达miR-1285后IFN-βm RNA转录水平显著下调,干扰miR-1285时IFN-β则显著上调(P <0.05);然而当PK-15受到SVA病毒感染后,过表达miR-1285可极显著促进IFN-β的转录(P <0.01),干扰miR-1285时IFN-βmRNA转录水平显著下调(P < 0.05)。同样,为了研究DDX3X对SVA感染PK-15细胞后IFNβ表达的影响,将DDX3X过表达和干扰质粒分别转染细胞,24 h后以1 MOISVA攻毒细胞,检测IFN-β表达情况,结果如图6B所示,过表达DDX3X可极显著促进IFN-β的转录水平(P<0.01),干扰DDX3X可明显抑制IFN-β的表达(P<0.05)。Western blot分析结果与荧光定量结果一致,在SVA感染48 h的PK-15细胞中,过表达miR-1285可促进IFN-β蛋白的表达,当miR-1285被抑制时,IFN-β的蛋白水平与对照组细胞中的蛋白水平相似(图7A);同样过表达DDX3X能够促进IFN-β蛋白的表达,干扰DDX3X的INF-β表达量与对照组相似(图7B)。上述结果表明,SVA感染PK-15细胞后miR-1285及其靶标DDX3X都能促进IFN-β分泌。

图6 miR-1285及其靶标DDX3X对IFN-βmRNA表达的调控作用Fig.6 Regulation effects of miR-1285 and its target DDX3X on the mRNA expression of IFN-β

图7 miR-1285及其靶标DDX3X对IFN-β蛋白表达的调控作用Fig.7 Regulation effects of miR-1285 and its target DDX3X on the protein expression of IFN-β
2.4 miR-1285及其靶标DDX3X对RIG-I信号通路中关键信号分子的影响
为了探究miR-1285及其靶标DDX3X与RIGI信号通路的关系,分别转染miR-1285 mimics、inhibitor或将si-DDX3X转染至PK-15细胞,qRTPCR检测RIG-I信号通路关键信号分子mRNA相对表达量,结果如图8、9所示。相比于对照组,转染miR-1285mimics后MAVS、TRAF3、IRF3、IRF7表达量显著降低(P <0.05),其他分子转录无明显差异。转染miR-1285 inhibitor后IRF3转录水平显著上调(P<0.05),其他分子的转录水平则无明显变化。当沉默DDX3X时,与对照组相比,接头分子中MDA5、TANK、TBK1表达量显著上调(P < 0.05、P <0.05、P <0.01),而MAVS、TRAF3表达量显著下调(P <0.05、P < 0.05),其他分子无明显变化(图9)。

图8 miR-1285对RIG-I通路信号转导分子的影响Fig.8 Effects of miR-1285 on signal transduction molecules of the RIG-I pathway

图9 DDX3X沉默对RIG-I通路信号转导分子的影响Fig.9 Effects of DDX3X silencing on signal transduction molecules of the RIG-I pathway
2.5 miR-1285及其靶标DDX3X对SVA 3C表达的调控
为了更好地理解miR-1285、DDX3X和SVA之间的关系,将miR-1285-mimics、inhibitor,si-DDX3X和DDX3X过表达质粒转染PK-15细胞,24 h后SVA感染细胞,分析SVA 3C的表达情况。结果(图10)显示,在转染miR-1285mimics、inhibitor的细胞中,3C mRNA的表达分别略有增加和减少。然而,在DDX3X过表达的细胞中,SVA 3C的产生被极显著阻断(P <0.01),当DDX3X沉默时,病毒表达极显著增加(P<0.01)。更重要的是,当miR-1285 mimics和DDX3X过表达质粒共同转染细胞时,SVA 3C表达极显著下调(P <0.01),当miR-1285 inhibitor和si-DDX3X质粒一起转染细胞时,3C生成极显著增加(P <0.01)(图10)。总之,miR-1285可以促进SVA 3C的产生,但这种趋势在统计学上并不显著,而DDX3X能显著阻断3C的表达,并能逆转miR-1285诱导的表达增加趋势。

图10 miR-1285及其靶标DDX3X对SVA 3C表达的影响Fig.10 Effects of miR-1285 and its target DDX3X on the expression of SVA 3C
3 讨论与结论
3.1 SVA感染PK-15细胞诱发miR-1285高表达
作为小RNA病毒科新发现的成员,宿主miRNAs在SVA感染中的作用尚不明确。本研究试验结果显示miR-1285的表达在SVA感染PK-15细胞后被激活,并且miR-1285的表达量随着SVA感染时间的延长和接毒剂量的提高而增加。大量报道表明,miR-1285在肺癌、胰腺癌、非侵入性滤泡性甲状腺肿瘤等肿瘤细胞和肝硬化、沙眼患者组织中均有差异性表达,提示miR-1285可能在肿瘤细胞行为中起关键作用[7,41-45],而SVA早期主要作为溶瘤细胞进行研究,可有效治疗一些神经内分泌肿瘤,如非小细胞肺癌等[45]。在SVA感染的PK-15细胞里发现显著差异表达的miR-1285,揭示二者具有潜在的联系。同时,本试验还发现,miR-1285与DDX3X存在着负靶向调控关系,miR-1285可通过与DDX3X的3'-UTR序列结合而抑制后者转录和蛋白水平的表达。在SVA感染的PK-15细胞中发现高表达的miR-1285及其靶标DDX3X,揭示了SVA与宿主miRNAs的互作关系。
3.2 miR-1285及其靶标DDX3X在先天免疫应答中的作用
先天免疫是宿主抵抗病毒感染的第一道防线,而I型IFN在抗病毒免疫应答中起着重要作用[46]。对于大多数RNA病毒而言,双链RNA(dsRNA)是一种复制中间产物,先天免疫反应中主要被宿主的RIG-I和M DA 5蛋白基因识别,从而激活下游IFN的产生[47-48]。本研究结果表明,在SVA感染的PK-15细胞里,miR-1285及其靶标DDX3X均能在转录和蛋白水平显著促进IFN-β的分泌。进一步探究二者对RIG-I信号通路关键分子的作用,发现当过表达miR-1285时,RIG-I信号通路中MAVS、TRAF3转录水平显著降低,此结果与干扰DDX3X时一致,提示miR-1285可能通过靶向DDX3X作用于MAVS、TRAF3,从而调控IFN的表达。本试验结果还显示,当干扰DDX3X时,MDA-5、TANK、TBK 1表达量显著上调。众多报道表明,DDX3X与RIG-I信号通路关系密切。例如,DDX3X可通过影响MAVS而上调IFN-β的表达[18]。Chen等[49]发现,DDX3X与MAVS、TBK 1、IKKε共定位,过表达DDX3X可抑制PRRSV复制。其他研究则表明,PRRSV的Nsp2蛋白能阻碍DDX3X激活MAVS诱导的IFN-β启动子,从而促进病毒复制[50]。本研究揭示了在SVA感染的PK-15细胞中,miR-1285及其靶标DDX3X在先天免疫应答中的潜在作用机制,丰富了对miR-1285及DDX3X功能的认识。
3.3 miR-1285及其靶标DDX3X对SVA 3C蛋白基因复制的影响
小RNA病毒的3C蛋白对促进病毒mRNA的翻译和复制有重要的作用[51]。有关SVA 3C的研究表明,3C蛋白可以通过切割M AVS、TRIF和TANK以及具有蛋白酶活性的IRF3/7来抑制宿主的先天免疫反应[52]。还有报道发现,3C可诱导细胞凋亡[53]或作为一种病毒性二肽酶促进病毒复制[54]。上述研究提示,SVA 3C蛋白在病毒感染过程中发挥重要功能。因此,本研究分析了miR-1285及其靶标DDX3X对SVA 3C表达的影响。结果显示,相对于对照组,过表达miR-1285对SVC 3C的转录有促进作用,miR-1285受抑制时SVC 3C的表达量下调,但上述作用均不明显。相反,DDX3X过表达可以显著抑制SVA 3C的表达;并且,同时过表达miR-1285及其靶标DDX3X,SVA 3C表达量仍然显著下调;说明,DDX3X可以逆转miR-1285诱导的上调趋势。虽然DDX3X对SVA的复制有抑制作用,但推测SVA感染后,这种作用被miR-1285阻断,因为miR-1285负靶向调控DDX3X,即抑制其表达。本研究探究了miR-1285及其靶标DDX3X对SVA 3C蛋白基因复制的作用,以期为SVA的防控提供参考。
3.4 结论
SVA感染PK-15细胞后,miR-1285表达量显著上调,miR-1285可显著促进IFN-β转录和蛋白水平的表达。miR-1285通过靶向DDX3X对RIG-I信号通路发挥作用。DDX3X对SVA 3C蛋白的表达有抑制作用,并且可逆转miR-1285诱导的上调趋势。本研究探究了SVA感染PK-15细胞后,宿主miR-1285及其靶标DDX3X的作用,研究结果将为SVA的防控提供新的思路和方法。

