根系分隔方式下花魔芋转录组分析
何 斐,李 川,Shah Faisal,刘富强,段园鹏,王 梦,阮 佳,魏梦琳,姜 浩,马星光,王 卓
(1.安康学院 现代农业与生物科技学院,陕西 安康 725000;2.白沙瓦农业大学 农学系,巴基斯坦 开伯尔-普赫图赫瓦省白沙瓦 23060)
间作是我国传统的种植方式之一,合理间作不仅能提高作物利用光、水分、养分等资源利用效率,而且还能控制病虫草害发生频度和强度,从而减少化学农药的使用和肥料投入[1-2],对促进农业可持续发展具有重要作用。
花魔芋(Amorphophalluskonjac)是目前自然界唯一能大量提取葡甘聚糖的重要经济作物,也是湖北、云南、四川、陕南等贫困山区乡村振兴的支柱产业[3]。葡甘聚糖是一种高分子水溶性膳食纤维,广泛应用于农业、食品、医药、保健、化工、纺织等许多领域,具有极大的商业价值[4]。刺槐(RobiniapseudoacaciaL.)是豆科落叶乔木,具有耐旱耐贫瘠、速生、适应性强且固氮效果好等优点,是干旱半干旱地区的主要造林树种,被我国北方地区广泛引种栽培[5-6]。研究表明,与刺槐间作能维持花魔芋根际微生物多样性,改善微生态环境,有效规避花魔芋软腐病和白绢病等病害,减轻经济损失。刺槐林下种植魔芋是我国陕南地区一种典型的种植方式,具有控病增产等优势[7-8]。间作增产优势主要源于作物间互作[9],根系形态、生理性状及基因表达等决定植株对土壤养分、水分的高效利用[10]。许多学者研究了花魔芋间套作的作物生长和效益[11-13],但其根系互作和基因表达调控相关研究报道较少。因此,研究刺槐间作花魔芋能进一步探究该模式的控病增产机理,对刺槐林下魔芋栽培技术水平的提高及推广具有重要意义。
根系是植物获取水分和养分的重要器官,易受环境因子的影响[14]。本研究以刺槐和花魔芋不同根系分隔方式为研究对象,利用Illumina NovaSeq高通量测序技术对花魔芋根系进行转录组研究,结合生信分析法对差异表达基因进行GO功能富集分析和KEGG代谢通路富集分析,研究与刺槐间作的花魔芋差异基因的表达,为间作花魔芋根系中相关基因的表达调控及响应机制提供分子基础。
1 材料和方法
1.1 试验设计
试验于2021年5月3日在安康学院农学大棚进行。采用两室根箱隔网装置(图1),试验按照根系不同分隔方式设置3个处理:塑料膜分隔(Film separation,FS);尼龙网分隔(Mesh separation,MS),尼龙网孔径为25 μm,水分、养分可穿过,根系不能通过;不分隔(Non-separation,NS)。A室种植刺槐5株,B室种植花魔芋3株,每处理重复3次。于2021年9月10日球茎膨大期采集各处理花魔芋根系,将采集的9个样本放入液氮速冻后转存于-80 ℃超低温冰箱。每个样本单独提取RNA,分别用于转录组测序和分析。

图1 两室根箱隔网系统Fig.1 Two compartments system
1.2 总RNA提取、建库及测序
使用TRIzol(Invitrogen,USA)RNA提取试剂盒提取花魔芋根系中的总RNA,用Bioanalyzer 2100 system(Agilent Technologies,USA)检测RNA完整性,使用Nanodrop检测RNA纯度。总RNA检测合格后委托上海派森诺生物科技有限公司构建cDNA文库,利用Illumina NovaSeq 6000平台测序。
1.3 测序数据分析
对测序获得的原始数据进行质控,经过匹配、过滤低质量碱基从而得到高质量的质控数据以保证后续分析结果的准确性。花魔芋无参考基因组,采用Trinity软件[15]对高质量数据(Clean data)进行组装拼接成转录本。去冗余后获得Unigenes,使用GO[16]、KEGG[17]、Pfam[18]、eggNOG[19]和Swissprot[20]和Nr数据库进行基因功能注释。
差异表达基因(DEGs)筛选:用FPKM值(每千个碱基的转录每百万映射读取的片段数)[21]计算基因表达量。采用DESeq对基因表达进行差异分析,筛选差异表达基因条件为:表达差异倍数|log2Fold Change|>1(Fold Change,FC),显著性P-value<0.05[22]。
差异表达基因GO注释和KEGG富集分析:利用eggnog-mapper软件进行差异表达基因的GO注释,使用topGO软件进行GO富集分析,通过P值(P<0.05)找出差异基因显著富集的GO term,从而确定差异基因行使的生物学功能。采用KOBAS注释系统(http://kobas.cbi.pku.edu.cn/)完成KEGG注释统计,以P值(Padjust)<0.05作为显著富集标准,进行差异表达基因的通路富集分析[23]。
1.4 差异表达基因的qRT-PCR验证
随机选取6个差异表达基因进行qRT-PCR表达量的验证,利用Primer Premier 5.0软件设计引物,选用EF1-a为内参基因[24],引物序列见表1。使用CFX96 Real-Time System(BIO-RAD)仪器,利用SYBR®Premix Ex TaqTMⅡ试剂盒进行qPCR,总反应体系20 μL:2×SYBR®Premix Ex TaqTMⅡ 10 μL、上下游引物(10 μmol/L)各0.5 μL、cDNA模板(50 ng/μL)1 μL、8 μL ddH2O。反应程序:94 ℃ 5 min;94 ℃ 45 s,60 ℃ 25 s,40个循环。每个样本设置3个重复,样本数值按照2-ΔΔCT法[25]计算相关基因mRNA转录水平。

表1 用于qRT-PCR验证的引物Tab.1 Primers used for qRT-PCR validation
2 结果与分析
2.1 转录组测序数据评估与组装分析
对测序数据进行统计分析和质量评估结果显示(表2),各样品测序数据的高质量序列条数在40 561 598~52 236 882(NCBI SRA数据库登录号:PRJNA841227,各样本序列登录号:SAMN28577734—SAMN28577742),Q20达到96.4%以上,Q30达到92.0%以上,表明测序样品的文库构建质量和测序质量结果良好,可用于后续分析。

表2 测序数据统计Tab.2 Statistics of sequencing data
皮尔逊相关系数表示样品间基因的表达水平相关性,相关系数越接近1,表明样品间表达模式的相似度越高。一般来说,相关系数在0.8~1属于极强相关,如果生物学重复的样本之间相关系数低于0.8,表示样品之间的相关性较低。从图2可以看出,以NS处理的样本为例,NS_1和NS_2的相关系数为0.95,NS_1和NS_3的相关系数为0.94,NS_2和NS_3的相关系数为0.99,说明NS处理组内样本之间的生物学重复较好。而NS、MS和FS 3个处理组间样本之间的相关系数均小于0.8,说明组间样本之间的差异性较大。

图2 基于皮尔逊相关系数的样品间重复性分析Fig.2 Repeatability analysis between samples based on Pearson correlation coefficient
对原始测序数据去除接头序列及低质量reads,共获得59.82 Gb Clean data,Trinity组装后共获得92 358条Transcript和40 122条Unigene序列,平均长度分别为1 047.36,912.36 bp,N50长度分别为1 478,1 441 bp,GC含量分别为48.49%和49.36%(表3)。
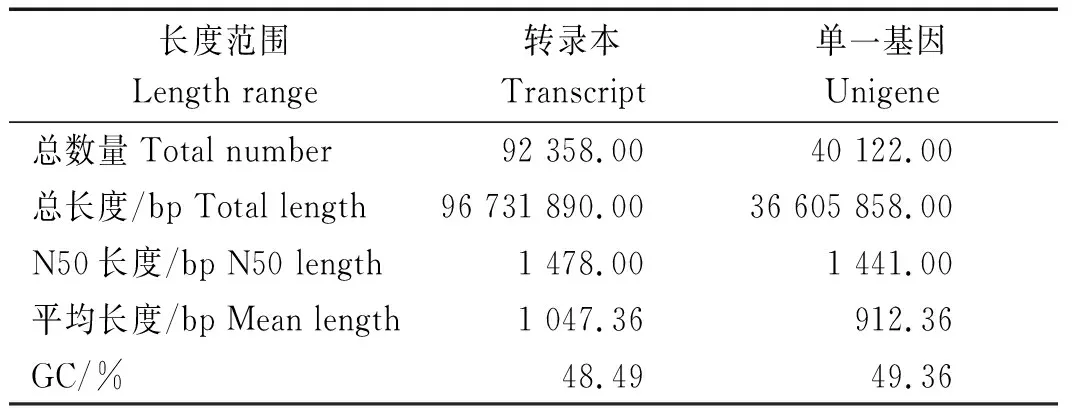
表3 组装结果分析Tab.3 Analysis of assembly
2.2 Unigene基本注释统计
花魔芋40 122个Unigene与Nr、GO、KEGG、Pfam、eggNOG和Swissprot数据库分别比对到23 960,12 517,11 934,16 531,23 066,20 994个。其中Nr数据库注释的信息最多,占总Unigene的59.72%,KEGG数据库注释的信息最少,占总Unigene的29.74%。在6大数据库中均注释到Unigene 5 377个,占总Unigene的13.40%。
2.3 基因差异表达分析
对不同处理进行两两比较(图3)结果显示,在FS_vs_MS组内,共有1 776个差异表达基因,其中588个上调表达(上调表达基因数量占差异表达基因比例为33.1%),1 188个下调表达。FS_vs_NS组内有差异表达基因733个,其中上调表达167个(上调表达基因数量占比22.8%),下调表达566个。MS_vs_NS组内有896个差异表达基因,有455个上调表达(上调表达基因数量占比50.8%),441个下调表达。通过对处理间差异表达基因筛选分析发现,FS_vs_MS的差异表达基因数量最多,是FS_vs_NS组内差异基因数量的2.4倍,说明尼龙网分隔的花魔芋根系中有更多基因参与表达调控来响应与刺槐的半交互互作,而塑料膜分隔的花魔芋根系差异基因数量较少,表明其受到地下根系交互作用影响较小。

图3 处理间差异表达基因的火山图与统计分析Fig.3 The volcano plot and statistical analysis of DEGs between treatments
2.4 差异表达基因的GO功能注释和富集分析
FS_vs_MS、FS_vs_NS和MS_vs_NS 3个处理的差异表达基因GO功能注释分析结果显示(图4),在生物过程大类中,差异表达较多的功能组是细胞进程、新陈代谢过程、有机物代谢过程、细胞代谢过程、初级代谢过程、氮化合物代谢过程和刺激响应;在细胞组分大类中,差异表达较多的功能组是有机氮化合物代谢过程、细胞、细胞内、细胞器、细胞内细胞器等;在分子功能大类中,差异表达较多的功能组主要是催化活性。其中,FS_vs_MS处理间差异表达基因GO功能注释到以上的生物过程、细胞组分和分子功能的基因数量最多,表明尼龙网分隔的花魔芋根系在这三大类功能方面与塑料膜分隔花魔芋相比存在较大区别,尼龙网分隔花魔芋根系的生长调控更复杂。尼龙网隔根使刺槐和魔芋土壤中水肥可以运移,但根系相互隔离,而塑料膜隔根使2种作物水肥转运和根系互作完全隔离,减小了群体根系对土壤资源的利用。与塑料膜隔根相比,尼龙网分隔的刺槐与魔芋存在半交互作用,从而影响了花魔芋根系基因的表达。
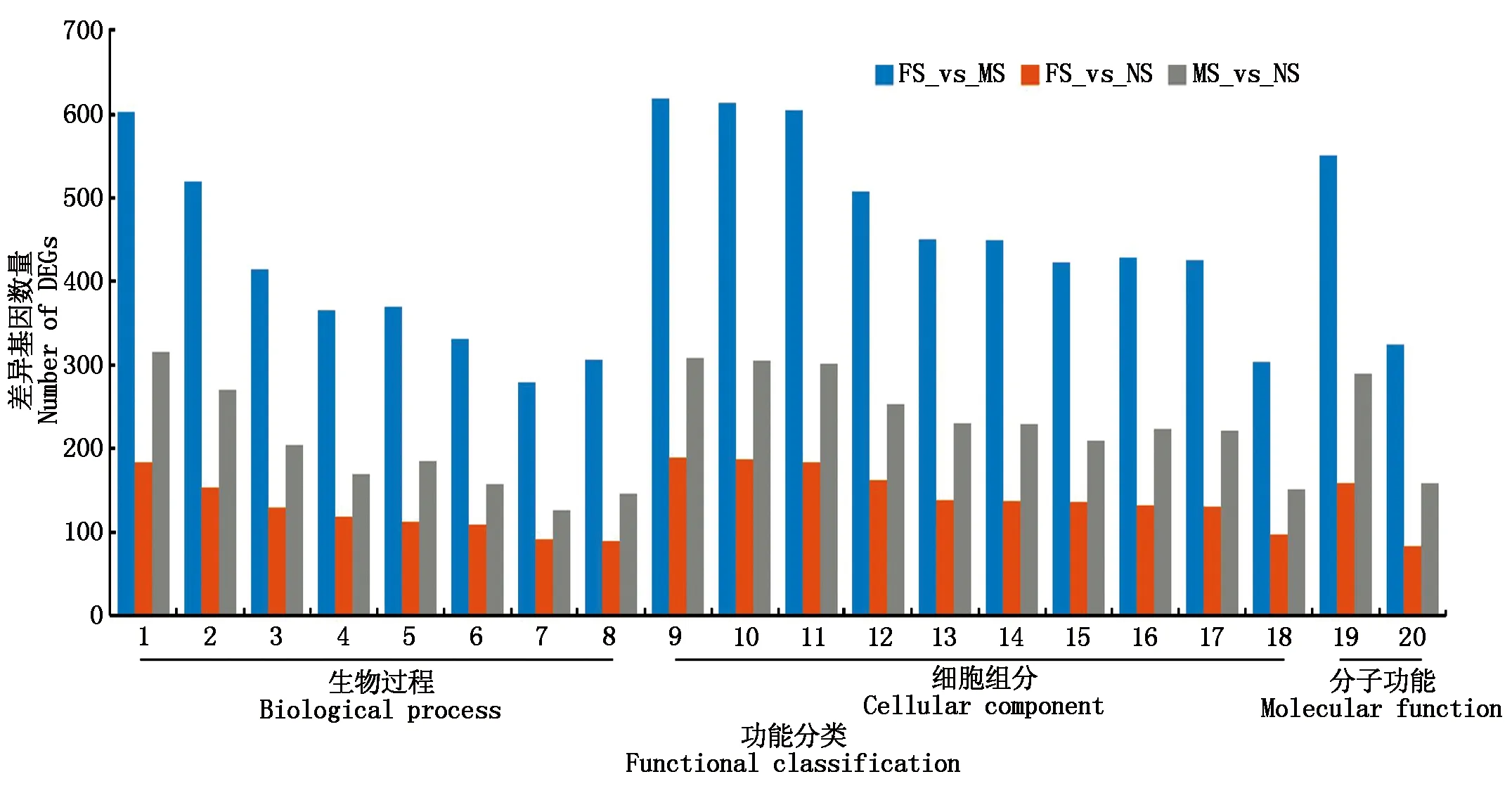
1.生物过程;2.细胞进程;3.新陈代谢过程;4.有机物代谢过程;5.细胞代谢过程;6.初级代谢过程;7.氮化合物代谢过程;8.刺激响应;9.细胞组分;10.有机氮化合物代谢过程;11.细胞;12.细胞内;13.细胞器;14.细胞内细胞器;15.细胞质;16.膜结合细胞器;17.细胞内膜结合细胞器;18.细胞膜;19.分子功能;20.催化活性。1.Biological process;2.Cellular process;3.Metabolic process;4.Organic substance metabolic process;5.Cellular metabolic process;6.Primary metabolic process;7.Nitrogen compound metabolic process;8.Response to stimulus;9.Cellular component;10.Organonitrogen compound metabolic process;11.Cell;12.Intracellular;13.Organelle;14.Intracellular organelle;15.Cytoplasm;16.Membrane-bounded organelle;17.Intracellular membrane-bounded organelle;18.Membrane;19.Molecular function;20.Catalytic activity.图4 处理间差异表达基因的GO注释分析Fig.4 The GO annotations analysis of DEGs between treatments
GO富集分析结果显示,FS_vs_MS处理间差异表达基因中,GO功能富集程度显著的前20条GO term主要有细胞膜、细胞质膜、细胞外围、细胞壁、外部囊状结构、细胞膜内在成分、质膜内在成分等(图5-A);FS_vs_NS处理间差异基因GO显著富集的主要有细胞膜、细胞质膜、细胞外围等(图5-B);MS_vs_NS处理间差异基因GO显著富集的主要有类囊体膜、类囊体、基质类囊体、光合膜等(图5-C)。由此可知,与塑料膜分隔单作相比,尼龙网分隔和未分隔间作花魔芋根系较大的变化主要在细胞膜、细胞质膜和细胞外围方面。


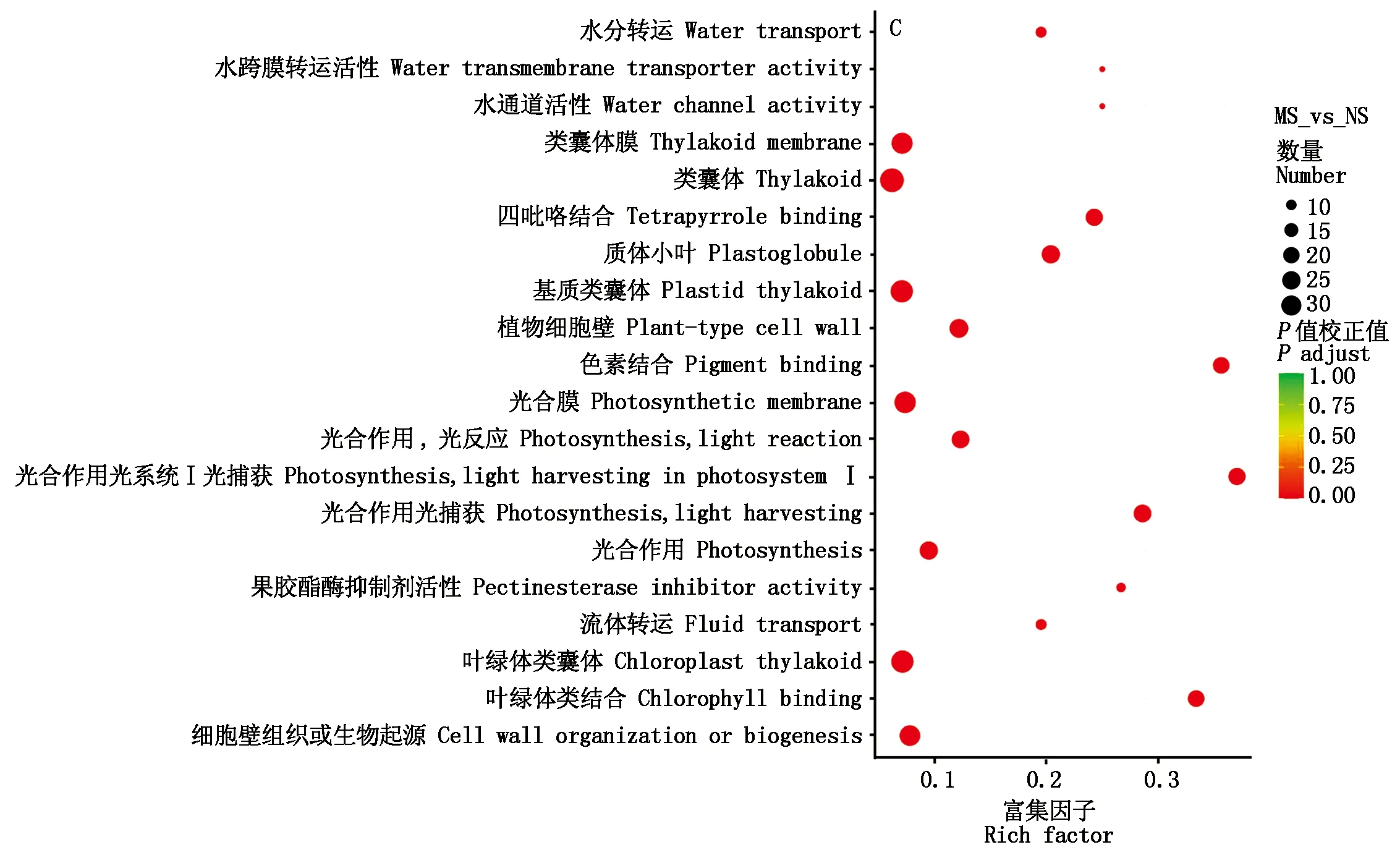
图5 处理间差异表达基因的GO富集分析Fig.5 The GO enrichment analysis of DEGs between treatments
2.5 差异表达基因的KEGG富集分析
对差异表达基因富集最显著的前20条KEGG pathway绘制气泡图。结果显示(图6),在FS_vs_MS处理间较显著富集的KEGG通路有核糖体、植物激素信号转导、植物MAPK信号通路、过氧化物酶体、氧化磷酸化等(图6-A);在FS_vs_NS处理间较显著富集的KEGG通路有核糖体、氧化磷酸化、植物激素信号转导等(图6-B);在MS_vs_NS处理间较显著富集的KEGG通路包括光合作用-天线蛋白、植物激素信号转导、泛素酮和其他萜类醌的生物合成、光合作用等(图6-C)。根据以上3个处理组的结果,可看出尼龙网分隔和未分隔间作花魔芋根系相对于塑料膜分隔单作花魔芋较显著的差别在于核糖体、氧化磷酸化和植物激素信号转导。


图6 处理间差异表达基因的KEGG富集分析Fig.6 The KEGG enrichment analysis of DEGs between treatments
2.6 差异表达基因的qRT-PCR验证
从转录组数据中随机挑取6个DEGs,推测为阿拉伯半乳聚糖蛋白(TRINITY_ DN5161_c0_g1)、磷脂酶A2(TRINITY_DN1055_c0_g1)、三角状五肽重复蛋白(TRINITY_DN41977_c0_g2)、水孔蛋白PIP2-8(TRINITY_DN1454_c0_g1)、DNA损伤修复蛋白(TRINITY_DN22369_c0_g1)、受体胞质丝氨酸/苏氨酸蛋白激酶RBK2(TRINITY_DN1700_c0_g1),利用qRT-PCR试验对这些基因表达进行进一步分析,结果显示(图7),6个DEGs的表达水平与转录组数据趋势一致,证实了转录组分析结果的可靠性。

1.阿拉伯半乳聚糖蛋白;2.磷脂酶A2;3.三角状五肽重复蛋白;4.水孔蛋白PIP2-8;5.DNA损伤修复蛋白;6.受体胞质丝氨酸/苏氨酸蛋白激酶RBK2。1.Arabinogalactan protein;2.Phospholipase A2;3.Pentatricopeptide repeat-containing protein;4.Aquaporin PIP2-8;5.DNA damage repair protein;6.Receptor-like cytosolic serine/threonine-protein kinase RBK2.图7 6个差异表达基因qRT-PCR验证Fig.7 qRT-PCR analysis of six selected DEGs
3 结论与讨论
本研究以刺槐和花魔芋不同根系分隔方式为研究对象,利用Illumina Novaseq 6000平台,对不同处理花魔芋根系进行转录组测序和分析,获得Q30均达到92.0%以上的高质量序列数据。通过对间作花魔芋根系转录组数据的分析,了解花魔芋根系在与刺槐不同根系分隔方式下的生物学过程及代谢通路,研究结果有助于探究间作花魔芋根系基因在与刺槐间作条件下的表达调控机制。
植物在环境胁迫条件下,通过改变自身的基因表达来调控代谢途径与物质合成[26]。本研究对处理间进行两两比较发现,FS_vs_MS的差异表达基因数量最多,是FS_vs_NS组内差异基因数量的2.4倍,说明尼龙网分隔的花魔芋根系中有更多基因被激活表达来响应与刺槐的半交互互作。差异表达基因GO功能注释分析后发现,在FS_vs_MS和FS_vs_NS处理间差异基因显著富集的GO term主要集中在植物生长比如细胞膜和细胞外围等。这些与植物生长相关的GO term可能影响间作花魔芋的生物量或产量,这从另一方面验证了前人关于间作花魔芋生理方面的研究结果,间作花魔芋的生长性状和产量品质优于单作[27-28]。
在差异表达基因的KEGG通路中,与塑料膜分隔相比,尼龙网分隔和未分隔间作花魔芋根系的植物激素信号转导通路显著富集,说明植物激素信号转导是花魔芋根系响应与刺槐间作栽培的重要途径,该结果与黄瓜[29]和刺角瓜[30]根系受到生物和非生物胁迫而显著富集的通路相似。激素是植物响应环境信号转导的主要成员[31],在间作花魔芋生长过程中发挥重要作用,因此,本研究也说明了尼龙网分隔和未分隔间作花魔芋具有更活跃的细胞代谢水平和更强的抗逆性。在FS_vs_MS和FS_vs_NS处理间较显著富集的KEGG通路还有核糖体和氧化磷酸化,这可能与尼龙网分隔的半交互和间作条件下花魔芋植株启动大量基因在核糖体翻译有关,氧化磷酸化途径与能量代谢有关[32],推测半交互状态和间作的花魔芋产生大量能量以更好地适应环境。
本研究对刺槐与花魔芋间作系统中塑料膜分隔、尼龙网分隔和未分隔的花魔芋根系进行转录组测序与分析。将各处理获得的转录组数据进行两两比较,FS_vs_MS、FS_vs_NS和MS_vs_NS的差异表达基因数分别为1 776,733,896个,其中上调表达基因分别占33.1%,22.8%和50.8%。通过对差异表达基因的GO和KEGG富集分析表明,尼龙网分隔的花魔芋根系中有更多差异表达基因参与调控,这些通路中的功能基因在间作花魔芋的生长过程中发挥重要作用,该结果为研究间作花魔芋根系基因表达调控提供了基础数据资料。

