基于PCR和巢式PCR技术的玉米南方锈病早期检测
马红霞,孙华,郭宁,刘树森,张海剑,石洁
基于PCR和巢式PCR技术的玉米南方锈病早期检测

河北省农林科学院植物保护研究所/农业农村部华北北部作物有害生物综合治理重点实验室/河北省农业有害生物综合防治工程技术研究中心,河北保定 071000
【目的】建立巢式PCR方法,快速检测处于病害潜育期的玉米叶片内的多堆柄锈菌(),为玉米南方锈病(southern corn rust)的预测和防治提供技术支持。【方法】根据多堆柄锈菌ITS区序列,在其变异区设计3条多堆柄锈菌特异性检测引物NX471-F、NX255-F和NX255-R,建立以NX471-F与真菌ITS区通用引物ITS4为外侧引物,NX255-F/NX255-R为内侧引物的巢式PCR。采用20 µL扩增体系:Ex Taq DNA聚合酶(5 U·µL-1)0.15 µL、10×Ex Taq Buffer(Mg2+plus)2µL,dNTP Mixture(各2.5 mmol·L-1)1.6 µL,上下游引物(10 μmol·L-1)各0.3 µL,DNA 1 µL,14.65 µL ddH2O。扩增程序:利用外侧引物NX471-F/ITS4进行第一步PCR扩增,95℃预变性7 min;95℃变性30 s,55℃退火30 s,72℃延伸45 s,30个循环;72℃再延伸7 min。将扩增后的产物稀释20倍,取1 µL用作第二步PCR的扩增模板,然后以内侧引物NX255-F/NX255-R进行第二步PCR扩增,95℃预变性7 min;95℃变性30 s,66℃退火30 s,72℃延伸26 s,30个循环;72℃再延伸7 min。同时选用内侧引物进行常规PCR扩增,扩增体系同巢式PCR,扩增程序除循环数为38,其余程序同巢式PCR的第二步PCR检测。在此条件下对多堆柄锈菌、高粱柄锈菌()、青杨叶锈病菌()和7种玉米常见病原菌进行特异性检测,对不同梯度多堆柄锈菌基因组DNA和3种人工接种病叶进行灵敏度检测。【结果】巢式PCR检测体系仅在检测多堆柄锈菌时,产生了255 bp的目的条带,其他菌株均未扩增出目的条带。巢式PCR检测体系对多堆柄锈基因组DNA的最低检测限为10 fg·µL-1,是常规PCR检测体系灵敏度的500倍。当1 g人工接种病叶含500—2.5×104个多堆柄锈菌夏孢子时,常规PCR和巢式PCR检出阳性率分别0和85.71%,巢式PCR可检测出的夏孢子个数最少为1 000个;当1 g人工接种病叶中含1—7个夏孢子堆时,常规PCR和巢式PCR检出阳性率分别76.19%和100%,常规PCR可检测出的夏孢子堆个数最少为2个,巢式PCR可检测出1个及以上夏孢子堆;当1 g人工接种病叶中含1—7个侵染点时,常规PCR和巢式PCR检出阳性率分别14.29%和66.67%,检测出的侵染点个数最少分别为6个和3个。【结论】成功建立了一种以NX471-F/ITS4为外侧引物,NX255-F/NX255-R为内侧引物的巢式PCR检测方法,可快速、高效、准确检测玉米叶片中潜伏期的多堆柄锈菌。
玉米南方锈病;多堆柄锈菌;常规PCR;巢式PCR
0 引言
【研究意义】玉米南方锈病(southern corn rust)是由多堆柄锈菌()引起的世界性病害。该病害主要危害叶片,也侵染茎秆、苞叶和雄穗。当多堆柄锈菌侵染叶片后,破坏其绿色组织,导致叶片干枯,植株早衰,籽粒灌浆不足,产量下降[1]。自20世纪90年代以来,该病害在我国东部沿海和黄淮海玉米种植区时常暴发,对玉米生产的威胁明显增大,已上升为主要病害[2-3]。2015年玉米南方锈病全国发生面积为523.9万公顷,玉米产量损失75.6万吨,分别是2008—2014年平均值的4.1—8.8倍[4]。2021年受台风“烟花”影响,黄淮海夏玉米区暴发南方锈病,是近5年最重的一年,如山东玉米南方锈病发生面积为168万公顷,其发生面积高于2015年[5]。多堆柄锈菌侵染植株后,在植物组织内扩展,当条件适宜时才产生夏孢子并突破表皮显出症状,病害潜育过程一般在8—13 d[6],甚至长达30 d以上。若显症后采取防治措施,不能很好地控制病情发展,因此建立快速、准确检测潜伏期多堆柄锈菌的方法,有助于该病害的预测与防治。【前人研究进展】目前国内外对玉米南方锈病的研究主要集中在抗性遗传分析[7-12]、发生规律[6]、初侵染来源[13-14]和防治,对玉米南方锈病病菌检测报道较少。对该病菌的检测方法传统上依靠显微观察夏孢子的形态和大小判断,但有时多堆柄锈菌夏孢子和高粱柄锈菌()夏孢子形状、颜色相近,容易误判;另外,普通显微观察在病原菌侵入早期很难观测到组织内的多堆柄锈菌。因此,分子检测方法陆续研发报道。目前常用方法以常规PCR[15-16]和荧光定量PCR[17-18]为主。如邢国珍等[15]以多堆柄锈菌ITS-rDNA为靶标,设计特异性引物,利用常规PCR技术进行检测,可与高粱柄锈菌或其他玉米常见真菌病原区分开,其最低检测浓度为100 pg·μL-1;于凯[16]利用常规PCR技术,采用设计的多堆柄锈菌特异性引物可以检测到10 pg·μL-1的多堆柄锈菌基因组DNA;Crouch等[17]建立的TanMan探针法检测多堆柄锈菌,灵敏度最低为50 pg·μL-1;张克瑜等[18]利用多堆柄锈菌特异性引物和TaqMan探针进行荧光定量PCR检测,其灵敏度达到1 pg·μL-1,较常规PCR提高了10倍。巢式PCR法利用两对PCR引物进行两轮PCR扩增反应,在第一轮扩增中,外引物用以产生扩增产物,此产物再用内引物进行第二轮扩增,具有更高的灵敏度和特异性[19-22],如汤春蕾[19]利用巢式PCR检测小麦条锈菌(),其灵敏度达1 fg·μL-1,较常规PCR提高了1 000倍。【本研究切入点】在多堆柄锈菌侵染田间玉米早期,越早检测出结果,留给预测和防治的空间越大,但越早叶片中的病菌所占比例也越低,要求的检测灵敏度越高。常规PCR灵敏度低,TaqMan探针法qPCR成本高,对设备技术要求较高,需要专业人士进行,而巢式PCR灵敏度高,方法简单,成本低,在低模板量样本检测中更具有应用价值。但该技术在南方锈病上的应用尚未见报道。【拟解决的关键问题】以不同浓度的多堆柄锈菌基因组DNA,携带不同个数的夏孢子、夏孢子堆和侵染点的人工接种病叶为研究对象,根据多堆柄锈菌ITS区序列的变异区,设计多堆柄锈菌特异性检测引物,建立一种高效、灵敏、准确的巢式PCR检测方法,以期为我国玉米南方锈病的预测与防治工作提供技术支持。
1 材料与方法
试验于2022年6—11月在河北省农林科学院植物保护研究所完成。
1.1 材料
健康玉米叶片:温室培养的未接菌的郑单958 4—5叶期的叶片;发病玉米叶片:人工接种发病的携带多堆柄锈菌夏孢子堆的郑单958叶片。
人工接种病叶制备:(1)采集新鲜的多堆柄锈菌夏孢子,加入一定量的无菌水,孢子浓度调至1×106个/mL,取不同量的孢子悬浮液分别加入到1 g健康叶片中,使1 g健康叶片中夏孢子个数分别为a1:500、a2:1×103、a3:1.5×103、a4:2×103、a5:5×103、a6:1×104、a7:2.5×104;(2)取人工接种叶片,用消毒后的剪刀沿褪绿圈将叶片上即将裂开的多堆柄锈菌夏孢子堆剪下,取不同个数的夏孢子堆分别与1 g健康叶片混合,使1 g健康叶片中夏孢子堆个数分别为b1:1、b2:2、b3:3、b4:4、b5:5、b6:6、b7:7;(3)取人工接种叶片,用消毒后的剪刀沿褪绿圈将叶片上夏孢子侵染点剪下,取不同个数的侵染点分别与1 g健康叶片混合,使1 g健康叶片中夏孢子侵染点个数分别为c1:1、c2:2、c3:3、c4:4、c5:5、c6:6、c7:7。
供试真菌:多堆柄锈菌、高粱柄锈菌、青杨叶锈病菌()、禾谷镰孢()、厚垣镰孢()、拟轮枝镰孢()、变红镰孢()、玉米生平脐蠕孢菌()、嘴突脐孢()、细极链格孢(),均为本实验室保存菌种。
引物:在NCBI下载多堆柄锈菌ITS区序列,根据其变异区在Primer-BLAST上设计3条多堆柄锈菌特异性检测引物NX471-F、NX255-F和NX255-R,其中NX471-F:5′-ATCTCTTGGCTCTCACATC-3′与真菌ITS区通用引物ITS4:5′-TCCTCCGCTTATTGATAT GC-3′组成外侧引物;NX255-F:5′-GAACGCACCTTGC ACCTTT-3′和NX255-R:5′-AAGCTCCAAGAACTTCC TCCTC-3′组成内侧引物,预期扩增目的片段大小为255 bp。引物由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 DNA的提取 供试真菌的基因组DNA提取方法采用艾德莱真菌基因组提取试剂盒;健康叶片、发病叶片和人工接种病叶的基因组DNA提取方法采用艾德莱改良CTAB法植物基因组DNA提取试剂盒,提取的DNA于-20℃保存待用。
1.2.2 常规PCR和巢式PCR方法的建立 常规PCR检测体系:以特异性内侧引物NX255-F/NX255-R进行常规PCR检测。20 µL PCR扩增体系:Ex Taq DNA聚合酶(5 U·μL-1)0.15 μL、10×Ex Taq Buffer(Mg2+plus)2 μL,dNTP Mixture(各2.5 mmol·L-1)1.6 μL,上下游引物(10 μmol·L-1)各0.3 μL,DNA 1 μL,14.65 μL ddH2O;PCR扩增程序:95℃预变性7 min;95℃变性30 s,66℃退火30 s,72℃延伸26 s,38个循环;72℃再延伸7 min。
巢式PCR检测体系:以外侧引物NX471-F/ITS4进行第一步PCR扩增,PCR扩增体系同常规PCR检测,PCR扩增程序:95℃预变性7 min;95℃变性30 s,55℃退火30 s,72℃延伸45 s,30个循环;72℃再延伸7 min。第一步PCR扩增完成后将PCR产物稀释20倍,取1 μL用作第二步PCR的扩增模板,然后以内侧引物NX255-F/NX255-R进行第二步PCR扩增,PCR扩增体系同常规PCR检测体系,扩增程序除了循环数改为30个外,其余程序同常规检测。
取上述两种PCR产物各5 μL分别于2%琼脂糖凝胶中电泳1 h(5 V·cm-1),随后用凝胶成像系统观察拍照。
1.2.3 序列测定与分析 将常规PCR扩增产物和巢式PCR的第一步及第二步扩增产物各选取3个送交生工生物工程(上海)股份有限公司进行测序,使用DNAStar软件结合测序峰值图对测序结果进行人工校正,将校正结果在NCBI网站上进行BLASTn比对。
1.2.4 引物特异性检测 利用外/内侧引物对10种真菌(多堆柄锈菌、高粱柄锈菌、青杨叶锈病、禾谷镰孢、厚垣镰胞、拟轮枝镰孢、变红镰孢、玉米生平脐蠕孢菌、嘴突脐孢、细极链格孢)基因组DNA进行扩增,以ddH2O为阴性对照。PCR体系和程序同巢式PCR检测体系。
1.2.5 引物灵敏度检测 将多堆柄锈菌基因组DNA浓度调整为10 ng·μL-1,按梯度稀释成不同浓度,a:1×106、5×105、1×105、5×104、1×104、5×103、1×103、500、100、50、10、5 fg·μL-1;b:107、106、105、104、103、100、10、1、10-1、10-2fg·μL-1,备用。取1 μL多堆柄锈菌基因组DNA(a)为模板,以NX255-F/NX255-R为引物进行常规PCR扩增,PCR体系和程序同常规PCR检测体系;同样取1 μL不同浓度的多堆柄锈菌基因组DNA(b)为模板进行PCR扩增,PCR体系和程序同巢式PCR检测体系;两种PCR检测体系均以ddH2O为空白对照。
1.2.6 人工接种病叶的检测 提取人工接种病叶(1):a1—a7的基因组DNA,2次重复,各取1 μL为模板分别进行常规PCR和巢式PCR扩增,以多堆柄锈菌基因组DNA为阳性对照,健康叶片基因组DNA为阴性对照,以ddH2O为空白对照。提取人工接种病叶(2):b1—b7和(3):c1—c7的基因组DNA,3次重复,各取1 μL为模板分别进行常规PCR和巢式PCR扩增,以多堆柄锈菌基因组DNA为阳性对照,健康叶片基因组DNA为阴性对照,以ddH2O为空白对照。
2 结果
2.1 ITS序列比对分析
经DNAMAN8软件分析比较,设计的3条引物序列均与其他菌株在部分位点上不同,表明这3条引物的特异性较高(图1)。

“-”:与多堆柄锈菌碱基序列相同the same base sequences with P. polysora;小写字母lowercase:与多堆柄锈菌碱基序列不同the different base sequences with P. polysora;“.”:碱基缺失the missing base;红色字体red font:设计的引物位置The position of the designed primers
2.2 序列测定
将人工校对后的常规PCR扩增产物以及巢式PCR的第一步和第二步扩增产物的测序结果在NCBI网站上进行BLASTn比对,结果显示,第一步巢式PCR的测序结果与多堆柄锈菌菌株A7-2(HQ154022.1)和ZMD-1(HQ154037.1)相似度分别为99.55%和99.33%;常规PCR和第二步巢式PCR的测序结果一致,是第一步测序结果的一部分,与A7-2(HQ154022.1)和DAOM 181751(MT932576.1)相似度均为100%。
2.3 引物特异性检测
利用外/内侧引物对10种真菌基因组DNA进行扩增。结果如图2所示,只有以多堆柄锈菌基因组DNA为模板的真菌有目的条带,约为255 bp,其他真菌均无目的条带。说明该对引物可以用于南方锈病病原菌的检测。
2.4 引物灵敏度检测
以多堆柄锈菌基因组DNA为模板,常规PCR和巢式PCR的最低检测限分别为5×103和10 fg·μL-1(图3),巢式PCR是常规PCR检测体系灵敏度的500倍。
2.5 人工接种病叶的检测
以人工接种病叶(1)基因组DNA为模板,常规PCR和巢式PCR检出阳性率分别0和85.71%,巢式PCR可检测出1 g玉米叶片中的多堆柄锈菌夏孢子个数最少为103个(图4-A、4-B)。以人工接种病叶(2)基因组DNA为模板,常规PCR和巢式PCR检出阳性率分别76.19%和100%,常规PCR可检测出1 g玉米叶片中的夏孢子堆个数最少为2个,巢式PCR可检测出1个及以上夏孢子堆(图4-C、4-D)。以人工接种病叶(3)基因组DNA为模板,常规PCR和巢式PCR检出阳性率分别14.29%和66.67%,常规PCR和巢式PCR可检测出1 g玉米叶片中的侵染点个数最少分别为6个和3个(图4-E、4-F)。阴性对照健康玉米叶片(J)和空白对照(ddH2O)均未扩增出目的片段,说明扩增体系未污染。

M:100 bp Ladder DNA Marker;1:多堆柄锈菌P. polysora;2:高粱柄锈菌P. sorghi;3:青杨叶锈病菌M. laricipopulina;4:禾谷镰孢F. graminearum;5:厚垣镰孢F. chlamydosporum;6:拟轮枝镰孢F. verticillioides;7:变红镰孢F. incarnatum;8:玉米生平脐蠕孢菌B. zeicola;9:嘴突脐孢E. rostratum;10:细极链格孢A. tenuissima;CK:ddH2O
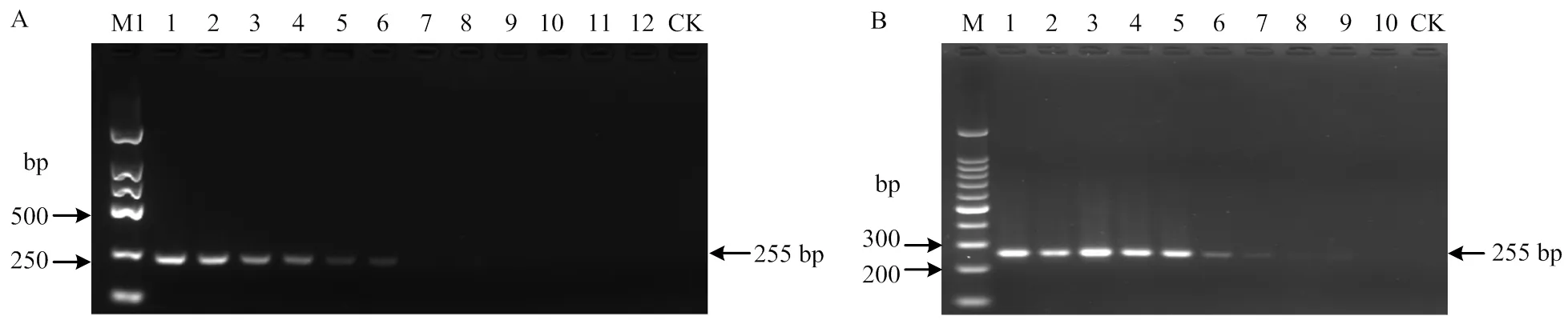
A:常规PCR Conventional PCR;B:巢式PCR Nested PCR;M1:DL2000 marker;M:100 bp Ladder DNA Marker。A中1—12:1×106、5×105、1×105、5×104、1×104、5×103、1×103、500、100、50、10、5 fg·μL-1多堆柄锈菌基因组DNA 1×106, 5×105, 1×105, 5×104, 1×104, 5×103, 1×103, 500, 100, 50, 10, 5 fg·μL-1P. polysora genome DNA;B中1—10:107、106、105、104、103、102、10、1、10-1、10-2 fg·μL-1多堆柄锈菌基因组DNA 107, 106, 105, 104, 103, 102, 10, 1, 10-1, 10-2 fg·μL-1P. polysora genome DNA
3 讨论
3.1 特异性引物的选择
基于PCR原理的分子生物学技术是一种灵敏度高、特异性强的快速检测技术,而PCP检测技术成功的首要条件在于特异性引物的筛选。目前开发特异性检测病菌的引物序列主要有3种途径:一是核糖体DNA,常用16S、ITS区[23]、28S[24];二是物种特异的持家基因,如RNA聚合酶([25]、[26])、延伸因子[27]、肌动蛋白、-微管蛋白[28]、钙调蛋白等;三是未知基因的特异DNA片段,如基因组特异性片段[29]、各种类型的分子标记如SCAR[30]、EST[31]等。rDNA-ITS序列含有可变异区,受外界环境影响较小,是植物病菌特异性检测的理想标记。多堆柄锈菌的ITS序列与同属菌株的相似性为79.48%—95.58%,表明种间差异明显,是特异性检测引物首选。目前检测多堆柄锈菌的特异性引物多集中在该序列[15-18]。特异性引物在Primer-BLAST时,还需要与病菌寄主的基因组DNA进行比较,排除寄主的干扰。将前人筛选的特异性引物与玉米基因组DNA比对,发现有大小不等的目标模板,而本研究筛选的内侧引物NX255-F/NX255-R在玉米基因组数据库中无目标模板,且特异性检测显示可专一性扩增多堆柄锈菌基因组DNA,表明引物特异性强,可用于南方锈病病原菌的检测。
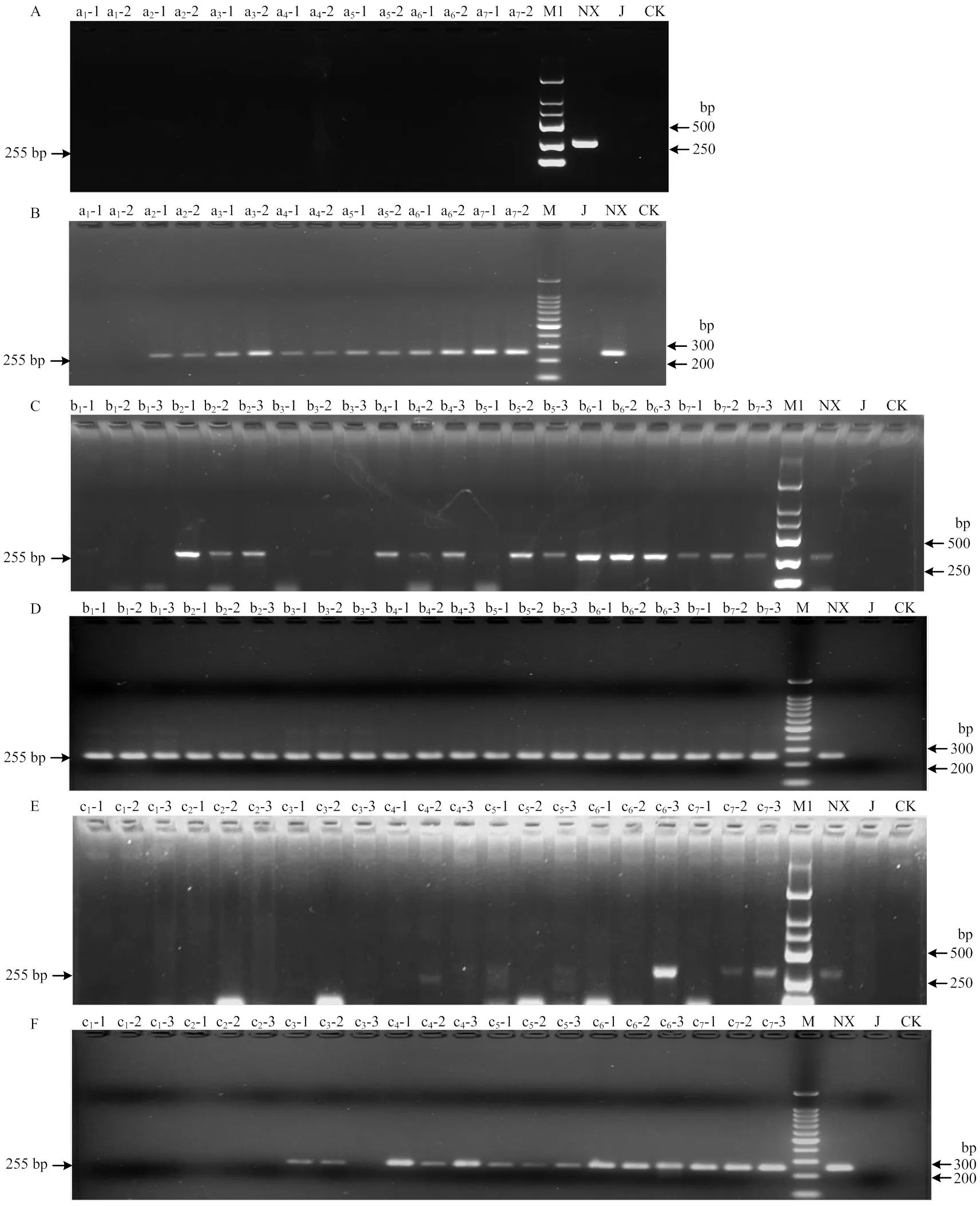
A、C、E:常规PCR Conventional PCR;B、D、F:巢式PCR Nested PCR;M1:DL2000 marker;M:100 bp Ladder DNA Marker;CK:ddH2O;NX:多堆柄锈菌基因组DNA P. polysora genome DNA;J:健康玉米叶片基因组DNA Health maize leaf genome DNA。A、B中a1—a7:1 g健康玉米叶片中夏孢子个数分别为500、1×103、1.5×103、2×103、5×103、1×104、2.5×104,两次重复500, 1×103, 1.5×103, 2×103, 5×103, 1×104, 2.5×104 of P. polysora urediniospores in 1 g of maize leaves, two repeats;C、D中b1—b7:1 g健康玉米叶片中夏孢子堆个数分别为1、2、3、4、5、6、7,3次重复1, 2, 3, 4, 5, 6, 7 of P. polysora uredia in 1 g of maize leaves, three repeats;E、F中c1—c7:1 g健康玉米叶片中夏孢子侵染点个数分别为1、2、3、4、5、6、7,3次重复1, 2, 3, 4, 5, 6, 7 of P. polysora infection sites in 1 g of maize leaves, three repeats
3.2 巢式PCR在病害潜育期检测的优势
常规PCR检测方法简单,灵敏度低;而qPCR灵敏度高,但成本高,这些缺点给实际检测多堆柄锈菌带来很大障碍。巢式PCR是基于第一次PCR扩增产物上的二次扩增结果,具有很好的灵敏度,在低模板量样本检测中应用非常广泛。研究发现,巢式PCR的检测灵敏度一般为10 pg·μL-1—1 fg·μL-1[32-34],如检测大豆疫霉为50 fg·μL-1[32],黑胡椒根腐病菌腐皮镰孢为1 fg·μL-1[34],是常规PCR的100—1 000倍,是qPCR的10倍[32]。本研究发现巢式PCR的检测灵敏度是常规PCR的500倍,是目前TaqMan探针法(灵敏度最低限1 pg·μL-1)的100倍[18]。人工接种病叶的检测结果再次表明巢式PCR的检测灵敏度较常规PCR高。
3.3 同类检测方法对样本中病原检出率的比较分析
不同的PCR法对植物病原菌的检出阳性率不同。如夏菲等[35]检测黄栌枯萎病菌()时,常规PCR检出阳性率为33.33%,巢式PCR检出阳性率为100%。本研究中常规PCR检测1 g玉米叶片中含的多堆柄锈菌夏孢子、夏孢子堆和侵染点检出阳性率分别为0、76.19%和14.29%;巢式PCR检出阳性率分别为85.71%、100%和66.67%。当植物体内病原菌含量低或分布不均匀时,巢式PCR也可能漏检[32]。本研究对人工接种病叶检测中,发现1 g叶片中多堆柄锈菌含量低于1×104个时,不是所有的重复都能检出病菌。因此,应用PCR法检测植物潜育期的病菌时,每个样品需设立多个重复,提高检出率。
4 结论
基于rDNA-ITS区开发了玉米南方锈病病原菌特异的常规PCR和巢式PCR检测技术。经验证,常规PCR和巢式PCR的最低检测限分别为5×103和10 fg·μL-1,可分别用于显症玉米叶片的检测和潜育期多堆柄锈菌的检测,方法简单、快速、灵敏度高。
[1] 王晓鸣, 石洁, 晋齐鸣, 李晓, 孙世贤. 玉米病虫害田间手册——病虫害鉴别与抗性鉴定. 北京:中国农业科学技术出版社, 2010: 27.
WANG X M, SHI J, JIN Q M, LI X, SUN S X. Field manual of maize pests and diseases—identification and evaluation on the resistance to insect pest and disease. Beijing: China Agricultural Science and Technology Press, 2010: 27. (in Chinese)
[2] 隋鹏飞, 王琰, 张茹琴, 夏淑春, 王志奎, 鄢洪海.山东省玉米南方锈病菌遗传多样性及初侵染来源分析//彭友良, 李向东.中国植物病理学会2017年学术年会论文集. 北京: 中国农业科学技术出版社, 2017.
SUI P F, WANG Y, ZHANG R Q, XIA S C, WANG Z K, YAN H H. Genetic diversity and analysis of initial infection sources ofcausing southern rust of maize in Shandong Province//PENG Y L, LI X D. Proceedings of the 2017 annual meeting of Chinese society for plant pathology. Beijing: China Agricultural Science and Technology Press, 2017. (in Chinese)
[3] 郭云燕, 陈茂功, 孙素丽, 武小菲, 江凯, 朱振东, 李洪杰, 何月秋, 王晓鸣. 中国玉米南方锈病病原菌遗传多样性. 中国农业科学, 2013, 46(21): 4523-4533. doi: 10.3864/j.issn.0578-1752. 2013.21.015.
Guo Y Y, Chen M G, Sun S L, WU X F, JIANG K, ZHU Z D, LI H J, HE Y Q, WANG X M. Genetic diversity ofUnderw. in China. Scientia Agricultura Sinica, 2013, 46(21): 4523-4533. doi: 10.3864/j.issn.0578-1752.2013.21.015. (in Chinese)
[4] 刘杰, 姜玉英, 曾娟, 纪国强, 刘莉, 邱坤, 徐永伟. 2015年我国玉米南方锈病重发特点和原因分析. 中国植保导刊, 2016, 36(5): 44-47.
Liu J, Jiang Y Y, Zeng J, JI G Q, LIU L, QIU K, XU Y W. Analysis of characters and factors on outbreak of southern corn rust in China in 2015. China Plant Protection, 2016, 36(5): 44-47. (in Chinese)
[5] 杨久涛, 张辉, 张继波, 邢晓飞, 韩伟, 国栋. 2021年山东省玉米南方锈病暴发流行原因分析与防控对策. 农业灾害研究, 2022, 12(6): 5-6, 9.
YANG J T, ZHANG H, ZHANG J B, XING X F, HAN W, GUO D. Outbreak of southern maize rust in Shandong Province in 2021 cause analysis and prevention and control countermeasures. Journal of Agricultural Catastrophology, 2022, 12(6): 5-6, 9. (in Chinese)
[6] 胡务义, 郑明祥, 阮义理, 潘飞云, 余北疆, 余英凤, 何万娥. 玉米南方型锈病发生规律与防治技术初步研究. 中国植保导刊, 2003, 23(12): 9-12.
HU W Y, ZHENG M X, RUAN Y L, PAN F Y, YU B J, YU Y F, HE W E. Preliminary studies on the incidences rules ofand its control technique. China Plant Protection, 2003, 23(12): 9-12. (in Chinese)
[7] 谭华, 邹成林, 郑德波, 韦新兴, 黄爱花, 蒋维萍, 韦慧, 黄开健. 分子标记辅助选择抗南方玉米锈病材料. 广东农业科学, 2016, 43(7): 6-10.
TAN H, ZOU C L, ZHENG D B, WEI X X, HUANG A H, JIANG W P, WEI H, HUANG K J. Selection of materials with resistance to southern corn rust (SCR) by marker-assistant selection (MAS) in maize (L.). Guangdong Agricultural Sciences, 2016, 43(7): 6-10. (in Chinese)
[8] ZHANG Y, XU L, ZHANG D F, DAI J R, WANG S C. Mapping of southern corn rust-resistant genes in the W2D inbred line of maize (L.). Molecular Breeding, 2010, 25(3): 433-439.
[9] 蒋雅娟, 贺岩, 张登峰, 徐丽, 苏胜宝, 戴景瑞, 王守才. 玉米抗南方型锈病基因共分离分子标记的研究. 作物学报, 2007, 33(5): 849-852.
JIANG Y J, HE Y, ZHANG D F, XU L, SU S B, DAI J R, WANG S C. Co-segregation molecular marker for southern corn rust resistance trait. Acta Agronomica Sinica, 2007, 33(5): 849-852. (in Chinese)
[10] ZHOU C J, CHEN C X, CAO P X, WU S W, SUN J W, JIN D M, WANG B. Characterization and fine mapping of, a resistance gene to southern corn rust in maize. Molecular Genetics and Genomics, 2007, 278(6): 723-728.
[11] 陈翠霞, 邢全华, 梁春阳, 于元杰, 梁凤山, 王洪刚, 王振林, 王斌. 南方玉米锈病抗病基因的定位及不同遗传背景对基因标记的比较分析. 遗传学报, 2003, 30(4): 341-344.
CHEN C X, XING Q H, LIANG C Y, YU Y J, LIANG F S, WANG H G, WANG Z L, WANG B. Genetic mapping of resistant gene to southern corn rust and the tagging analysis on different genetic background. Acta Genetica Sinica, 2003, 30(4): 341-344. (in Chinese)
[12] ZHAO P F, ZHANG G B, WU X J, LI N, SHI D Y, ZHANG D F, JI C F, XU M L, WANG S C. Fine mapping of, a southern rust resistance gene in maize. Journal of Integrative Plant Biology, 2013, 55(5): 462-472.
[13] 鄢洪海, 王琰, 张茹琴, 夏淑春, 王志奎, 宋希云. 基于ISSR-PCR对山东玉米多堆柄锈菌遗传多样性的研究及其初侵染菌源的推测. 菌物学报, 2018, 37(2): 157-165.
YAN H H, WANG Y, ZHANG R Q, XIA S C, WANG Z K, SONG X Y. Genetic diversity and deduction of primary infection source ofin Shandong Province based on ISSR-PCR. Mycosystema, 2018, 37(2): 157-165. (in Chinese)
[14] 王晓鸣, 刘骏, 郭云燕, 段灿星, 朱振东, 孙素丽, 杨知还. 中国玉米南方锈病初侵染源的多源性. 玉米科学, 2020, 28(3): 1-14, 30.
WANG X M, LIU J, GUO Y Y, DUAN C X, ZHU Z D, SUN S L, YANG Z H. Multiorigins of initial infection sources ofcausing southern rust of maize in China. Journal of Maize Sciences, 2020, 28(3): 1-14, 30. (in Chinese)
[15] 邢国珍, 魏馨, 李晶晶, 李闯, 刘娜, 蒋士君, 李春奇, 郑文明. 玉米南方锈病和普通锈病分子检测技术研究. 中国农业大学学报, 2017, 22(3): 6-11.
XING G Z, WEI X, LI J J, LI C, LIU N, JIANG S J, LI C Q, ZHENG W M. Molecular detection ofUnderw. andSchw. Journal of China Agricultural University, 2017, 22(3): 6-11. (in Chinese)
[16] 于凯. 玉米南方锈病的分子检测与玉米抗病性机制的研究[D]. 杨凌: 西北农林科技大学, 2010.
YU K. Molecule detection ofand resistance mechanism to southern corn rust in maize[D]. Yangling: Northwest A & F University, 2010. (in Chinese)
[17] CROUCH J A, SZABO L J. Real-time PCR detection and discrimination of the southern and common corn rust pathogensand. Plant Disease, 2011, 95(6): 624-632.
[18] 张克瑜, 李磊福, 谷医林, 孙秋玉, 马占鸿. 多堆柄锈菌潜育期侵染量实时荧光定量PCR检测体系的建立. 植物保护学报, 2022, 49(3): 832-839.
ZHANG K Y, LI L F, GU Y L, SUN Q Y, MA Z H. Establishment of quantitative real-time PCR detection system for latent infection of southern corn rust pathogen. Journal of Plant Protection, 2022, 49(3): 832-839. (in Chinese)
[19] 汤春蕾. 小麦叶片上潜伏期条锈菌的巢式PCR检测及小麦与条锈菌互作中相关激酶类基因的表达谱分析[D]. 杨凌: 西北农林科技大学, 2008.
TANG C L. Detection ofin latent infected wheat leaves by nested PCR and expression profiles analysis of protein kinase during interaction between wheat and stripe rust[D]. Yangling: Northwest A & F University, 2008. (in Chinese)
[20] 傅华英, 葛丹凤, 李晓燕, 吴小斌, 陈如凯, 高三基. 甘蔗赤条病菌巢式PCR检测. 植物保护学报, 2017, 44(2): 276-282.
FU H Y, GE D F, LI X Y, WU X B, CHEN R K, GAO S J. Nested-PCR detection ofsubsp., the pathogen of red stripe on sugarcane. Journal of Plant Protection, 2017, 44(2): 276-282. (in Chinese)
[21] 王楠, 李志勇, 董立, 白辉, 朱彦彬, 全建章, 董志平. 谷子锈菌巢式PCR检测体系的建立. 植物病理学报, 2015, 45(4): 438-442.
WANG N, LI Z Y, DONG L, BAI H, ZHU Y B, QUAN J Z, DONG Z P. Establishment of a nested PCR detection system of. Acta Phytopathologica Sinica, 2015, 45(4): 438-442. (in Chinese)
[22] 吴伟怀, 刘宝慧, 鹿鹏鹏, 梁艳琼, 贺春萍, 李锐, 易克贤. 甘蔗褐锈病菌单管巢式PCR检测体系的建立. 中国糖料, 2022, 44(3): 1-7.
WU W H, LIU B H, LU P P, LIANG Y Q, HE C P, LI R, YI K X. Establishment of single tube nested PCR detection system for. Sugar Crops of China, 2022, 44(3): 1-7. (in Chinese)
[23] WILSON A, SIMPSON D, CHANDLER E, JENNINGS P, NICHOLSON P. Development of PCR assays for the detection and differentiation ofand. FEMS Microbiology Letters, 2004, 233(1): 69-76.
[24] 徐鑫, 边勇, 陈哲, 孙悦, 刘子璐, 胡渤洋, 武扬, 张国庆. 基于DNA条形码的桑黄真菌分子鉴定. 北京农学院学报, 2019, 34(1): 20-27.
XU X, BIAN Y, CHEN Z, SUN Y, LIU Z L, HU B Y, WU Y, ZHANG G Q. Molecular identification of ‘Sang Huang’ by DNA barcoding. Journal of Beijing University of Agriculture, 2019, 34(1): 20-27. (in Chinese)
[25] 田擎. 平头炭疽菌、黑白轮枝菌、大丽轮枝菌及大豆根部病原菌的LAMP检测[D]. 南京: 南京农业大学, 2016.
TIAN Q. Lamp detection of,and soybean root pathogens[D]. Nanjing: Nanjing Agricultural University, 2016. (in Chinese)
[26] 程云方. 基于真菌基因组同源性分析的曲霉属特异性分子标记筛选[D].荆州: 长江大学, 2012.
CHENG Y F. Screening ofspecific molecular markers based on homology analysis of fungal genomes[D]. Jingzhou: Yangtze University, 2012. (in Chinese)
[27] 刘国霞, 谭晴晴, 齐军山, 王福玉, 陈雪燕, 范阳阳, 胡悦, 步迅, 张全芳. 基于序列位点特异性PCR快速鉴定小麦茎基腐病优势病原菌假禾谷镰孢菌. 农业生物技术学报, 2021, 29(5): 985-994.
LIU G X, TAN Q Q, QI J S, WANG F Y, CHEN X Y, FAN Y Y, HU Y, BU X, ZHANG Q F. Rapid identification of main pathogenof wheat crown rot using site-specific PCR based onsequence. Journal of Agricultural Biotechnology, 2021, 29(5): 985-994. (in Chinese)
[28] XU C N, ZHANG H J, CHI F M, JI Z R, DONG Q L, CAO K Q, ZHOU Z S. Species-specific PCR-based assays for identification and detection of Botryosphaeriaceae species causing stem blight on blueberry in China. Journal of Integrative Agriculture, 2016, 15(3): 573-579.
[29] KANG H X, PENG Y, HUA K Y, DENG Y F, BELLIZZI M, GUPTA D R, MAHMUD N U, URASHIMA A S, PAUL S K, PETERSON G, ZHOU Y L, ZHOU X P, ISLAM M T, WANG G L. Rapid detection of wheat blast pathogenpathotype using genome-specific primers and cas12a-mediated technology. Engineering, 2021, 7(9): 1326-1335.
[30] 周永进, 马鸿翔, 余桂红, 孙晓波, 张旭, 李杨瑞. 禾谷镰刀菌与亚细亚镰刀菌种型特异性的SCAR标记. 江苏农业学报, 2012, 28(5): 979-985.
ZHOU Y J, MA H X, YU G H, SUN X B, ZHANG X, LI Y R. Development of species-specific SCAR markers identifyingand. Jiangsu Journal of Agricultural Sciences, 2012, 28(5): 979-985. (in Chinese)
[31] 康健, 张林, 张梦雅, 闫红飞, 刘大群. 小麦叶锈菌特异分子标记建立. 河北农业大学学报, 2016, 39(4): 63-67.
KANG J, ZHANG L, ZHANG M Y, YAN H F, LIU D Q. Development of specific molecular markers in. Journal of Agricultural University of Hebei, 2016, 39(4): 63-67. (in Chinese)
[32] 徐静静, 蔺宇, 董立明, 王晓鸣, 武小菲, 朱振东. 用SSR标记和巢式PCR快速检测大豆疫霉菌. 中国农业科学, 2009, 42(5): 1624-1630. doi: 10.3864/j.issn.0578-1752.2009.05.015.
XU J J, LIN Y, DONG L M, WANG X M, WU X F, ZHU Z D. Rapid detection ofusing SSR marker and nested PCR. Scientia Agricultura Sinica, 2009, 42(5): 1624-1630. doi: 10.3864/j. issn.0578-1752.2009.05.015. (in Chinese)
[33] HONG Y, LUO Y, YI J, HE L, DAI L, YI T. Screening nested-PCR primer for ‘Liberibacterasiaticus’ associated with citrus Huanglongbing and application in Hunan, China. PLoS ONE, 2019, 14(2): e0212020.
[34] COSTA S S, MOREIRA G M, PFENNING L H. Development of a PCR protocol for the identification and detection off. sp.from soil and roots of black pepper (). Tropical Plant Pathology, 2017, 42(1): 55-59.
[35] 夏菲, 周江鸿, 车少臣, 仲丽, 赵正楠. 黄栌枯萎病菌巢式PCR检测方法的建立. 上海农业学报, 2021, 37(3): 47-51.
XIA F, ZHOU J H, CHE S C, ZHONG L, ZHAO Z N. Development of a nested PCR detection method forcausing verticillium wilt of. Acta Agriculturae Shanghai, 2021, 37(3): 47-51. (in Chinese)
Early Molecular Diagnosis of Southern Corn Rust Based on Conventional PCR and Nested PCR Assays

Plant Protection Institute of Hebei Academy of Agricultural and Forestry Sciences/Key Laboratory of IPM on Crops in Northern Region of North China, Ministry of Agriculture and Rural Affairs/IPM Centre of Hebei Province, Baoding 071000, Hebei
【Objective】The objective of this study is to establish a rapid detection method forduring the incubation period based on the nested PCR, and to provide support for prediction and control of southern corn rust.【Method】The nested PCR primers for the specific detection ofwere designed using the variant region of the ITS sequence, including outer primer NX471-F/ITS4 and inner primer NX255-F/NX255-R. For amplification, the 20 µL PCR reaction mixture contained: Ex Taq DNA polymerase (5 U·μL-1) 0.15 μL, 10×Ex Taq Buffer (Mg2+plus) 2 μL, dNTP Mixture (2.5 mmol·L-1each) 1.6 μL, forward and reverse primers (10 μmol·L-1) 0.3 μL each, template DNA 1 μL, ddH2O 14.65 μL. The PCR program was performed as follows: the outer primer NX471-F/ITS4 was used for the first amplification and denaturation at 95℃ for 7 min, 30 cycles of denaturation at 95℃ for 30 s, annealing at 55℃ for 30 s, extension at 72℃ for 45 s, and a final extension at 72℃ for 7 min. The product was diluted 20 times and used as the template for the second run of the nested PCR, which was amplified with the inner primer NX255-F/NX255-R, and the PCR program was denaturation at 95℃ for 7 min; 30 cycles of 95℃ for 30 s, 66℃ for 30 s, and 72℃ for 26 s; 72℃ for 7 min. At the same time, the inner primer was selected for conventional PCR, in which the reaction mixture was the same as the nested PCR, and the amplification conditions were the same as the second run, except that the number of reaction cycles was 38. Under these conditions, the specificity was detected for,,and seven other common maize pathogens, and the sensitivity of nested PCR was tested using genomic DNA ofand DNA from artificially inoculated leaves.【Result】Nested PCR could specifically detectfrom all tested fungi, with a 255 bp target fragment. The lowest detection limit of the nested PCR was 10 fg·μL-1, and the sensitivity was 500 times that of the conventional PCR. For the samples containing 500-2.5×104urediniospores per gram of artificially inoculated leaves, the detection rates of conventional PCR and nested PCR were 0 and 85.71%, respectively. Nested PCR could detect at least 1 000 urediniospores. For the samples containing 1-7 uredia per gram of artificially inoculated leaves, the detection rates of conventional PCR and nested PCR were 76.19% and 100%, respectively. Conventional PCR and nested PCR could detect at least 2 and 1 uredia, respectively. For the samples containing 1-7 infection sites per gram of artificially inoculated leaves, the detection rates of conventional PCR and nested PCR were 14.29% and 66.67%, respectively. Conventional PCR and nested PCR could detect at least 6 and 3 infection sites, respectively.【Conclusion】With NX471-F/ITS4 as the outer primer and NX255-F/NX255-R as the inner primer, a detection method forwas established based on the nested PCR, which could quickly, efficiently and accurately detect theduring the incubation period in maize leaves.
southern corn rust;; conventional PCR; nested PCR
2022-12-25;
2023-03-03
国家现代农业产业技术体系(CARS-02)、河北省重点研发计划(20326501D)
马红霞,E-mail:mahongxia0792@163.com。通信作者石洁,E-mail:shij99@163.com
10.3864/j.issn.0578-1752.2023.09.006
(责任编辑 岳梅)

