HIV/AIDS合并神经梅毒患者临床特征及预后分析
张维,李奇穗,邓长刚,黄薇,孙艳雨,袁婧
神经梅毒(neurosyphilis, NS)是由梅毒螺旋体(treponema pallidum, TP)侵犯中枢神经系统导致的慢性传染病,可表现为无症状感染或神经系统功能障碍[1]。HIV与NS传播途径和易感人群相似,并且都可累及中枢神经系统。据报道[2]合并HIV/AIDS者更易发生神经梅毒,对人体器官的破坏性大,致残率和病死率高。HIV感染可以加速神经梅毒的进展[3],改变NS的临床表现。由于其临床表现复杂、缺乏特异性,使HIV/AIDS人群感染神经梅毒后更易延误诊治。本研究对2017年1月—2021年12月重庆市公共卫生医疗救治中心收治的HIV/AIDS合并神经梅毒人群的临床资料进行回顾性分析,以期加深临床工作者对此类疾病的认识,为HIV/AIDS合并神经梅毒的诊治工作提供参考。
1 资料与方法
1.1资料来源 重庆市公共卫生医疗救治中心感染科2017年1月—2021年12月出院诊断同时包含“HIV/AIDS”和“神经梅毒”,并进行了腰椎穿刺检查的所有患者。排除同时合并颅内其他感染,如结核、细菌、真菌、病毒等;合并其他神经精神系统疾病者、妊娠期妇女、资料不全者均需排除。本研究经重庆市公共卫生医疗救治中心医院伦理委员会批准,并免除患者知情同意书。
1.2方法
1.2.1诊断标准 HIV/AIDS患者的诊断标准参照《中国艾滋病诊疗指南(2021版)》[4]。神经梅毒的诊断标准及分型标准参照《梅毒、淋病和生殖道沙眼衣原体感染诊疗指南(2020年)》[5]:①血液检测:TPPA阳性,RPR阳性;②脑脊液检测:白细胞计数>20×106/L,总蛋白>500 mg/L;③脑脊液TPPA和/或RPR阳性。
1.2.2NS治疗方案 除抗HIV病毒及常规对症、支持治疗外,均给予驱梅治疗:注射用青霉素钠300~400万U,1次/4 h,静脉注射,连续10~14 d。青霉素过敏者,选用头孢曲松钠2 g/d,静脉注射,连续10~14 d。之后使用苄星青霉素钠240万U肌肉注射,1次/周,连续3周。
1.2.3疗效判定 以患者出院或死亡为时间截点进行疗效评定。好转为患者出院时临床症状减轻,脑脊液白细胞计数、总蛋白下降,头颅CT/MRI较基线检查结果改善,血和/或脑脊液RPR滴度下降。

2 结果
2.1神经梅毒患者的基本情况 本研究共纳入86例HIV合并神经梅毒患者,其中有症状组70例,无症状组16例,平均年龄(37.63±1.36)岁,男84例,占97.67%。已启动HAART治疗 42例(48.84%),54例(62.79%)患者CD4+T淋巴细胞计数<200个/μL,60例(69.77%)HIV RNA>1 000 CPs/mL,感染途径以同性性行为感染为主(56.98%)。两组在年龄、感染途径(同性性行为、异性性行为)之间差异有统计学意义(P<0.05),见表1。
2.2头颅影像学检查及有症状组临床分型 86例患者中75例行颅脑MRI检查,11例行颅脑CT检查。
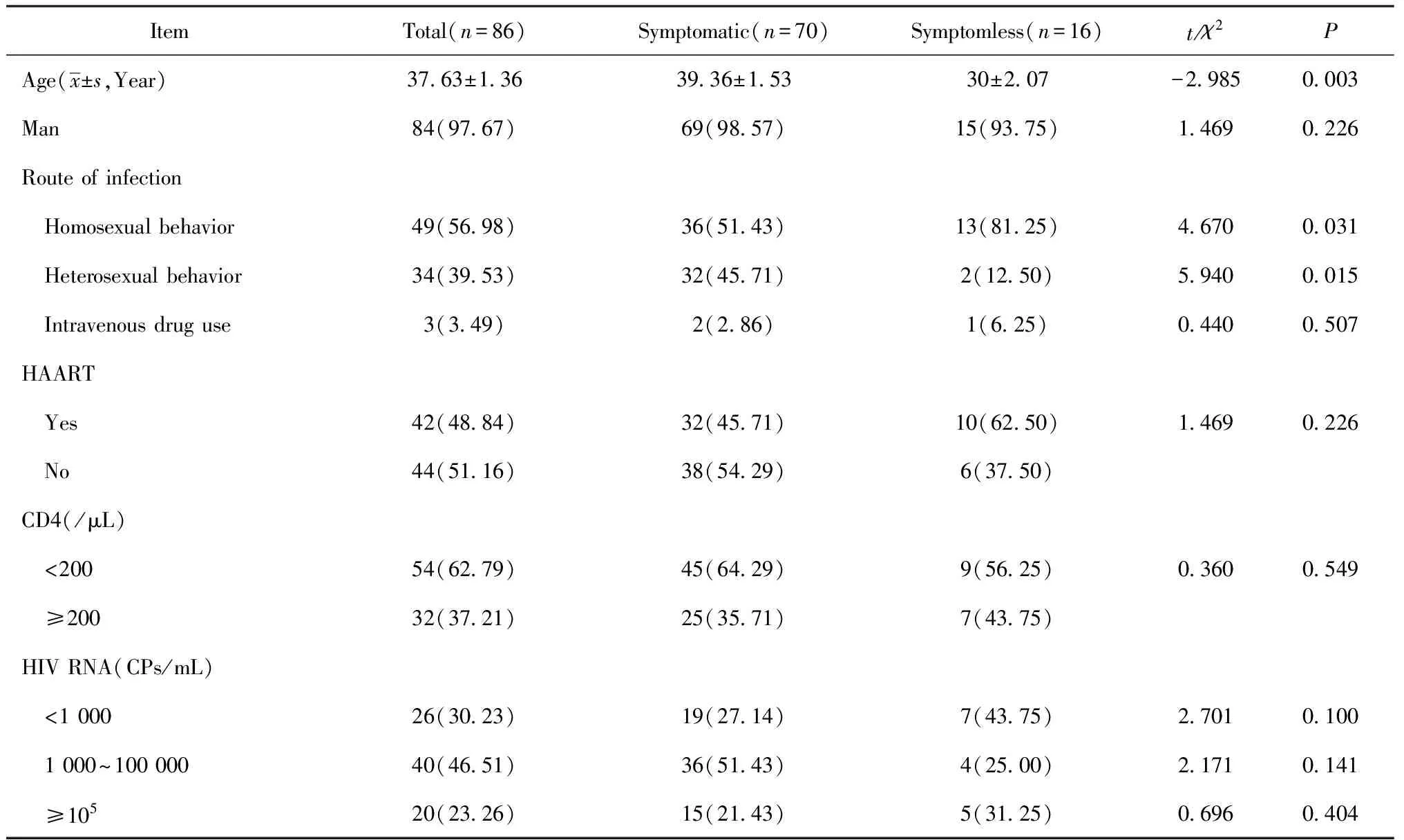
表1 86例神经梅毒患者基本情况 例(%)
无症状组16例:缺血灶8例(50.00%),脑白质病变3例(18.75%),脑萎缩5例(31.25%),脑膜增厚8例(50.00%),3例(18.75%)未见明显异常。有症状组共70例,36例(51.43%)缺血灶,8例(11.43%)脑白质病变,15例(21.43%)发生脑萎缩,12例(17.14%)梗死灶,2例(2.86%)脑炎样改变,1例(1.43%)可见脊髓病灶,46例(65.71%)见脑膜增厚,3例(4.29%)未见明显异常。有症状组具体临床分型如下:脑脊膜型26例(37.14%),脑膜血管型38例(54.29%), 麻痹性痴呆5例(7.14%), 脊髓梅毒1例(1.43%)。
2.3两组患者血清梅毒RPR滴度比较 86例神经梅毒患者,其血TPPA均呈阳性,故就血清梅毒RPR滴度进行比较。以RPR滴度≥1∶64最常见,为44例,占51.16%。两组患者血液PRP滴度均未出现1∶8,其余RPR滴度分布情况差异无统计学意义(P>0.05),见表2。
2.4两组患者脑脊液指标比较 全部患者脑脊液TPPA均呈阳性,有症状组脑脊液总蛋白明显高于无症状组,而HIV RNA则低于无症状组(P<0.05),但在患者脑脊液压力、白细胞计数、脑脊液RPR阳性方面差异均无统计学意义(P>0.05),见表3。

表2 两组患者血清梅毒PRP滴度比较 例(%)
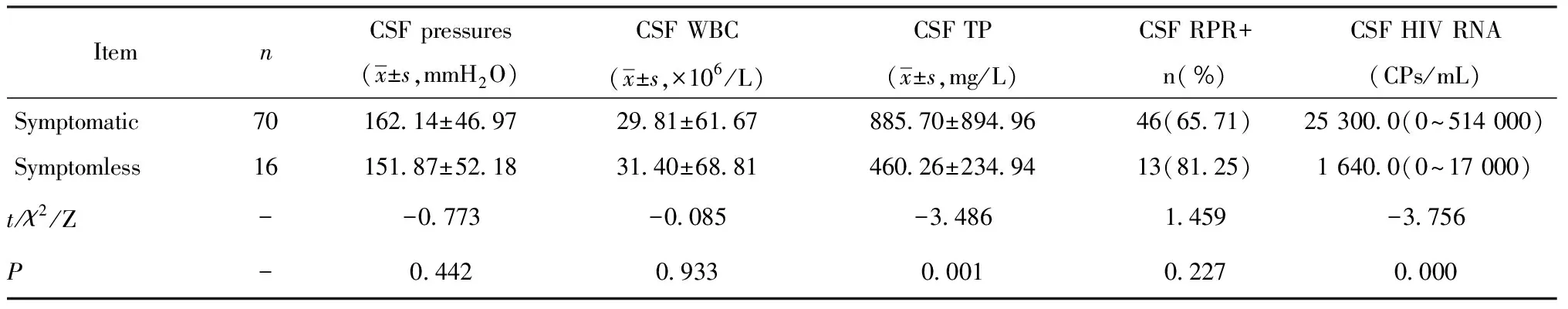
表3 两组患者脑脊液指标比较
2.5两组患者治疗后预后比较 86例患者有66例复查腰椎穿刺术,其中无症状组8例,有症状组58例;共70例复查头颅CT/MRI,其中无症状组10例,有症状组60例;80例复查血RPR,其中无症状组12例,有症状组68例。两组在脑脊液总蛋白下降(χ2=6.491,P=0.019)、头颅CT/MRI改善(χ2=5.526,P=0.036)差异有统计学意义(P<0.05);但在脑脊液白细胞计数下降(χ2=4.342,P=0.58)、脑脊液RPR滴度下降(χ2=0.024,P=1.000)、血RPR下降(χ2=1.569,P=0.348)方面差异无统计学意义(P>0.05)。2例脑膜血管型患者,因高龄、基础疾病多,继发坠积性肺炎导致呼吸衰竭死亡,其余患者均好转出院。有症状组住院时间(20.57±4.65)d,长于无症状组(17.25±2.24)d,差异有统计学意义(t=-2.774,P=0.007)。
3 讨论
近20年梅毒发病率一直呈上升趋势[1],随着有效的HAART治疗以及HIV暴露前后预防措施的出现,无保护性性行为增多,HIV/AIDS和梅毒的合并感染率有所上升[6]。NS可发生于梅毒任何阶段,部分患者在CD4 细胞及局部IFN-γ干扰素的作用下可使脑脊液中的梅毒螺旋体自发清除[7]。然而合并HIV感染导致的免疫受损,病原持续感染使NS的发生风险更高,但临床表现不典型,可能无任何症状存在。因此HIV/AIDS合并NS早期诊断及治疗仍面临挑战。
本研究男性明显多于女性,可能与感染途径以男男同性性行为(占56.98%)为主有关。有无临床表现与CD4计数、血HIV RNA、是否HAART治疗无关,与Martínez-Ayala等[8]报道一致,可能与HAART持续时间、血梅毒滴度、脑脊液HIV RNA有关。约1/5(16/86)无神经系统症状和体征,无症状组年龄相对较小但血RPR均≥1∶16,滴度较高,这与Sun等[9]将血清TRSUT滴度≥1∶16作为是HIV感染并发无神经症状NS的预测因子一致。本研究中血清RPR滴度≥1∶64最常见,提示合并HIV感染人群,血清RPR滴度越高,其发生神经梅毒的风险可能越大[10]。因此HIV/AIDS合并高梅毒滴度感染患者虽然无临床症状,仍建议常规进行腰椎穿刺术,把诊断及治疗窗提前,避免延误病情。本研究中无症状神经梅毒头颅影像学仅3例(18.75%)未见明显异常,这与HIV阴性无症状神经梅毒MRI多无特殊不一致[11],并且本研究结果还显示有症状组脑脊液HIV RNA高于无症状组,部分病例脑脊液HIV RNA高于血HIV RNA,可能与HIV逃逸有关[12]。有症状组存在更高的脑脊液总蛋白,因为HIV感染可能引起中枢神经系统炎性改变[13],引起脑脊液蛋白升高,TP更容易通过血脑屏障,导致NS的发生,这与Haule等[14]报道一致,因此HIV合并TP感染头颅影像学更易出现阳性结果。
本研究中有症状组以脑膜血管型(54.29%)和脑脊膜型(37.14%)为主,临床可能被误诊为脑梗死、精神类疾病、其他脑膜炎等[15],可能导致住院时间延长,与本研究一致。经治疗后有症状组在脑脊液总蛋白下降、头颅CT/MRI改善方面优于无症状组,可能与有症状组治疗前脑脊液HIV RNA明显高于无症状组,联合有效抗HIV治疗后HIV感染引起中枢神经系统炎性控制有关[13]。但在脑脊液白细胞计数下降、脑脊液RPR滴度下降、血RPR下降方面无明显差异。有2例患者死亡,死亡原因为坠积性肺炎引起的呼吸衰竭。
本研究为回顾性研究,病例总数较少,未把临床症状等客观指标纳入研究,缺少后续的随访数据,可能导致研究结果存在一定偏倚,将来的研究应注意增加样本量,收集长期随访数据。

