miR-335 通过调控铁死亡对大鼠脑缺血/再灌注损伤的保护作用及机制研究
袁莉,向军军,李丽琴,陈炜,胡跃强,姚春
缺血性卒中(ischemic stroke,IS)是全球范围内发病率高、死亡率高的常见疾病之一[1],是由血栓形成或栓塞导致血流突然中断并阻塞供应大脑特定区域血管引起的病症[2]。目前,溶栓治疗是IS的主要治疗方式之一,但其治疗时间窗较窄。近年研究发现,铁死亡可通过影响铁自噬或铁代谢而在IS的发展中发挥了重要作用[3]。当脑缺血/再灌注(ischemia/reperfusion,I/R)损伤时,自噬途径被激活并诱导铁蛋白过度降解,导致神经元中的游离铁增加,这种现象称为铁自噬,而铁自噬过程主要受核受体共激活因子4(nuclear receptor coactivator 4,NCOA4)的调节[4]。F-box和富含亮氨酸的重复蛋白5(F-box and leucine-rich repeat protein 5,FBXL5)是SCF型泛素连接酶的底物识别亚基,可作为哺乳动物细胞中铁代谢的主要调节剂,其缺乏会导致铁调节蛋白1的持续积累、铁摄取调节障碍,最终导致铁过载和活性氧的产生[5]。因此,FBXL5/NCOA4在大脑铁稳态中起重要作用。
miRNA作为非编码RNA,是IS等多种神经系统疾病的重要递质[6]。研究表明,miR-335可参与神经元的生长和发育,成年大鼠短暂大脑中动脉闭塞后脑组织miR-335表达降低[7]。但miR-335在大鼠脑I/R损伤中的具体调控机制尚不清楚。本研究旨在探讨miR-335通过调控铁死亡途径对大鼠脑I/R损伤的保护作用及机制,以期为IS提供新的治疗策略,最大限度地减轻脑I/R损伤后永久性脑损伤和残疾。
1 材料与方法
1.1 实验时间 本实验时间为2022年3—9月。
1.2 试验动物 成年雄性Sprague Dawley大鼠180只,体质量280~320 g,均购自广西中医药大学实验动物中心,生产许可证号:SCXK(湘)2019-0014。将大鼠饲养在受控环境中〔温度(21±2)℃,相对湿度(55±5)%,12 h光照/黑暗交替〕,实验期间,所有大鼠可自由获得食物和水,适应性饲养7 d。实验程序均按照美国国立卫生研究院实验动物护理和使用指南进行,并经广西中医药大学动物伦理委员会审核批准(批号:DW20211204-195)。
1.3 主要试剂 大鼠miR-335模拟物腺相关病毒及大鼠miR-335抑制物腺相关病毒(上海吉满生物科技有限公司),TRIzol™试剂(Ambion公司),mRNA反转录试剂盒、miRNA反转录试剂盒〔新贝(上海)生物科技有限公司〕,彩色预染蛋白Marker、山羊抗兔IgG HRP、ECL化学发光底物试剂盒、BCA蛋白浓度测定kit、内参抗GAPDH抗体(Biosharp公司),抗FBXL5抗体及抗NCOA4抗体(北京索莱宝科技有限公司生产)。
1.4 实验分组及干预方法 将180只大鼠随机分为假手术组、模型组、miR-335模拟物组、miR-335模拟物对照组、miR-335抑制物组、miR-335抑制物对照组,每组30只。假手术组大鼠仅暴露右侧大脑中动脉并缝合。模型组大鼠制备大脑中动脉闭塞/再灌注(middle cerebral artery occlusion/reperfusion,MCAO/R)损伤模型,具体如下:在大鼠右侧大脑中动脉做一中线颈部切口,然后定位右颈外动脉,采用大鼠硅胶线栓结扎其分支,造成大脑中动脉闭塞;大脑中动脉闭塞2 h后,拔出大鼠硅胶线栓一定长度以允许血液通过右颈内动脉回流,造成大脑中动脉再灌注[8]。本实验以模型制备后2 h Zea Longa评分1~3分为MCAO/R损伤模型制备成功标准。miR-335模拟物组大鼠在大脑中动脉脑立体定位注射miR-335模拟物腺相关病毒2 μl。脑立体定位注射方法如下:将大鼠麻醉后固定在StereoDrive立体定位系统框架中,取2 μl纯化后的腺相关病毒并将其固定在定位仪上,将注射器针尖移至大脑中动脉标记处并钻孔〔其中Y轴:0 mm,X轴:-2.5 mm,Z轴:-3.5 mm(相对于前囟点和硬脑膜表面)〕,进针深度达3 mm后缓慢注射腺相关病毒;7 d后制备MCAO/R损伤模型。miR-335模拟物对照组大鼠在大脑中动脉脑立体定位注射miR-335模拟物空载体,7 d后制备MCAO/R损伤模型。miR-335抑制物组大鼠在大脑中动脉脑立体定位注射miR-335抑制物腺相关病毒2 μl,7 d后制备MCAO/R损伤模型。miR-335抑制物对照组大鼠在大脑中动脉脑立体定位注射miR-335抑制物空载体,7 d后制备MCAO/R损伤模型。于模型制备后12、24、72 h,分别在各组随机选取10只大鼠并将其处死,取缺血半暗带区脑组织以进行后续实验。
1.5 Zea Longa评分 采用Zea Longa评分(5级评分法)评估各组大鼠模型制备后2、12、24、72 h神经功能缺损程度,评分越高表明大鼠神经功能缺损程度越严重[9]。
1.6 qRT-PCR 采用qRT-PCR检测各组大鼠模型制备后12、24、72 h脑组织miR-335、FBXL5 mRNA、NCOA4 mRNA相对表达量。使用TRIzol™试剂从缺血半暗带区脑组织中提取总RNA,采用mRNA反转录试剂盒和miRNA反转录试剂盒将总RNA合成cDNA。使用扩增试剂盒进行PCR扩增,反应条件:预变性95 ℃ 30 s 1个循环,变性95 ℃ 3~10 s、退火和延伸60 ℃ 10~30 s,共45个循环,融解曲线时间为仪器默认,1个循环数。以U6为内参,采用2-ΔΔCt法计算miR-335相对表达量;以GAPDH为内参,采用2-ΔΔCt法计算FBXL5、NCOA4 mRNA相对表达量[10]。引物序列见表1。

表1 引物序列及扩增长度Table 1 Primer sequence and amplification length
1.7 Western blot法 采用Western blot法检测各组大鼠模型制备后12、24、72 h脑组织FBXL5、NCOA4蛋白相对表达量。从缺血半暗带区脑组织匀浆中提取制备的蛋白质样品(n=6),然后通过SDS-PAGE电泳液缓冲液分离蛋白质并将其转移到硝酸纤维素膜上;加入5%脱脂奶粉于4 ℃封闭过夜,加入一抗(1∶1 000)进行孵育;加入二抗(1∶20 000)于室温下孵育60 min,采用TBST洗涤膜4次。使用Image J图像分析软件分析FBXL5、NCOA4蛋白相对表达量[11]。
1.8 统计学方法 使用SPSS 22.0统计学软件进行数据处理。符合正态分布的计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 Zea Longa评分 本研究大鼠均建模成功。假手术组大鼠Zea Longa评分为0分。模型制备后12、24、72 h,五组大鼠Zea Longa评分比较,差异有统计学意义(P<0.05);模型制备后12、24、72 h,miR-335模拟物组大鼠Zea Longa评分低于miR-335模拟物对照组,miR-335抑制物组大鼠Zea Longa评分高于miR-335抑制物对照组,差异有统计学意义(P<0.05),见表2。
表2 五组大鼠模型制备后12、24、72 h Zea Longa评分比较(±s,分,n=10)Table 2 Comparison of Zea Longa scores in five groups at 12,24 and 72 h after model preparation
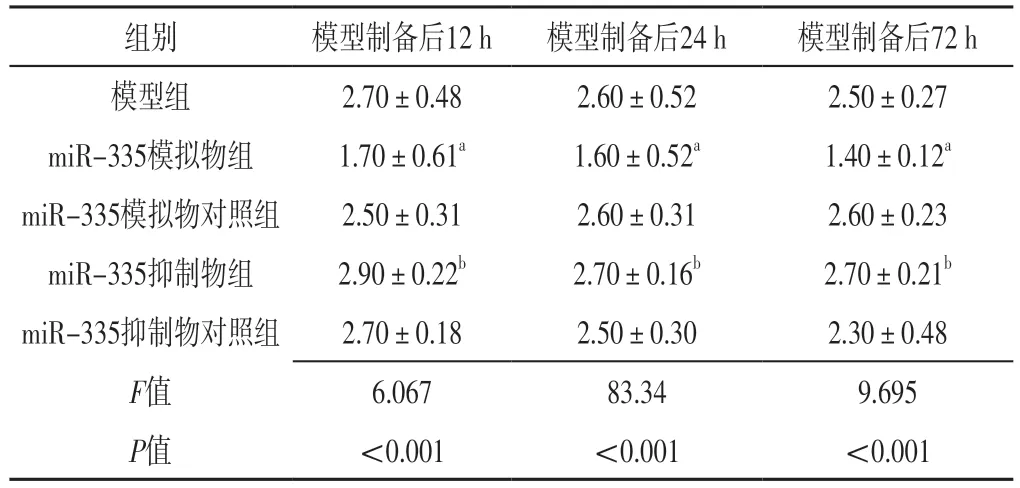
表2 五组大鼠模型制备后12、24、72 h Zea Longa评分比较(±s,分,n=10)Table 2 Comparison of Zea Longa scores in five groups at 12,24 and 72 h after model preparation
注:a表示与miR-335模拟物对照组比较,P<0.05;b表示与miR-335抑制物对照组比较,P<0.05
组别 模型制备后12 h 模型制备后24 h 模型制备后72 h模型组 2.70±0.48 2.60±0.52 2.50±0.27 miR-335模拟物组 1.70±0.61a 1.60±0.52a 1.40±0.12a miR-335模拟物对照组 2.50±0.31 2.60±0.31 2.60±0.23 miR-335抑制物组 2.90±0.22b 2.70±0.16b 2.70±0.21b miR-335抑制物对照组 2.70±0.18 2.50±0.30 2.30±0.48 F值 6.067 83.34 9.695 P值 <0.001 <0.001 <0.001
2.2 脑组织miR-335相对表达量 模型制备后12、24、72 h,六组大鼠脑组织miR-335相对表达量比较,差异有统计学意义(P<0.05);模型制备后12、24、72 h,模型组大鼠脑组织miR-335相对表达量低于假手术组,miR-335模拟物组大鼠脑组织miR-335 mRNA相对表达量高于miR-335模拟物对照组,miR-335抑制物组大鼠脑组织miR-335相对表达量低于miR-335抑制物对照组,差异有统计学意义(P<0.05),见表3。
表3 六组大鼠模型制备后12、24、72 h脑组织miR-335相对表达量比较(±s,n=10)Table 3 Comparison of relative expression levels of miR-335 in brain tissue in six groups at 12,24 and 72 h after model preparation
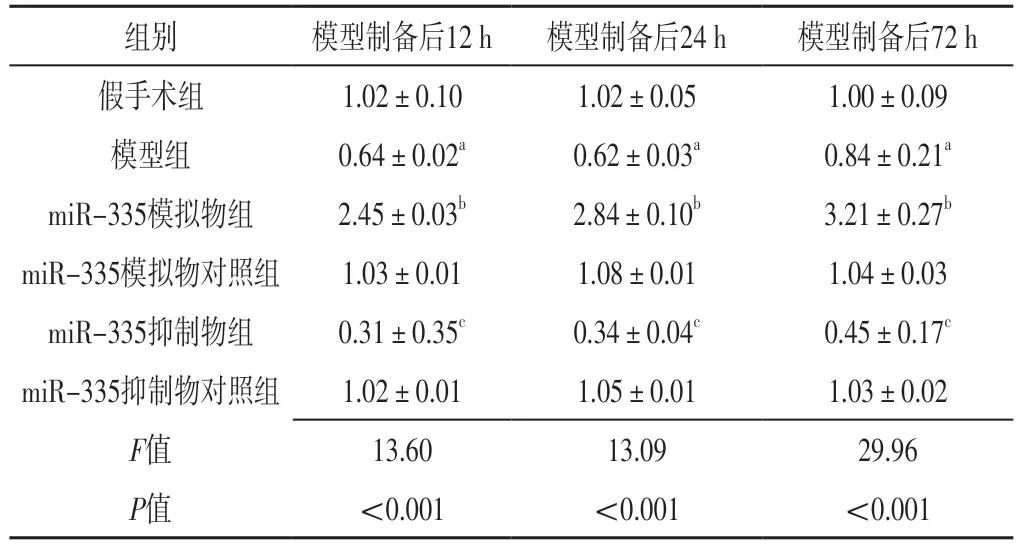
表3 六组大鼠模型制备后12、24、72 h脑组织miR-335相对表达量比较(±s,n=10)Table 3 Comparison of relative expression levels of miR-335 in brain tissue in six groups at 12,24 and 72 h after model preparation
注:a表示与假手术组比较,P<0.05;b表示与miR-335模拟物对照组比较,P<0.05;c表示与miR-335抑制物对照组比较,P<0.05
组别 模型制备后12 h 模型制备后24 h 模型制备后72 h假手术组 1.02±0.10 1.02±0.05 1.00±0.09模型组 0.64±0.02a 0.62±0.03a 0.84±0.21a miR-335模拟物组 2.45±0.03b 2.84±0.10b 3.21±0.27b miR-335模拟物对照组 1.03±0.01 1.08±0.01 1.04±0.03 miR-335抑制物组 0.31±0.35c 0.34±0.04c 0.45±0.17c miR-335抑制物对照组 1.02±0.01 1.05±0.01 1.03±0.02 F值 13.60 13.09 29.96 P值 <0.001 <0.001 <0.001
2.3 脑组织FBXL5、NCOA4 mRNA、蛋白相对表达量
模型制备后12、24、72 h,六组大鼠脑组织FBXL5、NCOA4 mRNA、蛋白相对表达量比较,差异有统计学意义(P<0.05);模型制备后12、24、72 h,模型组大鼠脑组织FBXL5 mRNA、蛋白相对表达量低于假手术组,miR-335模拟物组大鼠脑组织FBXL5 mRNA、蛋白相对表达量高于miR-335模拟物对照组,miR-335抑制物组大鼠脑组织FBXL5 mRNA、蛋白相对表达量低于miR-335抑制物对照组,差异有统计学意义(P<0.05);模型制备后12、24、72 h,模型组大鼠脑组织NCOA4 mRNA、蛋白相对表达量高于假手术组,miR-335模拟物组大鼠脑组织NCOA4 mRNA、蛋白相对表达量低于miR-335模拟物对照组,miR-335抑制物组大鼠脑组织NCOA4 mRNA、蛋白相对表达量高于miR-335抑制物对照组,差异有统计学意义(P<0.05),见表4~5、图1。
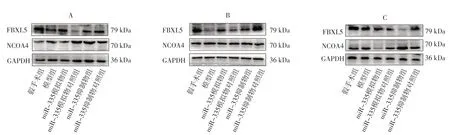
图1 六组模型制备后12、24、72 h脑组织FBXL5、NCOA4蛋白SDS-PAGE图Figure 1 SDS-PAGE of FBXL5 and NCOA4 proteins in brain tissue of six groups at 12,24 and 72 h after model preparation
表4 六组大鼠模型制备后12、24、72 h脑组织FBXL5、NCOA4 mRNA相对表达量比较(±s,n=10)Table 4 Comparison of relative expression levels of FBXL5 and NCOA4 mRNA in brain tissue in six groups at 12,24 and 72 h after model preparation
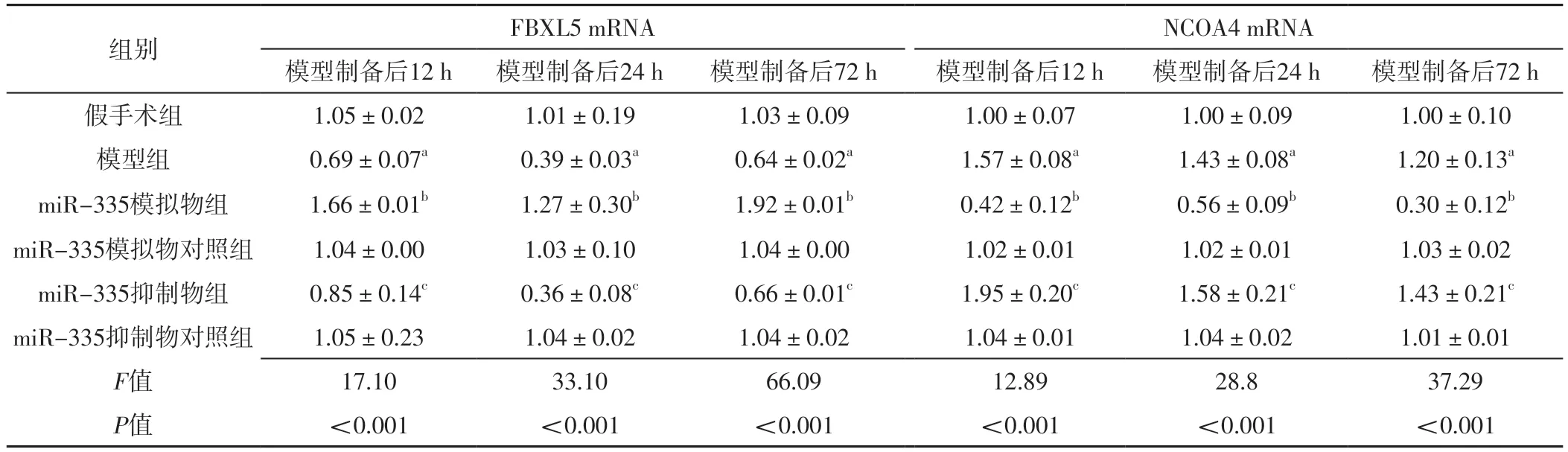
表4 六组大鼠模型制备后12、24、72 h脑组织FBXL5、NCOA4 mRNA相对表达量比较(±s,n=10)Table 4 Comparison of relative expression levels of FBXL5 and NCOA4 mRNA in brain tissue in six groups at 12,24 and 72 h after model preparation
注:a表示与假手术组比较,P<0.05;b表示与miR-335模拟物对照组比较,P<0.05;c表示与miR-335抑制物对照组比较,P<0.05
组别 FBXL5 mRNA NCOA4 mRNA模型制备后12 h 模型制备后24 h 模型制备后72 h 模型制备后12 h 模型制备后24 h 模型制备后72 h假手术组 1.05±0.02 1.01±0.19 1.03±0.09 1.00±0.07 1.00±0.09 1.00±0.10模型组 0.69±0.07a 0.39±0.03a 0.64±0.02a 1.57±0.08a 1.43±0.08a 1.20±0.13a miR-335模拟物组 1.66±0.01b 1.27±0.30b 1.92±0.01b 0.42±0.12b 0.56±0.09b 0.30±0.12b miR-335模拟物对照组 1.04±0.00 1.03±0.10 1.04±0.00 1.02±0.01 1.02±0.01 1.03±0.02 miR-335抑制物组 0.85±0.14c 0.36±0.08c 0.66±0.01c 1.95±0.20c 1.58±0.21c 1.43±0.21c miR-335抑制物对照组 1.05±0.23 1.04±0.02 1.04±0.02 1.04±0.01 1.04±0.02 1.01±0.01 F值 17.10 33.10 66.09 12.89 28.8 37.29 P值 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001
表5 六组大鼠模型制备后12、24、72 h脑组织FBXL5、NCOA4蛋白相对表达量比较(±s,n=10)Table 5 Comparison of relative expression levels of FBXL5 and NCOA4 proteins in brain tissue in six groups at 12,24 and 72 h after model preparation
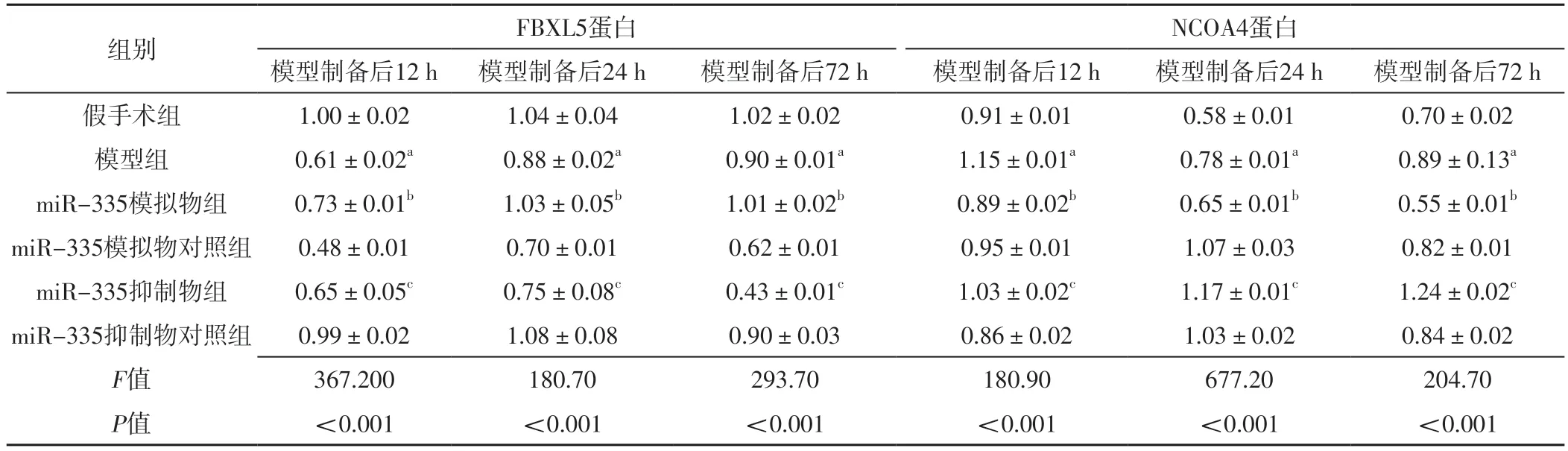
表5 六组大鼠模型制备后12、24、72 h脑组织FBXL5、NCOA4蛋白相对表达量比较(±s,n=10)Table 5 Comparison of relative expression levels of FBXL5 and NCOA4 proteins in brain tissue in six groups at 12,24 and 72 h after model preparation
注:a表示与假手术组相比,P<0.05;b表示与miR-335模拟物对照组比较,P<0.05;c表示与miR-335抑制物对照组比较,P<0.05
组别 FBXL5蛋白 NCOA4蛋白模型制备后12 h 模型制备后24 h 模型制备后72 h 模型制备后12 h 模型制备后24 h 模型制备后72 h假手术组 1.00±0.02 1.04±0.04 1.02±0.02 0.91±0.01 0.58±0.01 0.70±0.02模型组 0.61±0.02a 0.88±0.02a 0.90±0.01a 1.15±0.01a 0.78±0.01a 0.89±0.13a miR-335模拟物组 0.73±0.01b 1.03±0.05b 1.01±0.02b 0.89±0.02b 0.65±0.01b 0.55±0.01b miR-335模拟物对照组 0.48±0.01 0.70±0.01 0.62±0.01 0.95±0.01 1.07±0.03 0.82±0.01 miR-335抑制物组 0.65±0.05c 0.75±0.08c 0.43±0.01c 1.03±0.02c 1.17±0.01c 1.24±0.02c miR-335抑制物对照组 0.99±0.02 1.08±0.08 0.90±0.03 0.86±0.02 1.03±0.02 0.84±0.02 F值 367.200 180.70 293.70 180.90 677.20 204.70 P值 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001
3 讨论
IS具有高致残率、高死亡率等特点,对人体健康构成严重威胁[12-13]。miR-335已被证实是参与IS过程的重要调节剂,其在脑I/R损伤中起着至关重要的作用[14]。本研究结果显示,模型制备后12、24、72 h,miR-335模拟物组大鼠Zea Longa评分低于miR-335模拟物对照组,miR-335抑制物组大鼠Zea Longa评分高于miR-335抑制物对照组;模型制备后12、24、72 h,模型组大鼠脑组织miR-335相对表达量低于假手术组,miR-335模拟物组大鼠脑组织miR-335相对表达量高于miR-335模拟物对照组,miR-335抑制物组大鼠脑组织miR-335相对表达量低于miR-335抑制物对照组,与既往研究结果[15]一致,提示上调miR-335表达可有效减轻MCAO/R损伤模型大鼠神经功能缺损程度,下调miR-335表达可加重MCAO/R损伤模型大鼠神经功能缺损程度。SAMARAWEERA等[16]研究证实,miR-335可通过阻断神经元分化而维持非神经元特征。此外,低水平miR-335可鉴别诊断IS患者与健康对照者,且miR-335水平降低是IS的独立危险因素[17-18]。有动物实验表明,大脑中动脉闭塞模型大鼠缺血皮质中miR-335降低[19]。有体外与在体实验表明,I/R与氧糖剥夺/再灌注(oxygenglucose deprivation/reoxygenation,OGD/R)诱导的脑损伤24 h后miR-335下降[20]。miR-335可通过靶向rho关联含卷曲螺旋蛋白激酶2(rho-associated coiled-coil containing protein kinase 2,ROCK2)而促进应激颗粒的形成,进而抑制细胞凋亡,减轻大脑中动脉闭塞模型大鼠脑组织缺血性损伤程度[21]。
目前,IS患者有多种治疗方法,其中包括针对程序性细胞死亡的治疗策略。铁死亡是一种新定义的程序性细胞死亡,其特征是脂质过氧化的铁依赖性积累达到致死水平,其或可成为IS新的治疗靶点[22]。研究表明,I/R损伤可以通过选择性自噬途径诱导铁蛋白自噬,这是一种将载铁的铁蛋白与释放的不稳定铁一起输送到溶酶体进行降解,随后使神经元中游离铁增加的过程,该过程在全身铁稳态中具有重要作用[23]。NCOA4为选择性自噬受体,其在介导脑组织和细胞铁蛋白自噬中具有至关重要的作用[24]。近期,NCOA4介导的铁蛋白自噬被认为是调节铁死亡的关键机制,其过度激活会促进游离铁释放增多,而过量的游离铁又可通过芬顿反应而导致铁死亡[4,25]。大量研究表明,调节FBXL5对于铁稳态的维持至关重要[26-27]。FBXL5是F-box蛋白家族成员,其特定结构域可感知铁和氧并直接结合铁,因而其可作为哺乳动物细胞铁代谢的主要调节剂[28-30]。研究表明,FBXL5缺乏会导致铁调节蛋白的持续积累和不受调节的铁摄取,最终导致铁过载和活性氧的产生[23]。YAMAUCHI等[5]进行的动物实验表明,小鼠脑组织缺失FBXL5会诱导神经干祖细胞异常增殖,从而影响大脑发育,而全身缺乏FBXL5的小鼠由于铁过载和氧化应激而导致其细胞内铁水平紊乱并在子宫内死亡。为了验证miR-335是否通过调控FBXL5、NCOA4表达而减轻MCAO/R损伤模型大鼠神经功能损伤程度,本研究于大鼠大脑中动脉脑立体定位注射miR-335模拟物/抑制物腺相关病毒,结果显示,模型制备后12、24、72 h,模型组大鼠脑组织FBXL5 mRNA、蛋白相对表达量低于假手术组,miR-335模拟物组大鼠脑组织FBXL5 mRNA、蛋白相对表达量高于miR-335模拟物对照组,miR-335抑制物组大鼠脑组织FBXL5 mRNA、蛋白相对表达量低于miR-335抑制物对照组;模型组大鼠脑组织NCOA4 mRNA、蛋白相对表达量高于假手术组,miR-335模拟物组大鼠脑组织NCOA4 mRNA、蛋白相对表达量低于miR-335模拟物对照组,miR-335抑制物组大鼠脑组织NCOA4 mRNA、蛋白相对表达量高于miR-335抑制物对照组,提示上调miR-335表达有效减轻MCAO/R损伤模型大鼠神经功能缺损程度的机制可能与其促进FBXL5表达、抑制NCOA4表达,调控铁自噬与铁代谢,进而影响铁死亡有关。
综上所述,上调miR-335表达可有效减轻MCAO/R损伤模型大鼠神经功能缺损程度,其机制可能与miR-335促进FBXL5表达、抑制NCOA4表达,调控铁自噬与铁代谢,进而影响铁死亡有关,这为治疗IS导致的神经功能损伤提供了理论依据。
作者贡献:袁莉进行文章的构思与设计,负责撰写、修订论文;陈炜进行研究的实施与可行性分析;李丽琴进行数据收集、整理、分析;向军军进行结果分析与解释;胡跃强、姚春负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。

