脑出血患者血肿穿刺引流术后颅内感染的病原菌特点及危险因素▲
朱雪丽 杨 堃 王丽芸
(海南医学院第一附属医院1 感染科,2 神经外科,海南省海口市 570111)
脑出血是脑动脉破裂引发的局限性出血,常见于老年人,病因包括创伤、脑肿瘤、高血压等,致残率及病死率均较高,其中高血压性脑出血是脑出血的常见类型,约占全部脑出血的80%以上[1]。在发病早期及时诊治对于改善脑出血患者预后尤为关键。血肿穿刺引流术是治疗脑出血的常用手段,具有操作简便、微创等优势,可降低全身麻醉的相关风险,迅速缓解颅内高压[2]。然而,血肿穿刺引流术作为侵入性治疗手段,术后极易引发颅内感染。有研究显示,血肿穿刺引流术后颅内感染发生率最高可达45%[3]。颅内感染作为神经外科血肿穿刺引流术后严重的并发症之一,不仅会延长患者术后康复周期,影响手术效果,而且会增加其他并发症的发生风险及病死率[4]。因此,科学识别脑出血患者血肿穿刺引流术后颅内感染的相关影响因素及病原菌构成,开展针对性防治,对于改善患者预后具有重大意义。本研究分析血肿穿刺引流术后患者颅内感染的病原菌分布及耐药特点,并探讨其危险因素。
1 资料和方法
1.1 临床资料 选取2018年5月至2021年10月我院收治的276例脑出血患者作为研究对象。纳入标准:(1)符合《中国脑出血诊治指南(2019)》[5]中脑出血的诊断标准,影像学诊断明确为脑出血;(2)符合血肿穿刺引流术指征[5],且术前无颅内感染征象。排除标准:(1)伴有严重心、肾、肝、肺疾病的患者;(2)合并终末期脑疝、心血管疾病、凝血功能障碍的患者;(3)由脑血管畸形等导致出血的患者。其中,男性171例、女性105例,患者年龄47~72(59.34±6.03)岁。
1.2 颅内感染诊断标准 参考《神经外科中枢神经系统感染诊治中国专家共识(2021版)》[6]中有关颅内感染的诊断标准:(1)存在全身炎症反应,即发热(体温>38.5 ℃)或低体温(<36 ℃)、心率>90 次/min和呼吸频率>20 次/min;(2)存在头痛、头晕、恶心、呕吐、视盘水肿等表现;(3)颈部抵抗、克氏征、布氏征阳性;(4)出现意识状态的变化,由疲劳、精神萎靡不振、谵妄发展为嗜睡、昏睡,甚至昏迷等;(5)脑脊液白细胞计数>100×106/L,中性粒细胞百分比>70%;(6)脑脊液葡萄糖含量<2.2 mmol/L,脑脊液葡萄糖/血清葡萄糖比值<0.4。记录血肿穿刺引流术后1周内患者发生颅内感染的情况。
1.3 病原菌检查 使用腰椎穿刺法采集颅内感染患者脑脊液3 mL,分别接种于需氧培养瓶、厌氧培养瓶、真菌培养瓶,置入全自动血液培养仪(Becton,Dickinson and Company,型号:BACTEC9050)进行培养,待仪器报警后将标本分别转种于麦康凯平皿、巧克力平皿、血平皿,孵育后采用biosMerieumx公司VITEK-32型全自动微生物分析系统进行病原菌分离、鉴定,采用纸片扩散法进行药敏试验,根据美国临床和实验室标准化协会2017标准判读结果。质控菌株包括铜绿假单胞菌ATCC27853、金黄色葡萄球菌ATCC25923、白假丝酵母ATCC90028、大肠埃希菌ATCC25922。
1.4 一般临床资料的收集 收集患者性别、年龄、体质指数、脑出血部位、脑出血量、术前血清白蛋白水平、合并糖尿病情况及治疗相关指标。治疗相关指标包括穿刺部位、手术时间、引流管留置时间、术后脑脊液漏[7]发生情况、术中尿激酶使用次数、术后预防使用抗菌药物情况、手术次数、首次手术时机,若患者进行多次手术则手术时间、引流管留置时间取平均值。
1.5 治疗方法 在颅脑CT辅助下,以血肿最大层面中心作为靶点,标记体表位置,确认穿刺点深度。常规全身麻醉后切开头皮,使用脑膜穿刺针刺刺破脑膜,使用扩张器扩张手术通道,钢针辅助下将一次性颅脑外引流器的硅胶管插至血肿中心。将硅胶管连接注射器,多次抽取陈旧性出血,每次抽吸量可占出血量的10%~70%。将硅胶管固定在头皮,末端连接三通引流袋。术后1 d复查颅脑CT,确认引流管位置、血肿剩余量。若有血肿剩余且引流不畅,确认无再出血则经引流管注入生理盐水3 mL+尿激酶40 000 U、地塞米松1 mg+庆大霉素10 000 U,夹闭1 h后放开引流。若血肿<10 mL则停用尿激酶,若血肿基本消失则拔除引流管。
1.6 统计学分析 采用SPSS 22.0软件进行统计学分析。计数资料以例数(百分比)表示,组间比较采用χ2检验。对单因素分析中P<0.05的指标行多重共线性检验,方差膨胀因子(variance inflation factor,VIF)<10及容差>0.2时认为不存在多重共线性,则纳入Logistic回归模型进行多因素分析;根据Logistic回归模型建立诊断模型,分别采用似然比检验、Hosmer-Lemeshow检验对诊断模型的回归系数、拟合度进行假设检验。采用MedCalc 11.4软件绘制受试者工作特征(receiver operating characteristic,ROC)曲线,分析诊断模型对脑出血患者血肿穿刺引流术后发生颅内感染的诊断价值,获取曲线下面积(area under the curve,AUC)。以P<0.05为差异有统计学意义。
2 结 果
2.1 颅内感染发生情况 276例脑出血患者中,共45例患者在血肿穿刺引流术后1周内发生颅内感染,发生率为16.30%。
2.2 颅内感染患者的病原菌分布及主要病原菌耐药情况 在45例血肿穿刺引流术后颅内感染患者的脑脊液标本中共检出52株病原菌,其中革兰阴性菌14株(26.92%)、革兰阳性菌33株(63.46%)、真菌5株(9.62%)。主要致病菌(病原菌株数≥8株)金黄色葡萄球菌、凝固酶阴性葡萄球菌对阿莫西林、青霉素、红霉素、克林霉素耐药率均在80.00%以上,而对万古霉素耐药率均为0。见表1、表2。
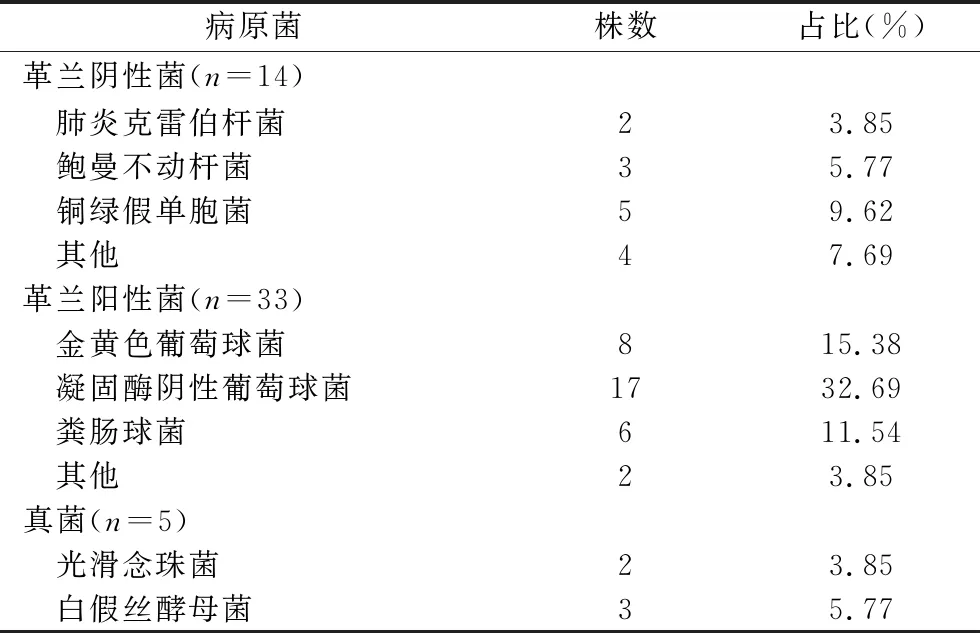
表1 血肿穿刺引流术后颅内感染患者的病原菌分布情况
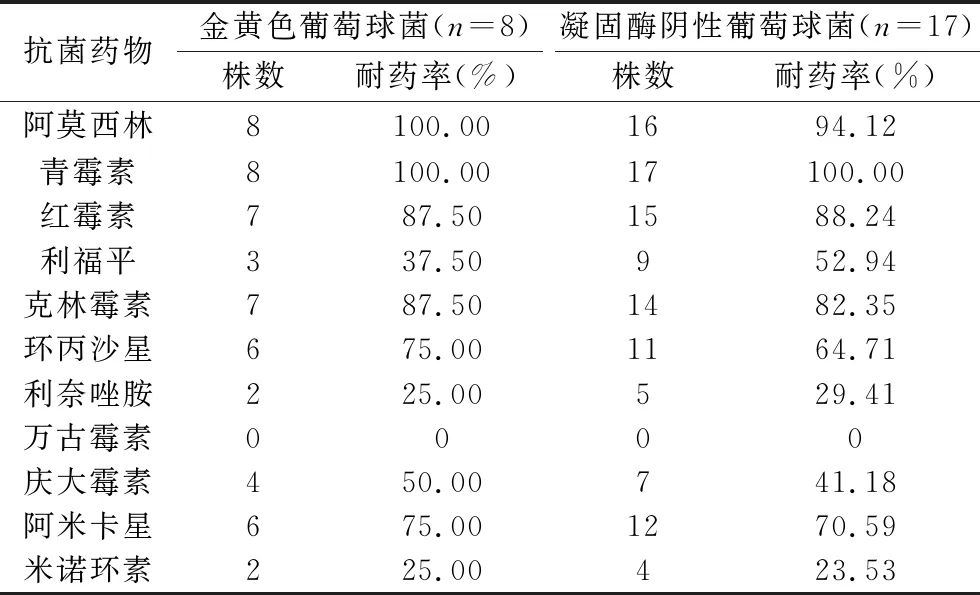
表2 主要病原菌的耐药率
2.3 脑出血患者血肿穿刺引流术后发生颅内感染影响因素的单因素分析 不同性别、体质指数、病因、脑出血部位、脑出血量、穿刺部位、手术时间、手术次数、首次手术时机患者之间,以及术后是否预防使用抗菌药物患者之间的颅内感染发生率差异均无统计学意义(均P>0.05);不同年龄、术前血清白蛋白水平、引流管留置时间、术中尿激酶使用次数患者之间,以及术后是否发生脑脊液漏、是否合并糖尿病患者之间的颅内感染发生率差异均有统计学意义(均P<0.05)。见表3。
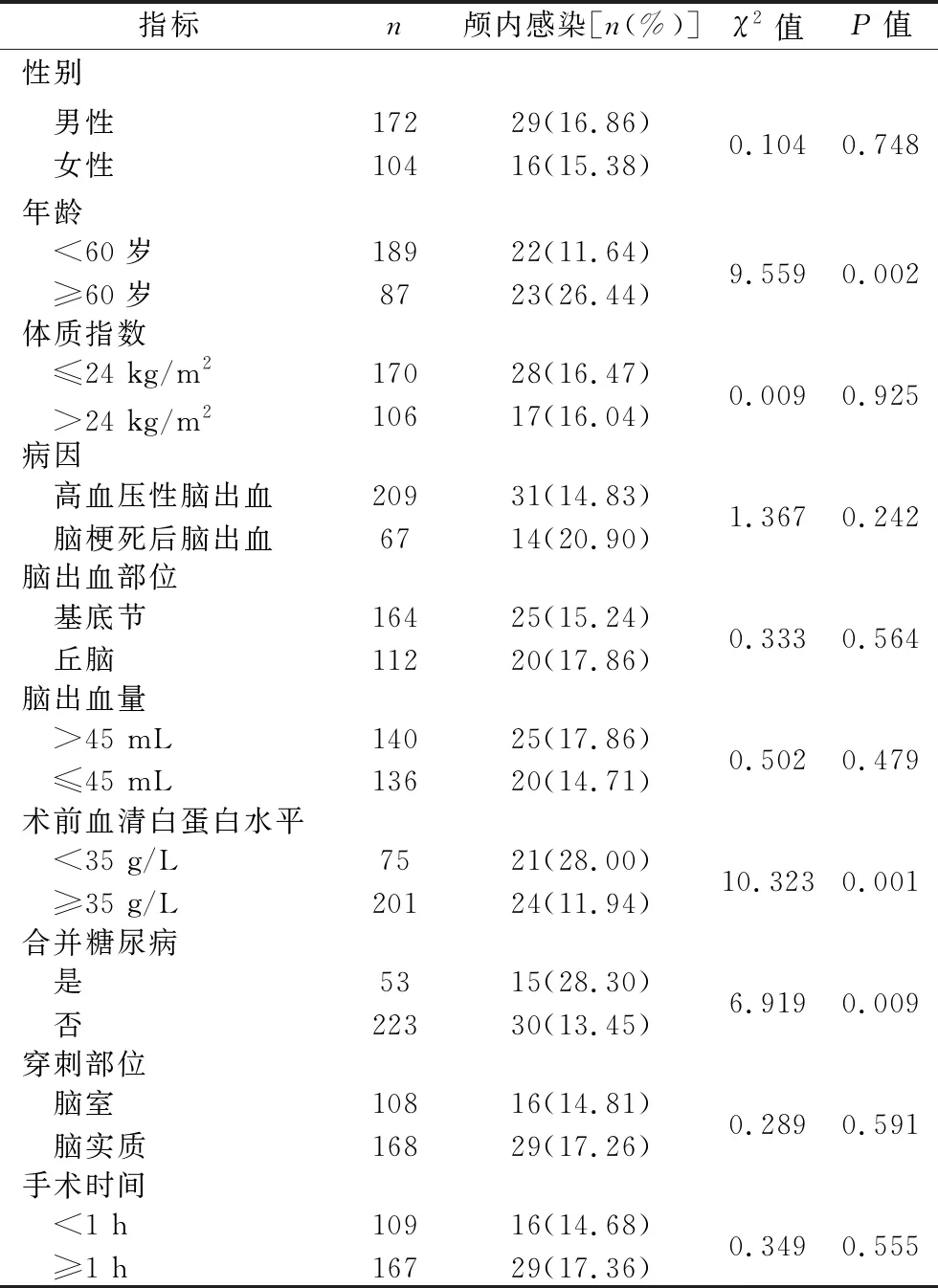
表3 单因素分析结果
2.4 脑出血患者血肿穿刺引流术后发生颅内感染影响因素的多因素分析 将2.3中差异有统计学意义的指标(年龄、术前血清白蛋白水平、引流管留置时间、术中尿激酶使用次数、术后发生脑脊液漏及合并糖尿病)进行多重共线性检验,结果显示6个指标的容差>0.2,VIF>10(见表4),提示以上指标多重共线的可能性低。以术后颅内感染(否=0,是=1)为因变量,以上述指标为自变量(赋值:年龄<60岁=0,≥60岁=1;术前血清白蛋白水平<35 g/L=1,≥35 g/L=0;留置引流时间<3 d=0,≥3 d=1;术中尿激酶使用次数≤3次=0,>3次=1;术后发生脑脊液漏是=1,否=0;合并糖尿病是=1,否=0),纳入多因素Logistic回归模型。结果显示,年龄、术前血清白蛋白水平、引流管留置时间、术中尿激酶使用次数、术后发生脑脊液漏及合并糖尿病均与脑出血患者血肿穿刺引流术后发生颅内感染有关(均P<0.05)。见表5。
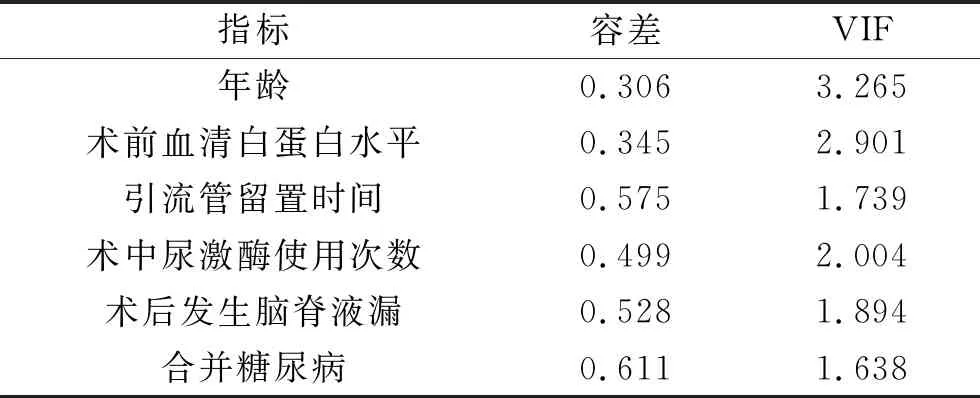
表4 相关指标的多重共线性检验结果
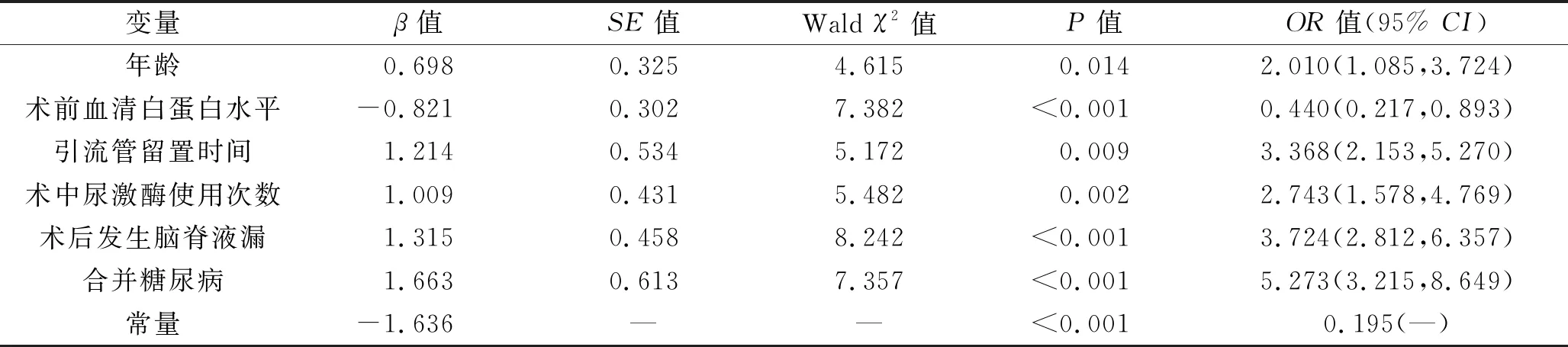
表5 多因素Logistic回归分析结果
2.5 诊断模型的构建结果 根据Logistic回归分析结果,构建诊断模型:logit(P)=-1.636+0.698×年龄-0.821×术前血清白蛋白水平+1.214×引流管留置时间+1.009×术中尿激酶使用次数+1.315×术后发生脑脊液漏+1.663×合并糖尿病。似然比检验结果显示χ2=132.58、df=8、P<0.001,表明该诊断模型建立具有统计学意义;Hosmer-Lemeshow检验显示χ2=6.376、df=6、P=0.621,表明该诊断模型的拟合效果较好。
2.6 诊断模型的效能 ROC曲线分析结果显示,当logit(P)取0.167时,诊断模型诊断脑出血患者术后发生颅内感染的AUC为0.852(95%CI:0.797,0.902;P<0.001),诊断敏感度为91.11%,特异度为55.84%。见图1。
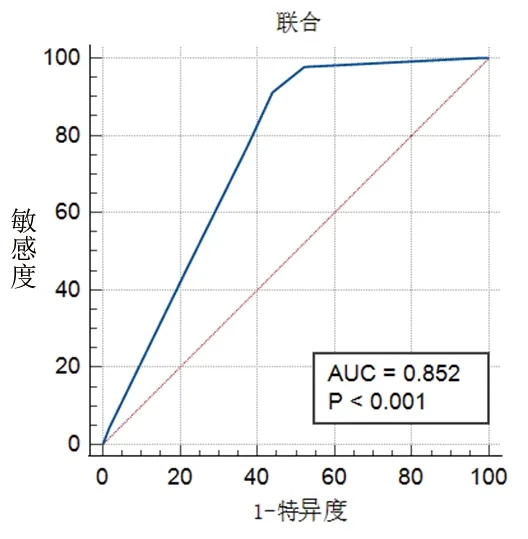
图1 诊断模型的ROC曲线
3 讨 论
脑出血是常见的脑卒中类型,约占13%,其病情急且重,出血量较大时可明显增加颅内压、降低脑灌注,若持续时间过长可引发不可逆性脑损害,导致患者预后不良[8]。有研究表明,重症脑出血患者的预后不仅与术后颅内压的控制情况有关,而且还受颅内感染等因素的影响[9]。有研究显示,神经外科术后细菌性脑膜炎的发生率为0~27%[10],有创操作所致细菌性脑膜炎的发生率可达10%~15%[11]。血肿穿刺引流术作为侵入性治疗手段,术后极易引发颅内感染。本研究结果显示,276例脑出血患者血肿穿刺引流术后颅内感染的发生率为16.30%(45/276),这提示脑出血患者血肿穿刺引流术后具有较高的颅内感染发生风险,故强化神经外科术后感染防治工作十分必要。
颅内感染是神经外科术后严重且常见的并发症,同时也是脑出血患者术后发生院内感染的重要原因[12]。抗菌药物是防治感染的主要方法,然而随着抗菌药物泛用、滥用现象日益严重,病原菌的菌谱不断变迁且耐药率不断升高,甚至可发生多重耐药。有研究显示,引起脑出血患者术后颅内感染的病原菌的耐药率逐年升高,其中对头孢类抗菌药物、红霉素、广谱青霉素的耐药率均超过80%[13]。因此,临床上须积极监测病原菌菌谱变迁及病原菌耐药率,科学使用抗菌药,从而提高感染的防治效果。本研究结果显示,革兰阳性菌是脑出血患者血肿穿刺引流术后发生颅内感染的最常见病原菌,且主要病原菌金黄色葡萄球菌、凝固酶阴性葡萄球菌对克林霉素、阿莫西林、青霉素、红霉素的耐药率均在80.00%以上,而对万古霉素的耐药率均为0,与上述研究结果相似。这提示针对脑出血术后颅内感染的患者,宜根据脑脊液药敏结果选择敏感度高、窄谱的抗菌药,以保证疗效。
目前针对神经外科术后发生颅内感染的危险因素的研究众多。李林山等[14]发现,术后脑脊液漏、引流管留置时间是高血压脑出血患者微创穿刺术后发生颅内感染的独立危险因素。代依含[15]也发现,术后脑脊液渗漏、引流管留置时间≥3 d的高血压脑出血患者血肿穿刺引流术后的颅内感染发生率更高。本研究结果也提示,存在术后脑脊液漏及引流管留置时间长的脑出血患者血肿穿刺引流术后更容易发生颅内感染,与上述研究结果相似。分析其原因:引流管与外界相通,可增加病原菌的侵袭风险,而存在脑脊液漏时病原体可经此通道进入颅内,且脑脊液营养成分高,但无吞噬细胞、补体等免疫细胞及免疫活性物质,故细菌易入侵并生长繁殖,从而引起颅内感染。有研究表明,血肿大小、合并糖尿病等与颅内感染的发生无关[16-17]。但本研究结果显示,合并糖尿病是脑出血患者血肿穿刺引流术后发生颅内感染的危险因素,与上述研究结果不同。合并糖尿病的脑出血患者血糖水平较高,而高糖环境利于细菌增殖,且可影响中性粒细胞吞噬功能,抑制T淋巴细胞活性,降低人体防御功能[18]。因此,合并糖尿病的脑出血患者血肿穿刺引流术后发生颅内感染的风险增大。同时,本研究中的脑出血患者血肿穿刺引流术后发生颅内感染还与年龄、术中尿激酶使用次数、术前血清白蛋白水平有关。推测原因如下:随着年龄增长,人体抵抗力、自身免疫力明显下降,防御病毒、细菌侵入能力低下,故更容易发生感染[19];血清白蛋白水平是营养评价指标,其水平降低提示患者营养不良,免疫功能及防御功能降低[20];术中输注尿激酶能溶解颅内血块,利于引流[21],但多次输注尿激酶可增加脑脊液逆流风险,从而增加颅内感染的风险。本研究将以上影响因素纳入多因素Logistic回归模型建立诊断模型,结果显示,该模型诊断脑出血患者血肿穿刺引流术后发生颅内感染的AUC为0.852,诊断敏感度为91.11%,特异度为55.84%。这提示当脑出血患者年龄≥60岁、引流管留置时间≥3 d、术前血清白蛋白水平<35 g/L、术中尿激酶使用次数>3次、术后存在脑脊液漏及合并糖尿病时,血肿穿刺引流术后发生颅内感染可能性较大,临床应对此类患者加强营养支持,强化引流管管理,积极控制血糖,从而降低患者术后颅内感染的发生风险。
综上所述,脑出血患者血肿穿刺引流术后颅内感染的最常见病原菌主要是革兰阳性菌,对常用抗菌药物的耐药率较高。此类患者发生颅内感染受年龄、术前血清白蛋白水平、术中输注尿激酶次数、引流管留置时间、术后脑脊液漏、合并糖尿病的影响。临床上应积极监测病原菌菌谱及其耐药率变化,及早明确以上危险因素,完善防治方案,如强化营养支持、合理控制血糖、避免多次手术、选择不同部位注射尿激酶等,从而降低脑出血患者血肿穿刺引流术后颅内感染的发生风险,改善患者预后。

