高强度超声波浴对小麦醇溶蛋白结构及抗原性的影响
曹佳兴,朱海兰,王君荣,蒙太和,张国治,4*
1.河南工业大学 粮油食品学院, 河南 郑州 450001 2.郑州科技学院 食品科学与工程学院, 河南 郑州 450064 3.中粮面业(武汉)有限公司, 湖北 武汉 430000 4.河南省面制主食工程技术研究中心, 河南 郑州 450001
小麦是世界范围内重要的粮食作物之一,特别在一些东方国家,有悠久的种植和食用历史。然而小麦同牛奶、鸡蛋、花生、大豆、树坚果、贝类、鱼类,并称为八大过敏原,是食物摄入过敏以及接触过敏的主要诱因之一[1]。食用小麦会诱发多种过敏症状,如乳糜泻、贝壳哮喘、面包师哮喘以及小麦依赖性运动过敏等。全球范围内有0.2%~0.9%的成年人和0.4%~1.3%的儿童存在小麦过敏症,并且这一数字还在持续上升[2-3]。中国是世界上最大的小麦生产国和消费国,小麦经常作为主食或其他食品辅料被广泛食用,这也给小麦不耐受群体带来了潜在威胁。
小麦醇溶蛋白(Glia)中存在大量抗原表位,是诱发小麦过敏的主要麸质蛋白之一[4-5]。目前,常用的蛋白质加工技术包括高温、超高压、超声、辐照、酶处理以及化学处理等。这些方法能有效降低过敏原的抗原性,其中酶处理的抑制效果最好[6],但是会导致蛋白质的加工性能较差;传统的高温技术以及超高压技术对抗原抑制效果并不稳定;辐照作为新型高效的食品加工技术,目前尚未被市场接受[7]。超声波是一种非热处理技术,近年来广泛应用于新兴食品的研发中。研究表明,超声技术对水产、乳制品和部分水果中过敏原的抗原性具有良好的抑制效果[8-10],但在小麦的免疫特性方面研究较少。
作者设置了不同的超声功率处理Glia,通过化学表征、光谱分析以及间接非竞争性酶联免疫吸附试验(ELISA)、免疫印迹吸附试验(Western blotting)测定Glia的结构以及抗原性,对超声处理前后Glia抗原性和结构变化的相关性进行了分析,为低敏性谷物食品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
小麦粉:河南省农业科学院;聚丙烯酰胺凝胶电泳试剂盒、兔抗小麦醇溶蛋白血清:上海雅酶生物技术有限公司;HRP-山羊抗兔IgG:Sigma公司;PVDF膜、福林酚试剂、双组分TMB显色剂、双组分DAB显色剂:北京索莱宝科技有限公司;5,5′-二硫代双-2-硝基苯甲酸(DTNB)、邻苯二甲醛:上海麦克林生化科技有限公司。其他试剂均为分析纯。
1.2 主要仪器与设备
全自动凯式定氮仪:福斯分析仪器公司;超声波清洗装置:昆山超声仪器有限公司;电泳装置及成像设备:Bio-Rad生命科学有限公司;傅里叶变换红外光谱仪:美国布鲁克仪器有限公司;荧光分光光度计、紫外分光光度计:岛津株式会社;激光显微拉曼光谱仪:美国赛默飞世尔仪器有限公司。
1.3 试验方法
1.3.1 蛋白质的制备
Glia的提取参照Zhang等[11]的研究。提取物通过凯氏定氮法测定其蛋白含量为91.27%。提取的Glia冻干后于4 ℃保存备用。
1.3.2 超声波浴处理
将Glia充分溶解在65%乙醇中,质量浓度为10 mg/mL。设定超声条件:超声时间2 h,功率0、240、360、480、600 W;频率40 kHz,温度30 ℃。
1.3.3 SDS-PAGE
参照李慧静[12]的方法对Glia进行SDS-PAGE分析,小麦醇溶蛋白与4倍上样缓冲液按照体积比3∶1 混合,煮沸10 min后上样。
1.3.4 游离巯基含量和游离氨基含量的测定
采用ELLMA法测定游离巯基含量[13]。将0.03 mL ELLMA工作液(8 mg DTNB溶解于2 mL TRIS(pH 8)缓冲液中)加入3 mL Glia溶液中,暗反应30 min后测定412 nm处吸光度。
游离巯基含量=75.53×A412×D/C,
式中:A412为412 nm处的吸光度;D为稀释倍数;C为样品质量浓度,mg/mL。
游离氨基含量的测定参照阳倩等[14]的方法。
1.3.5 FTIR分析
参照常慧敏等[15]的方法进行蛋白质FTIR扫描。准确称量1 mg样品,与100 mg KBr混合碾磨,压成薄片后用于光谱采集。
1.3.6 荧光光谱分析
将样品用PBS缓冲液(pH 7.2)溶解,样品质量浓度为0.25 mg/mL。设置荧光光谱参数:激发波长280 nm,发射波长290~500 nm。
1.3.7 拉曼光谱分析
使用10倍物镜聚焦,至窗口能够清晰地观察到样品。然后采集样品的拉曼光谱,设定波长785 nm,激光功率25 MW,狭缝宽度50 nm,采集范围400~2 000 cm-1。
1.3.8 Western blotting分析
参照Zhao等[16]的方法,对样品进行Western blotting分析。
1.3.9 ELISA分析
参照Zhang等[11]的方法,并稍加调整。采用间接非竞争ELISA分析超声波浴后Glia的抗原性变化。将100 μL /孔的2 mg/mL Glia用脱脂牛奶(5%)包被于96孔板中,4 ℃封闭过夜。倒净封闭液,使用PBST(PBS-吐温20)洗涤孔板3次以上,然后每孔加入100 μL 一抗(兔抗小麦醇溶蛋白血清),37 ℃孵化1 h。倒净孔板中的一抗血清,按照前文所述洗涤3次除去未反应的一抗血清,然后每孔加入100 μL 二抗血清(HRP-山羊抗兔IgG),37 ℃孵化1 h。反应结束后重复上述洗涤操作,去除未反应的二抗血清,然后加入TMB显色液(A液与B液体积比1∶1)显色15 min,使用H2SO4(2 mol/L)终止显色反应。Glia抗原性可由450 nm处吸光度(OD)表示,计算抗原抑制率:
抗原抑制率=(OD0-OD450)/OD0×100%,
式中:OD0为未进行超声处理的Glia在450 nm处的吸光度;OD450为超声处理的Glia在450 nm处的吸光度。
1.4 数据处理
试验均设定3组平行。通过SPSS 26.0对数据进行显著性分析。
2 结果与分析
2.1 超声波浴对Glia亚基的影响
通过还原性SDS-PAGE技术分离α/β-Glia、γ-Glia、ω- Glia,并且分析HIWU对Glia亚基的影响。由图1(a)可知,Glia的电泳条带主要集中于27~48 kDa。随着超声功率增强,Glia的条带没有显著改变,表明超声处理Glia不会产生新的小分子亚基,与O′sullivan等[17]的研究一致,超声处理并没有引起小麦蛋白亚基的显著变化。因为超声波浴是一种相对温和的处理方式,因此对于一些构象紧密的蛋白质,HIWU提供的能量并不能引起其一级结构的变化。非还原SDS-PAGE如图1(b)所示,在非还原条件下,Glia的分子质量主要集中在27~35 kDa之间。360 W和480 W超声处理后的Glia条带变深,这可能是α/β-Glia通过二硫键交联形成了蛋白质聚合体。600 W处理后的Glia条带强度减轻,这可能是超声引起的蛋白质聚集形成了大分子聚合体而无法进入泳道。
2.2 超声波浴对Glia游离巯基含量和游离氨基含量的影响
蛋白质中的巯基以及二硫键会影响蛋白质三级结构的稳定性,超声波诱发蛋白质变性,可能会体现在蛋白质游离巯基与二硫键之间的转换。未处理Glia中游离巯基含量为(5.37±0.10) nmol/mg,经过超声处理后Glia中游离巯基增加了(0.18~1.82) nmol/mg。在480 W超声处理后的Glia中游离巯基含量达到最大,为(7.19±0.13) nmol/mg。高强度超声破坏了蛋白质的空间结构,使其结构舒展[18],这可能导致内部的游离巯基暴露。然而当处理功率达到600 W时,游离巯基含量下降至(6.78±0.21) nmol/mg。这可能是因为高强度超声空化效应产生的自由基(H2O-OH-+H+)[19]、游离巯基被氧化,也有可能是由于超声引起蛋白质聚集,掩盖了部分巯基。
通过对游离氨基的测定,可以判断超声处理后Glia结构的展开程度和氧化程度[20]。由图2可知,未处理Glia中游离氨基含量为(587.25±1.07) nmol/mg。240 W超声处理后Glia中游离氨基有所减少,这可能是蛋白质聚集所致。随超声功率增强,Glia中游离氨基含量显著增加。
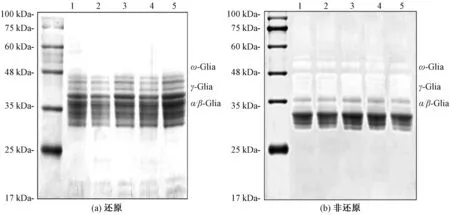
注:泳道1-5分别为超声功率0、240、360、480、600 W处理后的样品。图1 超声波浴处理后Glia的还原SDS-PAGE和非还原SDS-PAGEFig.1 Reduced SDS-PAGE and non-reduced SDS-PAGE of Glia after ultrasonic bath treatment
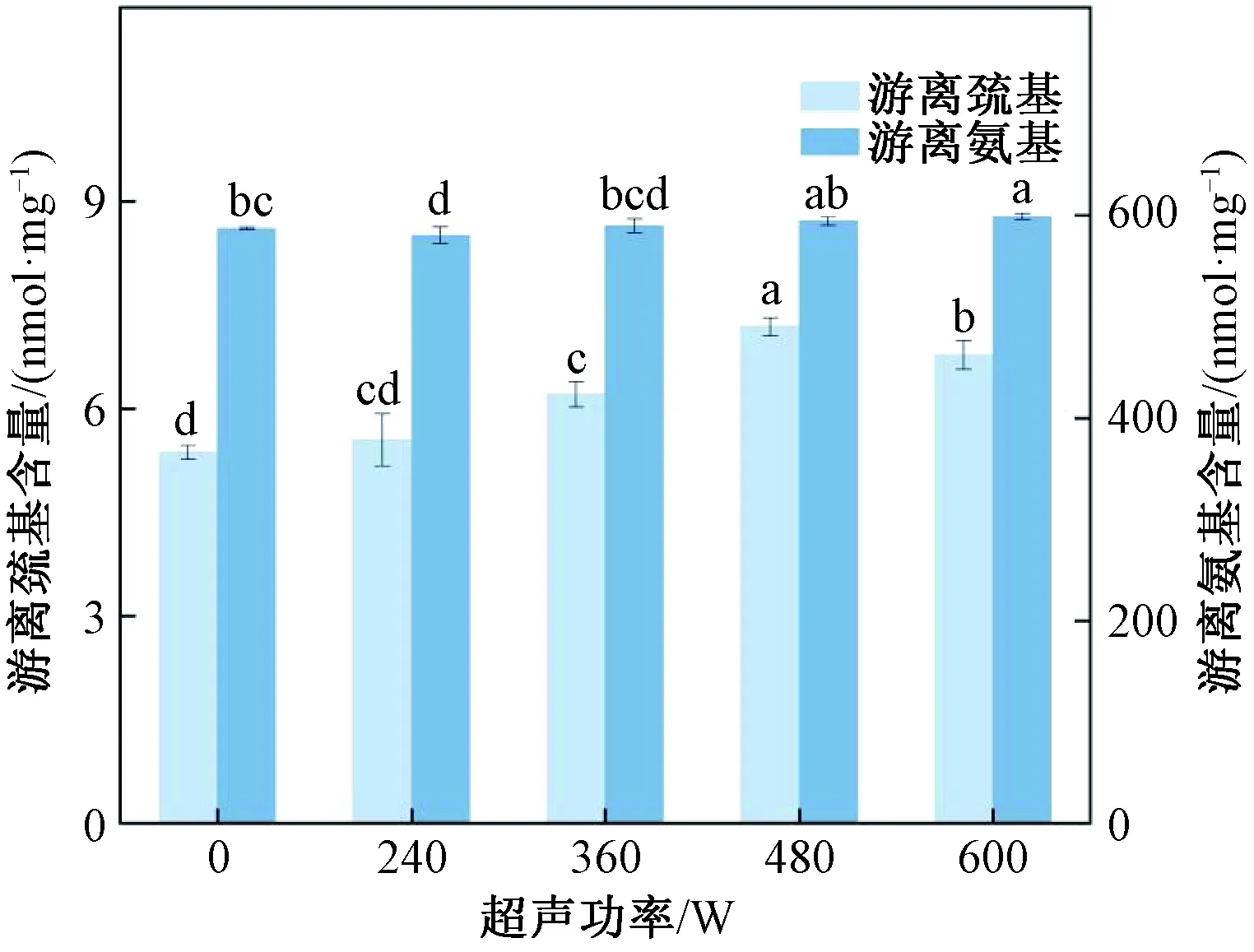
注:不同字母表示差异显著(P <0.05)。图7同。图2 超声波浴处理后Glia中游离巯基和游离氨基含量Fig.2 Content of free sulfhydryl and free amino groups in Glia after ultrasonic bath treatment
这可能是由于蛋白质结构拉伸导致氨基暴露。另外,超声产生的剪切空化效应,在溶液中产生微小气泡并瞬间破裂,导致局部瞬时温度升高使氨基氧化。
2.3 超声处理对Glia二级结构的影响
FTIR光谱的酰胺Ⅰ带包含了蛋白质二级结构的信息(图3),通过对其进行拟合计算得到蛋白质各种二级结构的含量。由表1可知,未处理Glia中β-折叠含量为(49.27±0.02)%,是Glia的主要二级结构,α-螺旋、β-转角和无规则卷曲分别为(14.39±0.01)%、(17.16±0.01)%和(19.18±0.03)%。在240 W功率处理后Glia的α-螺旋增加。继续增大处理功率,α-螺旋含量显著降低,同时蛋白质中无规则结构显著增加。这表明超声处理导致Glia二级结构去卷曲化,蛋白质的弹性降低。本研究中,Glia的有序结构被HIWU破坏,蛋白质的亲水或疏水区域暴露从而出现了新的分子内和分子键交联。然而Li等[21]研究发现,啤酒花谷蛋白样品中α-螺旋和β-折叠在经过150~350 W超声处理10 min后显著增加。因此,超声剪切作用也可能导致蛋白质结构更加扭曲复杂,形成新的折叠结构。
图3 超声波浴处理后Glia的FTIR光谱Fig.3 FTIR spectra of Glia after ultrasonic bath treatment
蛋白质的二级结构与其致敏性密切相关,Zhou等[22]用高静水压技术处理银杏种子蛋白,使其结构趋于无序化,并有效降低了蛋白的致敏性。He等[23]将花生过敏原Ara h1与膳食多酚结合,有效地降低了其对嗜碱性粒细胞的脱颗粒程度,这一过程也伴随着蛋白质二级结构的转变。Glia经超声处理后α-螺旋和β-折叠结构减少,蛋白质进一步趋于无序。这有可能是破坏了Glia的构象表位,使特异性抗体无法正常识别。
2.4 超声波浴对Glia三级结构的影响
蛋白质中由于酪氨酸(Tyr)、色氨酸(Trp)和苯丙氨酸(Phe)等芳香族氨基酸存在,使蛋白质具有内源荧光。这些氨基酸对微环境变化敏感,通过对其荧光进行分析可以判断蛋白质的三级结构变化。由图4可知,未处理的Glia最大荧光强度为511.47±0.45 A.U.,最强荧光发射波长为349 nm。样品经超声处理后均出现猝灭现象,并且Glia的内源荧光强度最大值(FLmax)随着超声功率增强而显著降低。HIWU使蛋白质结构舒展,蛋白质的空间构象改变,包裹在疏水区域的Tyr和Trp开始暴露并与极性环境接触,从而导致Glia内源荧光降低。
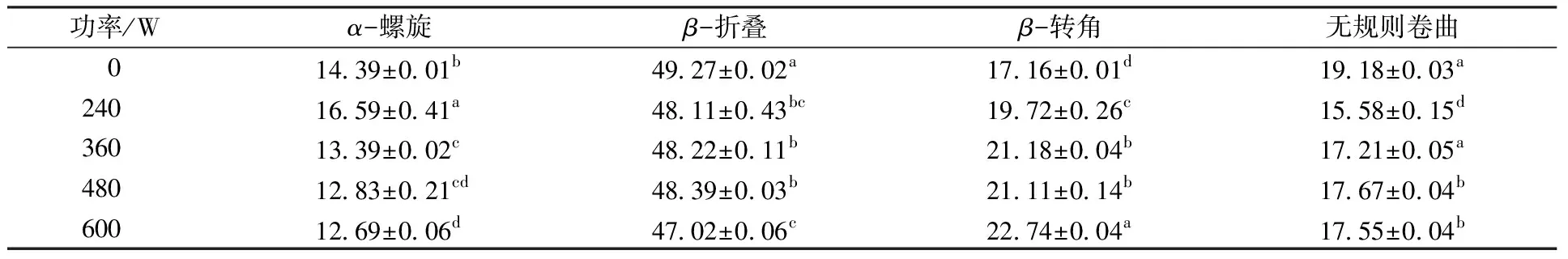
表1 超声波浴处理后Glia的二级结构含量Table 1 Content of Glia secondary structure after ultrasonic bath treatment %
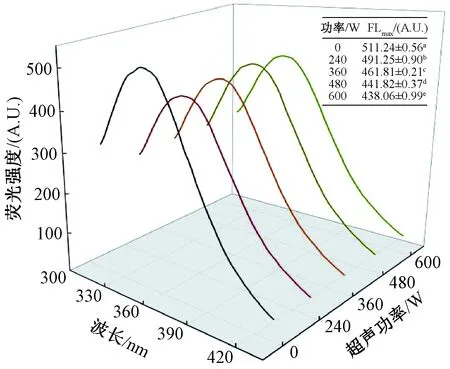
注:内插表中同列不同字母表示差异显著(P<0.05)。图4 超声波浴处理后Glia的荧光光谱Fig.4 Fluorescence spectra of Glia after ultrasonic bath treatment
2.5 超声波浴对Glia侧链结构的影响
2.5.1 酪氨酸和色氨酸
由图5可知,拉曼光谱中850、830 cm-1的特征峰是由于Tyr残基的对位取代苯环振动产生。这两处峰值之比(I850/I830)即费米共振可用于表征Tyr的位置状态[24]。若(I850/I830)≥1,则酪氨酸处于暴露状态;若(I850/I830)<1则处于包埋状态。由表2可知,未处理Glia的I850/I830小于1,说明Tyr处于“嵌入”状态。Glia经过超声后I850/I830均大于1,说明超声处理导致Glia三级结构发生变化,Tyr残基暴露,进一步与极性环境接触。
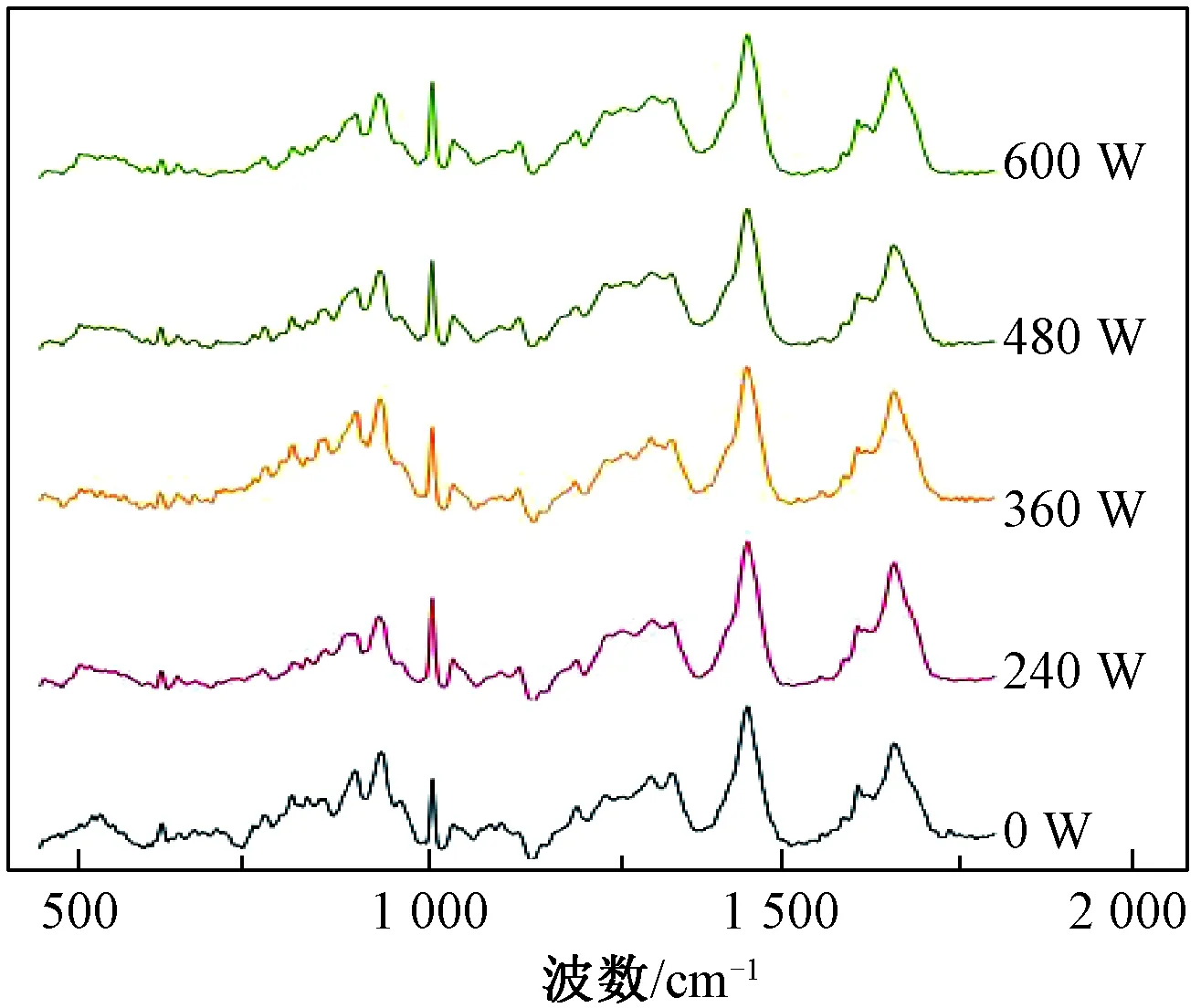
图5 超声波浴处理后Glia的拉曼光谱Fig.5 Raman spectra of Glia after ultrasonic bath treatment
拉曼光谱中760 cm-1处的峰(I760)由Trp残基伸缩振动产生。以phe作为内标进行归一化处理后,该处峰强度可用于Trp未知状态的表征。有研究表明,原本嵌入在疏水环境中的Trp暴露于极性环境后,其760 cm-1处的峰值会降低[25]。由表2可知,超声后Glia的I760小于未处理的,这表明Try残基逐渐从嵌入状态转变为暴露状态。
综上所述,超声处理导致Tyr和Trp暴露并更容易接触极性环境,蛋白质的三级结构在超声之后发生改变,这一结论与荧光分析一致。
2.5.2 二硫键构象分析
拉曼光谱在500~550 cm-1处的特征峰包含了蛋白质二硫键的结构信息。500~510 cm-1为g-g-g模式;515~525 cm-1为g-g-t模式;535~545 cm-1是t-g-t模式[26]。通过对500~550 cm-1范围内的峰进行拟合分析并计算以分析超声对二硫键结构的影响。
由表2可知,未处理的Glia中二硫键主体构型为g-g-g,其含量为(46.55±0.04)%,占比最高。g-g-g型主要作用于分子内部,t-g-t型主要与分子间二硫键作用有关。Glia中t-g-t型二硫键含量较少,这主要是由于ω-Glia中巯基含量较少,Glia分子间不易形成二硫键[27]。经过超声之后,Glia的构型从g-g-g转变为g-g-t和t-g-t,g-g-g含量显著降低而t-g-t含量显著增加。这可能是因为超声波在溶液中产生了强的空化效应破坏了原有的分子内二硫键,同时氧化了部分活跃的巯基形成分子间二硫键。另外,Glia中t-g-t含量在360 W时增加至(26.28±1.12)%,继续增强处理功率至600 W,t-g-t含量减少至(10.72±0.74)%,这可能是由于高强度的超声波打断了分子间的二硫键。超声作用力破坏了蛋白质的二硫键构象,这也使蛋白质的三级结构变得不稳定,导致结构松散暴露出新的游离巯基。当处理功率过高时,导致分子重新聚集,这也可能是在600 W时Glia游离巯基减少的原因之一。二硫键的存在使蛋白质的三级结构更稳定,可能使其结合表位更容易表达,当二硫键被还原时,蛋白质的抗体结合能力显著降低[28]。因此结构的变化与蛋白质的抗原性是密切相关的。
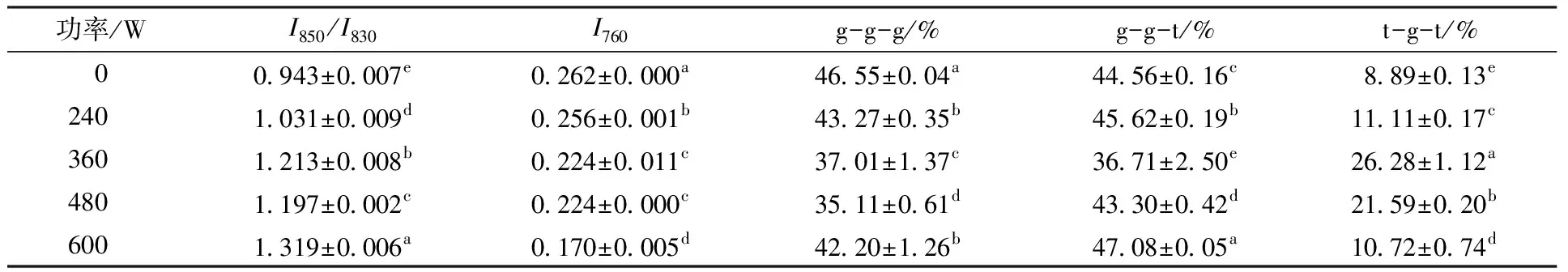
表2 超声波浴处理后Glia侧链结构变化及二硫键构型含量Table 2 Change of Glia side chain structure and the content of disulfide bond configuration after ultrasonic bath treatment
2.6 超声波浴对Glia亚基的抗体结合能力影响
采用Western blotting对Glia亚基的抗原性进行分析。由图6可知,未处理和超声处理的Glia均出现免疫条带,其中240、360、600 W处理后的Glia在25 kDa附近的反应条带略有加深,而480 W处理的Glia在25 kDa附近几乎没有免疫反应条带。说明超声产生了小分子亚基并且其具有结合IgG的能力,但这与SDS-PAGE分析不同,可能是由于Western blotting比SDS-PAGE更灵敏。超声处理对30~40 kDa内的Glia亚基抗原性影响不显著,可能是由于该处蛋白质结构稳定,超声提供的能量不足以对其产生影响。

注:泳道1-5分别为超声功率0、240、360、480、600 W处理后的样品。图6 超声波浴处理后Glia的免疫印记图Fig.6 Western blotting of Glia after ultrasonic bath treatment
Glia的抗原性受其线性表位和构象表位影响,而线性表位的变化对其影响更为显著[29]。但并不意味着线性表位的破坏会使Glia抗原性完全丧失,因为产生的一些小分子肽依然能够结合IgG诱发超敏反应。另外,构象表位同样是抗原在动物体内诱发超敏反应的重要原因,因此还需对其进一步分析。
2.7 超声波浴对Glia的抗原性影响
由图7可知,与未超声的Glia相比,超声处理显著降低了Glia的抗原性,并且随着超声功率增加,Glia的抗原性逐渐降低。超声功率为480 W时降低效果显著,其抗原抑制率为(33.03±1.72)%。当功率升高至600 W时,Glia的抗原性稍增加。影响蛋白质抗原性的主要原因是表位的完整性以及可接触性[30]。因此,Glia抗原性降低主要是超声导致蛋白质结构变化,从而使原有的抗原表位被破坏或隐藏,导致特异性抗体无法正确识别抗原表位。结合前文所述,蛋白质的α-螺旋和β-折叠含量降低;游离巯基暴露,酪氨酸和色氨酸极性环境增强和二硫键构象转变,表明蛋白质空间结构经超声处理后变得松散。而继续增大处理功率,又会增加Glia的抗原性,这可能是由于高强度超声处理使游离巯基重新氧化成二硫键,形成了新的构象表位;也有可能是蛋白质结构被破坏导致埋藏在内部的线性表位重新暴露,导致Glia抗原性增强。
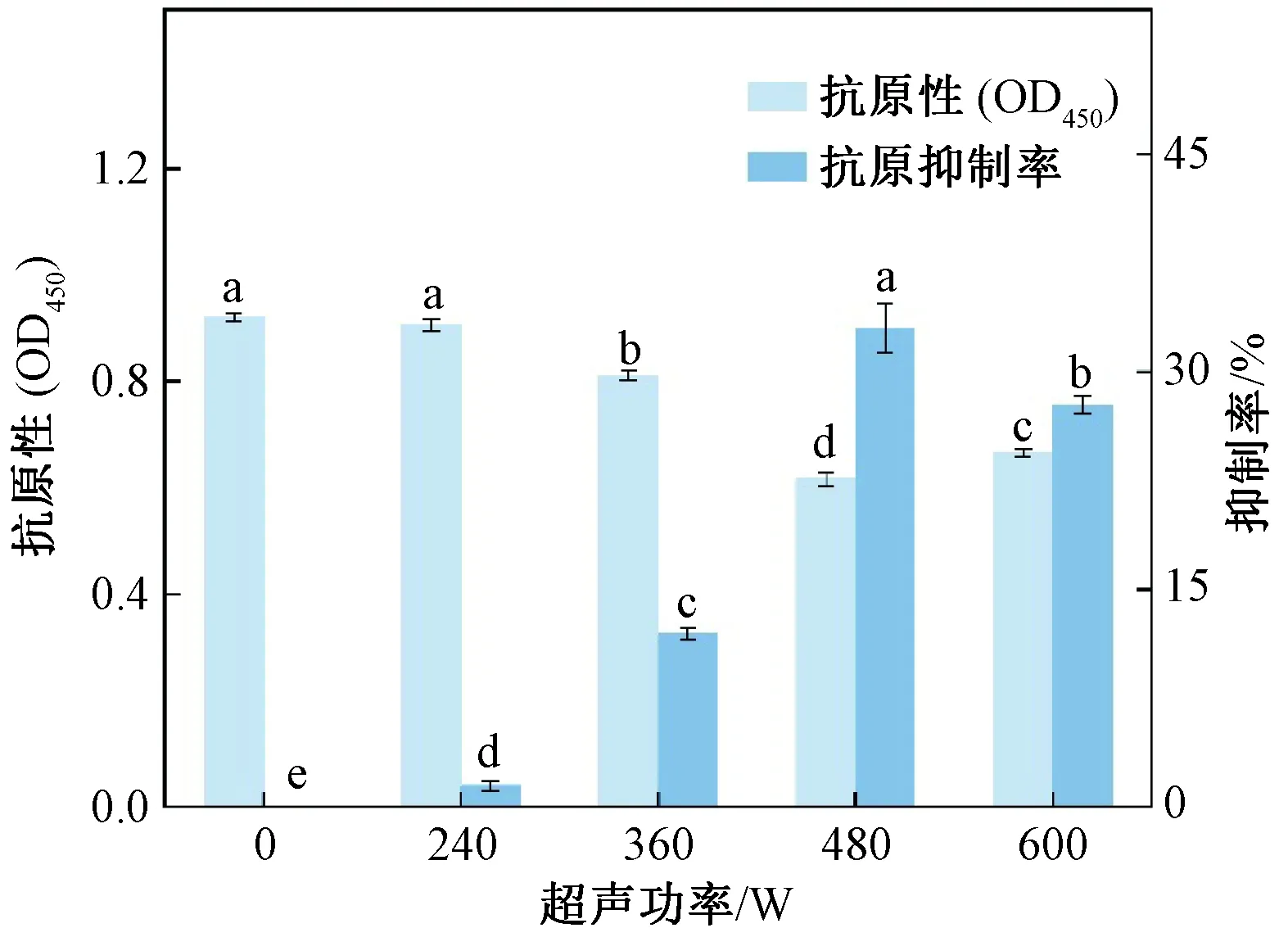
图7 超声处理后Glia抗原性变化Fig.7 Change of Glia antigenicity after ultrasonic bath treatment
3 结论
本研究采用化学法、光谱法分析超声处理对Glia结构的影响,并通过Western blotting、ELISA分析其抗原性变化。结果表明,超声处理显著降低了Glia的抗原性,在功率为480 W时降低效果最显著,其抗原抑制率为(33.03±1.72)%。化学表征发现,超声处理使Glia游离氨基和游离巯基的含量增加;SDS-PAGE分析并未发现有小分子亚基产生,而Western blotting结果却显示超声之后25 kDa处的亚基抗原反应增强。光谱分析表明,经过超声处理的Glia二级结构发生改变,有序结构含量降低;超声处理改变了Glia的三级结构和侧链结构,酪氨酸和色氨酸进一步暴露并接触到极性环境。此外,维持蛋白质空间构象稳定的g-g-g型二硫键含量减少。Glia空间构象的改变可能破坏或掩盖其抗原表位。本研究分析了超声功率变化对Glia结构和抗原性的影响,发现超声对Glia的二级、三级结构影响显著,适度超声能有效减少Glia的抗原反应。超声波作为新型食品加工技术,对开发低敏性谷物制品有广阔的应用前景,但其抑制机制需进一步研究。

