野燕麦对精噁唑禾草灵的敏感性水平及其ACCase基因序列分析
王祥宇 郝巧巧 远鑫洋 刘润强 王洪亮 张佩
摘要:為明确麦田野燕麦对精噁唑禾草灵的抗药性水平及抗性种群的靶标抗性机制,采用整株生物测定法对河南省不同地区的30个野燕麦种群的敏感性水平进行测定,同时对抗性野燕麦种群的靶标ACCase 基因片段进行扩增和测序。最终研究表明:供试种群中有5个对精噁唑禾草灵产生了高水平抗性,11个产生了中等水平抗性,11个产生了低水平抗性,3个为敏感种群。其中抗药性最高的种群是HZXH,用整株生物法测定后,精噁唑禾草灵对该种群的有效抑制中剂量(ED50)值为143.66 g a.i./hm2,相对抗性倍数为21.31。河南省不同地区的野燕麦种群对精噁唑禾草灵的敏感度不同,表明这些地区野燕麦对精噁唑禾草灵产生了不同程度的抗药性。对5个高水平抗性种群HLWY、HZXP、HZXH、HXGT、ZMSX和1个敏感种群HXZC进行靶标基因序列检测,均未发现与之前报道的6个ACCase特定位点的突变,野燕麦的抗药性机制有待继续研究。
关键词:野燕麦;抗药性;精噁唑禾草灵;生物测定;乙酰辅酶A羧化酶
中图分类号:S476 文献标志码:A 文章编号:1003-935X(2023)04-0037-07
Susceptibility of Avena fatua to Fenoxaprop-P-Ethyl and Sequence Analysis of Its ACCase Gene
WANG Xiang- yu1,HAO Qiao- qiao1,YUAN Xin- yang1,LIU Run- qiang1,WANG Hong- liang1,ZHANG Pei1,2
(1.School of Resources and Environment,Henan Institute of Science and Technology/Henan EngineeringResearch Center of Biological Pesticide & Fertilizer Development and Synergistic Application,Xinxiang 453003,China;2.Henan Postdoctoral Innovation Practice Base,Xinxiang 453003,China)
Abstract:This study aimed to clarify the fenoxaprop-P-ethyl-resistance level of Avena fatua and the target resistance mechanism of ACCase in resistant populations,determined susceptibility level of 30 A. fatua populations in different regions of Henan Province by whole plant bioassay,and amplified and sequenced the target ACCase gene fragments of resistant A. fatua populations. The final study showed that 5 tested populations had a high level of fenoxaprop-P-ethyl-resistance,11 had a medium level of resistance,11 had a low level of resistance,and 3 were sensitive populations. Among them,the population with the highest herbicide-resistance was HZXH. While the whole plant biological method was used to determine,the effective inhibition medium dose (ED50) of fenoxaprop-P-ethyl to this population was 143.66 g a. i./hm2,and the relative resistance multiple was 21.31. The sensitivity of A. fatua in different regions of Henan Province to fenoxaprop-P-ethyl is different,which indicated that A. fatua in these regions had different degrees of resistance to fenoxaprop-P-ethyl. The target gene sequences of five highly resistant populations including HLWY,HZXP,HZXH,HXGT and ZMSX and one sensitive population of HXZC were detected,but no mutation was found at the six ACCase specific loci reported previously. And the mechanism of herbicide-resistance of A. fatua needs to be further studied.
Key words:Avena fatua;herbicide-resistance;fenoxaprop-P-ethyl;bioassay;ACCase
野燕麦(Avena fatua L.)是禾本科燕麦属的一年生草本植物,在中国南北各地均有分布,主要危害小麦、油菜等作物[1]。野燕麦是中国15 种恶性杂草之一,在中国冬麦区危害率达15.6%,春麦区危害率达25.3%,全国严重危害面积约为160万hm2,造成小麦减产17.5亿kg/年[2]。化学除草剂在农业生产中起着非常重要的作用,虽然起步晚于杀虫剂和杀菌剂,但发展极其迅速[3]。精噁唑禾草灵(fenoxaprop-P-ethyl)是乙酰辅酶A 羧化酶(ACCase )抑制剂[4],具有活性高、杀草谱广和选择性强等优点,20世纪70年代后期在我国小麦田和油菜田开始使用,到20世纪90年代已成为我国油菜田防除一年生禾本科杂草的主要药剂。该除草剂的作用位点单一,所以容易产生抗药性[5]。目前,国内外对野燕麦的研究主要集中在生态适应性、遗传多样性、危害度调查和化学防除药剂的筛选以及对精噁唑禾草灵抗性水平及抗性机制研究方面。如李涛等对野燕麦种子的萌发特性以及防除药剂进行了研究,发现25 ℃为野燕麦的最适发芽温度,炔草酯和唑啉草酯的防效最高[6];李岩等的研究表明,安徽省14个地市不同野燕麦群体之间有遗传多样性[7];李鹏对野燕麦的靶标抗性机制进行了研究,但并没有发现特定位点发生突变[8]。虽然已有野燕麦对精噁唑禾草灵的抗药性的相关报道,但由于不同地区不同年份用药的差异,野燕麦对精噁唑禾草灵的抗药性也不同。为了明确河南省野燕麦对精噁唑禾草灵的抗药性水平及靶标抗性机制,试验采用整株生物测定法测定野燕麦的敏感性水平,并从分子层面明确野燕麦的ACCase基因序列,以期为麦田抗性杂草的治理及延缓抗药性杂草的发生提供理论基础。
1 材料与方法
1.1 试验材料
1.1.1 供试种子和药剂
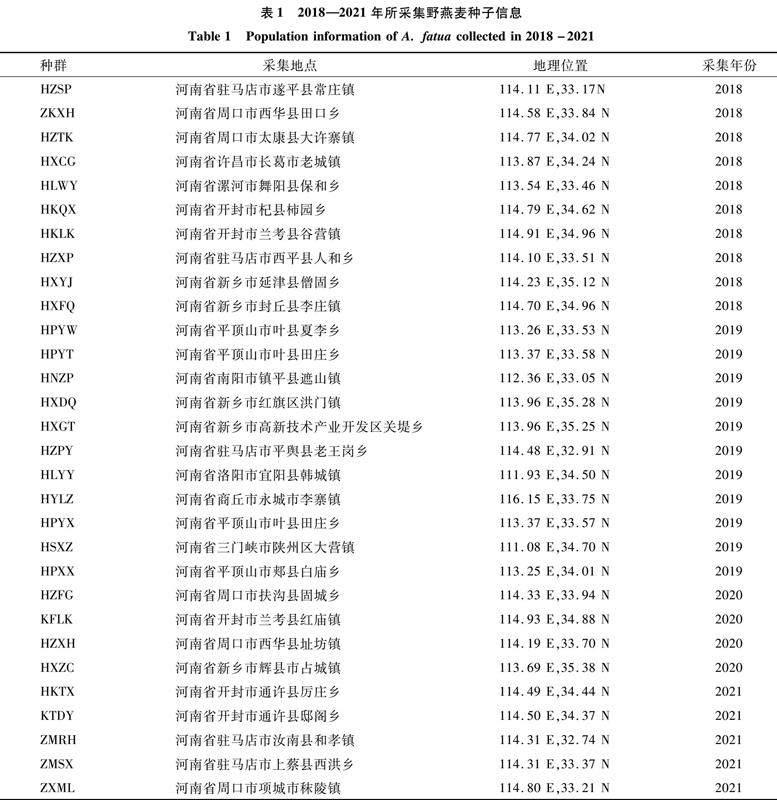
本试验所使用的野燕麦种子均来自河南省不同地区,采集的种子均为成熟有活力种子(表1)。供试除草剂为69 g/L精[XCY1.tif,JZ]唑禾草灵水乳剂,由中国农业科学院植物保护所北京中保绿农科技集团有限公司生产。
1.1.2 主要仪器
PCR仪[耶拿分析仪器(北京)有限公司]、电泳仪(北京君意东方电泳设备有限公司)、电子天平(上海众渊实业有限公司)、电热恒温水浴锅(上海跃进医疗器械有限公司)、涡旋振荡仪[艾卡(广州)仪器设备有限公司]、GTR16-2型高速冷凍离心机(北京时代北利离心机有限公司)、ASS-4 型自动控制农药喷洒系统(北京盛恒天宝科技有限公司)。
1.2 试验方法
1.2.1 供试种子信息
2018—2021年所采集的野燕麦种子信息见表1。
1.2.2 野燕麦对精噁唑禾草灵的敏感度测定方法
整株生物测定参照Feng等的方法[9],并稍作修改。将营养土(有机质含量为1.4%,pH值为5.6)和田园土按体积比1 ∶1混合,然后装入带有孔底的塑料盆(口径7 cm、底径5 cm、高8 cm)中,随即播种已经解除休眠的野燕麦种子,每个种群种28盆,每盆播种20个种子。置于室温中培养,白天温度为20 ℃,晚上15 ℃,每天光照12 h,正常水肥管理。
待野燕麦植株生长到1~2叶期时定苗,留20株/盆,继续培养至2~3叶期,采用北京盛恒天宝科技有限公司生产的 ASS-4 型自动定量喷雾系统(扇形喷头型号为TEEJET-9503EVS,喷雾塔为ASS-4型)进行茎叶喷雾处理。设定喷雾压力为 0.275 MPa,喷液量为 450 L/hm2,喷液速度为 1.2 L/min,喷头与植株之间的距离50 cm。根据预试验确定各种群处理剂量,本试验采用6个处理,分别为3.9、15.5、31.0、62.0、124.0、248.0 g a.i./hm2,每个处理4盆。另设清水作为空白对照(CK),在处理21 d后测定地上部茎叶的鲜重,计算每个野燕麦种群的鲜重抑制率,同时将药剂处理后存活的单株叶片留存,每个处理重复4次共28盆,整体重复2次。
1.2.3 野燕麦的ACCase基因克隆及序列分析
待野燕麦生长到3~4叶期,剪取100 mg叶片,放入研钵中加入液氮研磨,提取方法根据DNA Quick Plant System[非离心柱型,天根生化科技(北京)有限公司]说明书进行。根据NCBI上已公布的与野燕麦同源性较高的大穗看麦娘(Alopecurus myosuroides)的ACCase 基因序列(登录号:AJ310767)设计1对引物[8]:
正向引物,3′-CTGAATGAAGAAGACTATGGTCG[JP+1]-5′;反向引物3′-[JP9]TCCTCTGACCTGAACTTGATCTC[JP]-5′。
PCR扩增目的基因长度为1 050 bp,退火温度为55 ℃,包括1 781~2 088氨基酸突变位点。引物由生工生物工程(上海)股份有限公司负责合成。反应体系为25 μL,参数为:94 ℃ 2 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1.5 min,35个循环;72 ℃ 10 min,电泳验证结果,完成后将PCR产物送至生工生物工程(上海)股份有限公司进行测序。将测序所得序列在 NCBI 上进行 BLAST 比对,用BioEdit软件对扩增出的抗性与敏感野燕麦种群的ACCase基因序列进行比对,分析是否发生特定位点氨基酸突变。每个种群检测10株植株。
1.2.4 数据处理及抗性分级
使用R软件“drc”程序包中drm函数的W 1.4非线性拟合方程统计分析,导入原始数据计算出抑制中剂量(ED50)值[10]。根据每个野燕麦种群的ED50值,计算不同野燕麦种群的相对抗性倍数[11]。ED50值的计算公式:
f[x,(b,c,d,e)]=c+d-c1+exp[b(lgx-lge)]。(1)
式中:x表示鲜重抑制率;e表示ED50值;c和d分别代表置信区间的下限和上限;b代表e附近的相关斜率。
相对抗性倍数(RI)=抗性种群的ED50值/敏感种群ED50 值。(2)
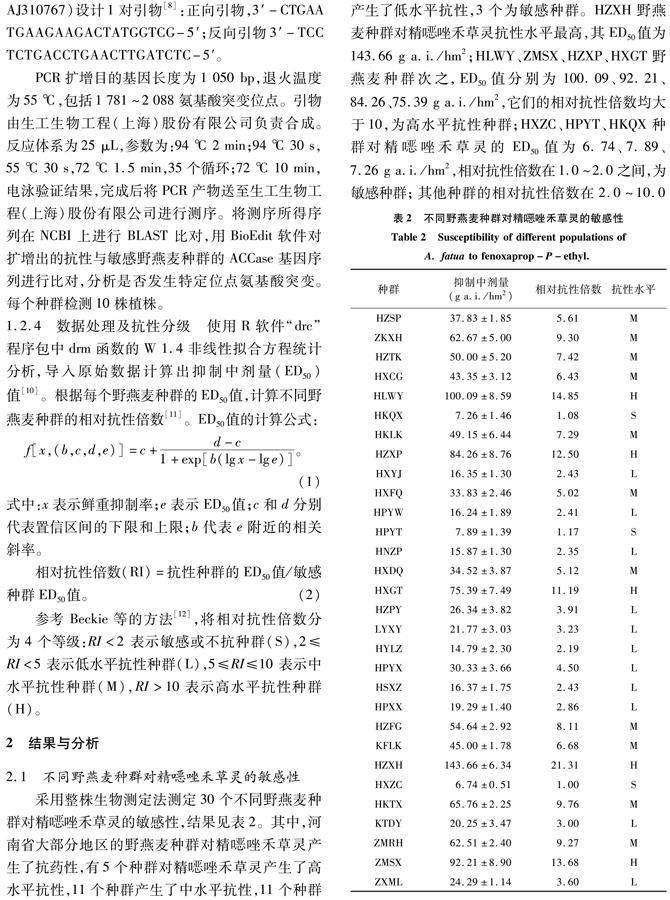
参考 Beckie等的方法[12],将相对抗性倍数分为 4 个等级:RI<2 表示敏感或不抗种群(S),2≤RI<5 表示低水平抗性种群(L),5≤RI≤10 表示中水平抗性种群(M),RI>10表示高水平抗性种群(H)。
2 结果与分析
2.1 不同野燕麦种群对精噁唑禾草灵的敏感性[HT]
采用整株生物测定法测定30个不同野燕麦种群对精噁唑禾草灵的敏感性,结果见表2。其中,河南省大部分地区的野燕麦种群对精噁唑禾草灵产生了抗药性,有5个种群对精噁唑禾草灵产生了高水平抗性,11个种群产生了中水平抗性,11个种群产生了低水平抗性,3个为敏感种群。HZXH野燕麦种群对精噁唑禾草灵抗性水平最高,其ED50值为143.66 g a.i./hm2;HLWY、ZMSX、HZXP、HXGT野燕麦种群次之,ED50值分别为100.09、92.21、84.26、75.39 g a.i./hm2,它们的相对抗性倍数均大于10,为高水平抗性种群;HXZC、HPYT、HKQX种群对精噁唑禾草灵的ED50值为6.74、7.89、7.26 g a.i./hm2,相对抗性倍数在1.0~2.0之间,为敏感种群; 其他种群的相对抗性倍数在 2.0~10.0之间。抗性种群占比90%,可见抗性野燕麦的发生情况严重。
2.2 抗精噁唑禾草灵野燕麦种群ACCase基因序列分析
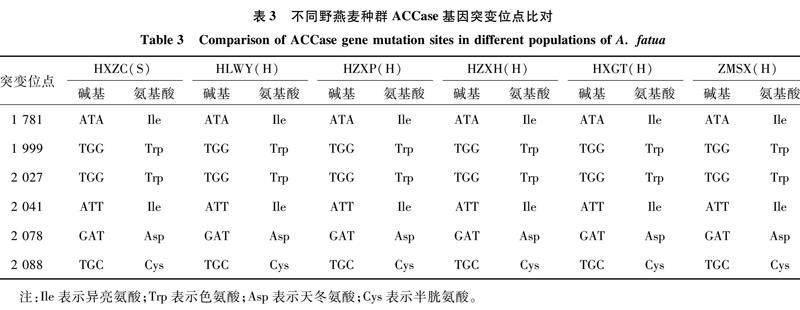
对HLWY、HZXP、HZXH、HXGT、ZMSX等5个高水平抗性野燕麦种群和HXZC敏感种群的ACCase基因序列进行靶标基因测序,用BioEdit进行多序列比对,查找野燕麦对精噁唑禾草灵ACCase抑制剂类除草剂抗性的相关基因位点,Yu等曾经报道过野燕麦对精噁唑禾草灵的抗药性与ACCase相关的突变位点有以下6个:1 781、1 999、2 027、2 041、2 078、2 088[13-14]。分析多序列比对结果(表3),均未在已报道的引起野燕麦抗药性的氨基酸突变位点发生突变。
3 讨论与结论
麦田野燕麦对除草剂产生抗性已有过报道。周志恒等研究發现,野燕麦已对精噁唑禾草灵和甲基二磺隆产生抗性,同时也对炔草酯、唑啉草酯、烯禾啶等产生交互抗性[15]。吕晓辉调查发现,西北地区野燕麦已对高效氟吡甲禾灵产生抗性[16]。郭峰等采用整株生物测定与种子生物测定检测了河南、湖北、江苏3个省份共11个野燕麦种群对精噁唑禾草灵和炔草酯的敏感性,发现金水闸野燕麦种群对精噁唑禾草灵和炔草酯敏感性最高[17]。本试验通过整株生物测定法确认了河南省野燕麦对精噁唑禾草灵的抗药性水平,其中HZXH、HLWY、ZMSX、HZXP、HXGT等野燕麦种群抗药性最高,相对抗性倍数分别为21.31、14.85、13.68、12.50、11.19。调查发现,这些地块连年施用精噁唑禾草灵,导致药剂对野燕麦的防效降低,这可能是野燕麦对精噁唑禾草灵产生高抗药性的原因。
精噁唑禾草灵是一种乙酰辅酶A 羧化酶(accase)抑制剂类除草剂,通过影响植株的正常生长发育,毁坏细胞构造,出现细胞毒素,从而达到除草的目的[18-19],因其作用靶标单一,长期使用药效降低,药量增加,使杂草产生抗药性[20]。杂草对除草剂的抗性包括靶标抗性和非靶标抗性,靶标抗性是指植物体内靶标酶发生突变产生抗性[21],其中靶标基因突变、靶标酶敏感性降低、靶标基因表达量上升等是杂草产生靶标抗性机制的重要原因[22]。赵宁等的研究表明,日本看麦娘ACCase基因第1 781位由异亮氨酸 (Ile) 突变为亮氨酸 (Leu),使日本看麦娘产生了靶标抗性[23];Kaundun研究发现,多花黑麦草中ACCase CT区天冬氨酸(Asp) 2 078被甘氨酸(Gly)取代,导致其对禾草灵、烯禾啶和唑啉草酯产生抗药性[24];非靶标抗性包括解毒代谢、氧化代谢、屏蔽作用或者隔离作用等增强,其中解毒代谢是最常见的非靶标抗性机制[25-26]。Kaundun等在抗性黑草种群中就发现,非靶标抗性是导致其对炔草酯和唑啉草酯产生抗性的主要原因[27];Neve等在原本敏感的多花黑麦草种群中,用低剂量高效氟吡甲禾灵进行筛选,仅仅经历3代后就使该种群对高效氟吡甲禾灵产生了代谢抗性[28]。本试验以抗性野燕麦生物型为研究材料,研究野燕麦抗药性的产生是否是由乙酰辅酶A羧化酶的基因序列发生突变所致,结果表明,这5个高抗性野燕麦种群均未在特定氨基酸突变位点发生突变,说明野燕麦产生抗性的机制不是由靶标基因突变引起的,可能是靶标酶活性降低或者靶标基因过量表达引起的靶标抗性,也可能是解毒代谢引起的非靶标抗性,其抗性机制有待进一步研究。
杂草对除草剂产生抗性已成为麦田作物草害治理的重大难题之一,为了有效控制杂草的危害、延缓抗药性的发展,对野燕麦的防除采用综合防治的策略,同时做到科学用药,并选用不同作用机制的除草剂交替使用[29]。
参考文献:
[1]涂鹤龄,邱学林,辛存岳. 野燕麦的发生现状与燕麦畏的应用[J]. 农药科学与管理,1991,12(3):12-13,25.
[2]魏守辉,张朝贤,朱文达,等. 野燕麦对不同小麦品种产量性状的影响及其经济阈值[J]. 麦类作物学报,2008,28(5):893-899.
[3]王新媛,李好海,闵 红,等. 河南省麦田杂草发生现状及防除技术研究[J]. 中国植保导刊,2020,40(12):49-53.
[4]鲁传涛,楚桂芬,徐洪乐,等. 河南省小麦田杂草发生现状调查[J]. 河南农业科学,2016,45(8):91-94.
[5]Grey T L,Bridges D C. Alternatives to diclofop for the control of Italian ryegrass (Lolium multiflorum) in winter wheat (Triticum aestivum)[J]. Weed Technology,2003,17(2):219-223.
[6]李 濤,袁国徽,钱振官,等. 野燕麦种子萌发特性及化学防除药剂筛选[J]. 植物保护,2018,44(3):111-116.
[7]李 岩,徐智明,朱德建,等. 江淮地区野燕麦遗传多样性研究[J]. 种子,2016,35(9):29-31.
[8]李 鹏. 野燕麦乙酰辅酶A羧化酶基因克隆、表达及突变点检测[D]. 新乡:河南科技学院,2018.
[9]Feng Y J,Gao Y A,Zhang Y,et al. Mechanisms of resistance to pyroxsulam and ACCase inhibitors in Japanese foxtail (Alopecurus japonicus)[J]. Weed Science,2016,64(4):695-704.
[10]Ritz C,Streibig J C.Bioassay analysis using R[J]. Journal of Statistical Software,2005,12(5):1-22.
[11]姜晓龙,梁帝允,刘都才.杂草早期防治——抗药性治理的有效措施[C]//中国化工学会农药专业委员会第十八届年会论文集.南宁,2018:35-38.
[12]Beckie H J,Tardif F J.Herbicide cross resistance in weeds[J]. Crop Protection,2012,35:15-28.
[13]Yu Q,Ahmad-Hamdani M S,Han H,et al. Herbicide resistance-endowing ACCase gene mutations in hexaploid wild oat (Avena fatua):insights into resistance evolution in a hexaploid species[J]. Heredity,2013,110(3):220-231.
[14]Christoffers M J,Berg M L,Messersmith C G.An isoleucine to leucine mutation in acetyl-CoA carboxylase confers herbicide resistance in wild oat[J]. Genome,2002,45(6):1049-1056.
[15]周志恒,张 粤,孙亚宁,等. 野燕麦(Avena fatua)对精噁唑禾草灵和甲基二磺隆的抗药性水平[J]. 杂草学报,2022,40(2):31-38.
[16]吕晓辉. 野燕麦、旱雀麦对高效氟吡甲禾灵的抗药性研究[D]. 西宁:青海大学,2016.
[17]郭 峰,张朝贤,黄红娟,等. 野燕麦对精噁唑禾草灵、炔草酯敏感性差异测定[J]. 植物保护学报,2012,39(1):87-90.
[18]Délye C,Jasieniuk M,le Corre V. Deciphering the evolution of herbicide resistance in weeds[J]. Trends in Genetics,2013,29(11):649-658.
[19]Singh G,Singh V,Singh M.Effect of fenoxaprop-p-ethyl (Puma super 10 EC) with and without surfactant (power activator) on weeds and wheat yield[J]. Indian Journal of Weed Science,2005,37:13-16.
[20]黄世霞,王庆亚,董立尧,等. 乙酰辅酶A羧化酶抑制剂类除草剂与杂草的抗药性[J]. 杂草科学,2003,21(2):1-5.
[21]徐洪乐,冷秋丽,闵 红,等. 河南省多花黑麦草对ACCase和ALS抑制剂的抗性及其靶标基因突变分析[J]. 植物保护学报,2023,50(1):224-230.
[22]Powles S B,Yu Q. Evolution in action:plants resistant to herbicides[J]. Annual Review of Plant Biology,2010,61:317-347.
[23]赵 宁,王 豪,张乐乐,等. 安徽省部分地区冬小麦田日本看麦娘Alopecurus japonicus对精噁唑禾草灵的抗性发生现状及ACCase基因突变研究[J]. 农药学学报,2019,21(1):35-42.
[24]Kaundun S S. An aspartate to glycine change in the carboxyl transferase domain of acetyl CoA carboxylase and non-target-site mechanism (s) confer resistance to ACCase inhibitor herbicides in a Lolium multiflorum population[J]. Pest Management Science,2010,66(11):1249-1256.
[25]毕亚玲,李君君,戴玲玲,等. 杂草对除草剂非靶标抗性机理研究进展[J]. 植物保护,2020,46(5):1-5,12.
[26]周志恒,张 粤,孙亚宁,等. 野燕麦(Avena fatua)对精噁唑禾草灵和甲基二磺隆的抗药性水平[J]. 杂草学报,2022,40(2):31-38.
[27]Kaundun S S,Hutchings S J,Dale R P,et al. Role of a novel I1781T mutation and other mechanisms in conferring resistance to acetyl-CoA carboxylase inhibiting herbicides in a black-grass population[J]. PLoS One,2013,8(7):e69568.
[28]Neve P,Powles S.Recurrent selection with reduced herbicide rates results in the rapid evolution of herbicide resistance in Lolium rigidum[J]. Theoretical and Applied Genetics,2005,110(6):1154-1166.
[29]李香菊,梁帝允,袁会珠. 除草剂科学使用指南[M]. 北京:中国农业科学技术出版社,2014.
基金项目:河南省科技攻关项目(编号:222102110074);河南科技学院高层次人才引进项目(编号:2018024)。
作者简介:王祥宇,男,硕士研究生,主要从事农药学研究。E-mail:360838299@qq.com。
通信作者:张 佩,博士,讲师,主要从事农药学研究。E-mail:zhangpei0519@126.com。

