一株仔猪产肠毒素大肠杆菌分离鉴定、耐药性分析及其卵黄抗体的制备
尹家银,喻娇,唐青海,滕威,阳坤,曹馨,徐晴,刘博,李泽
(衡阳师范学院生命科学与环境学院/南岳山区生物资源保护与利用湖南省重点实验室/动物微生物新型检测技术及生物制剂衡阳市重点实验室,湖南 衡阳 421008)
猪大肠杆菌病是一类由肠道致病性大肠杆菌引起的传染性疾病,包括黄痢、白痢以及水肿病,发病率及死亡率均较高,给养猪业带来重大经济损失[1]。其中,仔猪断奶后腹泻与肠产毒性大肠杆菌(EnterotoxigenicE.coli,ETEC)在肠道定植有较大关系,每年其导致的死亡占全球仔猪死亡的50%,是影响生猪生产的严重威胁之一[2,3]。ETEC 的主要毒力基因是elt、esta、estb和stx2e,其致病过程依赖黏附素和肠毒素的共同作用[4-6]。因致病性大肠杆菌的血清型多、变异快,接种疫苗一般达不到预防效果,临床常用抗生素治疗仔猪细菌性腹泻。而大肠杆菌易产生耐药性,甚至形成多重交叉耐药株,致使细菌耐药性问题愈发严重[7]。刘鑫宇等[8]对西藏林芝地区分离的猪源大肠杆菌(81 株)毒力基因检测的结果显示,毒力基因STb、STa+STb、eaeA出现的频率最高。佟春玉等[9]对黑龙江省仔猪腹泻大肠杆菌毒力基因检测的结果显示,STa、STb的检出率共占肠毒素检出株(74 株)的94.59%。Shahrani等[10]研究表明,在伊朗地区分离出的致病性大肠杆菌(620 株)对青霉素、链霉素、四环素等药物耐药率分别为100%、98.25%、98.09%。Shin等[11]在韩国地区分离出的致病性大肠杆菌(205 株)对链霉素、四环素、新霉素、头孢噻酚等药物耐药,耐药率分别为63.1%、54.5%、40.3%、32.8%。目前,主要采用广谱抗生素治疗猪大肠杆菌病,将导致细菌耐药、抗生素残留及食品安全等问题。因此,急需一种绿色安全的抗生素替代品,而IgY 作为理想的抗生素替代品之一,在养殖业具有巨大的发展潜力。
卵黄抗体(Egg yolk immunoglobulins,IgY)是禽卵黄中的一种免疫球蛋白,相比哺乳动物的IgG 具有更好的稳定性[12],在疾病检测、诊断、防治方面具有多种优点,是一种理想的抗生素替代品[13]。刘文鑫等[14]以重组E.coliK88ab 和K99 蛋白为抗原制备IgY,其预防、治疗有效率达100%。党如意等[15]以E.coliK88 蛋白为免疫原制备IgY,其对仔猪黄痢的治愈率为93.75%,远高于庆大霉素的,表明IgY 在养殖业具有广阔的应用前景。
本研究拟从某养猪场仔猪腹泻粪便样品中分离一株致病性大肠杆菌、分析其毒力基因和耐药性、制备特异性卵黄抗体,为临床仔猪大肠杆菌病的防治提供依据和技术手段。
1 材料与方法
1.1 材料
1.1.1 病料来源 疑似大肠杆菌感染的腹泻仔猪粪便样品由湖南省衡阳市某规模化养猪场提供。
1.1.2 主要试剂 ExTaq酶、BamHⅠ、Hind Ⅲ与DNA Marker,购自宝日医生物技术(北京)有限公司;PCR 清洁试剂盒与质粒提取试剂盒,购自Axygen 公司;肠杆菌科细菌生化编码鉴定管与药敏纸片,购自杭州微生物试剂有限公司;聚乙二醇(PEG-6000)等分析纯化学试剂,购自Solarbio 公司;MONTANIDETMISA71VG、201VG、15AVG系列疫苗佐剂,由法国SEPPIC 公司生产;Bradford 蛋白浓度测定试剂盒,购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1 细菌分离与纯化 将采集的病料用500 μL灭菌PBS 溶液稀释,接种于麦康凯(MC)培养基,37 ℃培养16 h。挑取粉红、不透明单菌落接种至LB液体培养基,37 ℃培养16 h。将菌液在MC 培养基上划线,37 ℃培养16 h。连续纯化3代,取第3 代菌液在LB 固体培养基上划线,37 ℃培养16 h,观察菌落形态特征。
1.2.2 细菌生化特性鉴定 取第三代菌液接种至生化鉴定管内,37 ℃培养1~2 d,记录试验现象,根据《伯杰氏细菌鉴定手册》对细菌进行鉴定。
1.2.3 细菌毒力基因检测 取第三代菌株接种于LB 液体培养基,37 ℃培养16 h。提取菌液DNA,根据参考文献[16]设计引物,引物信息见表1。PCR扩增体系(总体积25 μL):ExTaq酶12.5 μL,上、下游引物各1 μL,模板2 μL,ddH2O 补至25 μL。PCR扩增程序:95 ℃预变性5 min;98 ℃变性10 s,55 ℃退火30 s,72 ℃延伸50 s,35个循环;72 ℃延伸10 min,4 ℃保存。取3 μL PCR 产物用1.2%琼脂糖凝胶进行电泳检测。将目的基因克隆至pMD-19T 载体中,转化至DH5α 感受态细胞中,筛选阳性质粒,利用BamHⅠ和Hind Ⅲ双酶切鉴定,将阳性质粒送至深圳华大基因股份有限公司测序,采用DNAStar 和MEGA 等软件对所得序列与GenBank 中的毒力基因序列进行同源性比对与进化分析。

表1 引物序列及其反应条件
1.2.4 药敏试验 采用K-B 纸片扩散法测定分离菌株对15 种常见抗菌药物的敏感性,药敏敏感性判定按杭州微生物试剂有限公司对抑菌范围标准的解释进行。
1.2.5 产肠毒素大肠杆菌抗原的制备 取20 μL 第三代菌液接种于200 mL LB 液体培养基中,37 ℃下220 r/min 培养16 h,培养2 瓶菌液。
1)全菌体灭活法制备抗原。培养后1 瓶菌液中加入甲醛溶液至终浓度为0.2%,37 ℃灭活48 h,进行无菌检验,无细菌生长即合格。
2)超声波破碎法制备抗原。取另1 瓶菌液4 ℃下10 000 r/min 离心5 min,收集菌体沉淀,用PBS溶液重悬后进行超声波裂解,超声5 s,间隔5 s,共60 min。
1.2.6 疫苗制备 采用乳化法制备大肠杆菌灭活疫苗,按照佐剂厂家说明书将0.2%甲醛处理菌液和超声波破碎处理菌液分别与佐剂ISA 71VG、ISA 210VG 和ISA 15AVG 按7∶3、1∶1 和1.5∶8.5 比例乳化。等体积疫苗中抗原含量要保持一致。
1.2.7 动物免疫 将24 只产蛋高峰期的蛋鸡随机分成6 组(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ组),每组4 只。6 组疫苗抗原与佐剂成分依次为0.2%甲醛处理的菌液+ISA 71VG、0.2%甲醛处理的菌液+ISA 201VG、0.2%甲醛处理的菌液+ISA 15AVG、超声波破碎处理的菌液+ISA 71VG、超声波破碎处理的菌液+ISA 201VG、超声波破碎处理的菌液+ISA 15AVG。免疫剂量为1 mL/羽,于胸部肌肉注射疫苗,共免疫2次,间隔21 d。
1.2.8 高免卵黄抗体提取与纯度检测 收集首免后0、7、14、21、35、49、63 d 的鸡蛋,4 ℃保存。以聚乙二醇沉淀法提取IgY,卵黄与PBS 溶液按1∶2 比例混合,剧烈振荡30 s。加3.5 %(W/V)聚乙二醇(PEG-6000)充分混匀,37 ℃水浴15 min,取出静置作用1 h;4 ℃下12 000 r/min 离心30 min,过滤,滤液中加8.5 %(W/V)PEG-6000,37 ℃水浴15 min,充分搅拌溶解。4 ℃下12 000 r/min 离心30 min,弃上清液,在沉淀物中加PBS 溶液溶解,加12 %(W/V)(1.2 g)PEG-6000,37 ℃水浴15 min。4 ℃下12 000 r/min 离心30 min,弃上清液,在沉淀物中加PBS 溶液溶解(每10 mL 卵黄原液加入1 mL PBS 溶液溶解),置于透析袋内透析,-20 ℃保存。采用SDS-PAGE 电泳法评估IgY 纯度,若70 ku 处的重链条带和25 ku 处的轻链条带同时存在且带型明显,则该提取物合格;若重链或轻链缺一条或均无,则提取物不合格,需重新提取。
1.2.9 蛋鸡血清抗体制备 首次免疫后0、21、35、49 d 于蛋鸡翼下静脉采血1 mL,37 ℃静置3 h,血清自然析出后,4 ℃下5 000 r/min 离心3 min,分离血清,弃沉淀物,-20 ℃保存。
1.2.10 抗原及IgY 浓度测定 按照Bradford 蛋白浓度测定试剂盒(上海碧云天生物技术有限公司)的说明书操作,并以标准蛋白质浓度为横坐标,以吸光度为纵坐标,绘制标准曲线。根据标准曲线方程及样品使用体积,求得样品蛋白含量。
1.2.11 抗体效价测定 采用双向琼脂扩散试验进行抗体效价测定。在溴酚蓝琼脂平板上打孔,打孔器孔径5 mm,孔距4 mm,弃去琼脂块,并加热封底。于中间孔注入抗体,周围孔注入梯度稀释的灭活抗原(或中间孔注入灭活抗原,周围孔注入梯度稀释抗体)。将加好样的琼脂平皿放入湿盒中,37 ℃培养48~72 h。两孔之间出现清晰白色沉淀线为阳性,无沉淀线为阴性。
2 结果与分析
2.1 细菌分离鉴定结果
分离菌株在麦康凯培养基上具有粉红色、边缘光滑整齐、湿润扁平等特征(图1)。

图1 分离菌株在麦康凯培养基上的菌落形态
2.2 分离菌株的生化特性鉴定结果
由表2 可知,分离菌株可发酵葡萄糖、乳糖、棉子糖等,不发酵侧金盏花醇、硫化氢、枸橼酸盐等。根据《伯杰氏细菌鉴定手册》,该菌株生化反应结果符合大肠杆菌的生化特性。
2.3 毒力因子PCR 鉴定结果
2.3.1elt基因PCR 扩增elt基因PCR 扩增产物经1.2%琼脂糖凝胶电泳检测,在约272 bp 处出现特异性扩增条带(图2),与预期大小相符。
2.3.2estb基因PCR 扩增estb基因PCR 扩增产物经1.2%琼脂糖凝胶电泳检测,在约113 bp 处出现特异性扩增条带(图3),与预期大小相符。

图3 estb 基因的PCR 扩增电泳结果
2.4 重组克隆载体双酶切鉴定结果
2.4.1 pMD19T-elt 重组克隆载体的双酶切鉴定结果 pMD19T-elt 重组克隆载体的双酶切产物经1.2%琼脂糖凝胶电泳检测,在第6 号泳道约272 bp处出现了特异性扩增条带,与目的基因大小相符,说明目的基因已成功克隆至pMD-19T 载体中。
2.4.2 pMD19T-estb 重组克隆载体的双酶切鉴定结果 pMD19T-estb 重组克隆载体的双酶切产物经1.2%琼脂糖凝胶电泳检测,在第2、4、6 号泳道约113 bp处出现了特异性扩增条带,与目的基因大小相符,说明目的基因已成功克隆至pMD-19T载体中。

图5 重组克隆载体pMD-19T-estb 的酶切鉴定
2.5 elt 基因和estb 基因核苷酸序列、参考毒株同源性与遗传进化分析结果
2.5.1E.coli-elt 基因核苷酸序列、参考毒株同源性与遗传进化分析结果 与参考毒株(表3)比较发现,E.coli-elt 与越南2017 年毒株ECOPV-HL(MF990203)和EcoPV-173(MF990202)、美国2015年流行毒株UMNK88(CP002732)、巴西2008 年毒株225-IV(EU113245)、中 国2006 年毒株Eco412(DQ778054)及中国台湾2002 年毒株CH-C2(AF242418)基因核苷酸序列的同源性均在99%以上。使用MEGA 5.0 软件建立遗传进化树,分析分离株的elt基因与国内外已发表的毒株的关系。结果表明,分离株与越南流行毒株如ECOPV-HL(MF990203)、EcoPV-173(MF990202)、中国流行毒株如195(EF057802)、美国流行毒株如UMNK88(CP002732)等处于同一分支,遗传关系最近。而与丹麦株CFSAN018748、瑞士株14OD0056 和美国经典菌株F6699、F56656C1 处于不同分支,亲缘关系较远(图6)。

表3 elt基因的参考菌株

图6 elt基因的系统发育树
2.5.2E.coli-estb 基因核苷酸序列与参考毒株同源性与遗传进化分析结果 通过与参考毒株(表4)的对比发现,E.coli-estb 与中国近年新流行毒株CV839-15(CP024975)与及德国流行毒株EC32173(CP000913)基因核苷酸序列的同源性均为99.1%,与法国流行毒株17-462F(MH847580)及美国流行毒株UMNK88(CP002732)基因核苷酸序列的同源性均为100%。使用MEGA 5.0 软件建立遗传进化树,分析分离株estb基因与国内外已发表的毒株的关系(图7)。结果表明,分离株与美国流行毒株如UMNK88(CP002732)、法国流 行毒株 如17-462(MH847580)、德国流 行毒株 如 EC32173(CP000913)、中国流行毒株CV839-15(CP024975)处于同一分支,亲缘关系较近,而与丹麦株CFSAN018748(CP028195)、瑞士株 14OD0056(MG904993)、15OD0495(MG904998)等处于不同分支,亲缘关系较远。

表4 estb 基因的参考菌株

图7 estb 基因的系统发育树
2.6 分离菌株的药物敏感性
在测定的15 种药物中,分离菌株对多西环素、呋喃唑酮以及多种氨基糖苷类和喹诺酮类抗菌药物耐药,对其他药物表现为中介或敏感(表5)。

表5 分离菌株的药物敏感性
2.7 免疫后各组蛋鸡产蛋率
2019 年4 月13 日至2019 年6 月2日,于每天18:20—18:50 记录每组蛋鸡的产蛋数。计算Ⅰ~Ⅵ组蛋 鸡50 d 的平均 产蛋率 分别为(40.5±28.2)%、(51.0±33.2)%、(43.0±24.0)%、(43.0±24.0)%、(50.5±32.6)%、(55.5±32.9)%。
2.8 卵黄抗体的纯度检验
SDS-PAGE 检测纯度结果(图8)显示,粗提和透析后IgY 的重链(约70 ku)和轻链(约25 ku)都较明显,透析后的杂带比粗提少,抗体纯度高。

图8 E.coli-HuNHY19 菌株卵黄抗体的SDS-PAGE 检测
2.9 抗原、IgY 浓度的测定
用Bradford 法测得标准曲线的结果见图9。结果表明,牛血清白蛋白在范围内线性关系良好。测得抗原的OD为2.365,计算出抗原浓度为2.596 mg/mL。首免后7、14、19、49、56 d 各组卵黄抗体蛋白含量最高值分别出现在Ⅴ组(1.153 mg/g 卵黄)、Ⅳ组(1.427 mg/g 卵黄)、Ⅰ组(1.006 mg/g 卵黄)、Ⅳ组(1.428 mg/g卵黄)、Ⅲ组(1.462 mg/g 卵黄)。各组卵黄抗体含量在首免后19 d 均出现大幅下降,而在首免后49 d 呈上升趋势(图10)。
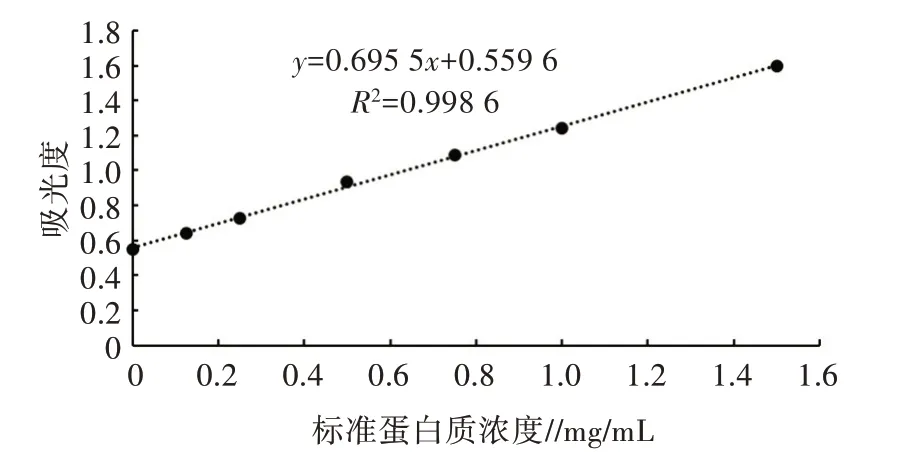
图9 Bradford 法测定蛋白含量标准曲线

图10 各组卵黄抗体含量的消长规律
2.10 抗体效价检测
首免后21 d蛋鸡血样中Ⅳ组效价最高,为1∶16;其次是Ⅰ组,效价为1∶4;Ⅱ组、Ⅴ组效价均为1∶2;Ⅲ组效价为1∶1。首免后35 d 蛋鸡血样中Ⅰ组、Ⅱ组、Ⅲ组和Ⅳ组效价均为1∶4;Ⅴ组和Ⅵ组效价均为1∶2。首免后49 d蛋鸡血样中Ⅰ组效价最高,为1∶8;其次是Ⅳ组,效价为1∶4;Ⅱ组和Ⅴ组效价为1∶2;Ⅲ组和Ⅵ组效价为1∶1(图11)。首免后49 d Ⅳ组蛋鸡卵黄抗体可与8 倍稀释抗原(0.209 mg/mL)特异性结合,效价达1∶4。

图11 各组蛋鸡血清抗体效价变化
3 讨论
本试验通过病例进行细菌学诊断,成功分离得到一株形态特征、生化特性均与大肠杆菌相符[17-19]的细菌。随着中国养猪业集约化发展,猪源产肠毒素大肠杆菌的致病性越来越强。由于ETEC 所带的毒力基因与致病性密切相关,因此检测细菌的毒力基因是确定致病性大肠杆菌常用方法。本试验检测出分离菌携带elt 和estb 两种毒力因子,与葛晨玲等[20]对广西地区ETEC 毒力基因的研究结果相同。刘玉芹等[21]对河北地区ETEC 毒力基因的研究结果显示,40 株分离菌全部含有肠毒素ST。不同地区ETEC 的毒力基因主要是肠毒素,可初步判定造成该规模猪场仔猪腹泻的主要致病原因是产肠毒素大肠杆菌。
目前,国内外对猪源大肠杆菌的耐药性已有大量研究。如黄琴[22]对猪源大肠杆菌(83 株)耐药性的研究结果显示,菌株对复方新诺明的耐药率接近100%;与本试验关于分离菌对复方新诺明的耐药结果不同。本试验药敏结果显示分离菌对复方新诺明和部分β-内酰胺类药物敏感,对头孢曲松、多黏菌素B 中介,对多西环素、呋喃唑酮以及多种氨基糖苷类和喹诺酮类抗菌药物耐药。García-Meniño等[23]对西班牙工厂化养猪场(2005—2017 年)的186 个致泻性大肠杆菌抗生素耐药率的研究显示,50%以上的分离菌株对氯霉素、庆大霉素、环丙星沙不敏感。赵位等[24]对野猪源大肠杆菌耐药性的研究结果与本研究相符,均对部分β-内酰胺类、四环素类药物耐药。大肠杆菌药敏结果不同的原因可能是不同时期、不同地区流行使用的抗菌药物不同;也可能是用药不规范,导致细菌耐药性增强。耐药菌的产生和扩散使得获取最新抗菌物质变得更加迫切。当前猪场大肠杆菌的耐药性已经非常普遍,应引起高度重视。
本研究采用全菌体灭活和超声波破碎灭活两种方法制备大肠杆菌灭活疫苗。由于不同佐剂与同一免疫原配伍所制的疫苗,产生的抗体存在差异[25]。本试验将上述两种方法制备的灭活抗原分别与ISA 71VG、ISA 201VG、ISA 15AVG 3 种不同类型的油性佐剂配伍。通过对各组蛋鸡产蛋率差异的比较,ISA 71VG 佐剂对蛋鸡产蛋率影响较小、波动相对稳定。SDS-PAGE 检测结果显示,透析前后IgY 重、轻链条带均明显,杂蛋白占比低,说明抗体结构完整、纯度高。通过对各组卵黄抗体含量消长规律的分析,首免后19 d 各组卵黄抗体的蛋白含量均呈现出下降后上升的趋势,可能是由于首免激活了蛋鸡的初次免疫应答,血液中抗体经过潜伏期才能转移至卵黄,在高峰期后抗体量下降;而后蛋白含量上升是由于二免激活了机体的再次免疫应答,迅速产生大量抗体。首免后56 d 0.2%甲醛处理的菌液与ISA 15AVG 配伍所致疫苗的卵黄抗体含量最高(1.462 mg/g 卵黄),超声波破碎处理的菌液与ISA 71VG 配伍所制疫苗的卵黄抗体含量次之(1.459 mg/g 卵黄),但该结果并不能反映出特异性卵黄抗体的含量,仍需结合各组抗体的效价对各组疫苗的免疫效果进行综合判断。
在相同佐剂配伍的条件下,比较不同灭活抗原对抗体效价的影响。ISA 71VG 佐剂配伍下,超声波破碎组和全菌体灭活组的血清抗体效价分别在首免后21 d 和49 d 达到最高峰,前者最高效价达1∶16,后者最高效价为1∶8。超声波破碎组抗体效价呈下降趋势,但整体效果优于全菌体灭活组,其抗体效价的强度高于全菌体灭活组,但持久度低于全菌体灭活组。这可能是超声波破碎使抗原的内含物释放,所制备的疫苗能够迅速刺激机体识别并产生免疫反应。随着时间的延长,破碎后的抗原比全菌体灭活抗原可能更易于分解、吞噬,因此其抗体效价持久度不如后者。ISA 201VG、ISA 15AVG 佐剂配伍下,全菌体灭活抗原免疫原性均高于超声波破碎抗原。在同种灭活抗原配伍的条件下,比较不同佐剂对抗体效价的影响。无论采用全菌体灭活法还是超声波破碎法制备灭活抗原,ISA 71VG 组的血清抗体效价的强度、持久度均高于ISA 201VG 组和ISA 15AVG 组。因此,综合蛋鸡应激反应、产蛋率及抗体效价等指标,ISA 71VG 佐剂免疫效果最佳,与韩涛涛等[26]的研究结果相符。

