超声造影、剪切波弹性成像和增强CT检查诊断肝细胞癌价值分析*
陈启全,李晓婷,杨勋祎,王 翔
原发性肝癌(PLC)发病率在我国癌症中排第4位,死亡率排第2位[1]。肝癌发病隐匿,进展迅速,且大部分患者存在肝硬化背景,发现肿瘤时往往已处于中晚期。因此,尽早定性诊断肝肿瘤具有重要的临床意义。超声造影(CEUS)可敏锐、直观地显示肝肿瘤血流灌注特点,在肝肿瘤定性诊断方面日益被广泛应用,其诊断价值也逐渐得到认可,被认为是继增强CT(contrast-enhanced CT, CECT)/磁共振成像(MRI)后又一强有力的影像学诊断手段[2]。剪切波弹性成像(SWE)是新兴的超声诊断技术,它基于声辐射力脉冲(ARFI)原理测量组织杨氏模量值,定量评估组织硬度[3]。已有研究表明,肝占位性病变性质与组织硬度相关。SWE可为肝肿瘤定性诊断提供有用的信息[4]。CT检查仍是肝肿瘤定性诊断的主要手段之一[5]。本研究探讨了CEUS联合SWE诊断PLC的价值,旨在为肝肿瘤的定性诊断提供更多依据。
1 资料与方法
1.1 病例来源 2020年6月~2022年6月我院诊治的肝占位性病变患者128例,男73例女55例;平均年龄为(59.3±8.4)岁。纳入患者存在不同程度的肝硬化,术前行CEUS、SWE和CT检查发现有肝占位性病变,结节直径为12~40 mm,平均为(26.8±5.9)mm。排除标准:其他脏器肿瘤、对造影剂过敏、存在严重的心肺肝肾功能不全、妊娠或哺乳期妇女。本研究经我院医学伦理委员会审核,患者签署知情同意书。
1.2 影像学检查 使用SIEMENS Definition AS 64排CT和碘海醇、PHILIPS EPIQ7和TOSHIBA Aplio500彩超诊断仪,C5-1和PVT-375BT凸阵探头(1.0~5.0 MHz)和(1.0~6.0 MHz,配备有SWE功能)和声诺维造影剂(SonoVue)。CT检查∶先行全肝平扫,随后静脉注射碘海醇1.5 ml.kg-1(2.5~3.5 ml/s),在30 s、60 s和120 s后分别行动脉期、门脉期和延迟期扫描。参照《现代全身CT诊断学》[6]作出诊断;CEUS检查:先行全肝常规超声扫查,随后静脉注射SonoVue混悬液2.4 ml,实时观察病灶灌注情况。CEUS诊断肝癌标准[7]:病灶在动脉期呈高增强,门脉期或延迟期廓清;SWE检查:使用二维超声清晰显示病灶最佳切面,选择SWE模式,使图像稳定在5~6帧时,采集并存储,记录杨氏模量最大值(Emax)。SWE诊断肝癌的标准[8]:Emax≥39.60 kPa。
1.3 病理学检查 取手术后组织或穿刺细胞学检查,作出病理学诊断。

2 结果
2.1 病理学诊断情况 在本组128例肝占位性病变患者中,病理学检查诊断肝细胞癌(HCC)72例,良性结节56例(肝硬化再生结节39例,肝海绵状血管瘤17例)。
2.2 CEUS诊断情况 两组CEUS检查动脉期、门脉期和延迟期增强程度具有显著性差异(P<0.05);79.2%HCC组呈“快进快出”表现,81.9%动脉期呈高增强, 62.5%门脉期呈低增强,79.2%延迟期呈低增强;80.4%良性病变呈“慢进慢出”表现,44.6%动脉期、76.8%门脉期和80.4%延迟期为等增强;CEUS诊断的敏感性为83.3%(60/72),特异性为87.5%(49/56),准确性为85.2%(109/128),阳性预测值为89.6%(60/67),阴性预测值为80.3%(49/61,表1)。
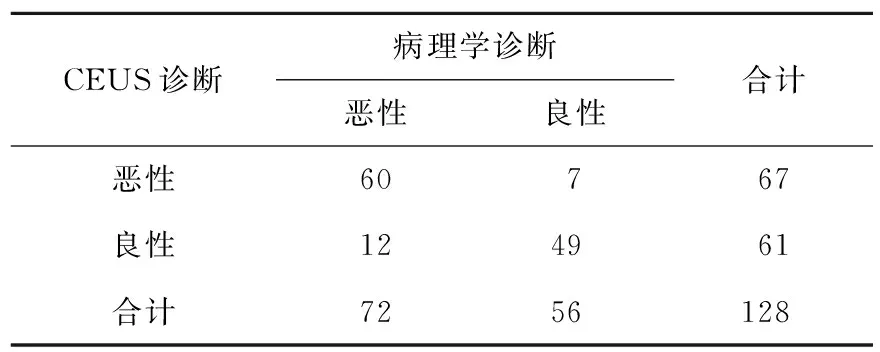
表1 CEUS诊断结果
2.3 SWE诊断情况 HCC组Emax为(42.5±7.1)KPa,显著高于良性组[(36.3±6.5)KPa,t=5.064,P<0.01];以Emax≥39.6 KPa为诊断恶性病变的截断点,SWE诊断的敏感性为79.2%(57/72),特异性为76.8%(43/56),准确性为78.9%(101/128),阳性预测值为81.4%(57/70),阴性预测值为74.1%(43/58,表2)。
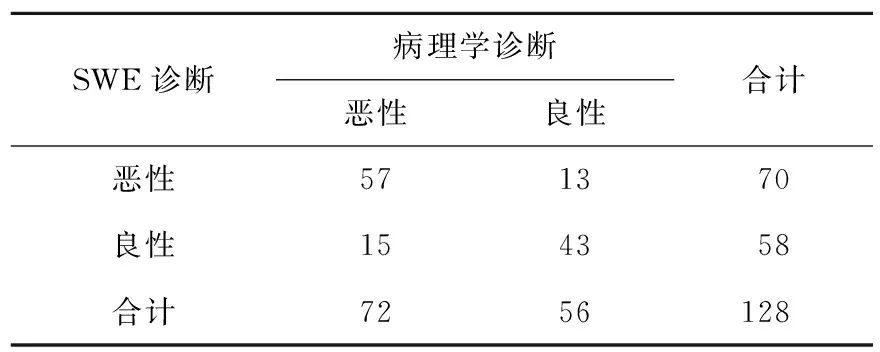
表2 SWE诊断结果
2.4 CT诊断情况 两组病灶增强CT检查动脉期、门脉期和延迟期增强程度具有显著性差异(P<0.05); 77.8%HCC病灶呈“快进快出”表现,83.3%动脉期呈高增强,59.7%门脉期呈低增强,77.8%延迟期呈低增强;82.1%良性病变呈“慢进慢出”表现,42.9%动脉期、78.6%门脉期和82.1%延迟期均为等增强;CT诊断的敏感性为77.8%(56/72),特异性为87.5%(49/56),准确性为82.0%(105/128),阳性预测值为88.9%(56/63),阴性预测值为75.4%(49/65,表3)。
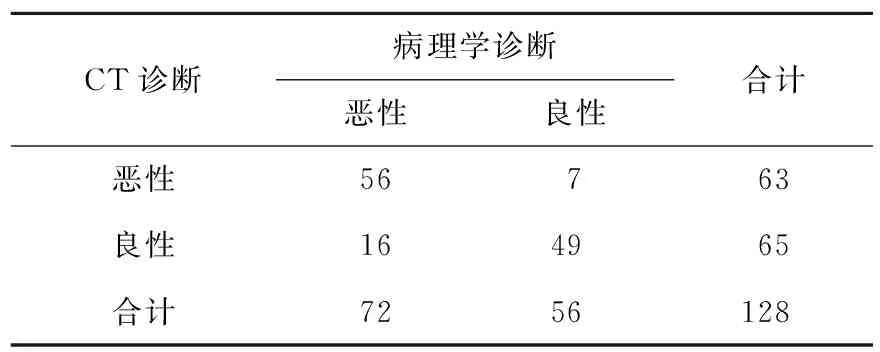
表3 CT诊断结果
3 讨论
肝癌具有高发病率和高致死率。早期诊断和治疗对改善预后具有重要的意义。随着影像学技术的持续快速发展,非侵入性影像学检查手段成为诊断肝占位性病变良恶性性质的主要手段。
超声检查是鉴别诊断肝肿瘤最常用的影像学手段,但常规超声仅可描述病灶的形态学特征,恶性病灶与良性病灶存在交叉重叠现象,已远远不能满足临床诊断的要求[9]。CEUS是能分辨血流分布特征的诊断技术,能清晰地观察肿瘤的血流灌注特征,也越来越多地应用于肝肿瘤的定性诊断[10,11]。一般情况下,恶性肿瘤呈“快进快出”表现,而良性肿瘤呈“快进/慢进慢出”表现。因此,CEUS定性诊断的关键在于了解病灶在门脉期和延迟期的增强特点[12]。本研究显示,79.2%恶性组病变呈“快进快出”表现,81.9%动脉期呈高增强, 62.5%门脉期呈低增强, 79.2%延迟期呈低增强,但仍有部分结节在门脉期(36.1%)和延迟期(20.8%)呈等增强,表现为“快进慢出”。由于肝癌病理学类型不同,CEUS不同时期增强程度也存在差异,其中假腺管型为双重(肝动脉、门静脉)供血型,而实体型和梁索型则以肝动脉供血为主,均表现为“快进快出”。纤维硬化型为乏血供型,表现为“快进慢出”。本研究良性肿瘤为肝海绵状血管瘤,表现为血管腔呈囊性扩张和血窦形成,肝硬化再生结节以门静脉为主要供血血管,故在动脉期、门脉期和延迟期多呈“慢进慢出”。21.4%在动脉期呈高增强,考虑病灶以肝动脉为主要供血动脉有关。本研究显示,CEUS对肝肿瘤的定性诊断的敏感性为83.3%,特异性为87.5%,准确性为85.2%,具有很高的诊断效能,与既往研究报道结果[13,14]一致。
SWE是一种新型弹性成像技术,其应用的基础是不同病灶组织的构成及分化程度不同,基于ARFI原理获得的剪切波速度和量化的杨氏模量参数不同,能反映病灶的硬度,进而判断病灶的良恶性[15]。研究表明,Emax对肝脏局灶性病变具有较好的诊断效能[16]。因此,本研究采用Emax作为诊断HCC的依据,也取得一定的效果。本研究显示,恶性病灶Emax显著大于良性病灶,与有关研究结果一致17]。肝良性肿瘤主要病理学类型为肝海绵状血管瘤,由纤维组织和血管腔组成,且血窦血液含量高,故组织较软,其Emax较低,而肝癌病灶主要为致密的癌巢组织,可侵入周围组织,导致组织致密性增加,故组织较硬。有些肝癌病灶被SWE诊断为良性肿瘤,考虑可能与肿瘤细胞分化程度有关。低分化癌窦腔间隙少,癌细胞密度高。因此,相较于高分化癌,低分化癌的Emax相对较高[18]。有些良性肿瘤被诊断为恶性病灶,考虑其因肝硬化增生结节组织构成,间质结构较紧密,硬度值相对较高,易被误诊。
近年来,两种及两种以上影像学手段联合诊断是临床研究的热点。多项研究证实,相较于单一诊断方法,联合诊断可进一步降低漏诊和误诊率,提高占位性病灶的整体诊断效能[19,20]。本研究采用CEUS诊断,12例肝癌病灶增强表现不典型,被误诊为良性肿瘤,而采用SWE诊断,一些良性病灶因其硬度值较高,被诊断为恶性。
目前,CT和CEUS如同MRI一样,仍是定性诊断肝肿瘤的主要手段之一。CT和CEUS均以病灶血流信号和血流动力学表现为依据进行肿瘤定位和定性诊断[21]。恶性病灶在增强CT和CEUS检查时均表现为“快进快出”,分别占77.8%和79.2%,而良性病灶则表现为“慢进慢出”,分别占82.1%和80.4%,两者表现一致,与既往研究结果[22]相符。采用CEUS和SWE技术诊断,因无电离辐射,检查过程快捷、方便,具备良好的临床应用价值。在临床上,CT、超声和MRI均是良好的诊断肝占位性病变的方法,但科学选择,不过度检查,可使患者最大程度地获益。

