糖原合酶激酶3β抑制剂TDZD-8对急性肝衰竭小鼠肝组织炎症的保护作用研究*
张丹眉,石春霞,陈 倩,张璐懿,张清奇,邹旭晨,龚作炯
急性肝衰竭(acute liver failure, ALF)是一种致死率高、缺乏有效的治疗措施、预后差的严重临床综合征,常伴有高胆红素血症、凝血功能障碍和肝性脑病。脂多糖(lipopolysaccharides,LPS)联合D-氨基半乳糖(D-galactosamine,D-Gal)诱导的ALF模型与人类肝功能衰竭相近,被广泛用于探索肝功能衰竭的发生机制和治疗药物研究[1]。过度的炎症反应和细胞自噬失调是ALF发生的重要致病机制。肝脏损伤激活炎症机制,促进细胞因子,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白介素-1β(interleukin-1β,IL-1β)等释放,进一步加重肝脏损伤,导致肝功能障碍[2]。自噬在ALF的发病过程中起着基础性预防功能,激活自噬可以抑制促炎因子的产生,改善肝损伤[3]。多种细胞广泛表达糖原合酶激酶3β(glycogen synthase kinase 3β,GSK3β),后者在静息时处于活性状态,而其第9位丝氨酸被磷酸化后其活性被抑制,参与细胞增殖和分化等各种生理活动[4]。多种研究显示,活化的GSK3β能够激活核因子-κB(nuclear factor kappa-B,NF-κB),提高转录因子IRF3的活性,从而促进炎症因子的合成和释放[5],促进炎症反应。此外,GSK3β可以通过多种通路抑制自噬通量,促进疾病进展[6]。目前,有研究应用GSK3β抑制剂TDZD-8通过激活自噬,减轻肾脏缺血再灌注损伤,同时可以降低NF-κB的活性[7]。抑制GSK3β活性也可减轻PM2.5诱导的支气管炎症,缓解症状[8]。然而,针对TDZD-8对ALF影响及其作用机制尚不完全清楚。本实验采用LPS联合D-Gal诱导ALF小鼠模型,观察到TDZD-8的保护作用,并采用蛋白印迹(Western blot,WB)等方法检测炎症因子和自噬相关蛋白表达,探索了可能的保护机制,为防治ALF进行了新的探索。
1 材料与方法
1.1 动物、药物与试剂 24只8周龄雄性无特定病原体级C57BL/6小鼠(购自湖南斯莱克景达实验动物有限公司),体质量约为20~25 g; D-Gal和LPS购自美国Sigma-Aldrich公司; TDZD-8购自美国MCE公司;定量荧光检测游离双链DNA(cell free-DNA,cf-DNA)试剂盒购自美国赛默飞公司;检测小鼠TNF-α和IL-1β的ELISA试剂盒和检测丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆红素(TBIL)的生化试剂盒购自上海江莱生物科技有限公司;抗IL-1β抗体、抗Beclin抗体购自英国Abcam公司;抗IL-18、抗ULK1、抗P62和抗GAPDH抗体购自武汉三鹰公司。
1.2 ALF动物模型的制备 取24只小鼠,随机分为三组,每组8只。TDZD-8处理组:给予小鼠TDZD-8 2 mg. kg-1腹腔注射,预处理。2 h后,给予D-Gal 400 mg.kg-1和LPS 100 μg.kg-1腹腔注射,制备ALF模型;模型组:先给予小鼠等量0.9%氯化钠注射液腹腔注射,2 h后腹腔注射相同剂量的D-Gal和LPS,制备ALF模型;对照组:于两个阶段分别给予小鼠腹腔注射等量0.9%氯化钠注射液。造模后24 h处死小鼠,收集血清和肝组织,-80℃冻存。取肝组织0.3 cm × 0.4 cm,于4%多聚甲醛溶液中固定,石蜡包埋,切片、HE染色,光镜下观察。
1.3 肝组织匀浆细胞因子检测 取肝组织,匀浆,5000 r/m离心15 min,取上清,采用ELISA法测定TNF-α和IL-1β水平。
1.4 血生化及cf-DNA测定 常规检测血生化指标;采用荧光染料法检测血清cf-DNA含量。
1.5 肝组织UNC-51样激酶1 ( UNC-51-like kinase 1, ULK1)、Beclin1、P62、IL-1β和IL-18蛋白检测 采用蛋白免疫印迹法检测,将收集的组织取黄豆大小称量,按照1 g组织15 ml裂解液的比例加入蛋白裂解液,提取组织蛋白质。用BCA法测定蛋白含量,以每孔30 μg蛋白含量调整蛋白浓度,加入上样缓冲液后100℃煮沸10 min,每孔等量上样,电泳后转膜,室温下5%脱脂奶粉封闭1 h,加入一抗4℃摇床孵育过夜。而后TBST洗膜,室温孵育荧光二抗1 h,用TBST洗膜,使用Odyssey仪器扫描,分析计算各指标的相对表达量。
2 结果
2.1 各组小鼠肝组织病理学改变 对照组小鼠肝小叶结构正常,肝细胞无明显变性、坏死或炎症细胞浸润;模型组和TDZD-8组有不同程度的肝损伤表现,模型组损伤更为严重,可见明显的小叶内充血、肝组织结构紊乱和肝细胞变性、坏死及炎症细胞浸润;TDZD-8处理组小鼠肝组织仍有少量的损伤表现,但其程度明显较模型组改善(图1)。
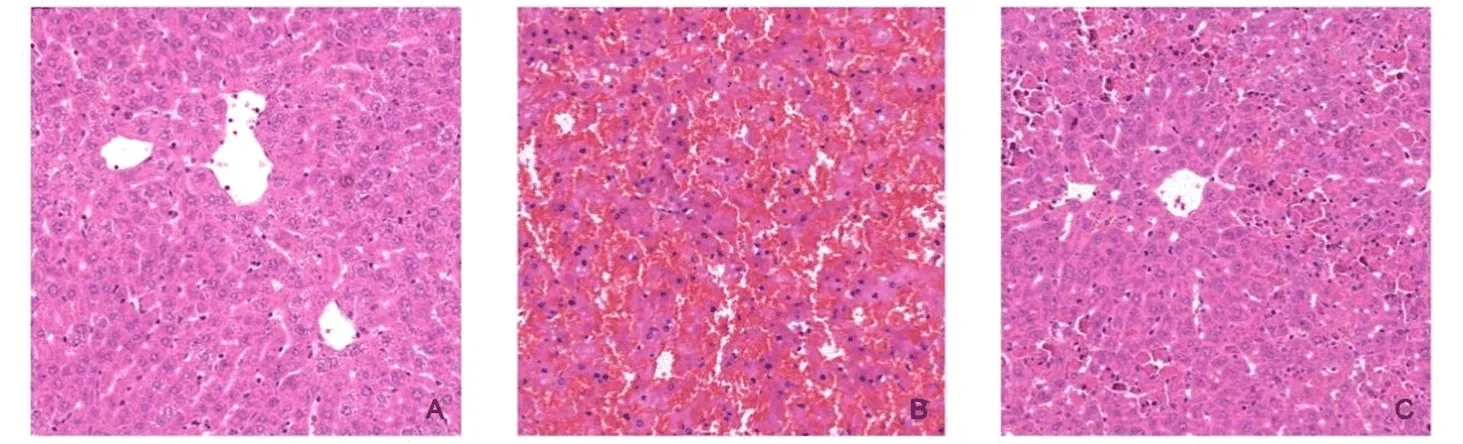
图1 小鼠肝组织病理学表现(HE, 200×)A:对照组;B:模型组;C:TDZD-8处理组
2.2 各组小鼠血生化指标比较 模型组血清ALT、AST和TBIL水平显著高于对照组(P<0.05),而TDZD-8处理组小鼠血清肝功能指标较模型组均有显著的降低(P<0.05,表1)。

表1 各组小鼠血生化指标比较
2.3 各组血清和肝组织匀浆炎症指标变化比较 模型组小鼠血清cf-DNA以及肝匀浆TNF-α和IL-1β水平显著高于对照组(P<0.05),而经TDZD-8处理后,这些指标水平均较模型组显著降低,差异有统计学意义(P<0.05,表2)。

表2 各组血清和肝组织匀浆炎症指标比较
2.4 三组肝组织细胞因子相对表达量比较 模型组IL-18和IL-1β相对表达量较对照组显著增强(#P<0.05),而TDZD-8处理组小鼠蛋白相对表达量较模型组显著减弱(*P<0.05,图2A、2B)。
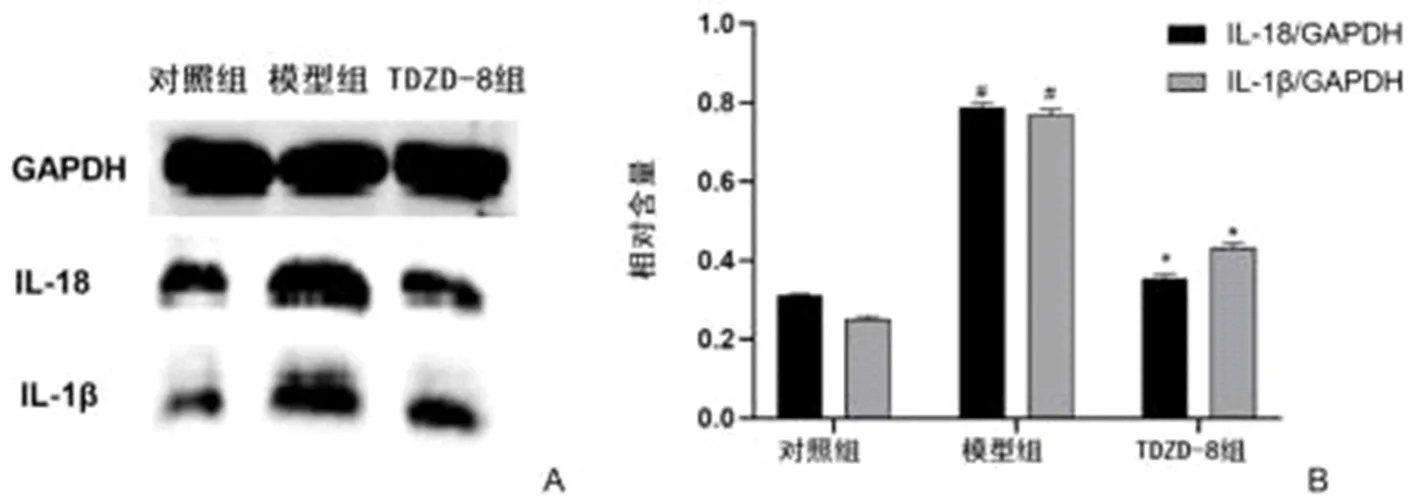
图2 三组肝组织细胞因子表达情况 与对照组比,#P<0.05;与模型组比,*P<0.05
2.5 三组肝组织ULK1、Beclin1和P62相对表达量比较 模型组肝组织ULK1和Beclin1相对表达量均显著低于对照组(*P<0.05),而P62蛋白表达显著高于对照组(#P<0.05),经TDZD-8处理,肝组织ULK1和Beclin1相对表达量显著高于模型组,而P62蛋白表现显著降低(*P<0.05,图3)。
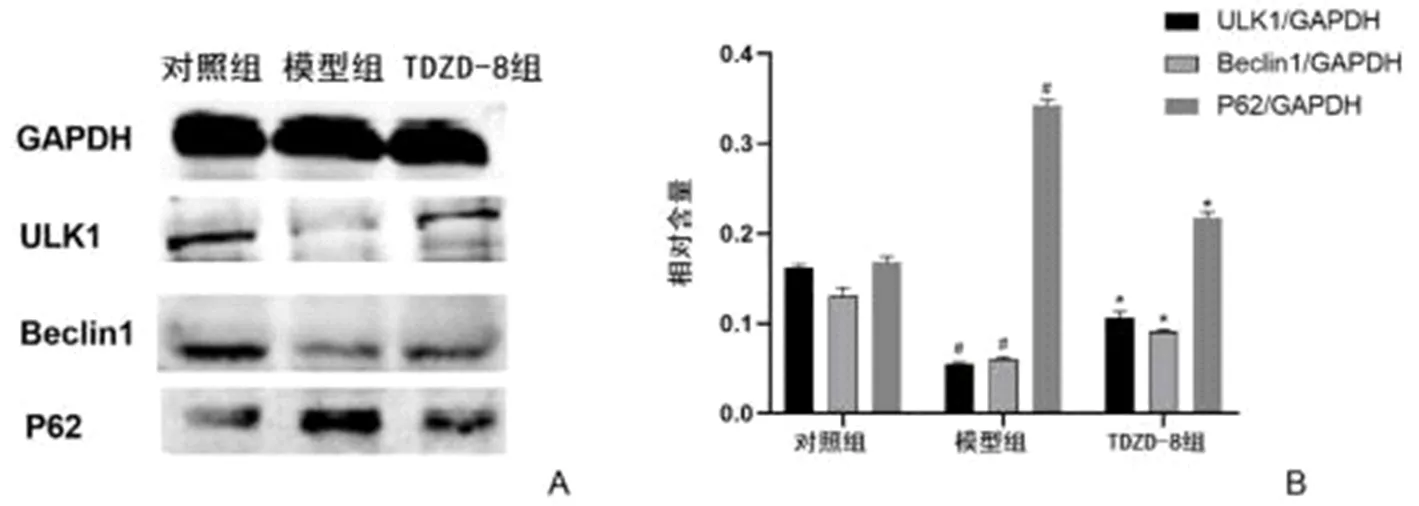
图3 各组肝组织ULK1、Beclin1和P62相对表达量比较 与对照组比,#P<0.05;与模型组比,*P<0.05
3 讨论
作为GSK3两种亚型之一的GSK3β,是在哺乳动物组织细胞广泛分布的丝氨酸/苏氨酸蛋白激酶。在细胞静息时,其处于活性状态,能磷酸化多种底物,调节细胞增殖、分化、凋亡等多种生理过程。同时,与肿瘤、炎症等疾病密切相关[9],能够通过调节PI3K/AKT信号通路[5]、与AMPK相互作用[10]等通路促进细胞凋亡、加重炎症反应、抑制自噬产生等加重疾病进展。非ATP竞争性GSK3β抑制剂,TDZD-8被显示有损伤保护、抗炎症和抗氧化应激等功能。TDZD-8通过磷酸化GSK3β第9位丝氨酸而抑制其活性,并通过抑制炎症反应和氧化应激等方式起到损伤保护作用。在大鼠慢性肾移植模型,TDZD-8能抑制GSK3β活性,通过抑制NF-κB激活和巨噬细胞浸润等而改善肾功能、减少蛋白尿,减少肾损伤[11,12]。实验发现,TDZD-8处理组小鼠肝组织充血、炎细胞浸润和细胞骨架破坏都有所缓解,血清ALT、AST、TBIL水平有明显的下降,提示GSK3β抑制剂TDZD-8具有一定的肝脏保护功能,能缓解肝损伤。
ALF的发生伴随着炎症反应的过度激活。有研究显示,NF-κB通路和NLRP3炎症小体形成在ALF进展过程中发挥重要作用。NF-κB是激活产生各种促炎因子,如IL-1β的关键转录因子,能抑制NF-κB的转录活性,缓解ALF动物肝损伤[13]。同样地,NLRP3炎症小体的激活能促进半胱氨酸天冬氨酸蛋白酶-1(cysteinyl aspartate specific proteinase-1,caspase-1)的激活,切割炎症因子IL-1β和IL-18的前体,生成具有活性的IL-1β和IL-18,促进炎症反应和细胞死亡[14]。cf-DNA被认为是损伤的组织和凋亡坏死细胞分泌的核酸片段,以低水平状态存在于正常健康个体。在异常细胞死亡损伤的疾病时,如癌症、创伤、炎症性疾病等,大量核酸从坏死细胞释放到血流,以致cf-DNA水平显著升高。cf-DNA已成为衰老、组织损伤和细胞应激的有希望的生物标志物。有研究显示,血浆cf-DNA水平与非酒精性脂肪肝、乙型肝炎和肝细胞癌等多种肝病相关,有望成为新型的非侵入性标志物。在肝细胞癌,cf-DNA水平也与肝脏炎症程度相关,在一定程度上能够反映肝脏的炎症损伤[15]。本实验结果显示,模型组无论是IL-1β和IL-18还是TNF-α和cf-DNA水平均较对照组升高。有研究显示在狼疮肾炎小鼠,应用TDZD-8抑制GSK3β活性可以通过抑制NLRP3炎症体的激活,下调IL-1β等炎症因子的产生,而缓解肾损伤[16]。在本实验,经TDZD-8处理的小鼠炎症因子水平均有所降低,可能是通过抑制GSK3β活性,继而抑制NF-κB转录活性和NKRP3炎症小体的激活。GSK3β抑制剂可能是通过激活过氧化物酶体增殖激活受体(PPARα)而抑制NF-κB通路的。
自噬是一种溶酶体介导的细胞内分解代谢的过程。在细胞应激状态下,如营养缺乏、缺氧等时,自噬被激活,移除受损的细胞器以维持细胞稳态、防止细胞损伤和支持细胞生存[17]。同时,自噬也可以分解老化的细胞器或折叠错误的蛋白质,维持能量平衡。自噬过程包括自噬的诱导启动、自噬小体形成和自噬小体与溶酶体的融合。ULK1被认为是启动自噬的主要成分之一。ULK1的激活能促进自噬程序的启动[18]。转录因子EB(transcription factor EB,TFEB)正向调解自噬和溶酶体基因的转录,其活性受GSK3β等分子的调节[19]。P62蛋白是目前广泛研究的自噬相关底物。在细胞自噬诱导时,P62蛋白在细胞中聚集。相反,自噬水平抑制时,P62蛋白水平也会下降。AKT、AMPK和PPARα等信号分子参与调解自噬程序的启动,并与GSK3β之间相互影响,涉及多条信号通路。抑制GSK3β活性被认为能够通过多种方式促进自噬产生和溶酶体酸化,参与损伤的保护过程。在乙型肝炎病毒引起的急性肝衰竭患者也观察到自噬通量的下降[20]。正如本研究结果显示,模型组自噬标志蛋白ULK1和Beclin1水平均较对照组降低,但P62蛋白在模型组明显升高,而经GSK3β抑制剂处理后,自噬水平较对照组明显升高,说明抑制GSK3β后可以逆转ALF动物自噬抑制状态,可能通过自噬通路减轻肝脏炎症,改善肝脏损伤。同样地,在肾缺血再灌注损伤动物,应用GSK3β抑制剂TDZD-8能够通过激活自噬水平而上调水通道蛋白1表达[7],而起到缓解肾损伤的作用。利益冲突 所有作者均声明不存在利益冲突。

