超声弹性成像评估自身免疫性肝炎患者肝纤维化分期价值分析*
朱 琳,陈 洋,杨 青,刘俊启
自身免疫性肝炎(autoimmune hepatitis,AIH)是因自身免疫功能紊乱而引起的慢性肝病。AIH多伴有不同程度的肝纤维化,临床常通过长期药物治疗来延缓肝脏病变进程。由于肝纤维化程度与患者治疗效果和预后密切相关,因而明确患者肝纤维化分期将有助于临床诊疗方案的合理制定,改善预后[1,2]。肝组织活检是目前临床普遍用于评估肝病患者肝纤维化分期的金标准,但该检查具有侵入性,可能存在取样误差[3]。天冬氨酸氨基转移酶与血小板比值指数(aspartate aminotransferase to platelet ratio index,APRI)等指标是临床评估慢性肝病患者肝纤维化分期的常用指标[4]。随着影像学技术的成熟发展,超声弹性成像(ultrasound elasticity,UE)逐渐应用于临床诊断。UE属于声触诊组织量化技术,是一种新型超声诊断方法,可为临床提供病灶区域组织弹性或硬度的有效定量信息,以此反映病变组织病理学特性,对乳腺、甲状腺、前列腺等相关疾病诊断具有重要的参考价值[5-7]。我们采用UE检测了AIH患者的肝脏,以分析其诊断肝纤维化分期的价值。
1 资料与方法
1.1 病例来源 2017年3月~2022年3月我院诊治的AIH患者58例,男性9例,女性49例;年龄为36~62岁,平均年龄为(49.3±8.7)岁。AIH诊断符合《自身免疫性肝炎诊断和治疗共识(2015年)》标准[8]。排除标准:(1)药物性、病毒性、酒精性、脂肪性、遗传代谢性肝病;(2)肝癌或合并其他恶性肿瘤;(3)有肝移植或腹部手术史。本研究符合《赫尔辛基宣言》及其附录准则中伦理学要求,患者签署知情同意书。
1.2 UE检查 使用法国声科声蓝超声诊断仪,4C1探头,频率为2.5~7.5 MHz。入组患者检查前均禁食水12 h,取仰卧位,充分暴露肋间隙。嘱患者检查期间屏住呼吸,选择右侧肋间斜冠状切面,取肝包膜下2 cm右肝实质区域,避开肝脏内大血管和胆管,以10 mm×5 mm窗口为感兴趣区,待图像稳定后发射脉冲,获得病灶处剪切波速度(shear wave velocity,SWV),连续检测5次,取均值。
1.3 肝穿刺活检 在日本东芝 Aplio500彩色超声诊断仪引导下,使用美国巴德16 G全自动活检枪获取长度≥1.5 cm的肝组织,经固定、石蜡包埋、切片、HE染色,使用日本奥林巴斯公司提供的CX23光学显微镜下观察。采用METAVIR标准进行肝纤维化分期评估,无纤维化为F0期,汇管区纤维化但无纤维间隔形成为F1期,汇管区纤维化伴少数纤维间隔形成为F2期,间隔纤维化为F3期,早期肝硬化为F4期。将≤F1期为无肝纤维化,≥F2期为显著性肝纤维化。
1.4 血清学指标检测 采用间接免疫荧光法检测血清抗核抗体、抗平滑肌抗体、抗可溶性肝抗原抗体、抗肝肾微粒体抗体-1型和抗肝细胞溶质抗原抗体-1型(德国欧蒙公司);使用南京贝登医疗股份有限公司提供的全自动生化分析仪检测血生化指标;使用日本东亚公司生产的血液分析仪检测血小板计数(platelet count,PLT),计算APRI=[(AST(U/L)/AST正常值上限(U/L)×100/PLT(×109/L)][9]。
2 结果
2.1 AIH患者肝纤维化分期情况 在58例AIH患者中,肝组织病理学检查发现F0期7例(12.1%)、F1期15例(25.9%)、F2期17例(29.3%)、F3期13例(22.4%)和F4期6例(10.3%),即无显著肝纤维化22例(37.9%),显著性纤维化36例(62.1%)。
2.2 不同肝纤维化分期的AIH患者一般资料比较 显著性肝纤维化组SWV和APRI显著高于,而血小板计数显著低于无显著肝纤维化组(P<0.05,表1)。

表1 不同肝纤维化分期患者一般资料比较
2.3 各指标评估AIH患者显著性肝纤维化的效能情况 经ROC分析,PLT计数、APRI和SWV评估AIH患者显著性肝纤维化具有较高的应用价值,其中以SWV的效能最高(P<0.05,表2、图1)。

表2 各指标评估AIH患者显著性肝纤维化的价值分析
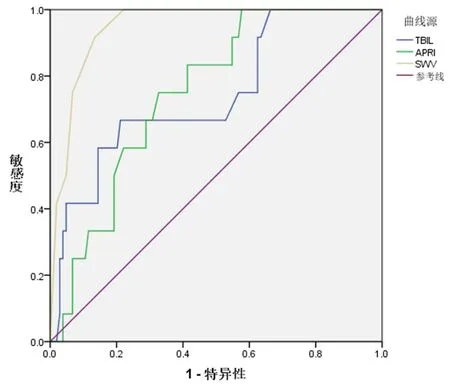
图1 各指标评估AIH患者显著性肝纤维化的ROC曲线
3 讨论
AIH发病机制尚未完全明确,普遍认为其发病是由于病原微生物、药物或遗传等因素共同造成的机体自身免疫系统紊乱,导致肝内炎症反应和肝纤维化,主要特点为血清自身抗体阳性,组织学上主要表现为界面性肝炎[10]。目前,我国AIH发病率尚无准确的数据,但随着自身抗体检测和肝穿刺活检的广泛开展,临床报道的AIH发病数正呈逐年上升的趋势[11]。治疗AIH的目标是患者得到病情和肝组织学缓解,但由于AIH起病隐匿,诊断较难。若不及时干预,肝内炎症加重易导致肝纤维化,甚至发展为肝硬化或肝功能衰竭等严重威胁患者生命[12]。研究显示,肝组织学完全缓解较未完全缓解者有更高的肝纤维化逆转率和长期生存率[13]。因此,准确评估、动态监测AIH患者肝纤维化程度对疾病治疗及预后评估有重要的意义。
无创性定量诊断肝纤维化一直是临床研究的热点。有研究发现,血小板计数和APRI可以反映肝细胞实质性损伤和胆汁淤积情况。随着慢性肝病患者肝纤维化程度的加重,肝细胞发生变性、坏死,造成肝脏门体分流,导致肝脏胆汁酸代谢异常,APRI显著升高[14,15]。对比分析不同肝纤维化分期的慢性乙型肝炎患者血清AST和APRI后发现,F2~F4期患者AST和APRI显著高于F0~F1期患者[16]。APRI与肝纤维化程度呈正相关,APRI异常升高提示AIH患者肝纤维化进展严重[17]。另有研究显示,肝活检检查结果与APRI在判断AIH患者肝硬化方面具有一致性[18]。本研究显著性肝纤维化患者血小板计数和APRI显著高于非显著肝纤维化患者,与以往研究结果类似。除血清学指标外,影像学检查手段也逐渐被应用于AIH患者肝纤维化评估。UE属于新型影像学评估手段,其可弥补肝活检难以动态观察肝纤维化进展的不足[19]。随着患者纤维化程度不断进展,最终在弹性成像上表现为组织产生位移、应变或速度分布改变,通过图像处理对组织内部弹性模量进行分析可评价组织内部的相应情况,其在探测生物体组织硬度特性方面有较高的应用价值[20]。本研究显示,显著性肝纤维化患者SWV显著高于无肝纤维化患者,这一指标变化与肝纤维化病理学变化特点相符合。在肝纤维化病变过程中,各种致病因素导致肝实质炎症甚至肝细胞坏死,造成肝内纤维结缔组织异常增生,星状细胞被过度激活而产生大量的胶原成分,与其他细胞外基质一起沉积于肝内,肝脏胆汁酸代谢发生障碍,加重肝纤维化,肝脏实质硬度也明显增加[21]。采用UE技术评估103例AIH患者肝纤维化程度发现,UE参数与组织学纤维化分期有显著的相关性[22],与本研究结果类似。
国外研究表明,UE诊断肝硬化具有较高临床应用价值,但是否可以作为评估AIH患者肝纤维化严重程度的手段尚不明确[23]。本研究经ROC分析发现,采用APRI和SWV诊断AIH患者显著性肝纤维化的AUC分别为较高,其敏感度和特异度也较好,提示这些指标评估AIH患者肝纤维化分期的价值较高。血小板和APRI可反映肝纤维化程度,肝组织发生广泛炎症时,细胞外基质沉积、降解,导致血小板计数下降和APRI升高,而基质纤维化可致肝组织硬度增加,UE检测参数则直接反映肝脏组织硬化程度,在相同病理学分期情况下,肝窦毛细血管化的改变滞后于肝组织纤维化时实质硬度的变化[24]。也有研究表明,在临床病情稳定或早期肝纤维化患者,其血清学指标保持相对稳定或呈低水平,用其诊断肝纤维化可能会出现偏差,而采取UE技术检测则不受患者肥胖体质、腹腔积液、肝脏脂肪变性等的影响,检测的SWV的稳定性更为可靠[25]。因此,相较于血小板计数,采用APRI和SWV评估AIH患者肝纤维化分期的诊断效能更佳。

