川陈皮素对急性肾损伤大鼠的改善作用及机制研究
耿永芝 杨利 李国伟 张金涛 程晓磊 檀立端
摘要:目的 探究川陈皮素(NOB)通过调节沉默信息调节因子1(SIRT-1)/叉头框转录因子O3a(FOXO3a)通路介導的自噬对急性肾损伤(AKI)大鼠的改善作用及其机制。方法 采用一次性腹腔注射顺铂(20 mg/kg)的方法构建AKI大鼠模型。将60只SPF级SD雄性大鼠采用随机数字表法分为对照组(Control组)、AKI模型组(Model组)、低剂量NOB组(NOB-L组,200 mg/kg)、高剂量NOB组(NOB-H组,400 mg/kg)和高剂量NOB+SIRT-1抑制剂EX527组(NOB-H+EX527组,400 mg/kg NOB+5 mg/kg EX527),每组12只。末次给药后收集大鼠24 h尿液,检测24 h尿微量白蛋白含量、尿N-乙酰-β-D-氨基葡萄糖甘酶(NAG)含量和尿β2微球蛋白(β2-MG)含量;酶联免疫吸附试验(ELISA)检测大鼠血清中尿素氮(BUN)、血肌酐(Scr)和肾脏中超氧化物歧化酶(SOD)、丙二醛(MDA)水平;HE染色观察大鼠肾小管组织病理变化;TUNEL染色法检测肾小管细胞凋亡;实时荧光定量PCR(qPCR)法检测大鼠肾脏组织中SIRT1和FOXO3a mRNA表达;Western blot检测大鼠肾脏组织中SIRT1/FOXO3a通路和自噬相关蛋白的表达。结果 与Control组相比,Model组大鼠肾脏组织病理损伤严重,24 h尿微量白蛋白、尿NAG、尿β2-MG、血BUN、血Scr、肾小管损伤评分、肾脏MDA水平、细胞凋亡率升高,肾脏SOD水平、SIRT1/FOXO3a通路和自噬相关蛋白表达降低(P<0.05);与Model组相比,NOB-L组和NOB-H组大鼠肾脏组织病理损伤减轻,24 h尿微量白蛋白、尿NAG、尿β2-MG、血BUN、血Scr、肾小管损伤评分、肾脏MDA水平、细胞凋亡率降低,肾脏SOD水平、SIRT1/FOXO3a通路和自噬相关蛋白表达升高(P<0.05)。结论 NOB可能通过激活SIRT-1/FOXO3a通路,促进自噬,进而改善大鼠的AKI。
关键词:川陈皮素;急性肾损伤;顺铂;自噬相关蛋白质类;SIRT-1/FOXO3a
中图分类号:R285.5文献标志码:ADOI:10.11958/20221287
Study on the improvement effect and mechanism of nobiletin on rats with acute kidney injury
GENG Yongzhi YANG Li LI GuoweiZHANG Jintao CHENG Xiaolei TAN Liduan
1 Department of Emergency, Chengde Central Hospital, Chengde 067000, China; 2 Department of General Surgery,
Kuancheng Manchu Autonomous County Hospital
Corresponding Author E-mail: ceinf60@163.com
Abstract: Objective To investigate the ameliorating effect and mechanism of nobiletin (NOB) by regulating the autophagy mediated by silent information regulator 1 (SIRT-1)/forkhead box transcription factor O3a (FOXO3a) pathway in rats with acute kidney injury (AKI). Methods A rat model of AKI was established by a one-time intraperitoneal injection of cisplatin (20 mg/kg). Sixty SPF SD male rats were randomly grouped by random number table into the control group, the AKI model group (model group), the low-dose NOB group (NOB-L group, 200 mg/kg), the high-dose NOB group (NOB-H group, 400 mg/kg) and the high-dose NOB+SIRT-1 inhibitor EX527 group (NOB-H+EX527 group, 400 mg/kg NOB+5 mg/kg EX527), with 12 rats in each group. The 24-hour urine of rats was collected after the last administration. The 24-hour urine microalbumin content, urine N-acetyl-β-D-glucosaminidase (NAG) content and urinary β2-microglobulin (β2-MG) content were detected. The serum levels of urea nitrogen (BUN) and creatinine (Scr), levels of superoxide dismutase (SOD) and malondialdehyde (MDA) in kidney were detected by enzyme-linked immunosorbent assay (ELISA). HE staining was used to observe the pathological changes of renal tubules. TUNEL staining was applied to observe the apoptosis of rat kidney tissue. SIRT1 and FOXO3a mRNA expression levels in rat kidney tissue were measured by qPCR. Western blot assay was applied to detect the expression of SIRT1/FOXO3a pathway and autophagy-related proteins in rat kidney tissue. Results Compared with the control group, there was severe renal tissue pathological injury in the model group, and the 24 h urine microalbumin content, urine NAG, urine β2-MG, BUN, Scr, renal tubular injury score, renal MDA level and apoptosis rate were obviously increased. The renal SOD level, SIRT1/FOXO3a pathway and autophagy-related protein expression were obviously decreased (P<0.05). Compared with the model group, the pathological injury of kidney tissue was reduced in the NOB-L group and the NOB-H group, and the 24 h urine microalbumin content, urine NAG, urine β2-MG, BUN, Scr, renal tubular injury score, renal MDA level and apoptosis rate were obviously decreased. The renal SOD level, SIRT1/FOXO3a pathway and autophagy-related protein expression were obviously increased (P<0.05). Conclusion NOB may promote autophagy by activating the SIRT-1/FOXO3a pathway, thereby improving acute kidney injury in rats.
Key words: nobiletin; acute kidney injury; cisplatin; autophagy-related proteins; SIRT-1/FOXO3a
急性肾损伤(AKI)是一种肾功能快速下降的临床综合征,其表现为肾小球滤过率下降,血清肌酐(Scr)快速升高、尿量减少[1-2]。持续的AKI可能进一步导致慢性肾脏病甚至终末期肾病,并伴随高发病率和高病死率,严重危害患者生命健康[3]。引起AKI的因素主要有肾实质性病变、梗阻性肾病、感染、药物性因素等[4]。顺铂作为一种常见的抗肿瘤药物,经机体代谢后易在肾皮质中堆积,造成肾毒性,导致肾损伤,是临床应用顺铂的主要问题之一[5]。顺铂所致AKI使机体存在自噬缺陷,从而造成一系列氧化应激、炎症反应、线粒体功能障碍和凋亡等[6]。川陈皮素(NOB)又称蜜桔黄素,是从中药陈皮中提取的一类黄酮类化合物,其具有抗血栓、抗炎、抗氧化、抗癌等作用[7]。武俊紫等[8]发现NOB对糖尿病肾病大鼠具有治疗作用。但NOB是否对AKI大鼠的肾脏组织具有保护作用,目前鲜有报道。研究发现,调节沉默信息调节因子1/叉头框转录因子O3a(SIRT-1/FOXO3a)通路在氧化应激、凋亡、自噬等病理生理过程中发挥重要作用,能参与调控线粒体自噬,维持细胞稳态[9]。但其在AKI中的作用尚不清楚。本研究通过建立AKI大鼠模型,研究NOB对大鼠AKI的改善作用和机制。
1 材料与方法
1.1 实验动物 60只8周龄SPF级雄性SD大鼠,体质量180~220 g,购自广东维通利华实验动物技术有限公司,动物生产许可证号:SCXK(粤)2022-0063。动物饲养于通风实验室,室温(25±2)℃,保持湿度40%~60%,动物自由进食、饮水。适应性饲养1周后用于实验。本研究已得到承德市中心医院动物伦理委员会的批准。
1.2 主要试剂及仪器 NOB(纯度>98%)购自百灵威科技有限公司;Trizol试剂、RIPA裂解液、顺铂购自美国Sigma-Aldrich公司;SIRT-1抑制剂EX527购自美国Selleck公司;BCA蛋白定量试剂盒购自美国Invitrogen公司;考马斯亮蓝购自成都艾科达化学试剂有限公司;尿素氮(BUN)和Scr试剂盒、BCA蛋白定量试剂盒购自武汉博士德生物工程有限公司;TUNEL染色试剂盒购自英国Abcam公司;尿β2微球蛋白(β2-MG)酶联免疫吸附试验(ELISA)试剂盒购自上海博湖生物科技有限公司;兔抗鼠尿N-乙酰-β-D-氨基葡萄糖甘酶(NAG)、兔抗鼠微管相关蛋白1轻链3-Ⅰ(LC3-Ⅰ)、微管相关蛋白1轻链3-Ⅱ(LC3-Ⅱ)、Beclin-1、SIRT1、FOXO3a蛋白一抗及羊抗兔二抗购自Cell Signaling Technology公司;超氧化物歧化酶(SOD)、丙二醛(MDA)ELISA试剂盒购自Abcam公司;兔抗鼠GAPDH抗体购自杭州贤至生物有限公司。UVP Gelstudio PLUS touch凝胶成像仪购自德国耶拿公司;JC-1086A酶标仪购自青岛聚创环保集团;病理切片机(RM 2016)购自德国Leica公司;实时荧光定量PCR仪(型号7500)购自美国应用生物系统公司。
1.3 研究方法
1.3.1 AKI模型建立与分组 采用随机数字表法抽取48只大鼠,参照文献[5]方法,构建顺铂致大鼠AKI模型。大鼠进行一次性腹腔注射顺铂(20 mg/kg),造模24 h后,大鼠BUN和Scr水平≥造模前2倍,提示AKI造模成功。将造模成功的48只大鼠采用随机数字表法分为AKI模型组(Model组)、低剂量NOB组(NOB-L组,200 mg/kg)、高剂量NOB组(NOB-H组,400 mg/kg)和高剂量NOB+EX527组(NOB-H+EX527组,400 mg/kg NOB+5 mg/kg EX527)[10],每组12只。余12只大鼠为对照组(Control组),注射与顺铂等量的生理盐水。造模各組大鼠24 h后开始灌胃给药,每日1次,共3 d。Control组和Model组灌胃与NOB等量的生理盐水。
1.3.2 24 h尿微量白蛋白、NAG和β2-MG水平检测 末次给药后使用代谢笼收集各组大鼠24 h尿液,使用考马斯亮蓝色法测定24 h尿微量白蛋白;按试剂盒说明书操作测定尿液NAG和β2-MG水平。
1.3.3 ELISA法检测大鼠血清中BUN和Scr水平 末次给药后,所有大鼠予1%戊巴比妥腹腔注射进行麻醉,取大鼠腹主动脉血液。收集血液后于4 ℃放置4 h,3 000 r/min低温离心10 min,取上层血清。处死所有大鼠,摘取肾脏,切去左肾肾小管部分使用4%多聚甲醛进行组织固定,剩余肾脏组织保存在液氮中。根据ELISA试剂盒说明书检测各组大鼠血清BUN和Scr水平。
1.3.4 HE染色观察大鼠肾小管组织病理学变化 将1.3.3中固定的肾脏组织经脱水、包埋、切片(厚度5 μm)后进行HE染色,中性树脂封片,在光学显微镜下观察肾脏组织的病理学变化并拍照。每张切片随机读取10个视野进行肾小管损伤评分。评分标准如下[11]:0分,无损伤;1分,轻度损伤(如出现单细胞或片状的孤立损伤);2分,中度损伤(损伤面积≤25%);3分,重度损伤(25%<损伤面积≤50%);4分,极重度损伤(损伤面积>50%)。取每张切片10个视野的总分均值为该组的肾小管损伤评分。
1.3.5 TUNEL染色检测肾小管细胞凋亡 将肾小管组织切片经烤片过夜、脱蜡脱水后加入50 μL 3%过氧化氢以清除内源性过氧化物酶;室温孵育30 min后用PBS洗涤3次,每次5 min;滴加50 μL TUNEL反应液,避光孵育60 min,PBS洗涤3次,每次5 min;加入POD转换液50 μL避光孵育30 min,PBS洗涤3次,每次5 min;加入DAB底物显色,用苏木精复染,中性树胶封片。在光学显微镜下观察肾小管细胞凋亡情况。采用Image J软件统计细胞数量,计算细胞凋亡率。细胞凋亡率(%)=凋亡细胞数/细胞总数×100%。
1.3.6 ELISA法检测大鼠肾脏组织中的SOD和MDA水平 取冻存的肾小管组织加入冰生理盐水后充分匀浆,3 500 r/min离心10 min,取上清液按试剂盒说明书测定SOD和MDA含量。
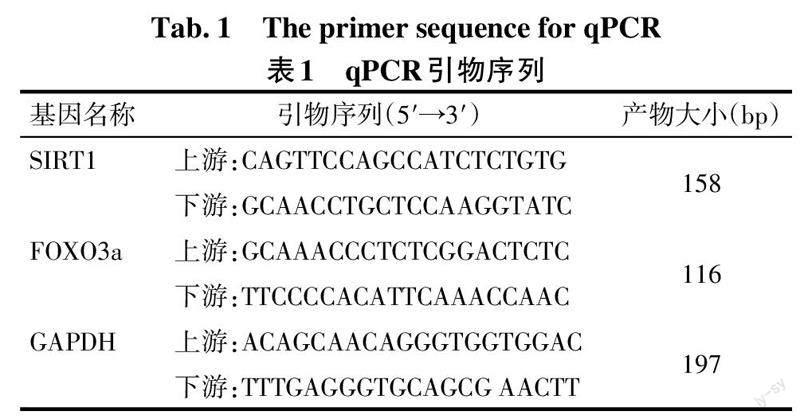
1.3.7 实时荧光定量PCR(qPCR)法检测肾脏组织中SIRT1和FOXO3a mRNA表达 取1.3.3中的肾小管组织,加入Trizol液提取总RNA,将其反转录为cDNA,将cDNA放于荧光定量PCR仪中进行扩增。引物由上海生工生物工程有限公司合成,序列见表1。反应体系共20 μL:cDNA模板2 μL,上、下游引物各0.5 μL,2×Go Taq qPCR Master Mix 10 μL,ddH2O补至20 μL。反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火40 s,72 ℃延伸30 s,共计40个循环。2-ΔΔCt相对定量法计算SIRT1、FOXO3a mRNA相对表达量,用内参GAPDH对其进行标准化。
1.3.8 Western blot检测肾脏组织中SIRT1/FOXO3a通路和自噬相关蛋白表达 取肾小管组织加入RIPA裂解液提取总蛋白,利用BCA法对蛋白进行定量。取50 μg蛋白经10%的SDS-PAGE分离后,转膜,3%室温封闭,加入稀释的一抗SIRT1(1∶1 000)、FOXO3a(1∶5 000)、LC3-Ⅱ(1∶1 000)、LC3-Ⅰ(1∶1 000)、Beclin-1(1∶1 000)、GAPDH(1∶1 000),4 ℃下孵育过夜。次日复温,洗膜,加入相应二抗(1∶5 000),于37 ℃孵育1.5 h,TBS洗膜3次,每次10 min,用Odyssey成像系统进行显色并分析数据。
1.4 统计学方法 采用SPSS 25.0软件进行数据分析,计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结果
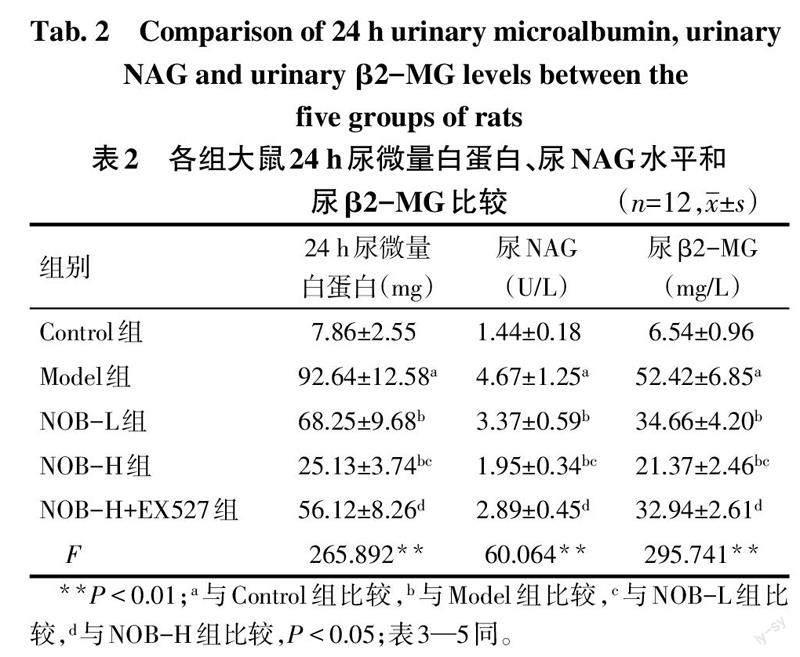
2.1 各组大鼠24 h尿微量白蛋白、NAG和尿β2-MG的表达水平比较 与Control组相比,Model组大鼠24 h尿微量白蛋白量、尿NAG和尿β2-MG水平升高(P<0.05);与Model组相比,NOB-L组和NOB-H组大鼠24 h尿微量白蛋白量、尿NAG和尿β2-MG水平下降(P<0.05);与NOB-L组相比,NOB-H大鼠的24 h尿微量白蛋白量、尿NAG和尿β2-MG水平下降(P<0.05);与NOB-H组相比,NOB-H+EX527组大鼠24 h尿微量白蛋白量、尿NAG和尿β2-MG水平升高(P<0.05)。见表2。
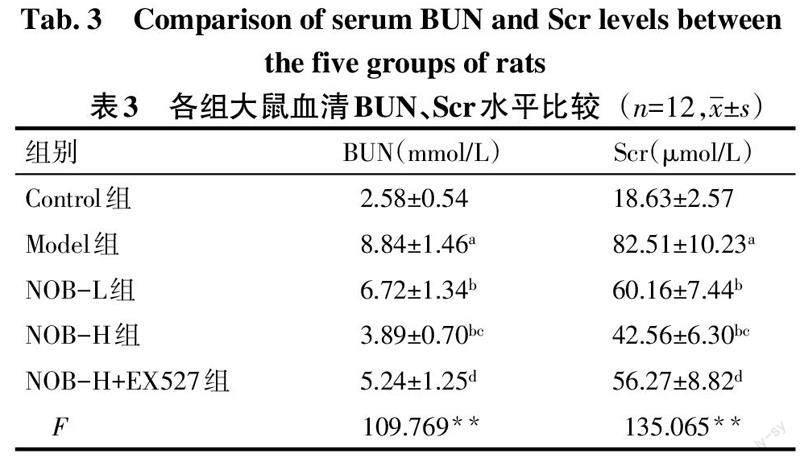
2.2 各组大鼠血清中BUN和Scr水平的比较 与Control组相比,Model组大鼠血清BUN、Scr水平升高(P<0.05);与Model组相比,NOB-L组、NOB-H组大鼠血清BUN、Scr水平下降(P<0.05);与NOB-L组相比,NOB-H组大鼠血清BUN、Scr水平下降(P<0.05);与NOB-H组相比,NOB-H+EX527组大鼠血清BUN、Scr水平升高(P<0.05)。见表3。
2.3 各组大鼠的肾小管组织病理学变化与肾小管损伤评分 HE染色显示,Control组大鼠肾小管细胞排列整齐,结构清晰,无明显病理学变化;Model组大鼠肾小管细胞排列紊乱,肾小管扩张,可见坏死性细胞脱落,有大量炎性细胞浸润;与Model组相比,NOB-L组和NOB-H组大鼠的肾小管损伤有所减轻,细胞结构有所恢复,细胞坏死减少,炎性细胞浸润减轻;与NOB-H组相比,NOB-H+EX527组肾小管病理损伤加重,细胞坏死性脱落增多,炎性细胞浸润增多。见图1。Control组、Model组、NOB-L组、NOB-H组、NOB-H+EX527组肾小管损伤评分分别为(0.00±0.00)、(3.78±0.38)、(2.50±0.53)、(1.82±0.33)和(2.60±0.70)分,差异有统计学意义(n=10,F=59.180,P<0.05)。与Control组相比,Model组大鼠肾小管损伤评分升高(P<0.05);与Model组相比,NOB-L组、NOB-H组大鼠肾小管损伤评分降低(P<0.05);与NOB-L组相比,NOB-H组大鼠肾小管损伤评分降低(P<0.05);与NOB-H组相比,NOB-H+EX527组大鼠肾小管损伤评分升高(P<0.05)。
2.4 各组大鼠肾脏组织凋亡情况 Control组、Model组、NOB-L组、NOB-H组、NOB-H+EX527组细胞凋亡率(%)分别为2.56±0.69、18.47±2.77、14.36±1.52、6.68±0.74和12.30±1.08,差异有统计学意义(n=12,F=208.029,P<0.05)。与Control组相比,Model组大鼠细胞凋亡率升高(P<0.05);与Model组大鼠相比,NOB-L组、NOB-H组大鼠细胞凋亡率降低(P<0.05);与NOB-L组大鼠相比,NOB-H组大鼠肾脏细胞凋亡率降低(P<0.05);与NOB-H组相比,NOB-H+EX527组大鼠肾脏组织细胞凋亡率升高(P<0.05)。见图2。
2.5 各组大鼠肾脏组織中SOD和MDA水平比较 与Control组相比,Model组大鼠肾脏SOD含量减少,MDA含量增加(P<0.05);与Model组相比,NOB-L、NOB-H组大鼠肾脏SOD含量增加,MDA含量减少(P<0.05);与NOB-L组相比,NOB-H组大鼠肾脏SOD含量增加,MDA含量减少(P<0.05);与NOB-H组相比,NOB-H+EX527组大鼠肾脏中SOD含量减少,MDA含量增加(P<0.05)。见表4。
2.6 各组大鼠肾脏组织中SIRT1、FOXO3a mRNA表达水平比较 与Control组相比,Model组大鼠肾脏组织中SIRT1、FOXO3a mRNA表达水平降低(P<0.05);与Model组相比,NOB-L和NOB-H组的大鼠肾脏组织中SIRT1、FOXO3a mRNA表达水平升高(P<0.05);与NOB-L组相比,NOB-H组大鼠肾脏组织中SIRT1、FOXO3a mRNA表达水平升高(P<0.05);与NOB-H组相比,NOB-H+EX527组大鼠肾脏组织中SIRT1、FOXO3a mRNA表达水平降低(P<0.05)。见表4。
2.7 各組大鼠肾脏组织中SIRT1/FOXO3a通路和自噬相关蛋白表达比较 与Control组相比,Model组大鼠肾脏组织SIRT1、FOXO3a、LC3-Ⅱ/LC3-Ⅰ、Beclin-1蛋白表达降低(P<0.05);与Model组相比,NOB-L组和NOB-H组大鼠肾脏组织的SIRT1、FOXO3a、LC3-Ⅱ/LC3-Ⅰ、Beclin-1蛋白表达升高(P<0.05);与NOB-L组相比,NOB-H组大鼠肾脏组织的SIRT1、FOXO3a、LC3-Ⅱ/LC3-Ⅰ、Beclin-1蛋白表达升高(P<0.05);与NOB-H组相比,NOB-H+EX527组大鼠肾脏组织SIRT1、FOXO3a、LC3-Ⅱ/LC3-Ⅰ、Beclin-1蛋白表达降低(P<0.05)。见表5、图3。
3 讨论
AKI的发病率在许多国家持续升高,且患者出现心肌梗死、心力衰竭等严重并发症的风险增加[12]。药物性因素引起肾损伤是AKI的主要病因之一。目前对于顺铂导致的AKI还缺乏有效治疗药物,因此研究其病理机制,有助于药物开发。本研究结果显示,Model组大鼠24 h尿微量白蛋白、尿NAG、尿β2-MG、血清BUN、Scr水平显著高于Control组,肾脏组织出现肾小管结构紊乱、扩张,可见细胞坏死性脱落,并存在炎性浸润,达到AKI诊断标准[13],说明顺铂诱导的AKI大鼠模型建立成功。
NOB是从芸香科植物村橘中提取的一种多甲氧基黄酮类中药单体,药理作用广泛[14]。杨榆青等[15]研究发现,NOB能减少糖尿病肾病大鼠24 h尿微量白蛋白,降低BUN和Scr,降低肾脏转化生长因子-β和Smad2的表达,保护糖尿病肾病的肾脏损害。Malik等[16]研究发现,NOB主要通过抗氧化、抗炎和抗凋亡作用改善顺铂诱导的AKI。本研究结果显示,与Model组大鼠相比,NOB-L组和NOB-H组大鼠24 h尿微量白蛋白、尿NAG、尿β2-MG、血清BUN、Scr水平、肾小管损伤评分、肾脏MDA、肾脏组织细胞凋亡率显著低于Model组,肾脏组织中SOD水平显著高于Model组,HE染色观察到肾脏组织的病理损伤有所减轻,说明NOB对AKI大鼠的肾脏组织具有保护作用。
自噬是一种高度保守的细胞机制,它可以通过形成与溶酶体融合的自噬小体,非选择性或选择性地清除受损的蛋白质或者细胞器,使细胞免受营养剥夺、凋亡、炎症等不利因素,对细胞与组织起保护作用[17]。LC3、Beclin-1是自噬的关键性蛋白[18],而AKI与自噬密切相关[19]。本研究发现,与Model组相比,NOB-L组和NOB-H组LC3-Ⅱ/LC3-Ⅰ、Beclin-1蛋白表达显著升高,而肾小管损伤减轻,表明自噬可以影响顺铂诱导的AKI,但其作用机制尚不清楚。张驰昊等[20]研究发现虾青素可以通过上调PTEN诱导假定激酶1(PINK1)/Parkin信号通路来提高线粒体自噬水平,从而减轻大鼠对比剂诱导的AKI。李燕菊等[21]研究发现水飞蓟素可能通过调控腺苷酸活化蛋白激酶(AMPK)/SIRT1途径促进自噬,减轻大鼠AKI。本研究结果表明,NOB可提高AKI大鼠自噬水平并抑制细胞凋亡。
氧化应激是由过度的活性氧产生,导致细胞损伤的重要因素之一。研究表明,氧化应激反应能激活自噬途径,而自噬能保护心肌细胞、成骨细胞等免受氧化应激的损伤[22]。本研究结果显示,与Model组相比,NOB-L组、NOB-H组大鼠肾脏组织MDA水平显著降低,SOD水平显著升高,与上述自噬途径激活的表现相一致,说明氧化应激状态的表现能从一定程度反应细胞自噬途径的激活程度。
SIRT1是一类烟酰胺腺嘌呤二核苷酸(NAD+)依赖型去乙酰化酶,可以通过抑制下游靶蛋白FOXO乙酰化来调控炎症、凋亡等病理生理过程[23]。Liu等[24]发现虾青素可通过增加SIRT-1/FOXO3a表达,在体内外水平上减轻造影剂诱导的AKI。Dusabimana等[25]研究发现NOB能通过激活SIRT-1/FOXO3a通路,介导自噬和线粒体生物合成来改善肝缺血再灌注损伤。本研究结果显示,与Model组相比,NOB-L组和NOB-H组大鼠肾脏组织中SIRT-1、FOXO3a mRNA和蛋白表达升高,推测NOB可能通过激活SIRT-1/FOXO3a通路来减轻顺铂诱导的AKI。为了验证此猜想,笔者利用SIRT1抑制剂EX527来干预高剂量NOB处理的AKI大鼠,结果发现EX527降低NOB对AKI大鼠肾脏的保护作用。
综上所述,NOB可能通过激活SIRT-1/FOXO3a通路,减轻顺铂诱导的AKI大鼠的肾损伤。本研究只是初步探索了NOB对AKI的作用机制,对自噬中相关炎症小体和其他通路分子的具体作用尚不明确,还需进一步探究。
参考文献
[1] KELLUM J A,ROMAGNANI P,ASHUNTANTANG G,et al. Acute kidney injury[J]. Nat Rev Dis Primers,2021,7(1):52. doi:10.1038/s41572-021-00284-z.
[2] RONCO C,BELLOMO R,KELLUM J A. Acute kidney injury[J]. Lancet,2019,394(10212):1949-1964. doi:10.1016/S0140-6736(19)32563-2.
[3] LEVEY A S,JAMES M T. Acute kidney injury[J]. Ann Intern Med,2017,167(9):ITC66-ITC80. doi:10.7326/AITC201711070.
[4] WANG S W,XU Y,WENG Y Y,et al. Astilbin ameliorates cisplatin-induced nephrotoxicity through reducing oxidative stress and inflammation[J]. Food Chem Toxicol,2018,114:227-236.
[5] PICKKERS P,OSTERMANN M,JOANNIDIS M,et al. The intensive care medicine agenda on acute kidney injury[J]. Intensive Care Med,2017,43(9):1198-1209. doi:10.1007/s00134-017-4687-2.
[6] HOLDITCH S J,BROWN C N,LOMBARDI A M,et al. Recent advances in models,mechanisms,biomarkers,and interventions in cisplatin-induced acute kidney injury[J]. Int J Mol Sci,2019,20(12):3011. doi:10.3390/ijms20123011.
[7] JAYAKUMAR T,LIN K C,LU W J,et al. Nobiletin,a citrus flavonoid,activates vasodilator-stimulated phosphoprotein in human platelets through non-cyclic nucleotide-related mechanisms[J]. Int J Mol Med,2017,39(1):174-182. doi:10.3892/ijmm.2016.2822.
[8] 武俊紫,姚政,熊光轶,等. 川陈皮素对糖尿病肾病大鼠的作用研究[J].中华中医药学刊,2020,38(8):117-121,270. WU J Z,YAO Z,XIONG G Y,et al. Effect of nobiletin on diabetic nephropathy rats[J]. Chinese Archives of Traditional Chinese Medicine,2020,38(8):117-121,270. doi:10.13193/j.issn.1673-7717.2020.08.029.
[9] 胡彦,王锁刚,翟琼瑶,等. 积雪草苷调控SIRT1-FOXO3-PINK1-Parkin通路介导的线粒体自噬保护肾缺血再灌注损伤的机制研究[J]. 天津医药,2021,49(11):1148-1153. HU Y,WANG S G,ZHAI Q Y,et al. The study of asiaticoside regulating SIRT1-FOXO3-PINK1-Parkin pathway-mediated protective mechanism of mitochondrial autophagy on renal ischemia-reperfusion injury[J]. Tianjin Med J,2021,49(11):1148-1153. doi:10.11958/20210354.
[10] 魏桂梅,任錕,赵璐,等. 薯蓣皂苷通过调控SIRT1-FoxO1-自噬通路减轻糖尿病大鼠胰岛素抵抗[J]. 中国病理生理杂志,2022,38(2):303-310. WEI G M,REN K,ZHAO L,et al. Dioscin attenuates insulin resistance in diabetic rats by regulating SIRT1-FoxO1-autophagy signaling pathway[J]. Chinese Journal of Pathophysiology,2022,38(2):303-310. doi:10.3969/j.issn.1000-4718.2022.02.014.
[11] FURUICHI K,WADA T,IWATA Y,et al. Administration of FR167653,a new anti-inflammatory compound,prevents renal ischaemia/reperfusion injury in mice[J]. Nephrol Dial Transplant,2002,17(3):399-407. doi:10.1093/ndt/17.3.399.
[12] FAULHABER-WALTER R,SCHOLZ S,HALLER H,et al. Health status,renal function,and quality of life after multiorgan failure and acute kidney injury requiring renal replacement therapy[J]. Int J Nephrol Renovasc Dis,2016,9:119-128. doi:10.2147/IJNRD.S89128.
[13] ROY J P,DEVARAJAN P. Acute kidney injury:Diagnosis and management[J]. Indian J Pediatr,2020,87(8):600-607. doi:10.1007/s12098-019-03096-y.
[14] 郑德冲. 川陈皮素通过改善自噬流逆转大鼠急性心肌梗死后心室重构的机制研究[D]. 广州:广州医科大学,2018. ZHENG D C. Nobiletin attenuates adverse cardiac remodeling after acutemyocardial infarction inrats via restoring autophagy flux[D]. Guangzhou:Guangzhou Medical University,2018. doi:10.7666/d.D01553006.
[15] 杨榆青,陈滟,陈学秋,等. TGF-β/Smads信号通路在川陈皮素治疗糖尿病肾病大鼠中的变化特点研究[J]. 长春中医药大学学报,2020,36(4):666-669. YANG Y Q,CHEN Y,CHEN X Q,et al. Study on the changes of TGF-β/smads signaling pathway in the treatment of diabetic nephropathy rats with nobiletin[J]. Journal of Changchun University of Chinese Medicine,2020,36(4):666-669. doi:10.13463/j.cnki.cczyy.2020.04.017.
[16] MALIK S,BHATIA J,SUCHAL K,et al. Nobiletin ameliorates cisplatin-induced acute kidney injury due to its anti-oxidant,anti-inflammatory and anti-apoptotic effects[J]. Exp Toxicol Pathol,2015,67(7/8):427-433. doi:10.1016/j.etp.2015.04.008.
[17] WU Y,YAO Y M,LU Z Q. Mitochondrial quality control mechanisms as potential therapeutic targets in sepsis-induced multiple organ failure[J]. J Mol Med (Berl),2019,97(4):451-462. doi:10.1007/s00109-019-01756-2.
[18] DIKIC I,ELAZAR Z. Mechanism and medical implications of mammalian autophagy[J]. Nat Rev Mol Cell Biol,2018,19(6):349-364. doi:10.1038/s41580-018-0003-4.
[19] CUI J,BAI X,CHEN X. Autophagy and acute kidney injury[J]. Adv Exp Med Biol,2020,1207:469-480. doi:10.1007/978-981-15-4272-5_34.
[20] 张驰昊,郑迪,张成,等. 虾青素通过上调PINK1/parkin通路增强线粒体自噬并减轻大鼠对比剂急性肾损伤[J]. 中国病理生理杂志,2022,38(8):1430-1439. ZHANG C H,ZHENG D,ZHANG C,et al. Astaxanthin enhances mitophagy through PINK1/parkin pathway to attenuate contrast-induced acute kidney injury in rats[J]. Chinese Journal of Pathophysiology,2022,38(8):1430-1439.
[21] 李燕菊,冯杰,赵婷,等. 水飞蓟素通过调控AMPK/SIRT1途径促进自噬并抑制凋亡减轻大鼠急性肾损伤[J]. 中国中西医结合肾病杂志,2022,23(1):11-15,96-97. LI Y J,FENG J,ZHAO T,et al. Silymarin promotes autophagy and inhibits apoptosis by regulating AMPK/SIRT1 pathway to reduce acute kidney injury in rats[J]. Chinese Journal of Integrated Traditional and Western Nephrology,2022,23(1):11-15,96-97. doi:10.3969/j.issn.1009-587X.2022.01.004.
[22] 米健國,乔荣勤,刘少津. 补肾健脾活血方干预骨质疏松模型大鼠骨代谢、氧化应激及自噬的变化[J]. 中国组织工程研究,2022,26(26):4147-4152. MI J G,QIAO R Q,LIU S J. Bushen Jianpi Huoxue Recipe improves bone metabolism,oxidative stress, and autophagy in osteoporotic rats[J].Chinese Journal of Tissue Engineering Research,2022,26(26):4147-4152.
[23] ZOU Z,LIU B,ZENG L,et al. Cx43 inhibition attenuates sepsis-induced intestinal injury via downregulating ROS transfer and the activation of the JNK1/Sirt1/FoxO3a signaling pathway[J]. Mediators Inflamm,2019,2019:7854389. doi:10.1155/2019/7854389.
[24] LIU N,CHEN J,GAO D,et al. Astaxanthin attenuates contrast agent-induced acute kidney injury in vitro and in vivo via the regulation of SIRT1/FOXO3a expression[J]. Int Urol Nephrol,2018,50(6):1171-1180. doi:10.1007/s11255-018-1788-y.
[25] DUSABIMANA T,KIM S R,KIM H J,et al. Nobiletin ameliorates hepatic ischemia and reperfusion injury through the activation of SIRT-1/FOXO3a-mediated autophagy and mitochondrial biogenesis[J]. Exp Mol Med,2019,51(4):1-16. doi:10.1038/s12276-019-0245-z.
(2022-08-18收稿 2022-09-28修回)
(本文编辑 李志芸)

