6种生物刺激素对水稻吸收氯虫苯甲酰胺的影响
周春丽, 万 群, 程金金, 蒋文奇, 刘嘉楠, 陆 顺, 张 国, 于居龙, 曹崇江, 余向阳
(1.中国药科大学工学院,江苏南京 211198; 2.江苏省农业科学院,江苏南京 210014;3.江苏丘陵地区镇江农业科学研究所,江苏句容 212400)
近年来,稻纵卷叶螟呈暴发性发生,严重危害水稻生产[1]。目前,防治稻纵卷叶螟的方法主要是喷雾[2-4]或施用氯虫苯甲酰胺颗粒剂[5-6]。此外,于居龙等的研究表明,使用氯虫苯甲酰胺处理水稻种子可以增强对稻纵卷叶螟的防治效果并且可长效防控稻纵卷叶螟,减少前期稻纵卷叶螟防治用药次数[1,7-9]。但是拌种处理水稻种子仍旧存在着一些问题:一方面是农药容易吸附在土壤中,使得大部分农药没有被植物的根系吸收,降低了农药的利用率[10];另一方面是田间水分对药剂有淋溶作用,使作物为实际靶标的有效利用率大幅度降低[11]。因此,提高农药的利用率,降低种子处理过程中农药使用量的问题亟待解决。
生物刺激素是一种激素类物质,具有促进种子萌发、提高作物品质、增强植物抵抗盐碱及病虫害的能力[12]。赤霉素是一种二萜类化合物和植物激素,可激活细胞分裂以及细胞增大过程,可以促进作物提前发芽[13],促进根系和茎的伸长[14];脱落酸能调控植物的多种生理活动,使用低浓度的脱落酸浸种水稻种子对秧苗生长有促进作用[15-16];复合氨基酸可以为作物提供多种氨基酸,促进作物合成蛋白质,促进作物的生长;亚精胺属于脂肪含氮物,杨安中等使用亚精胺浸种发现,亚精胺能提高水稻种子的发芽率[17];烯效唑浸种可提高稻苗光合效率,使用低浓度的烯效唑可以促进种子发芽[18-20];海藻酸钠是一种多糖类物质,张运红等研究发现,海藻酸钠可以缓解镉对水稻的毒害[21]。
有关生物刺激素与杀虫剂混配使用的研究较少。杨富军等研究发现,使用赤霉素与氯虫苯甲酰胺进行花生种子拌种处理之后,可以增加花生的防治效果[22]。此外生物刺激素与除草剂混配对除草剂也有增效作用,赤霉素可以增强草甘膦、苄嘧·唑草酮的作用,芸薹素内酯可以增强苄嘧·唑草酮的作用[23-24]。但有关生物刺激素与氯虫苯甲酰胺混配拌种处理影响水稻中氯虫苯甲酰胺含量的研究尚未见报道。因此,本试验以不添加生物刺激素为对照,研究6种生物刺激素(赤霉素、脱落酸、氨基酸、亚精胺、烯效唑、海藻酸钠)分别与氯虫苯甲酰胺的3个梯度浓度混配进行拌种,旨在研究不同混配组合对水稻吸收农药的影响,以期提高水稻吸收氯虫苯甲酰胺的能力,为水稻药剂拌种减药增效提供理论基础。
1 材料与方法
1.1 供试品种
供试水稻品种为南粳9108。
1.2 仪器与试剂
仪器:QTRAP 5500+液相色谱-质谱仪、AB 5500+高效液相色谱串联质谱仪(美国AB Sciex公司)、Kinetex F5色谱柱(100 mm×3.0 mm,2.6 μm,美国Phenomenex公司)、离心机(Centrifuge 5804 R,美国eppendorf公司)、干冰研磨机。
试剂:20%氯虫苯甲酰胺(CAP)悬浮剂(美国杜邦公司生产);氯虫苯甲酰胺标准品(纯度99.0%,德国Dr.Ehrenstorfer Gmbh公司);乙腈(色谱纯,上海麦克林生化科技有限公司);无水MgSO4(西陇科学股份有限公司);C18、PSA分析纯(分析纯,中国安谱公司);红色着色剂;赤霉素、脱落酸、氨基酸、亚精胺、烯效唑、海藻酸钠(上海源叶生物科技有限公司);6种生物刺激素使用浓度溶液的配制:赤霉素11 g/L、脱落酸1 g/L、氨基酸93.75 g/L、亚精胺14.525 g/L、烯效唑0.2 g/L、海藻酸钠 10 g/L)。
1.3 种子处理方法
以氯虫苯甲酰胺100%推荐量、75%推荐量和50%推荐量(最终氯虫苯甲酰胺药剂有效用量分别为2.0、1.5、1.0 g/kg种子)3个浓度拌种作为3个处理对照,以不拌药处理为空白处理,以氯虫苯甲酰胺(100%推荐量、75%推荐量或50%推荐量)+赤霉素/脱落酸/氨基酸/亚精胺/烯效唑/海藻酸钠作为试验处理。种子处理方法采用湿拌法,湿拌法参考于居龙等的拌种方法[1],称取44 kg的水稻种子,放入网袋在清水中将稻种浸泡48 h,沥干12 h,平均分成22份种子(每份相当于2 kg干种子)置于一次性自封袋中,其中1份不做任何处理。氯虫苯甲酰胺100%推荐量/75%推荐量/50%推荐量+赤霉素/脱落酸/氨基酸/亚精胺/烯效唑/海藻酸钠6个试验处理:分别量取20、15、10 g的20%氯虫苯甲酰胺,加入6种生物刺激素各10 mL于自封袋中,再加入红色着色剂。3个对照处理则以清水代替生物刺激素。各个处理在添加完药剂和试剂后快速晃动自封袋至整个袋子中种子出现均匀红色,即种子与药液、试剂已充分混匀,平铺于纸上,阴干后播种。
1.4 田间试验方法
试验于镇江市农业科学院农业科技创新中心基地进行。各处理的稻种播种在12个硬质塑料育秧盘(60 cm×30 cm×3.5 cm)中,2021年6月7日播种,6月20日大田移栽。各处理均设置3个重复小区,每个重复小区的移栽面积大于75 m2。用单泥埂将重复小区分开,用双泥埂将各处理隔开,各处理单独排灌,避免各处理之间的田水串流。各处理在播种后30、60、80、110 d取样,测定水稻植株中茎和叶组织中氯虫苯甲酰胺的残留量,并计算添加生物刺激素处理与未添加生物刺激素处理在水稻生长全周期中茎和叶组织中的氯虫苯甲酰胺残留量的变化量。茎和叶组织中氯虫苯甲酰胺的残留量变化率公式如下:
式中:C1为(100%、75%、50%推荐量+生物刺激素)氯虫苯甲酰胺残留量,mg/kg;C2为(100%/75%/50%推荐量)氯虫苯甲酰胺残留量,mg/kg。
1.5 氯虫苯甲酰胺LC-MS/MS分析检测方法
1.5.1 仪器方法 液相色谱条件:色谱柱为Kinetex F5色谱柱(100 mm×3.0 mm,2.6 μm),进样体积2 μL,柱温保持40 ℃;流动相为0.1%甲酸水溶液(A)和乙腈(B),流速为0.3 mL/min,梯度洗脱程序:0~1.0 min,20% B;1.0~2.0 min,20% B;2.0~3.0 min,85% B;3.0~4.0 min,100% B;4.0~5.0 min,100% B;5.0~6.0 min,20% B;6.0~7.0 min,20% B。
质谱条件:电喷雾离子源ESI,正离子模式,雾化气(N2)、辅助气(N2)为55 psi,离子源温度为 550 ℃,电喷雾电压为5.50 kV,定量定性离子对为484.0/453.0(m/z)。
1.5.2 试验方法 样本预处理:五点取样法每个处理取一定数量的水稻,取样后地上部分茎和叶组织分开处理,干冰研磨机研磨之后每个处理称取1 g样品,重复4次,加入乙腈5 mL提取,用移液枪移取1 mL上清液于加有无水MgSO4(0.15 g)、C18(0.025 g)和PSA(0.025 g)的2 mL离心管中,涡旋混匀30 s,8 000 r/min离心2 min,过0.22 μm滤膜,待LC-MS/MS测定。
1.5.3 标准曲线制作 用电子天平准确称取 0.01 g 的氯虫苯甲酰胺标准品于10 mL容量瓶中,用乙腈溶解配制成质量浓度为1 000 mg/L的标准液。以空白水稻的茎、叶提取液为基质液,用系列稀释法将1 000 mg/L标准液稀释至所需的质量浓度(0.001、0.005、0.01、0.05、0.1、0.5、1 mg/L),以质量浓度对峰面积作图,即得基质匹配标准溶液。
1.5.4 添加回收率的测定 分别称取茎空白样品1 g、叶空白样品1 g,茎、叶分别配制0.05、0.1、1 mg/L 3个添加水平,重复3次,按照“1.5.2”节的提取方法处理之后,用LC-MS/MS 进行测定,计算添加回收率。
利用Microsoft Excel 2010与Gradpaph Prism进行数据处理,所有数据处理均未经转换。
2 结果与分析
2.1 线性范围
从表1可以看出,在0.001~1 mg/L范围内,氯虫苯甲酰胺的浓度与仪器响应呈良好线性,r2≥0.996。
2.2 准确度和精密度
从表1可以看出,在水稻茎和叶基质中添加不同质量浓度的氯虫苯甲酰胺,平均回收率范围为83%~97%,相对标准偏差(RSD)为0.3%~4.4%。实验回收率和相对标准偏差符合农药残留分析的要求。
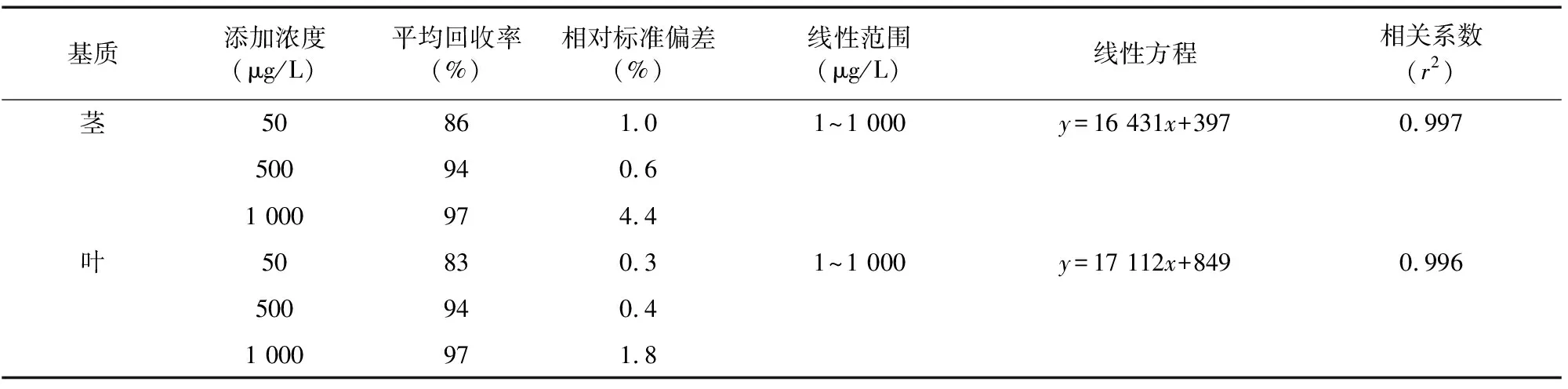
表1 氯虫苯甲酰胺在各基质的添加回收率
2.3 各处理水稻茎组织中氯虫苯甲酰胺的残留量
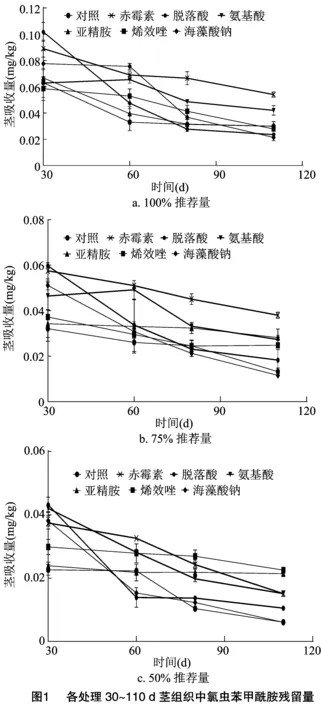
播种后30、60、80、110 d,对水稻植株的茎进行取样,并测定氯虫苯甲酰胺的残留量,具体如图1所示。可以看出,随着播后时间增加,茎组织中氯虫苯甲酰胺残留量呈现下降趋势。6种生物刺激素与氯虫苯甲酰胺100%推荐量混合拌种后,水稻茎组织中的氯虫苯甲酰胺残留量在水稻的整个生育期比对照多的是添加了赤霉素、氨基酸的处理;与氯虫苯甲酰胺75%推荐量混合拌种后,水稻茎组织中的氯虫苯甲酰胺残留量在水稻的整个生育期比对照多的是添加了赤霉素、氨基酸、亚精胺的处理;与氯虫苯甲酰胺50%推荐量混合拌种后,水稻茎组织中的氯虫苯甲酰胺残留量在水稻的整个生育期比对照多的是添加了赤霉素、氨基酸、亚精胺、烯效唑的处理。
2.4 各处理水稻叶组织中氯虫苯甲酰胺的残留量
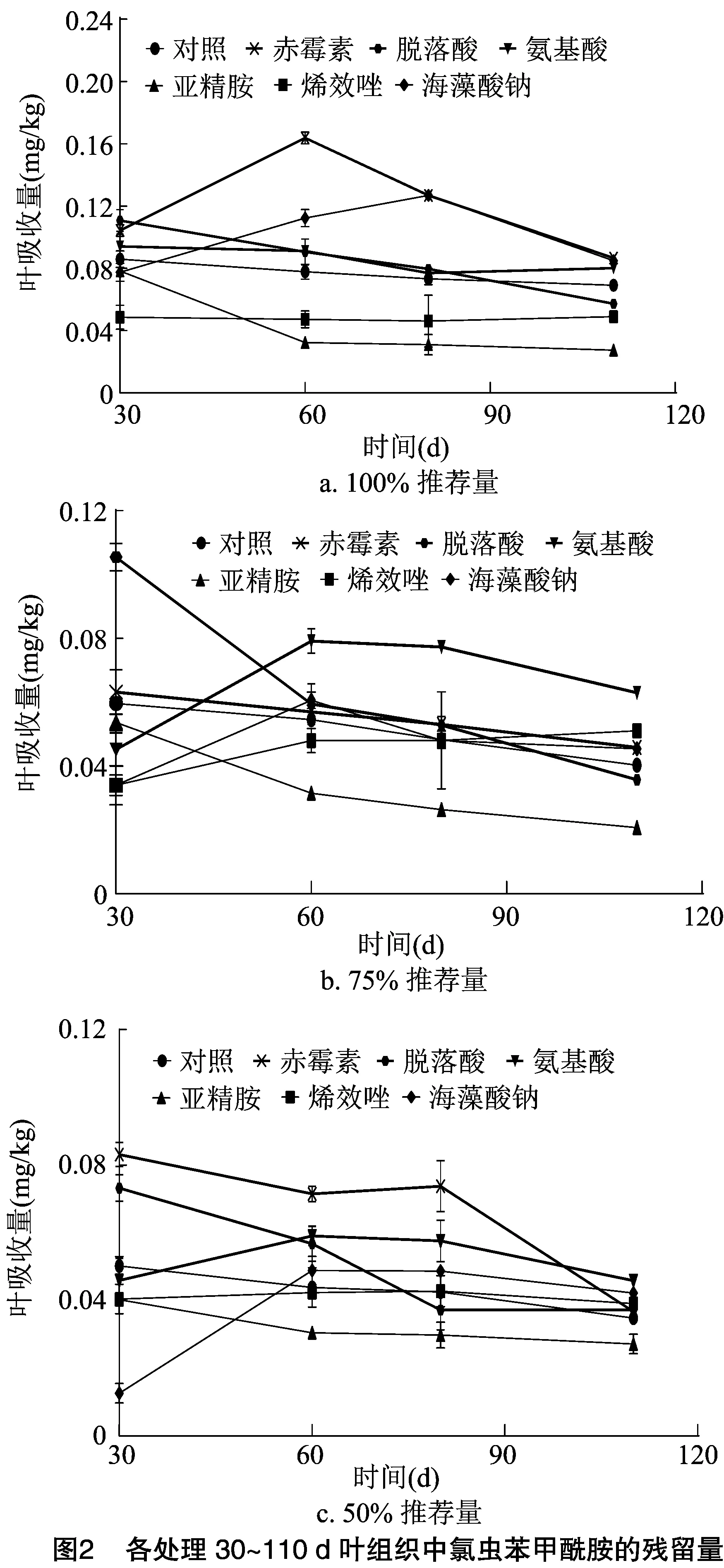
播种后30、60、80、110 d,对水稻植株的叶进行取样,并测定氯虫苯甲酰胺的残留量(图2)。可以看出,随着播后时间增加,水稻植株叶组织中氯虫苯甲酰胺的残留量总体呈下降趋势。6种生物刺激素与氯虫苯甲酰胺100%推荐量混合拌种后,水稻叶组织中的氯虫苯甲酰胺残留量在水稻大部分生育期比对照多的是添加了赤霉素、氨基酸、海藻酸钠的处理;与氯虫苯甲酰胺75%推荐量混合拌种后,水稻叶组织中的氯虫苯甲酰胺残留量在水稻大部分生育期比对照多的是添加了赤霉素、氨基酸的处理;与氯虫苯甲酰胺50%推荐量混合拌种后,水稻叶组织中的氯虫苯甲酰胺残留量在水稻大部分生育期比对照多的是添加了赤霉素、氨基酸的处理。
2.5 各处理水稻茎和叶组织中氯虫苯甲酰胺残留量的变化率
表2为6种生物刺激素分别与氯虫苯甲酰胺100%推荐量、75%推荐量、50%推荐量混合拌种后在水稻的生育期110 d内茎和叶组织中氯虫苯甲酰胺残留量的变化率。赤霉素、脱落酸、氨基酸、亚精胺、烯效唑、海藻酸钠与氯虫苯甲酰胺100%推荐量混合拌种后水稻茎中氯虫苯甲酰胺残留量比对照分别增加了86%、18%、48%、7%、19%、35%,叶中氯虫苯甲酰胺残留量比对照分别增加了58%、9%、12%、-46%、-37%、33%;与氯虫苯甲酰胺75%推荐量混合拌种后水稻茎中氯虫苯甲酰胺残留量比对照分别增加了112%、37%、69%、45%、29%、13%,叶中氯虫苯甲酰胺残留量比对照分别增加了8%、21%、34%、-36%、-7%、-5%;与氯虫苯甲酰胺50%推荐量混合拌种后水稻茎中氯虫苯甲酰胺残留量比对照分别约增加了98%、39%、88%、91%、121%、14%,叶中氯虫苯甲酰胺残留量比对照分别增加了52%、17%、23%、-26%、-3%、-7%。
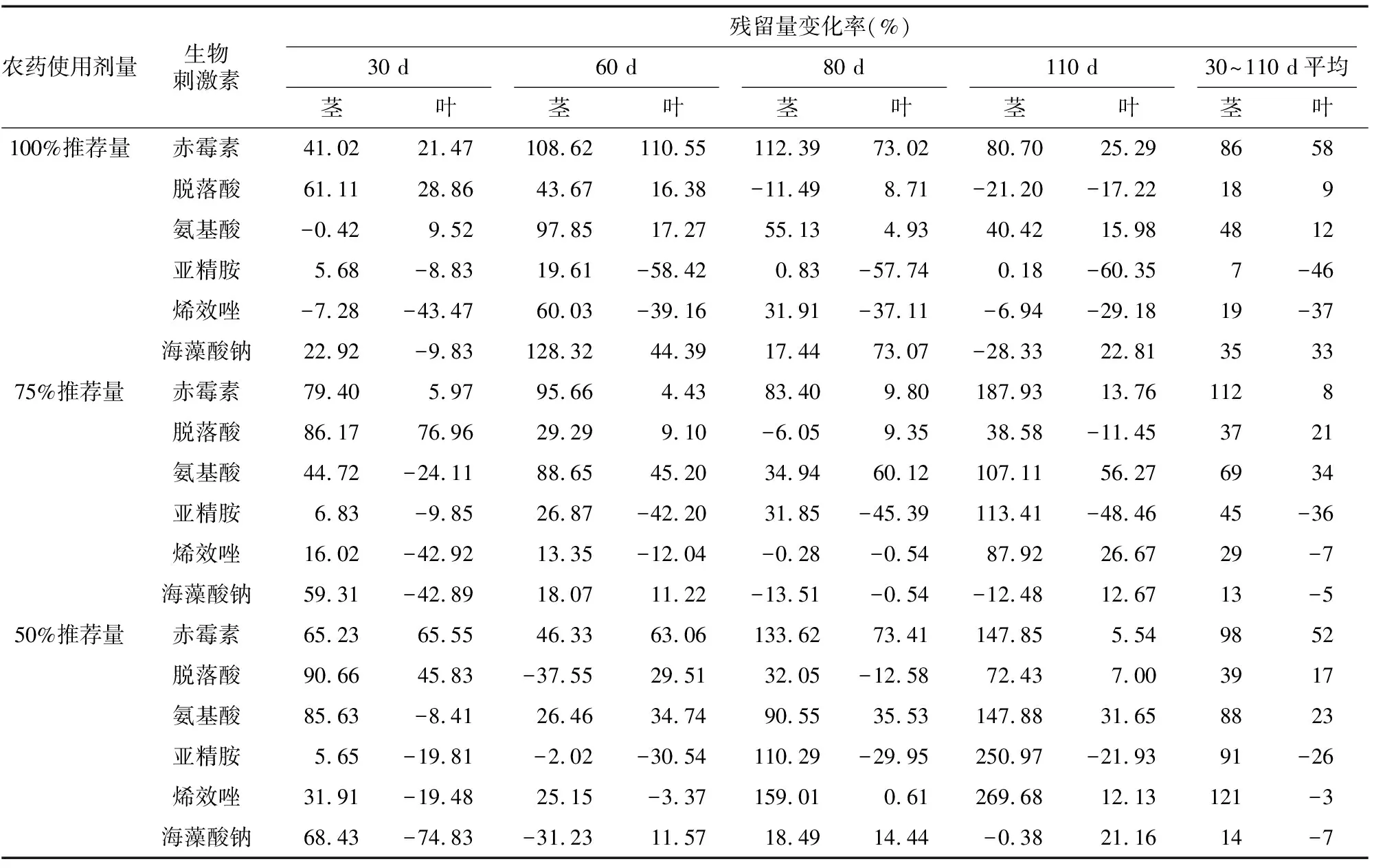
表2 6种生物刺激素对水稻不同生育期氯虫苯甲酰胺残留量的变化率
因此,6种生物刺激素分别与100%推荐量、75%推荐量、50%推荐量混合拌种后,赤霉素和氨基酸在水稻大多数生育期都能够增加水稻茎和叶组织中氯虫苯甲酰胺的残留量,分别添加赤霉素和氨基酸后,100%、75%、50%推荐量下,水稻茎中氯虫苯甲酰胺的残留量分别增加了86%、112%、98%和 48%、69%、88%;叶中氯虫苯甲酰胺的残留量分别增加了58%、8%、52%和12%、34%、23%。脱落酸、亚精胺、烯效唑和海藻酸钠多数在前期(30~60 d)有少量增加茎或叶中氯虫苯甲酰胺的残留量,但在后期(80~110 d)茎或叶中氯虫苯甲酰胺的残留量基本没有增加或者是比对照少。
3 讨论
药剂处理水稻种子是一种经济、有效、省工省力的方式,可以达到长效、可持续绿色防控害虫的效果[25]。近年来,稻纵卷叶螟严重危害水稻的生产[1,26-27]。目前,使用氯虫苯甲酰胺对水稻种子进行处理可有效防控稻纵卷叶螟。但是种子处理还存在农药利用率低的问题,因此,本试验研究了6种生物刺激素(赤霉素、脱落酸、氨基酸、亚精胺、烯效唑、海藻酸钠)分别与氯虫苯甲酰100%推荐量、75%推荐量和50%推荐量混合拌种后是否能够增强氯虫苯甲酰胺的药效试验。
本研究表明,6种生物刺激素中,赤霉素和氨基酸分别与各推荐剂量的氯虫苯甲酰胺混合拌种后能够明显增加茎和叶组织中氯虫苯甲酰胺的残留量。添加赤霉素后,水稻茎中的氯虫苯甲酰胺残留量分别增加了86%、112%、98%,叶中的氯虫苯甲酰胺残留量分别增加了58%、8%、52%;添加氨基酸后,氯虫苯甲酰胺在水稻茎中的残留量增加了48%、69%、88%,在叶中的残留量增加了12%、34%、23%。
赤霉素是一种二萜类化合物和植物刺激素。赤霉素除了有促进种子萌发的作用,还具有刺激茎节间伸长的作用,其效果比生长素更为显著,但不改变节间数,节间长度增加的原因是赤霉素能够促进细胞伸长和细胞分裂[28]。杨富军等使用赤霉素与氯虫苯甲酰胺混合对花生进行拌种,研究发现,添加赤霉素后可以增强对棉铃虫、蛴螬和斜纹夜蛾3种主要花生虫害的防治效果,还可以提高花生的出苗率以及产量[22]。
另外赤霉素作为激素可以与很多基因的启动子结合调控基因的表达,Li等研究发现,缺乏AP2/ERF家族基因SHOEBOX的水稻植株根分生组织严重变小,这些植物在发芽后根分生组织中的细胞较短,并且发现外源赤霉素的应用可以使SHOEBOX的野生型植物的根分生组织细胞的大小恢复正常[29]。Ragni等研究发现,赤霉素可以直接刺激拟南芥下胚轴木质部扩张,从而增加下胚轴的水和溶质运输能力,推测赤霉素可以促进水稻木质部的扩张,从而促进了水稻转运的能力,从而增强水稻对氯虫苯甲酰胺的吸收[30]。Chiba等研究发现,赤霉素的转运蛋白为NRT1/PTR FAMILY(NPF)蛋白,此蛋白最初被鉴定为硝酸盐或二/三肽转运蛋白,推测赤霉素激活了农药转运蛋白的表达,从而增强了水稻对氯虫苯甲酰胺的吸收[31]。
葛明惠等发现,在水稻幼苗期施用5%复合氨基酸增效剂可以显著增加水稻幼苗的株高、叶绿素含量(SPAD值)、根系生长指标、地上部干质量和氮、磷、钾累积吸收量[32]。曹小闯等使用氨基酸肥水溶液对水稻浸种,并在水稻的幼苗期、分蘖期、破口前进行叶面喷施,发现可以增加水稻营养器官氮素积累量以及叶片氮素向穗转运,有利于提高水稻对氮素的利用率。因此,推测氨基酸通过提高水稻的健康程度及增强植株抗逆境胁迫能力来提高对农药的吸收[33]。
4 结论
结果表明,生物刺激素赤霉素和氨基酸分别与氯虫苯甲酰胺混合拌种处理后可以显著促进水稻对氯虫苯甲酰胺的吸收,从而达到提高防效的目的。因此在水稻种植中,可以将其与药剂混合进行种子处理,促进水稻吸收药剂,增加药剂的药效。此外,赤霉素和氨基酸促进水稻对氯虫苯甲酰胺吸收的机制有待进一步研究。

