iTRAQ技术筛选差异蛋白S100A8在特发性膜性肾病中的表达及意义
黄宇珊,黄娟,李斯毅,吴勇,唐凤英
(1. 汕头大学医学院,广东 汕头 515041;2. 广东省惠州市中心人民医院肾内科,广东 惠州 516001)
特发性膜性肾病(idiopathic membranous nephropathy,IMN)是一种免疫复合物介导的肾脏疾病[1],由足细胞抗原自身抗体引起,包括磷脂酶A2受体(phospholipase A2 receptor,PLA2R)和含有7A的凝血酶反应蛋白1型结构域(thrombospondin type-1 domain-containing 7A,THSD7A),临床多表现为肾病综合征,早期诊断依赖肾活检病理。肾活检是有创检查,有出血风险[2]。血清 PLA2R 抗体(anti-PLA2R)是目前公认且可用于临床检验的IMN生物标志物[3],但仅约51.6%~82.0% IMN患者PLA2R阳性[4],3%~5%患者THSD7A阳性[5]。因此,需寻找新的可靠的生物标志物。同位素标记相对与绝对定量蛋白组学(isobaric tags for relative and absolute quantification,iTRAQ)技术是一种定量蛋白质组学的经典方法,具有敏感性高、重复性好的特点。本研究采用基于iTRAQ技术的蛋白质组学方法进行比较蛋白质组学分析寻找目标蛋白,对目标蛋白通过蛋白质免疫印迹(Western Blot,WB)及酶联免疫吸附方法(ELISA法)进一步确认目标蛋白表达情况,以期发现IMN的候选生物标志物。
1 材料与方法
1.1病例收集 收集2021年1月至2021年8月惠州市中心人民医院肾内科住院的初治肾病综合征患者及我院体检中心健康体检者的外周血样本。分组:①IMN组30例;②非特发性膜性肾病组(not-idiopathic membranous nephropathy,NIMN)组30例,病理类型为系膜增生性肾小球肾炎;③健康组30例。IMN组和NIMN组患者均符合肾病综合征诊断标准:大量蛋白尿(>3.5 g/24 h),低蛋白血症(<30 g/L),高脂血症和高度水肿。所有患者均未使用激素及免疫抑制剂治疗。血清样品均为清晨空腹时采集,至少禁食8 h,3 000 r/min 10 min,收集上清液,分装后-80 ℃保存备用。同时获取3组受检者的性别、年龄等一般信息,血清肌酐、24 h尿蛋白、甘油三酯等结果。本研究所遵循的程序符合伦理学要求,并经本院伦理委员会批准(伦理号:kyll2022022)。所有受试者均签署知情同意书。
1.2实验方法 首先对6例IMN患者(女4例,男2例,平均年龄33.13岁)、6例NIMN患者(女4例,男2例,平均年龄32.23岁)和4例年龄和性别匹配的健康对照者进行基于iTRAQ的蛋白质组分析,包括iTRAQ肽标记、分类、质谱分析和数据库比较。其后对30例IMN患者、30例NIMN患者和30名健康受试者的外周血用Western Blot及ELISA法进行S100A8蛋白定量验证。
1.2.1iTRAQ蛋白质组学分析 将每组等量的蛋白质变性(8 mmol/L尿素、4%丙磺酸、30 mmol/L HEPES、1 mmol/L PMSF、2 mmol/L EDTA、10 mmol/L二巯基苏糖醇),还原(二巯基苏糖醇),烷基化(碘乙酰胺),消化(胰蛋白酶),并用iTRAQ试剂标记,健康对照品 iTRAQ 113和114;IMN组iTRAQ 115、117、121;NIMN组iTRAQ 116、118、119。将iTRAQ标记的肽混合,用2D液相色谱(HILIC/SCX和保留相)分析,然后用Q-exactive质谱仪(Thermofisher)进行质谱分析。用Proteome Discoverer 1.3软件转化原始图谱文件为.mgf文件,将其提交MASCOT 2.3.0服务器检索,通过MASCOT服务器上形成的搜库文件,根据FDR<0.01标准对数据进行筛选,完成蛋白质鉴定和定量,得到差异蛋白。对差异蛋白进行生物信息学分析。
1.2.2Western Blot(WB)法验证目标蛋白 选取目标蛋白S100A8进一步验证。对30例IMN患者、30例NIMN患者和30名健康受试者的外周血用WB法检测3组S100A8蛋白表达量。取受试者样本,蛋白质裂解液提取外周血蛋白质,BCA法测得蛋白质浓度,分别于对应孔中加入40 μg蛋白质,在10.0% Tris-HCl SDS/PAGE 凝胶上还原分离,将分离后的蛋白质转移到聚偏二氟乙烯(PVDF)膜上,使用封闭液对转印膜封闭处理后,用S100A8单克隆抗体等进行一级抗体封阻和探测,在4 ℃下过夜,根据制造商方案,加入二级抗体,通过增强型化学发光检测,与β-肌动蛋白的内部对照相比较,通过测量相应带的光密度(OD)来量化S100A8蛋白的相对水平。数据报告为相对强度单位。蛋白条带经ImagJ软件定量分析。
1.2.3酶联免疫吸附试验(ELISA试验)定量检测目标蛋白 双抗体夹心法对3组外周血标本进行S100A8蛋白定量检测。用人S100A8 ELISA试剂盒(美国SAB公司),按说明书进行标准品制备、酶标包被板加样、温育、洗板、加酶等操作后用酶标仪450 nm波长依序测量各孔的吸光度(OD值),根据标准品浓度计算出S100A8蛋白浓度。
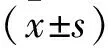
2 结果
2.13组基本资料对比结果 3组在年龄、性别构成比、血压、体重指数(BMI),差异无统计学意义(P>0.05)。IMN组和NIMN组的24 h尿蛋白定量、血清肌酐、尿酸、总胆固醇、甘油三酯高于健康对照组(P<0.05),血清白蛋白低于健康对照组(P<0.05)。见表1。

表1 3组基本资料对比结果
2.2蛋白质组鉴定结果
2.2.1蛋白质差异性变化 通过iTRAQ分析鉴定IMN患者和NIMN组之间血清差异表达蛋白,共鉴定到总蛋白数量为938个,通过蛋白质定量分析,与NIMN组相比,IMN组的8个蛋白质显示出表达上调,6个蛋白质显示出表达下调,差异蛋白信息,见表2。

表2 差异表达蛋白
2.2.2生物信息学分析 对筛选的14个差异表达蛋白进行蛋白质互作(PPI)网络分析。本研究发现这些差异蛋白涉及细胞分裂、细胞分化、细胞浆移动、细胞凋亡、细胞存活、DNA甲基化、活性氧生成、细胞增殖等生物进程。图1、图2显示了与这些蛋白质相关的9个生物过程及各差异蛋白之间的相互关系。结果表明,目标蛋白S100A8生物学功能主要集中在细胞增殖、细胞分化及细胞凋亡过程。
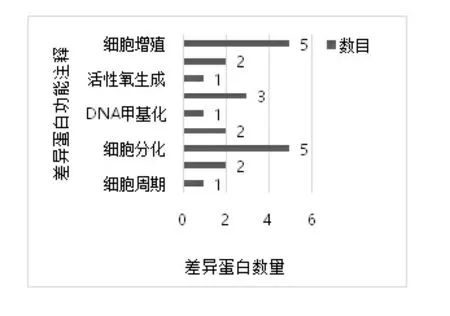
图1 IMN患者差异表达蛋白质相关的9个生物过程
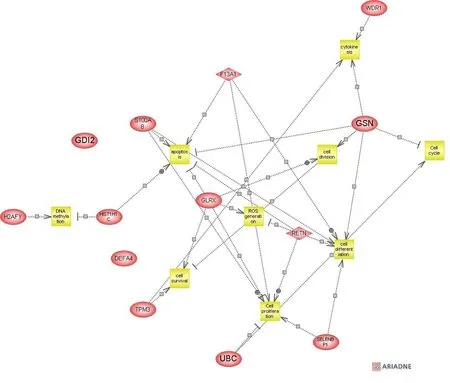
注:Pathway Studio 6.0对13种差异表达蛋白(14种差异表达蛋白,不包括未命名蛋白产物)及其调控的细胞过程进行了注释。图中圆点表示差异表达蛋白质,正方形表示 KEGG 条目,颜色表示富集程度即P值大小。
2.3S100A8蛋白的Western Blot法验证 从14种不同水平的蛋白质中选择了S100A8蛋白质进一步研究,这种蛋白质以前没有被报道为IMN的生物标志物,并且可以通过WB法检测。然后对S100A8的WB数据进行了统计分析。结果示S100A8在IMN组和NIMN组有表达差异,条带灰度(P<0.05)。见图3、图4。
2.4ELISA检测结果 IMN组S100A8蛋白水平为(124.64±35.5) ng/mL,高于NIMN组[(80.69±20.98) ng/mL]和健康对照组[(47.73±9.58) ng/mL],差异有统计学意义(P<0.001),见图5。ROC曲线分析显示S100A8蛋白cut-off 值为80.16 ng/mL,其对于诊断IMN的敏感性为93.30%,特异性为75.00%,曲线下面积(areaunder the curve,AUC)为0.911,95%可信区间为 0.844~0.978。S100A8 蛋白可以很好地对IMN组与非IMN 组和健康对照组进行区分。见图6。

注:3例正常对照组为N1~N3,3例IMN患者为C4~C6,NIMN患者为E7~E9;检测β-肌动蛋白作为每个样本的内部对照。
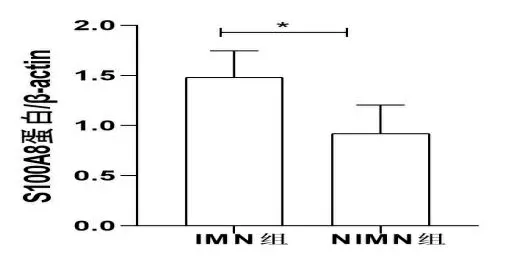
注:*P<0.05。
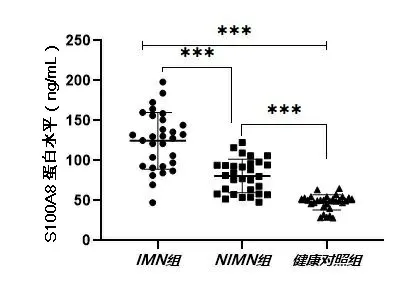
注:图中的点表示样本S100A8蛋白水平;***P<0.001。
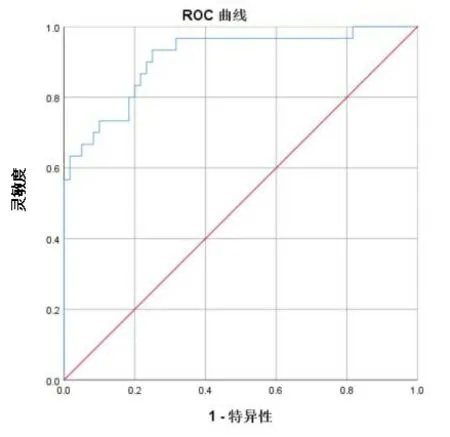
图6 S100A8蛋白水平ROC曲线
3 讨论
膜性肾病是非糖尿病成年人中最常见的原发性肾小球疾病[6]。约30%的MN膜性肾病患者在长期随访中进展为终末期肾病(ESRD),因此在诊断时预测对特定治疗方案的反应或MN膜性肾病的最终结果和预后可能有助于精准治疗[7]。iTRAQ 技术是一种可同时对4种或8种样品进行相对和绝对定量研究的定量蛋白质组学方法[8],已被用于鉴定敏感和特异的疾病状态预后标志物,在肾脏疾病领域应用广泛[9]。
本研究采用iTRAQ技术研究IMN、NIMN患者和健康者之间的差异表达蛋白,发现S100A8蛋白在IMN患者组表达明显升高。通过Western Blot和ELISA进一步证实S100A8蛋白是IMN患者的高表达蛋白。S100A8蛋白来自S100蛋白家族,是晚期糖基化终产物受体(receptor for advanced glycation end products,RAGE)的配体, 晚期糖基化终末产物(advanced glycation end products,AGEs)是蛋白质和脂质的非酶糖基化和氧化的产物,糖尿病肾病是证明AGEs在肾脏疾病中致病作用的经典模型[10]。最近研究表明[11],AGEs会在非糖尿病肾病尿毒症患者体内积累。在慢性肾脏病(chronic kidney disease,CKD)患者中,由于产量增加和肾排泄受损,AGEs水平显著增加[12]。AGEs通过交联结构蛋白或与RAGE相互作用启动多个细胞内信号通路,激活核因子κ-B(NF-kB)[13],增加氧化应激,从而导致CKD[14]。因此,抑制AGEs/RAGE/NF-κB通路,对预防CKD具有重要意义。本研究发现S100A8蛋白在IMN组及NIMN组均升高,表明S100A8蛋白参与CKD进程,推测AGEs/RAGE/NF-κB通路激活所致,确切机制需要后续研究探索。IMN患者的S100A8蛋白生物学功能主要集中在细胞增殖、细胞分化及细胞凋亡过程,推测S100A8蛋白引起IMN的机制与机体的细胞分化、异常增殖及凋亡等相关。而S100A8蛋白在IMN组升高更明显,ROC 曲线分析显示S100A8 蛋白可以很好地对 IMN组与非IMN 组和健康对照组进行区分,表明S100A8表达在肾脏病不同病理类型中存在差异。有研究表明,S100A8蛋白参与免疫介导炎症反应,与炎症严重程度相关[15],提示IMN的免疫损伤较NIMN严重。通过检测外周血S100A8的表达有助于诊断IMN,S100A8可能是IMN的候选生物标志物,这需要进一步探索研究。
本研究有几个局限性。首先S100A8浓度并不仅在IMN患者升高[16-19],S100A8的升高能否特异性反映IMN情况仍有待进一步研究。其次,本研究为单中心研究,纳入病例数较少,未设置继发性膜性肾病组对照,需要更多标本量行前瞻性研究来验证研究结果。为了进一步研究S100A8在IMN的可能机制,必须招募更多的IMN患者来分析S100A8是否可能是IMN的生物标志物。
总之,本研究表明IMN患者外周血S100A8蛋白水平升高。S100A8蛋白有成为新的诊断与监测IMN患者的生物标志物的潜力,可能是IMN的候选生物标志物。

