阿拉伯木聚糖对帕金森病大鼠行为学和肠道菌群影响研究
罗雪莲,王功俊,王洁,冯云,黄晓华,包成政,潘敏夫,邵熔,李雪斌,,4
(1. 右江民族医学院,广西 百色 533000;2. 右江民族医学院附属医院肾内科,广西 百色 533000;3. 右江民族医学院附属医院神经内科,广西 百色 533000;4. 广西高校桂西地区高发病防治研究重点实验室,广西 百色 533000)
帕金森病(Parkinson’s disease,PD)是神经系统退行性中最常见的疾病之一,具有不断发展的复杂层次。它一直与路易体有关的帕金森氏症的经典运动特征和黑质中多巴胺能神经元的丧失为特征[1]。在中老年人群中发病率普遍增高,严重影响到患者的生活质量[2]。PD的临床表现包括多种运动症状和非运动症状,PD患者的胃肠功能障碍的临床表现包括营养不良、口腔及口腔疾病、涎漏、吞咽困难、胃轻瘫、便秘、排便功能障碍[3]。当前临床上治疗PD用多巴胺可以暂时控制住病人的运动症状,但是非运动症状如多巴胺能神经元持续丢失的现象和胃肠道功能障碍的问题尚不能解决。因此,临床上需要更多的治疗方法和药物来延缓PD的进展。
阿拉伯木聚糖(arabinoxylans,AX)是在许多谷物中发现的非淀粉多糖,它具有免疫调节和益生活性,其功能活性是与结构组成密切相关的[4]。目前对于小麦AX的免疫调节功能的研究较少,不能确定其益生活性与免疫调节功能是否存在一定的联系,AX的免疫调节作用可能与肠道短链脂肪酸的间接作用有关[5]。 AX作为一种膳食纤维,它们能增加双歧杆菌和乳酸菌等的有益微生物群。双歧杆菌在结肠中发酵膳食纤维时,产生的短链脂肪酸可以使肠道的pH值降低,并且可以抑制潜在致病菌的生长,作为一种功能性低聚糖,它的益生作用可以使许多慢性疾病的风险降低[6]。有大量研究发现肠道中的α-突触核蛋白聚集会使肠道的菌群失调,从而导致肠道的通透性增加,这可能会让肠神经系统中的α-突触核蛋白积聚进而影响大脑,促进疾病的发生与发展[7]。故本研究基于“肠道菌群-肠-脑轴”对PD大鼠肠道菌群特点进行分析,观察AX对PD大鼠行为学及肠道菌群的影响,是否能通过改善肠道菌群的失调从而降低脑内α-突触核蛋白的表达,为AX治疗PD提供新的思路。
1 材料与方法
1.1实验动物及试剂 选取SD成年健康雄性SPF级大鼠40只,重量体质量150~180 g,6~8周龄,购于湖南省长沙市天勤生物技术有限公司,实验动物生产许可证:SCXK(湘)2019-0014。所有实验大鼠均于室温20 ℃左右,相对湿度45%~55%,SPF级动物房中单笼适应性饲养1周后进行实验。实验过程中严格按照实验动物理论学要求以及中华人民共和国《实验动物管理条例》完成各项饲养工作,并按实验动物3R原则给予人道关怀。主要实验试剂:鱼藤酮 (上海希格玛贸易有限公司,货号R8875-5G);葵花籽油(上海麦克林生化科技股份有限公司,货号C14294665);美多芭(上海罗氏制药有限公司,货号H10930198);AX(上海赛普瑞特分子生物科技有限公司,货号4891668326689);α-突触核蛋白(上海艾博抗贸易有限公司,货号ab27766);酪氨酸蛋白(上海艾博抗贸易有限公司,货号ab137869)。
1.2实验方法
1.2.1实验分组 40只SD大鼠,采用随机数字法随机分为5组,即:空白组、假手术组、模型组、美多芭组、AX组,每组各8只。
1.2.2模型制备 PD模型制备:采用于颈背部皮下注射鱼藤酮葵花油乳化液1.5 mg/(kg·d),鱼藤酮在葵花油中的浓度为1.5 mg/mL,每天注射1次,注射按照动物体质量给药,每周停药1次,共30 d。在给鱼藤酮葵花油乳化液期内,当动物出现四肢瘫痪、无法站立行走、翻身困难、无法进食时,立即终止注射。筛选模型制作成功的标准为:发生行为学记分后(3~5周)即终止给鱼藤酮[8]。行为学评分标准,参照文献[9],按照表1评分:行为学评分2~8分可认为成模,按照评分标准筛选造模成功大鼠共24只。假手术组:于颈背部皮下注射等规格的不含有鱼藤酮的葵花油乳化液,每天1次,共30 d。

表1 PD模型评分标准
1.2.3给药方式及剂量 模型制备成功后,美多芭组给予美多芭混悬液50 mg/(kg·d)灌胃,AX组以AX混悬液800 mg/(kg·d)灌胃,模型组按体质量予蒸馏水灌胃,1天1次,连续14 d。空白组及假手术组正常饲养,不予任何药物干预。
1.2.4行为学检测 悬挂实验:用于大鼠肌张力的检测,在实验准备开始前,让实验大鼠适应环境30 min,在距地面1 m处,提前准备一根直径2 mm、长约20 cm的金属丝,将大鼠两前爪悬挂于水平放置的金属丝上,记录大鼠落地前的时间,如大鼠在3 s内跌落或仅一个爪抓住金属丝均属失败。每只大鼠重复测量3次,每次间隔5 min,最后悬挂时间取3次平均值。
1.2.5免疫组化染色 大鼠麻醉后,断头取脑,将全脑固定于4%的多聚甲醛中,固定24 h后切下中脑,用石蜡包埋中脑组织,切片常规脱蜡至水,将切片放入3%柠檬酸修复液高压修复,待顶开气阀后修复10 min。将高压锅自然冷却至室温,蒸馏水水洗5 min。加入3%甲醇双氧水20 min,蒸馏水水洗5 min,PBS浸泡1 min。滴加5%BSA,室温孵育30 min弃掉。滴加一抗工作液(稀释倍数为1∶120),4 ℃孵育过夜,PBS缓冲液洗3次,每次5 min。滴加二抗工作液,37 ℃孵育20 min。PBS缓冲液洗3次,每次5 min。DAB显色,自来水洗,苏木素复染、分化、反蓝、脱水,透明、封片,显微镜观察各组大鼠中脑黑质组织α-SYN蛋白和TH蛋白的表达情况,采集100倍镜下图片。结果细胞核呈蓝色,阳性结果呈棕色或棕黄色。依据阳性免疫反应的图象选取阳性表达区域,用Image-Pro Plus软件测定阳性免疫染色强度和面积,最后计算平均光密度值,平均光密度=积分光密度/总面积。
1.2.6肠道菌群检测 用1.5 mL无菌EP管收集大鼠结肠粪便,收集完成后将粪便立即置于-80℃冰箱保存。经过质量检测后行16S rDNA 基因高通量测序技术检测大鼠肠道菌群,选取细菌16S rDNA的V3-V4区域序列进行基因扩增及基因测序,通过α多样性指数ACE、Chao1、Shannon、Simpson进行多样性比较,并且通过组间菌群差异分析找出各组之间的差异菌群。
2 结果
2.1悬挂实验结果 与空白组和假手术组相比,模型组大鼠悬挂实验停留时间较短(P<0.05);假手术组和空白组无明显差异(P>0.05);经过14 d干预后,与模型组相比,AX组和美多芭组大鼠悬挂时间明显增长(P<0.05);AX组和美多芭组相比无统计学差异(P>0.05)。见表2。
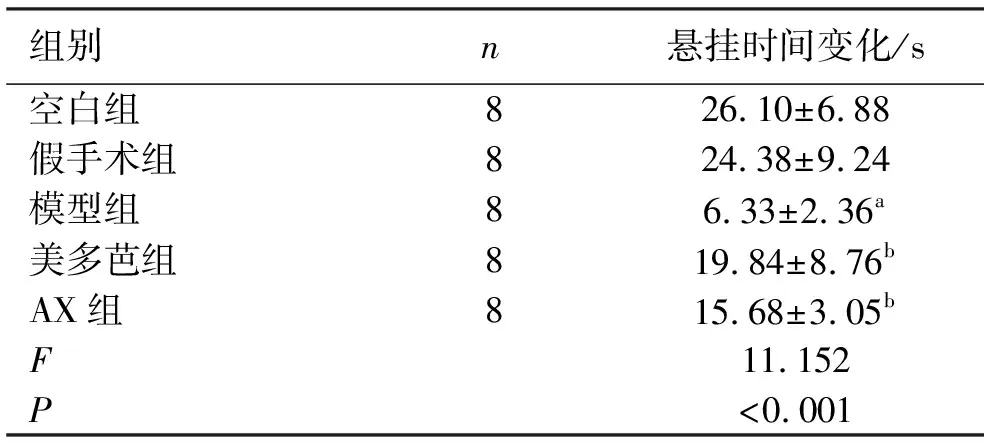
表2 各组大鼠干预14 d后的悬挂时间
2.2免疫组化染色结果 如图1所示,阳性结果呈棕黄色。与空白组和假手术相比,模型组α-SYN表达显著升高;与模型组相比,美多芭组和AX组α-SYN表达明显下降。TH蛋白在模型组中明显低表达,与模型组相比,美多芭和AX组中TH表达上升。
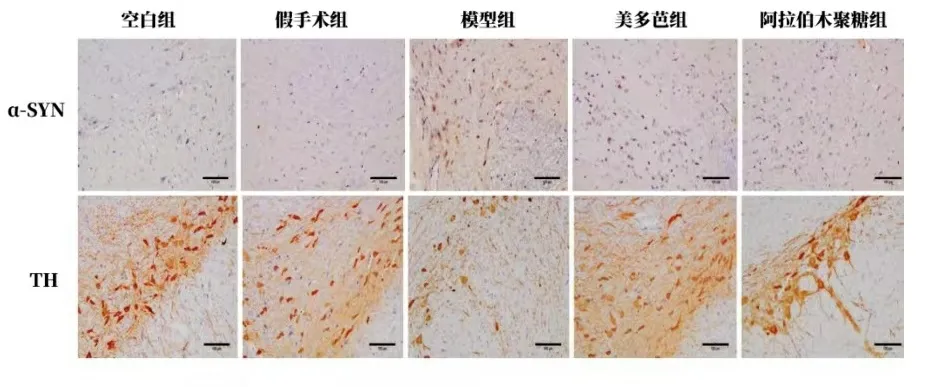
图1 各组大鼠中脑黑质α-SYN和TH表达
2.3各组大鼠肠道菌群16S rRNA检测结果
2.3.1菌群α多样性分析 采集大鼠结肠粪便,进行16S rRNA高通量基因测序结束检测大鼠肠道菌群。菌群α多样性分析结果发现,与空白组和假手术组相比,模型组ACE、Chao1、Shannon、Simpson指数降低,菌群多样性较少,差异有统计学意义(P<0.05)。与模型组相比,AX组ACE、Chao1、Shannon、Simpson指数升高,菌群多样性较丰富,差异有统计学意义(P<0.05)。见表3。
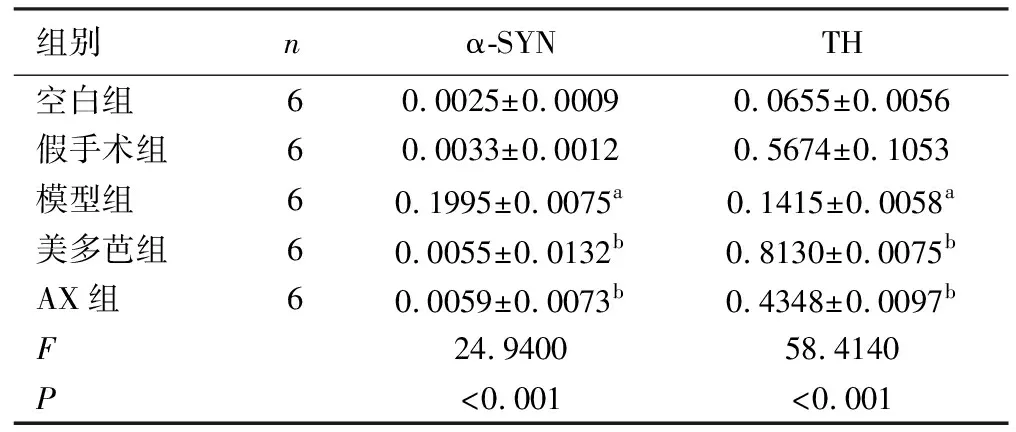
表3 各组大鼠α-SYN和TH蛋白平均光密度值
2.3.2LEfSe 物种差异分析 采用LEfSe方法找到组间差异物种,结果显示,各组大鼠肠道菌群差异显著,以LDA阈值>3测量代表微生物具有显著差异,如图2A结果空白组和假手术组中毛螺科(Lachnospiraceae)、毛螺目(Lachnospirales)和未定义的梭状芽孢杆菌丰度(Unclassified_ clostridia_ UCG_ 014)增加为主,模型组中普雷沃氏菌(Prevotellaceae)、拟杆菌门(Bacteroidota)、拟杆菌目(Bacteroidales)、拟杆菌纲(Bacteroidia)相对丰度增加;与模型组相比,AX组改变主要以厚壁菌门(Firmicutes)、梭状芽孢杆菌纲(Clostridia)、毛螺目(Lachnospirates)和毛螺科(Lachnospiraceae)相对丰度增加为主。以见图2B。
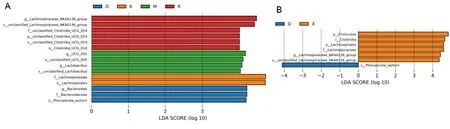
注:K为空白组,R为假手术组,D为模型组,M为美多芭组,X为AX组。
3 讨论
本研究探索了AX对PD大鼠的作用,检测了PD大鼠的运动功能、中脑黑质中α-突触核蛋白和酪氨酸羟化酶的表达及肠道菌群结构,研究结果表明,给予大鼠注射含有鱼藤酮葵花油乳化液造模后,大鼠微生物菌群中拟杆菌门(Bacteroidota)、拟杆菌目(Bacteroidales)、拟杆菌纲(Bacteroidia)相对丰度增加;在给予AX干预后,发现PD大鼠行为学表现和肠道菌群失调有明显的改善效果,能够有效恢复PD大鼠的肌力,延长了大鼠的悬挂时间;重新构建PD大鼠肠道菌群结构,能够升高健康菌群厚壁菌门(Firmicutes)、梭菌纲(Clostridia)、毛螺菌科(Lachnospiraceae)的丰度,降低致病菌群拟杆菌门(Bacteroidetes)的丰度,抑制黑质α-SYN表达的同时,增加了中脑黑质TH的表达,保护了多巴胺能神经元,研究提示AX可能通过肠道菌群-肠-脑轴来改变肠道菌群结构从而缓解PD症状达到治疗效果。有相关研究表明,在灌胃一定剂量的AX后,能够使鼠结肠内容物双歧杆菌和乳酸菌的含量增加同时使大肠杆菌和粪肠球菌含量显著降低[10]。而本研究中的菌群改变与之不同,原因可能是给予的AX的剂量和时间有所不同,加上动物本身之间存在的差异所导致,但是通过灌胃AX同样起到促进有益菌生长的作用。
在过去的20多年里,大量的研究已经证实了肠道微生物群与PD存在密切的联系[11-12]。肠道菌群不仅对胃肠道有调控作用,还对帕金森症等中枢神经系统疾病等产生重要影响[13]。众所周知,PD通常与黑质致密部多巴胺能神经元的进行性损失有关,该区域和其他大脑区域的神经元产生含有聚集的α-突触核蛋白的路易体[14],从而表现出相关症状。便秘是最常见的非运动PD症状,往往先于运动功能障碍发作数十年,这可能支持肠道血脑屏障的相关的假设[15]。肠道菌群的组成和丰度失调可同时影响肠神经系统和中枢神经系统,提示存在微生物-肠-脑轴,从而引起中枢神经系统疾病。“肠道菌群-肠-脑”轴相互作用机制涉及神经和神经胶质细胞、神经递质、大脑神经营养因子、炎症因子、短链脂肪酸、循环代谢产物、血脑屏障和氧化应激等多方面[16-18]。AX是在许多谷物中发现的非淀粉多糖,是目前公认的一种膳食纤维。现有文献表明[19],AX作为一种多糖,可能会影响肠道相关的微生物生长和免疫系统。研究发现肠道菌群已被认为是代谢综合征发展的重要贡献者。膳食纤维可通过调节肠道菌群和代谢终产物最终发挥有益作用[20]。AX能够通过调整肠道菌群结构改善帕金森症状,在本研究中,通过AX混悬液灌胃干预后,能够提高PD大鼠肠道微生物中厚壁菌门Firmicutes、梭菌纲Clostridia、毛螺菌科Lachnospiraceae的丰度。其中厚壁菌门的相对丰度与PD病人的认知障碍息息相关,Lachnospiraceae_UCG_004在PD病人中丰度降低并可能引起便秘,毛螺菌科的增加能够抑制NF-κB的激活,从而抑制炎症反应的发生而延缓神经退行性过程[21]。
本实验采用了AX干预PD大鼠发现,AX组悬挂试验中的悬挂时间进一步增加,同时可以使黑质中α-SYN蛋白的表达降低,并且增加黑质中TH蛋白的表达,起到延缓PD的多巴胺能神经元神经退化的作用。
综上所述,AX可能通过调节肠道菌群的丰度及组成来改善PD的症状,其可能机制是使肠道菌群进行重建,促进肠道有益菌的增长,并且抑制有害菌的生长,从而改善肠道环境;通过“肠道菌群-肠-脑”轴作用到神经系统,与此同时脑内黑质α-SYN和TH蛋白含量发生改变起到保护神经元细胞的作用,使得PD症状得到了改善,说明AX在PD的治疗上有着很好的应用前景,或许未来其可用于治疗PD。

