热处理促进淀粉和蛋白质中持久性自由基生成的影响
黄晓霞,陈 全,计丕霞,吴 敏,潘 波
(昆明理工大学 环境科学与工程学院,云南省土壤固碳与污染控制重点实验室,云南 昆明 650500)
0 引 言
持久性自由基(Persistent Free Radicals,PFRs)[1]是一种比酰基、羟基等自由基寿命更长,能随着环境介质迁移进入生物体内的新型环境污染物.PFRs通常在高温热处理,如燃烧、热解、水热碳化等过程中形成[2],其可在环境中持续数小时甚至数天,严重威胁人体健康.PFRs主要通过两种途径引起人体暴露风险:一种是在体外产生活性氧,让机体处于氧化应激状态,第二种是进入人体诱导活性氧产生,损伤生物体内的蛋白质、DNA等生物大分子[3-4].
食物从消化道摄入是PFRs进入人体的重要途径之一.研究发现热处理不同食品部位产生PFRs的含量不同,如面包外皮的PFRs含量是面包内心的2~5倍[5],杏仁片中的PFRs含量是杏仁核中的5倍[6].不同热处理方式也会使食品产生PFRs的强度不同,微波热处理大米蛋白形成了以碳为中心的PFRs,其产生的PFRs信号强度约为热传导方式的3倍[7];微波热处理水分活度为0.4的大米淀粉产生的PFRs比热传导方式高1个数量级,受其激发产生PFRs的温度也低于热传导处理[8],其原因是电磁场可直接作用于水分子、淀粉分子或蛋白质分子内的极性基团,提供断键所需的解离能.而微波和电炉热处理不饱和脂肪酸,只有电炉加热使其产生了明显的自由基信号,这与电炉加热使不饱和脂肪酸中的C=C和C=O断裂,而微波没有改变不饱和脂肪酸的结构有关[9].此外,通过对不同植物油热处理,发现多元不饱和脂肪酸含量越丰富的植物油,热氧化稳定性越差,在热处理过程中更易产生PFRs[10],并且亚麻酸含量越高的植物油产生的自由基信号强度越强[11].但当前研究多关注于植物油中PFRs的产生情况,油与食物相互作用对食物中产生PFRs的影响以及不同加热方式对不同成分食品中PFRs的影响仍鲜被关注.
淀粉类和蛋白质类食品是我们日常生活必不可少的食物,油炸方式也是中国传统烹调食物的方法之一.因此本研究采用空气热解和油浴加热两种方式分别对淀粉、蛋白质淀粉混合物以及蛋白质进行热处理,采用电子顺磁共振(EPR)检测不同食品组分中的PFRs信号强度,判定其种类并探究不同食品组分产生PFRs差异的原因与产生机制.研究结果将有助于提高人们对高温加工食品的健康风险认识,也有利于控制热处理过程中PFRs的产生,降低食物处理方式不当对人体的伤害.
1 材料与方法
1.1 样品的制备
分别称取纯马铃薯淀粉(购买于源叶生物)和纯乳清蛋白质粉(美国西尔玛配料有限公司)各 20.00 g,加入UP水搅拌均匀,将其揉成一个光滑面团(含水率约30%)后压制成大小均一的小圆柱体.同理,称取蛋白质粉和淀粉各 10.00 g 混合,制成蛋白质淀粉混合物.设置空气热解温度和油炸锅温度分别为220、250、280和 310 ℃,每个温度下加热样品3 min,立即取出适量油浴加热后的油样进行EPR测试,同理进行相同温度加热大豆油3 min的EPR测试.热解处理和油浴处理的固体样品待冷却后研磨成粉末状,待进一步测试.
1.2 测试方法
1) EPR测试:用石英毛细管吸取油样,用固体胶封口后插入干净的顺磁管中;称量固体样品置于 4 mm 顺磁管中.顺磁管置于电子顺磁共振波谱仪(Bruker X-band A 300-6/1)内腔中进行样品的EPR光谱测定.调制频率为 100 kHz,调制幅度为 1.00 G,扫描宽度为 100 G,转换时间和时间常数分别为 40 ms 和 20.48 ms,EPR微波功率为 18 mW,扫描时间为 40.96 s,接收器增益为3.17×103,X轴分辨率为 1 024 点.其中,每个光谱的相对峰高度被估计为自由基信号的相对强度.
2) 红外光谱(FTIR)测试:将样品放入干燥的溴化钾(KBr)中,样品与KBr的比例为1∶200,充分研磨至混合均匀后使用压片机压制成透明薄片,放入傅里叶变换红外光谱仪(Varian 640-IR,美国)中,扣除背景干扰值后进行样品的扫描测定.FTIR检测参数为:扫描次数为32次,分辨率为8,扫描范围为 4 000~400 cm-1.
3) 元素分析(EA)测试:称取样品1.95~2.35 mg 至锡箔船中,包裹严密,放入元素分析仪(MicroCube,Elementar,Germany)中进行C、N、O、H、S元素分析.
1.3 数据处理
红外谱图分析采用OMNIC 8.2数据处理软件,所得的谱图与空气谱图进行差减.通过EPR程序Bruker WinEPR处理获得g值、自由基信号强度和线宽.以上所有测试至少重复3次,实验数据采用Excel 2016进行统计,Origin 2019b进行作图.
2 结果与讨论
2.1 油浴加热和空气热解对淀粉类食品产生PFRs的影响
2.1.1 热处理温度及方式对淀粉生成PFRs的影响
油浴加热和空气热解淀粉 3 min 产生的PFRs信号强度图谱可见图1.从图中可以看出,随着温度的升高,淀粉中的PFRs信号强度逐渐增强,表明淀粉中PFRs的产生与加热温度显著相关.热处理温度低于 220 ℃ 时,两种热处理淀粉中均未检测到PFRs信号.280 ℃ 油浴加热产生的PFRs信号稍高于同温度下热解产生,但两种加热方式产生的PFRs信号强度无显著性差异.相比 280 ℃ 温度条件,310 ℃ 油浴加热和热解淀粉产生的PFRs信号强度分别突增约10倍和50倍.通过TG/DTG/DTA对淀粉进行热分析,发现在 300 ℃ 有一个明显的质量损失峰[12],质量损失69%,证实淀粉结构在 300 ℃ 左右会发生质的变化.温度为 310 ℃ 时,淀粉分子结构中的烷基侧链、羟基、醚基等弱键断裂,产生大量新的自由基,新产生的自由基通过与自身反应或与周围环境中的稳定组分结合,形成稳定自由基[13].

(a) (b)图1 淀粉在热解(a)和油浴加热(b)处理下PFRs信号强度图谱Fig.1 PFRs signal intensities of starch treated by pyrolysis (a) and oil heating (b)
对热处理后油中的PFRs信号进行检测,结果见图2.从图中可知,虽然大豆油含有丰富的不饱和脂肪酸,但提高热处理温度和添加淀粉都不会使油中产生PFRs.与Zhao等[9]的研究结果不同的是,他们在热处理不饱和脂肪酸纯物质过程中检测到PFRs信号,其原因可能是不饱和脂肪酸纯物质中不含抗氧化剂,而食用油在生产过程中会人为添加一定量的抗氧化剂[14],可与食用油热氧化过程中产生的烷基、过氧基和烷氧基等脂质自由基反应[15],减缓油脂的氧化速度,进而阻止PFRs的产生.虽然油脂与淀粉之间的相互作用对油脂产生PFRs的影响较小,但油脂与淀粉之间的相互作用会影响淀粉中PFRs的产生.两种加热方式在 310 ℃ 产生的PFRs信号强度有显著性差异,热解淀粉产生的PFRs信号强度约为油浴加热的3倍.其原因可能是升高温度破坏了淀粉的结晶区,使支链淀粉含量减少、直链淀粉含量增加[16],而直链淀粉可与脂质发生络合反应,形成的淀粉-脂质复合物可以提高淀粉的结晶度,抑制淀粉糊化[17],从而减少PFRs的产生.
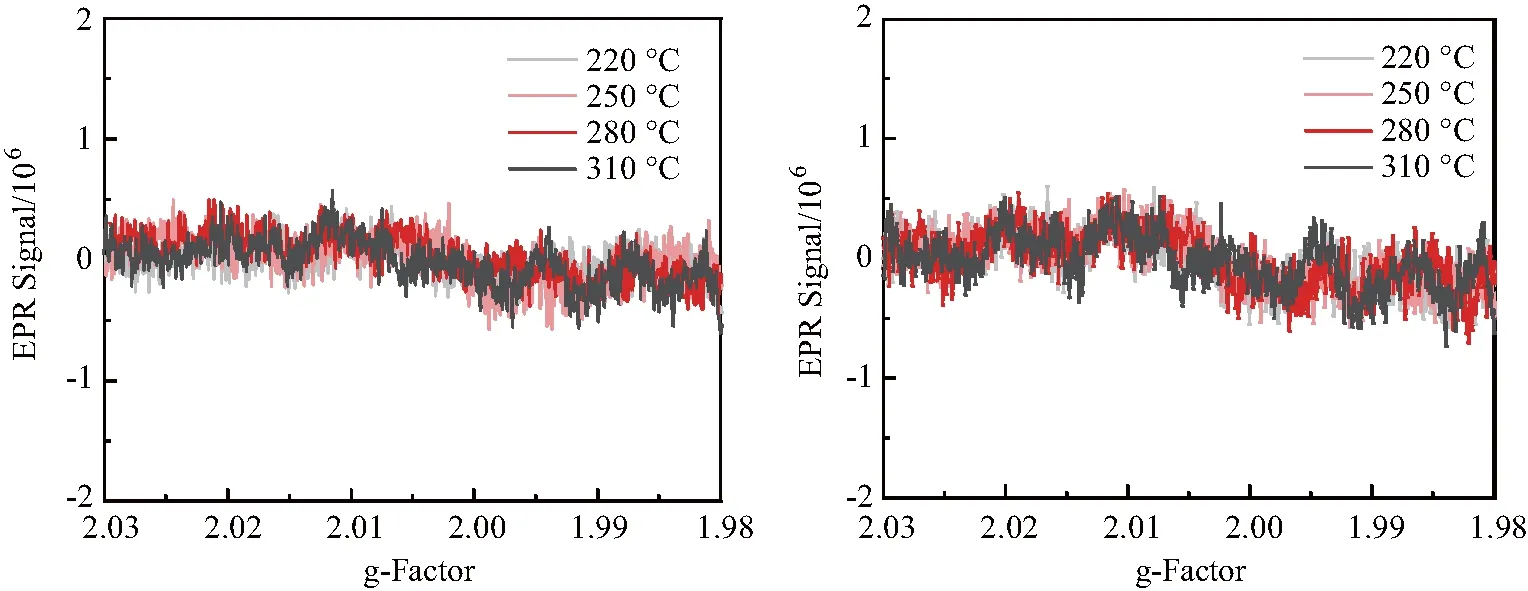
(a) (b)图2 热处理对油中PFRs影响情况:(a)为加热3 min后的大豆油;(b)为油炸淀粉3 min后的大豆油Fig.2 Effect of heat treatment on PFRs in oil: (a) soybean oil after heating for 3 min;(b) soybean oil after frying starch for 3 min

图3 不同热处理方式加工淀粉在 不同温度下的g值和线宽Fig.3 The g value and line width of starch treated by different treatment methods
EPR信号的波普分裂因子(g值或g因子)是提供分子内部结构信息的重要特征参数.从图3的g值变化来看,随着温度升高,油浴加热和空气热解均使淀粉产生的PFRs的g值下降,表明PFRs从以O为中心逐渐转变为以C为中心.线宽(ΔHp-p)表示孤对电子从激发态的高能状态返回低能状态所经历的时间长短,这一过程也称为弛豫时间,ΔHp-p越小弛豫时间越长[18].图3中,热解淀粉的ΔHp-p从 9.677 4 降至 4.398 6,油浴加热淀粉的ΔHp-p从 19.061 6 降至 4.398 9,可见随着加热温度的升高,淀粉的线宽不断减小,孤对电子从高能态返回低能态的弛豫时间不断增加,其自由基的生成种类逐渐减少[9].此外,大豆油中虽然没有产生PFRs,但其受热不稳定易产生瞬时性自由基,可攻击破坏淀粉结构产生以多个原子为中心的PFRs[15],自由基的生成种类多于热解,因此 250 ℃ 油浴加热淀粉的ΔHp-p明显高于热解.
2.1.2 淀粉分子官能团变化与PFRs之间的关联
图4的FTIR光谱用于研究热解和油浴加热对淀粉分子碳骨架结构的影响.图4(a)中 1 719 cm-1出现的吸收峰归因于碳水化合物COO-的拉伸振动;1 020 cm-1、567 cm-1处的吸收峰归因于α-1,4糖苷键(C-O-C)的骨骼振动[19].-CH2吸收峰(2 927 cm-1)和C-O-C(1 020 cm-1)峰在加热过程中明显减弱并发生红移,表明淀粉分子间氢键被削弱,淀粉分子内的结晶区域被破坏.1 740~1 640 cm-1淀粉出现的较强吸收峰是由半缩醛基引起,并且随着温度的升高,此处的吸收峰有分裂成2个峰的趋势,这2个峰可归为羰基峰和C=C双键峰[12].图4(b)在相似位置也能找到相同官能团的振动,除此之外,2 913 cm-1、2 848 cm-1和 1 739 cm-1分别对应甲基、亚甲基和酯基的分子振动,这些都是食用油中脂肪酸和甘油三酯的特征官能团[20].
2.1.3 淀粉分子元素变化与PFRs之间的关联
不同温度热解和油浴加热淀粉后其元素变化情况见图5.热处理后淀粉的C含量上升,O含量下降,O/C比和H/C比下降,表明淀粉热处理后含氧官能团降低,芳香化程度上升.其中 310 ℃ 时C含量增加率最大,O含量损失率最大,说明在 310 ℃ 时淀粉的降解速率最快,这与Zhao等[21]报道的热解淀粉化学结构一致.在热处理过程中,淀粉结构中的O-H键和C-O键断裂,生成烷氧基自由基和烷基自由基,烷氧基自由基通过脱烷基化反应生成C=O键(1 719 cm-1),淀粉中的羟基通过脱水反应还可以形成C=C键(1 631 cm-1).用 600 MHz13CNMR深入研究了玉米淀粉在不同温度下的化学结构变化,发现淀粉在 200 ℃ 热处理后C-4(δ=62 ppm)和C-1(δ=100 ppm)峰开始消失,同时,甲基和亚甲基峰强增加,随着温度继续升高,到 300 ℃ 时甲基和亚甲基峰强减弱,C=O键增强,并形成了苯环结构[22].Zhang等[23]发现淀粉的降解产物主要含有环酮、苯酚和烷基苯.研究证实,芳环C=C键和C=O键与PFRs的产生显著相关[24].因此,随着温度的升高,淀粉产生的PFRs信号强度越强,并且在 310 ℃ 出现PFRs信号突增的情况,与淀粉在热处理过程中不断碳化,淀粉结构不断芳香化,在形成芳香族化合物过程中产生的C=C键和C=O键有关.

(a) (b)图4 热解(a) 和油浴加热(b) 淀粉红外光谱Fig.4 FTIR of starch heated by pyrolysis (a) and oil heating (b)
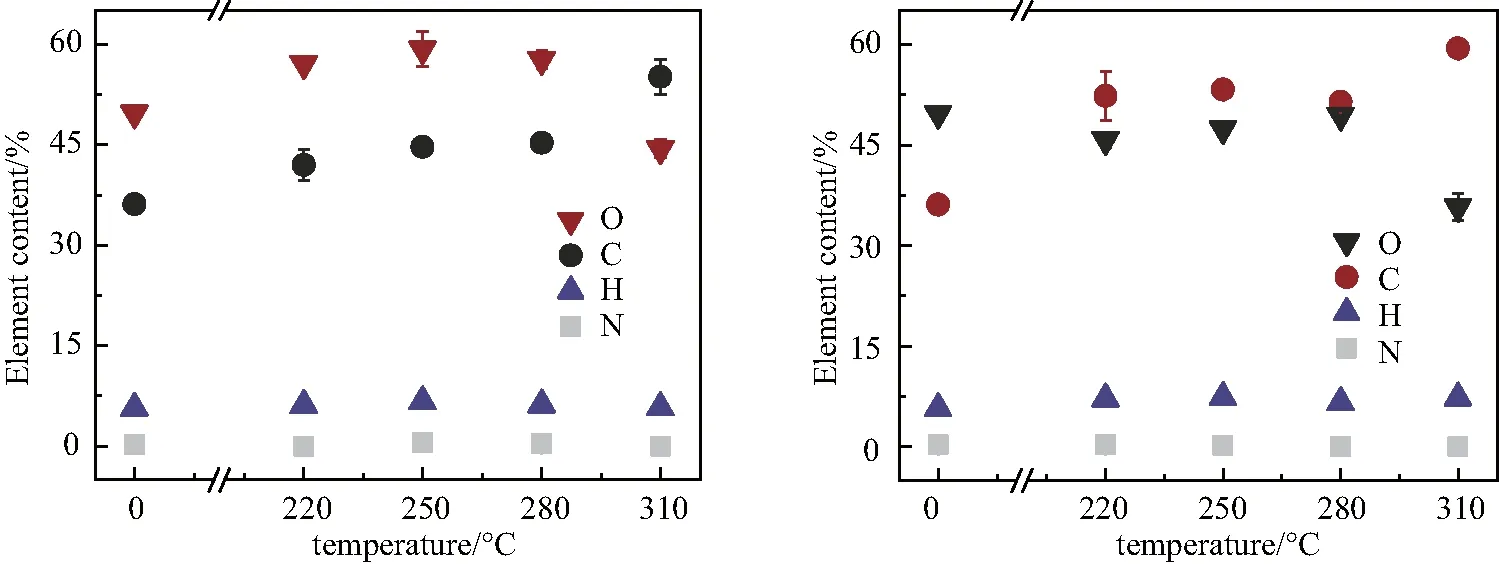
(a) (b)图5 不同温度热解(a)和油浴加热(b)淀粉的元素含量Fig.5 Element contents of starch produced by pyrolysis (a) and oil heating (b)
2.2 空气热解对不同成分食品产生PFRs的影响
由于热处理方式不同,食品产生的PFRs也不同,即使是同一食物的不同部位,也具有明显的自由基强度差异[5],因此需要探究不同成分食品热处理过程产生PFRs的差异.前面的研究指出,在一定温度范围内,油浴加热和热解处理对食品产生PFRs差异不明显,但油脂的存在会影响食品在热处理过程中结构变化的判定,因此为排除食用油中油脂成分对食品结构表征的干扰,本实验采用马弗炉对日常饮食中常见的食品成分:淀粉,蛋白质以及它们的1∶1混合物进行热解处理.
2.2.1 同温度下蛋白质比淀粉更易产生PFRs
热处理不同成分食品的PFRs信号强度图谱见图6.当加热温度达到 280 ℃ 时,才能观察到淀粉样品产生的PFRs信号,而蛋白质产生的PFRs信号在 220 ℃ 时就能观察到,这一现象与Wei等[25]的研究结果相符:玉米淀粉的初始热解温度为 280.4 ℃,而大豆蛋白的初始热解温度为 217.9 ℃.由此可推测不同成分食品PFRs来源与其结构分解有关.
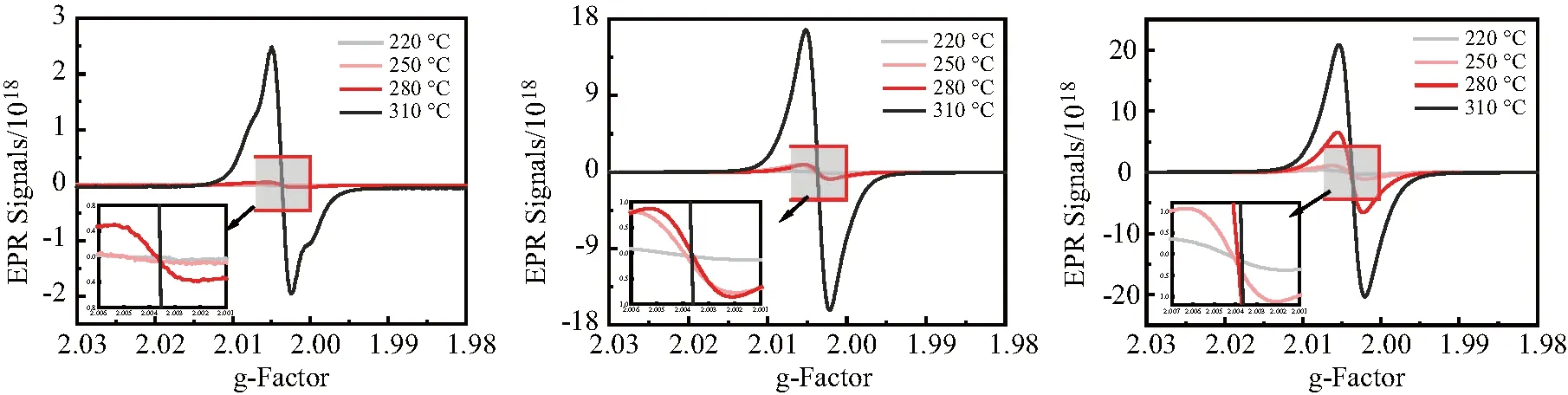
(a) (b) (c)图6 热解不同成分食品产生PFRs信号强度图谱(a为淀粉,b为蛋白质淀粉混合物,c为蛋白质)Fig.6 PFRs signal intensities produced by pyrolysis of food with different components(a: starch;b: protein-starch mixture;c: protein)
此外,容易观察到相同温度下蛋白质相较淀粉更容易产生PFRs,其产生的PFRs峰形较淀粉也有所差异.其中,310 ℃ 热处理蛋白质产生的PFRs强度为淀粉的8~10倍,可能是因为蛋白质中的氢键和二硫键会促进蛋白质与自由基的反应与转移[26].蛋白质中的二硫键断裂形成巯基,游离的巯基和游离的硫醇基团能促进蛋白质之间的聚集,且氨基酸残基易受到氧自由基的攻击形成羰基和二酪氨酸,反应过程比淀粉更复杂,形成PFRs的途径更多,因此更容易产生PFRs,进而PFRs信号强度更强[27-28].
图6中可观察到不同温度热处理蛋白质产生的PFRs信号强度均高于蛋白质淀粉混合物,这可能与淀粉蛋白质混合加热会产生美拉德反应有关.原因在于,碳水化合物的存在能够增加蛋白质的变性温度,减弱自由基生成反应[27],即添加淀粉后,需要更高的能量才能使蛋白质结构充分展开,因此蛋白质的PFRs信号强度最高,建议在日常蛋白质食品加工中可适当添加淀粉,有助于降低PFRs强度.
马弗炉热处理不同成分的食品的g值和线宽见表1.可以看出,不同组分的g值和线宽都随着温度的升高而降低.g值的变化表明随着温度的升高,不同成分食品产生小分子杂原子自由基减少,而生成了更多大分子芳香烃自由基.在 250 ℃ 时,相对淀粉蛋白质混合物和蛋白质,淀粉存在小分子杂原子自由基更多.由于线宽越小弛豫时间越长,表明不同食品组分在加热过程中自由基逐渐从低能量状态转变为高能量状态.

表1 不同成分食品热解后的g值和线宽
2.2.2 不同成分食品的元素变化与PFRs之间的关联
不同成分食品热解的元素分析见表2,其中蛋白质的C含量最高、O含量最低,热处理后不同成分食品中的C含量均增加,O含量均降低.随着加热温度的升高,不同食品成分的O/C和H/C均下降,表明不同成分食品的芳香度均随着热解温度的升高而增加,推测食品在热处理过程中发生了脱水、脱羧以及环化等反应形成了苯环结构,使芳香度增加[21].但蛋白质的O/C和H/C更低,因其变性温度低,热稳定性较差[29],故在热处理过程中,蛋白质的碳化过程比淀粉更快,在形成芳香族化合物过程中相应产生的芳环C=C和羰基基团更多,形成的PFRs强度更高.值得注意的是,蛋白质淀粉混合物的N含量随着温度的升高不断增加,可能是蛋白质中的氨基酸脱氮过程与碳水化合物的羰基之间发生美拉德反应,促进N杂环化合物的形成[25].由于含N化合物一般会转化为更稳定的芳香结构[30],而芳香结构是形成和稳定自由基的重要因素[31],因此蛋白质的PFRs强度远高于淀粉也可能与N元素在其中发挥的作用有关.

表2 热解不同成分食品元素含量变化
2.2.3 不同成分食品分子官能团变化与PFRs之间的关联
热解不同食品成分的红外光谱图谱对比可见图7.图7(b)和7(c)中 3 600~3 200 cm-1归因于蛋白质的O-H和N-H拉伸振动,2 922 cm-1为脂肪族C-H拉伸振动,1 390 cm-1为脂肪族弯曲振动[32].1 650~1 500 cm-1之间的峰对应芳环中双键的振动,如C=C或C=N[33].740 cm-1代表芳香环的摇摆振动[34].从图中可见随着温度的升高,N-H键,C-N键(1 525 cm-1)逐渐减弱并消失,C=C键或C=N键先减弱后增加,可能与蛋白质淀粉混合物中产生的N杂环化合物转化为更稳定的芳香族化合物有关.由图7(b)可见,蛋白质淀粉混合物 250 ℃ 以下的FTIR图与淀粉差别不大,280 ℃ 以上的FTIR图与蛋白质的一致,表明淀粉与蛋白质混合后初始热解过程主要由蛋白质主导,后续热解过程主要由淀粉主导.
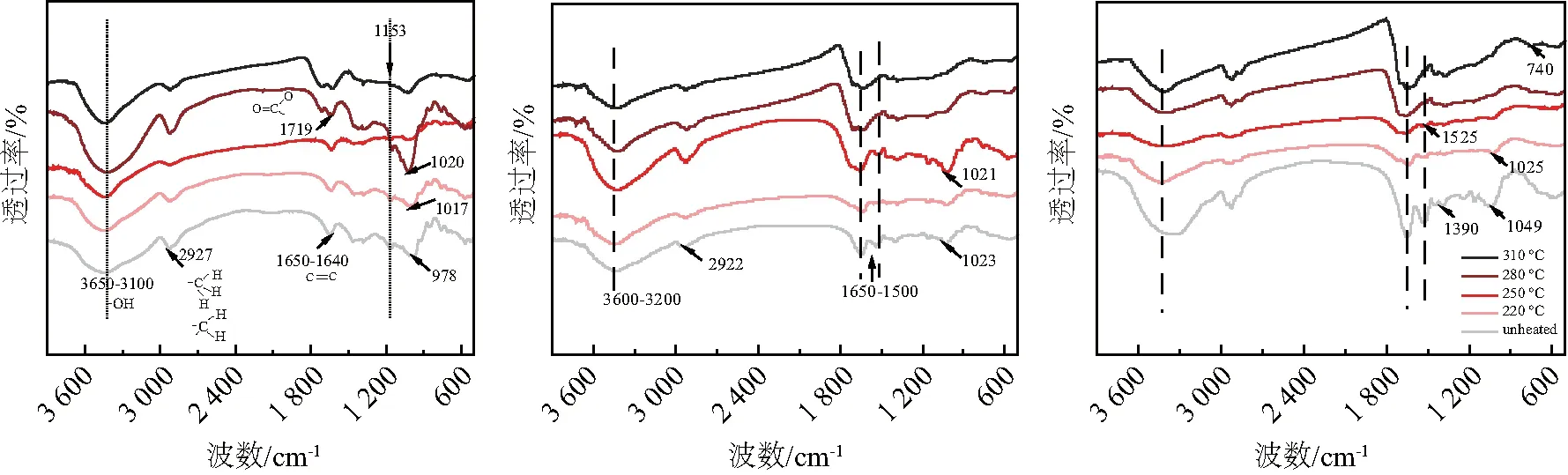
(a) (b) (c)图7 热解淀粉(a)、蛋白质淀粉混合物(b)和蛋白质(c)的红外光谱图谱Fig.7 FTIR of pyrolyzed starch (a),protein-starch mixture (b) and protein (c)
3 结 论
本研究阐述了热处理方式及温度对淀粉产生PFRs的影响和热处理对不同成分食品产生PFRs的影响,建立了食品结构变化与PFRs信号之间的关联,所得主要结论如下:
1) 食品中产生PFRs信号强度与加热温度显著相关.热处理温度低于 220 ℃ 时,淀粉中不产生PFRs信号.温度越高,淀粉产生的PFRs信号强度越强.淀粉热处理过程中生成PFRs可能与淀粉结构不断芳香化、分子中的O-H键和C-O键断裂产生C=C键和C=O键有关.
2) 在一定的热处理温度下,食品中产生的PFRs信号强度与热处理方式无明显相关性.温度为250~280 ℃,空气热解和油浴加热均能使淀粉产生PFRs信号,但PFRs信号强度之间无显著性差异.进一步升高温度时,热解淀粉产生的PFRs信号强度约为油浴加热的3倍.为降低淀粉类食品中PFRs对人体的危害,宜采用油浴加热的方式进行热处理.
3) 温度对蛋白质类食物产生PFRs影响显著,其初始热解温度比淀粉更低,在 220 ℃ 就检测出较强的PFRs信号.同一温度热处理蛋白质产生的PFRs也高于淀粉,可能是蛋白质热解过程比淀粉更复杂,形成PFRs的途径更多,蛋白质中的氢键、二硫键以及N元素可促进蛋白质与自由基的反应,蛋白质中的氨基酸残基也易受到氧自由基的攻击形成羰基.同一温度蛋白质淀粉混合物PFRs信号强度和N/C比低于蛋白质,因此日常加工蛋白质类食品,可适当添加淀粉,有助于减少PFRs的产生.

