不同高粱品种碳代谢相关酶、SPS基因表达的比较分析
徐洪超,商 靖,吕 鑫,逄洪波,王兰兰,李雪梅,马莲菊, 王艳秋,李玥莹
(1.沈阳师范大学生命科学学院,辽宁沈阳 110034; 2.辽宁省农业科学院高梁研究所,辽宁沈阳 110161)
高粱是当今世界上的主要粮食作物之一,是一种产量高、抗逆性强、适应性广的C4植物[1]。根据用途不同高粱可以分为粒用高粱、糖用高粱(甜高粱)、帚用高粱、饲用高粱4种类型。高粱还可以作为酿酒、酿醋和制糖的原料[2]。由于需求的增加,高粱的种植面积呈现上升的趋势,但很难达到像水稻、玉米种植规模的水平[3]。因此,如何提高高粱的产量,是目前科研工作者所需要研究的问题。碳代谢是植物最基础的生理代谢过程[4],碳代谢可以通过协调多种相关酶来影响植物的生长发育,对植物产量和品质的形成过程具有重要意义。
碳代谢过程涉及多种相关酶,包括蔗糖合成酶(SS)、蔗糖磷酸合成酶(SPS)、可溶性淀粉合成酶(SSS)、腺苷二磷酸葡萄糖焦磷酸化酶(ADPG-ppase)、尿苷二磷酸葡萄糖焦磷酸化酶(UDPG-ppase)等关键酶。SS作为植物蔗糖代谢过程的关键酶,可以催化蔗糖的分解与合成。SS不仅与植物产量、品质、淀粉含量相关,还在植物胁迫过程中发挥重要作用[5]。目前已经在高粱[6]、小麦[7]等多种植物体中克隆到了SS基因,并转化到其他植物中,蔗糖含量、光照等因素均可以影响SS基因的表达。前人研究发现,高粱叶片中SS、SPS活性与可溶性总糖含量呈极显著正相关关系,说明它们对高粱的糖积累过程具有重要意义[8]。SPS是调控蔗糖合成的关键酶之一,广泛存在于叶片、块茎、果实等组织中,除了在植物生长发育中发挥作用,在面对干旱、低温等胁迫时作出响应[9],SPS还可以调节碳分配。Hashida等研究表明,对水稻SPS基因进行敲除,会降低叶片中SPS活性,从而影响淀粉和蔗糖的比例[10]。SPS基因最早在玉米中被分离出来[11],甜菜[12]、枸杞[13]等物种中均相继克隆出SPS基因。光照、温度等外界因素都可以影响SPS基因的表达。SSS通常存在于可溶性基质中,在玉米胚乳中已经分离出4种类型SSS(zSSI、zSSIIa、zSSIIb 和 zSSIII),催化支链淀粉的合成[14]。曲莹等研究发现,SSS活性与淀粉含量分配的关系因生长发育的进程不同而不同[15]。温度、光照、CO2浓度等因素都能影响SSS的活性。ADPG-ppase、UDPG-ppase是淀粉合成过程中的关键酶[16]。依兵研究发现,ADPG-ppase、UDPG-ppase不仅可以催化直链淀粉的积累,还能调节支链淀粉的合成[17]。
本研究以辽粘3号、辽糯12号、辽杂11号和辽杂53号4个高粱品种为试验材料,分别测定高粱的碳代谢相关酶活性,用荧光定量PCR技术分析SPS基因的表达情况,从生理和基因的角度为筛选优质高粱品种提供理论依据与指导。
1 材料与方法
1.1 试验材料
试验材料是由辽宁省农业科学院高粱研究所提供的辽粘3号、辽杂11号、辽糯12号、辽杂53号4个高粱品种。试验采取多因素随机区组设计,行长6 m,行宽0.55 m,4行区,3次重复,氮肥用量为180 kg/hm2,磷、钾肥用量均为75 kg/hm2。
1.2 试验方法
1.2.1 碳代谢相关酶活性测定 试验于2021年在辽宁省农业科学院进行。在苗期(6月初)、拔节期(6月末7月初)、抽穗期(7月末)、成熟期(9月中下旬)4个高梁生长时期,分别随机选取辽粘3号、辽杂11号、辽糯12号、辽杂53号高粱植株的倒二叶和顶端的籽粒(抽穗期和成熟期),放入液氮速冻,迅速带回实验室于-80 ℃冰箱保存,用来测定碳代谢关键酶活性以及SPS基因的相对表达量。
SS、SPS活性的测定方法:按照张志良等的方法[18]提取粗酶液,在反应体系中依次加入0.1 mL Hepes-NaOH缓冲液、0.04 mL MgCl2、0.04 mL UDPG、0.04 mL果糖溶液、0.1 mL酶提取液进行SS活性的测定;SPS活性测定可与SS活性测定同时进行,只需将SS反应体系中的果糖溶液换成6-磷酸果糖溶液,其余试剂用量操作均与上述一致。
SSS、ADPG-ppase、UDPG-ppase的活性采用江苏宝莱公司的ELISA试剂盒检测,具体方法参照说明书。
1.2.2SPS基因表达量测定
1.2.2.1 总RNA的抽提 本过程所用试剂及其操作步骤均由武汉赛维尔生物科技有限公司提供。
1.2.2.2 反转录 逆转录反应体系见表1。

表1 逆转录反应体系
逆转录程序设置:第1阶段25 ℃,5 min;第2阶段42 ℃,30 min;第3阶段85 ℃,5 s。
1.2.2.3 RT-qPCR反应 PCR反应体系:2× qPCR Mix 7.5 μL,2.5 μmol/L基因引物(上游+下游)1.5 μL,反转录产物(cDNA)2.0 μL,ddH2O 4.0 μL。反应条件:第1阶段95 ℃预变性10 min;第2阶段95 ℃变性15 s,60 ℃退火/延伸30 s,40个循环。基因表达分析特异性引物见表2。

表2 基因表达分析特异性引物
1.3 统计分析
试验数据采用SPSS 20.0软件进行差异显著性分析,使用Origin 2021软件进行作图。
2 结果与分析
2.1 不同时期不同品种高粱SS活性比较分析
2.1.1 不同时期不同品种高粱叶片中SS活性比较分析 由图1可知,在苗期、拔节期、抽穗期、成熟期4个时期内,叶片中SS活性整体呈现先降后升的变化趋势,苗期和拔节期的SS活性变化不大,拔节期达到最低值,成熟期高粱叶片SS活性远远高于苗期和拔节期。辽粘3号、辽杂11号、辽糯12号、辽杂53号成熟期高粱叶片SS活性分别是苗期的5.30倍、3.25倍、3.13倍、3.78倍。
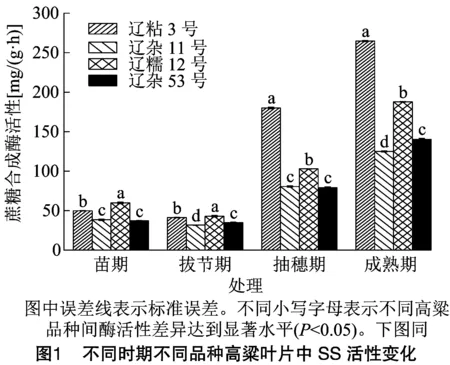
苗期和拔节期辽糯12号高粱叶片SS活性最高,辽粘3号次之;抽穗期和成熟期辽粘3号高粱叶片SS活性均显著高于其他3个高粱品种(P<0.05),抽穗期辽粘3号SS活性分别是辽杂11号、辽糯12号、辽杂53号的2.23倍、1.75倍、2.28倍;成熟期辽粘3号SS活性分别是辽杂11号、辽糯12号、辽杂53号的2.12倍、1.41倍、1.89倍。
2.1.2 不同时期不同品种高粱籽粒中SS活性比较分析 由图2可知,成熟期高粱籽粒SS活性要高于抽穗期,辽粘3号、辽杂11号、辽糯12号、辽杂53号成熟期高粱籽粒SS活性分别是抽穗期的2.05倍、1.66倍、1.52倍、4.64倍。抽穗期高粱籽粒SS活性表现为辽粘3号>辽糯12号>辽杂11号>辽杂53号,其中辽粘3号和辽糯12号差异不显著;成熟期高粱籽粒SS活性表现为辽粘3号>辽杂53号>辽糯12号>辽杂11号,辽粘3号显著高于其他品种(P<0.05),分别比辽杂53号、辽糯12号、辽杂11号提高了9.01%、36.83%、40.58%。

2.2 不同时期不同品种高粱SPS活性比较分析
2.2.1 不同时期不同品种高粱叶片中SPS活性比较分析 由图3可知,在苗期、拔节期、抽穗期、成熟期4个时期,高粱叶片SPS活性呈先降后升的变化趋势,拔节期活性最低,成熟期活性最高,这与SS活性的变化趋势基本一致。辽粘3号、辽杂11号、辽糯12号、辽杂53号成熟期高粱叶片SPS活性分别是苗期的5.09倍、3.32倍、3.12倍、2.87倍。
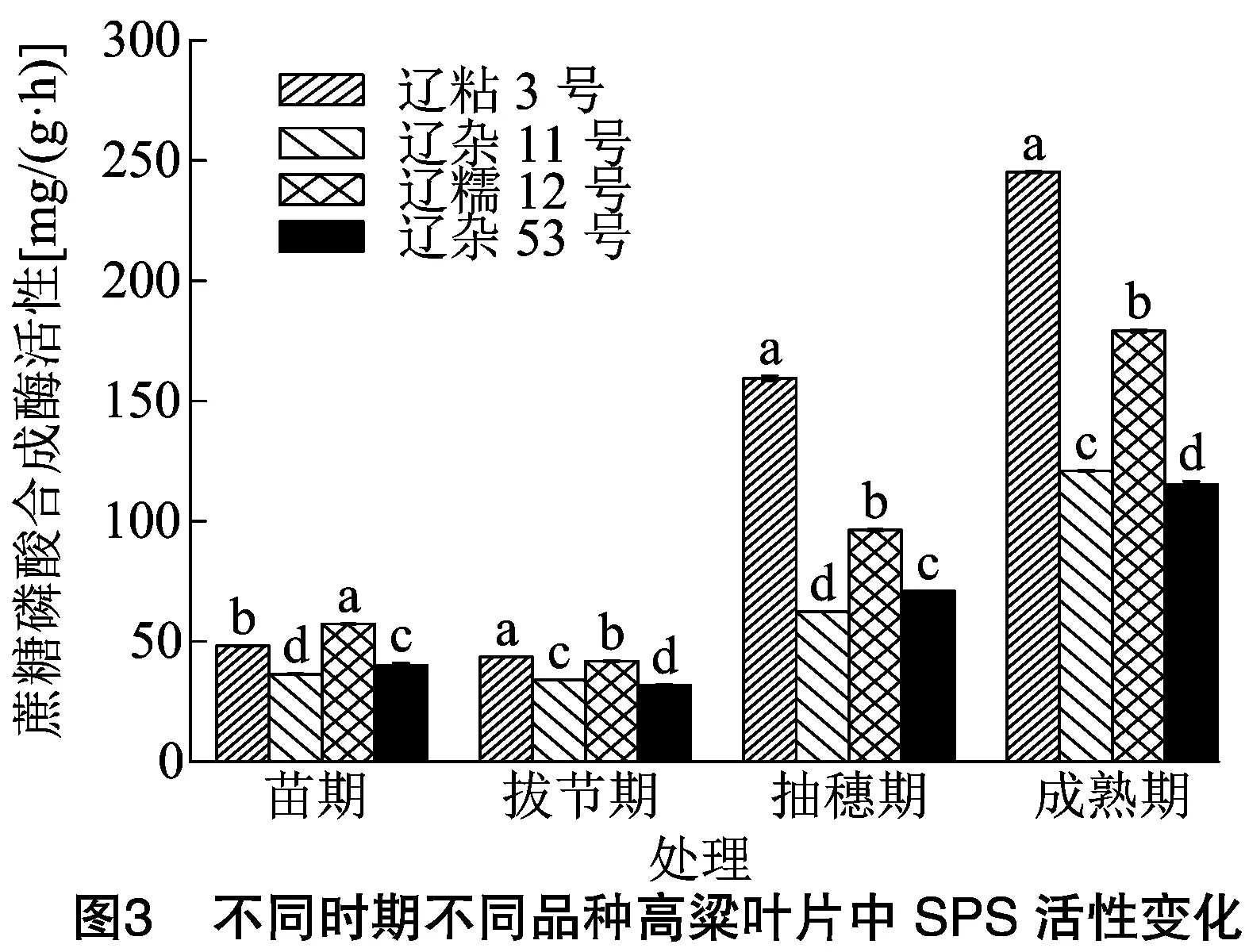
苗期高粱叶片SPS活性表现为辽糯12号>辽粘3号>辽杂53号>辽杂11号;抽穗期高粱叶片SPS活性表现为辽粘3号>辽糯12号>辽杂53号>辽杂11号,辽粘3号显著高于其他3个品种;成熟期辽粘3号高粱叶片SPS活性也显著高于其他3个品种(P<0.05),分别是辽糯12号、辽杂53号、辽杂11号的1.37倍、2.12倍、2.03倍。
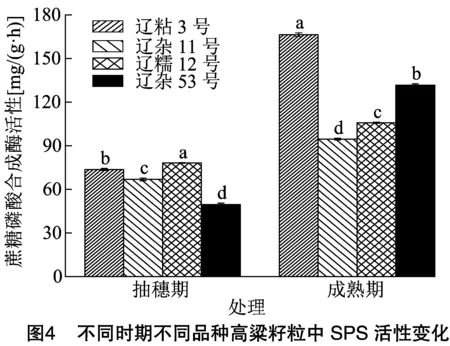
2.2.2 不同时期不同品种高粱籽粒中SPS活性比较分析 由图4可知,成熟期高粱籽粒SPS活性明显高于抽穗期,成熟期辽粘3号、辽杂11号、辽糯12号、辽杂53号高粱籽粒的SPS活性分别是抽穗期的2.26倍、1.41倍、1.35倍、2.66倍。抽穗期辽糯12号高粱籽粒SPS活性最高,辽粘3号次之;成熟期高粱籽粒SPS活性表现为辽粘3号>辽杂53号>辽糯12号>辽杂11号,辽粘3号高粱籽粒SPS活性分别比辽杂53号、辽糯12号、辽杂11号提高了26.26%、57.22%、75.81%。
2.3 不同时期不同品种高粱SSS活性比较分析
2.3.1 不同时期不同品种高粱叶片中SSS活性比较分析 由图5可知,在苗期、拔节期、抽穗期、成熟期4个时期内,辽粘3号和辽杂11号高粱叶片SSS活性呈先降后升的趋势;辽糯12号和辽杂53号呈先升再降再升的变化趋势,但4个品种的SSS活性均在成熟期达到最高。成熟期辽粘3号、辽杂11号、辽糯12号、辽杂53号高粱叶片SSS活性分别是苗期的1.80倍、1.41倍、1.64倍、1.11倍。
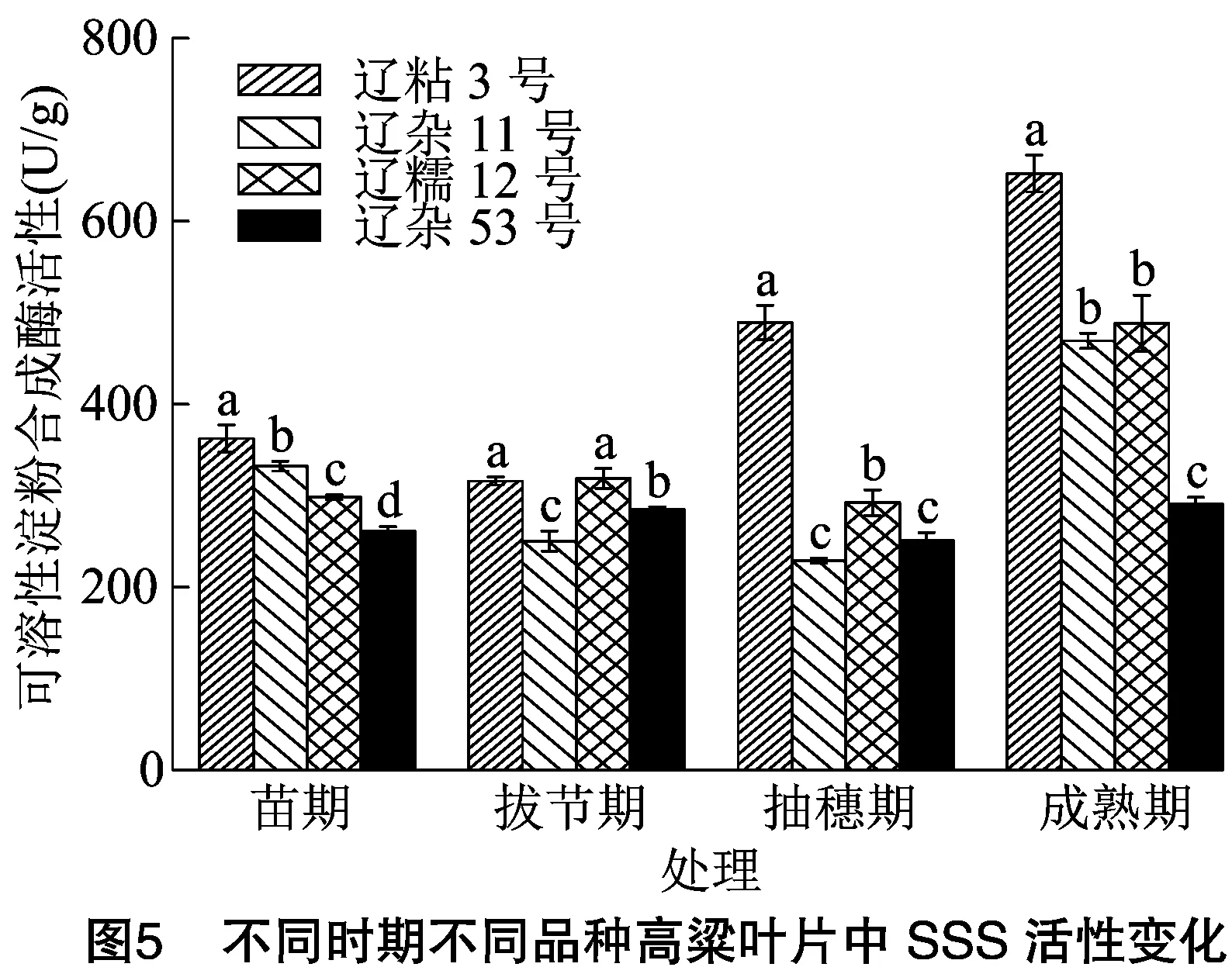
苗期,高粱叶片SSS活性表现为辽粘3号>辽杂11号>辽糯12号>辽杂53号,辽粘3号SSS活性显著高于其他3个品种;拔节期,高粱叶片SSS活性表现为辽糯12号>辽粘3号>辽杂53号>辽杂11号,辽糯12号和辽粘3号之间差异不显著;抽穗期和成熟期辽粘3号高粱叶片SSS活性均最高,辽糯12号次之,抽穗期辽粘3号高粱叶片SSS活性分别是辽糯12号、辽杂53号、辽杂11号的1.67倍、1.95倍、2.14倍;成熟期辽粘3号高粱叶片SSS活性分别是辽糯12号、辽杂53号、辽杂11号的1.34倍、2.24倍、1.39倍。
2.3.2 不同时期不同品种高粱籽粒中SSS活性比较分析 由图6可知,除辽杂53号外,其余3个高粱品种成熟期籽粒SSS活性均高于抽穗期,辽粘3号、辽杂11号、辽糯12号、辽杂53号成熟期高粱籽粒SSS活性分别是抽穗期的1.44倍、1.38倍、1.48倍、94%。抽穗期高粱籽粒SSS活性表现为辽杂53号>辽粘3号>辽杂11号>辽糯12号;成熟期辽粘3号高粱籽粒SSS活性显著高于其他3个高粱品种(P<0.05),分别比辽糯12号、辽杂11号、辽杂53号提高了17.57%、23.59%、25.74%。

2.4 不同时期不同品种高粱ADPG-ppase活性比较分析
2.4.1 不同时期不同品种高粱叶片中ADPG-ppase活性比较分析 由图7可知,在苗期、拔节期、抽穗期、成熟期4个时期内,不同高粱品种的变化趋势不太一致,除辽杂11号外,其他高粱品种在抽穗期出现峰值,辽粘3号高粱叶片ADPG-ppase活性从苗期到抽穗期的变化比较大,抽穗期ADPG-ppase的活性是苗期的1.47倍。
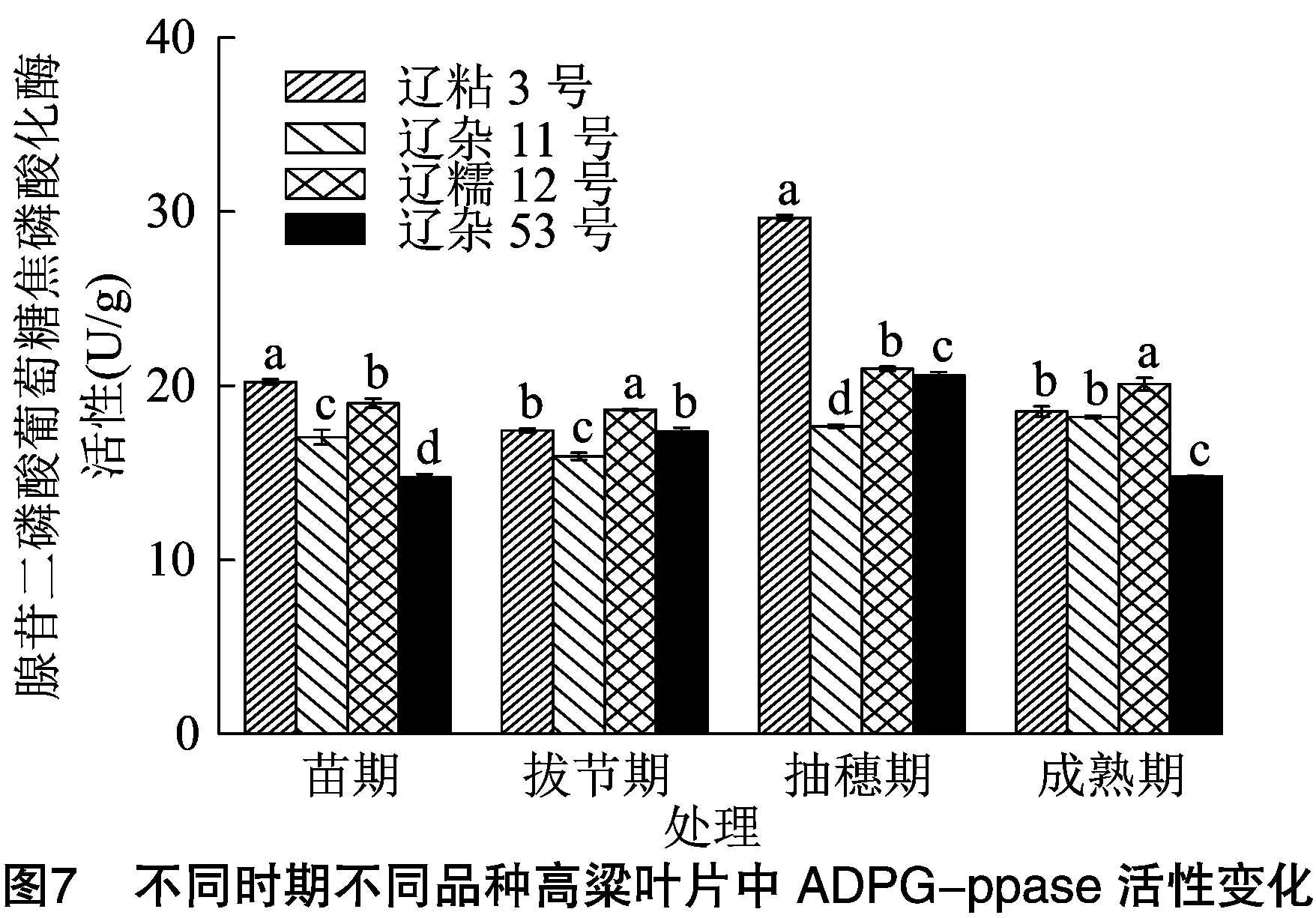
苗期,高粱叶片ADPG-ppase活性表现为辽粘3号>辽糯12号>辽杂11号>辽杂53号,辽粘3号显著高于其他3个品种(P<0.05);拔节期,高粱叶片ADPG-ppase活性表现为辽糯12号>辽粘3号>辽杂53号>辽杂11号;抽穗期,辽粘3号高粱叶片ADPG-ppase活性显著高于其他3个高粱品种,分别比辽糯12号、辽杂53号、辽杂11号提高了41.32%、43.91%、67.69%;成熟期辽糯12号高粱籽粒ADPG-ppase活性最高,辽粘3号次之。
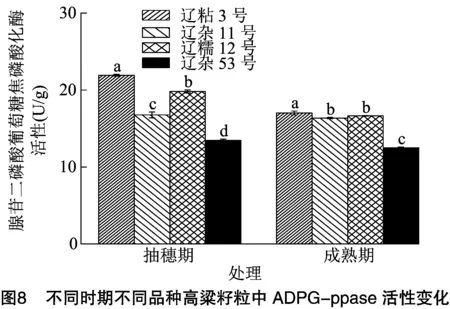
2.4.2 不同时期不同品种高粱籽粒中ADPG-ppase活性比较分析 由图8可知,4个高粱品种成熟期高粱籽粒ADPG-ppase活性均低于抽穗期,辽粘3号、辽杂11号、辽糯12号、辽杂53号成熟期高粱籽粒ADPG-ppase活性分别是抽穗期的78%、98%、84%、93%。抽穗期、成熟期高粱品种籽粒ADPG-ppase活性均表现为辽粘3号>辽糯12号>辽杂11号>辽杂53号,抽穗期,辽粘3号高粱籽粒ADPG-ppase活性显著高于其他3个品种,分别比辽糯12号、辽杂11号、辽杂53号提高了10.62%、30.72%、62.72%。
2.5 不同时期不同品种高粱UDPG-ppase活性比较分析
2.5.1 不同时期不同品种高粱叶片中UDPG-ppase活性比较分析 由图9可知,在苗期、拔节期、抽穗期、成熟期4个时期内,辽粘3号和辽糯12号叶片UDPG-ppase活性呈升高趋势,辽杂11号和辽杂53号呈先升再降再升的变化趋势,UDPG-ppase活性均在成熟期达到最高。辽粘3号成熟期高粱叶片UDPG-ppase活性是苗期的1.44倍。
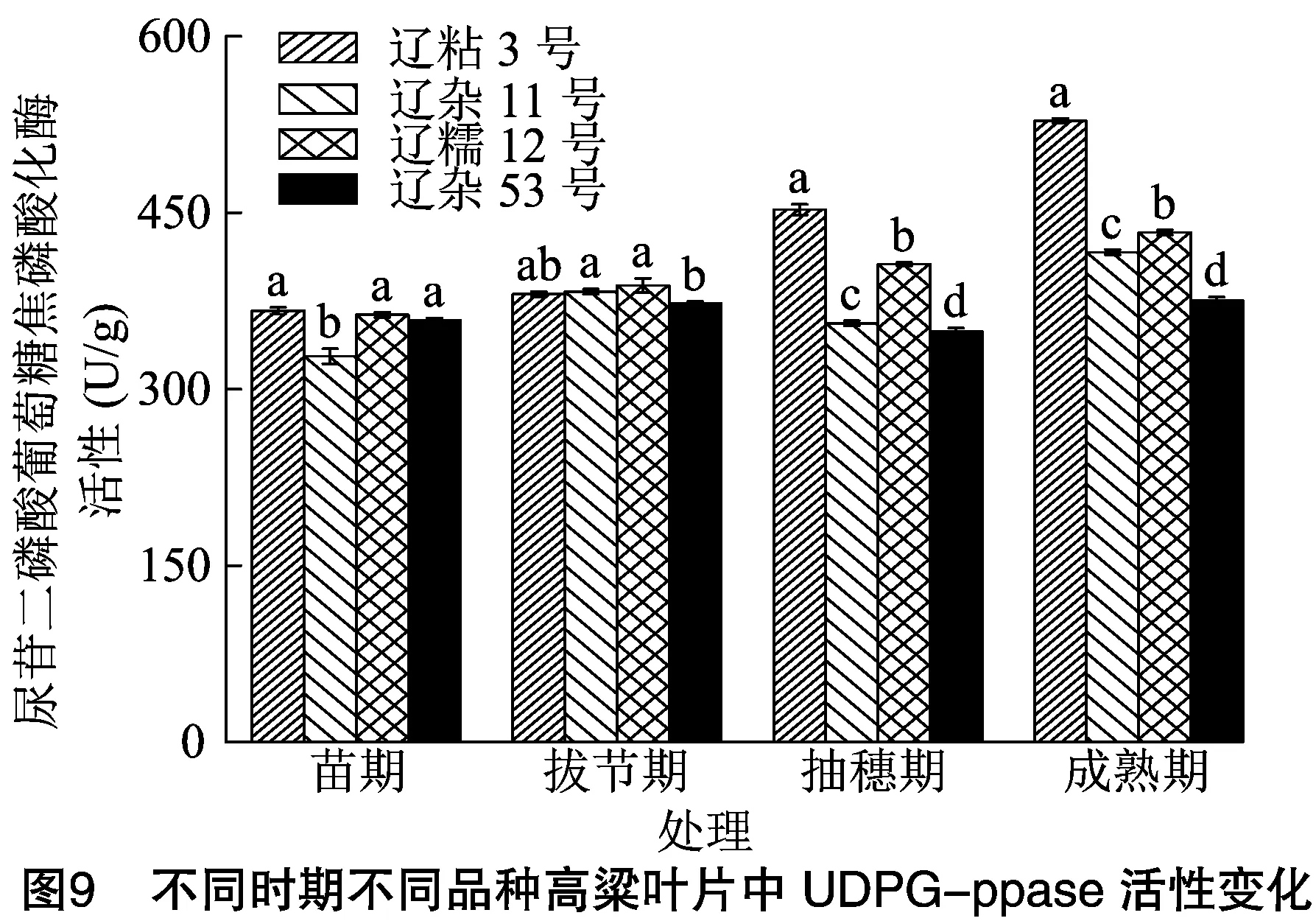
苗期,高粱叶片UDPG-ppase活性表现为辽粘3号>辽糯12号>辽杂53号>辽杂11号,辽粘3号、辽糯12号、辽杂53号之间差异不显著;拔节期高粱叶片UDPG-ppase活性表现为辽糯12号>辽杂11号>辽粘3号>辽杂53号;抽穗期和成熟期高粱叶片UDPG-ppase活性均表现为辽粘3号>辽糯12号>辽杂11号>辽杂53号,4个高粱品种之间差异显著,抽穗期辽粘3号高粱叶片UDPG-ppase活性分别比辽糯12号、辽杂11号、辽杂53号提高了11.37%、27.10%、29.65%;成熟期辽粘3号高粱叶片UDPG-ppase活性分别比辽糯12号、辽杂11号、辽杂53号提高了21.87%、26.83%、40.66%。
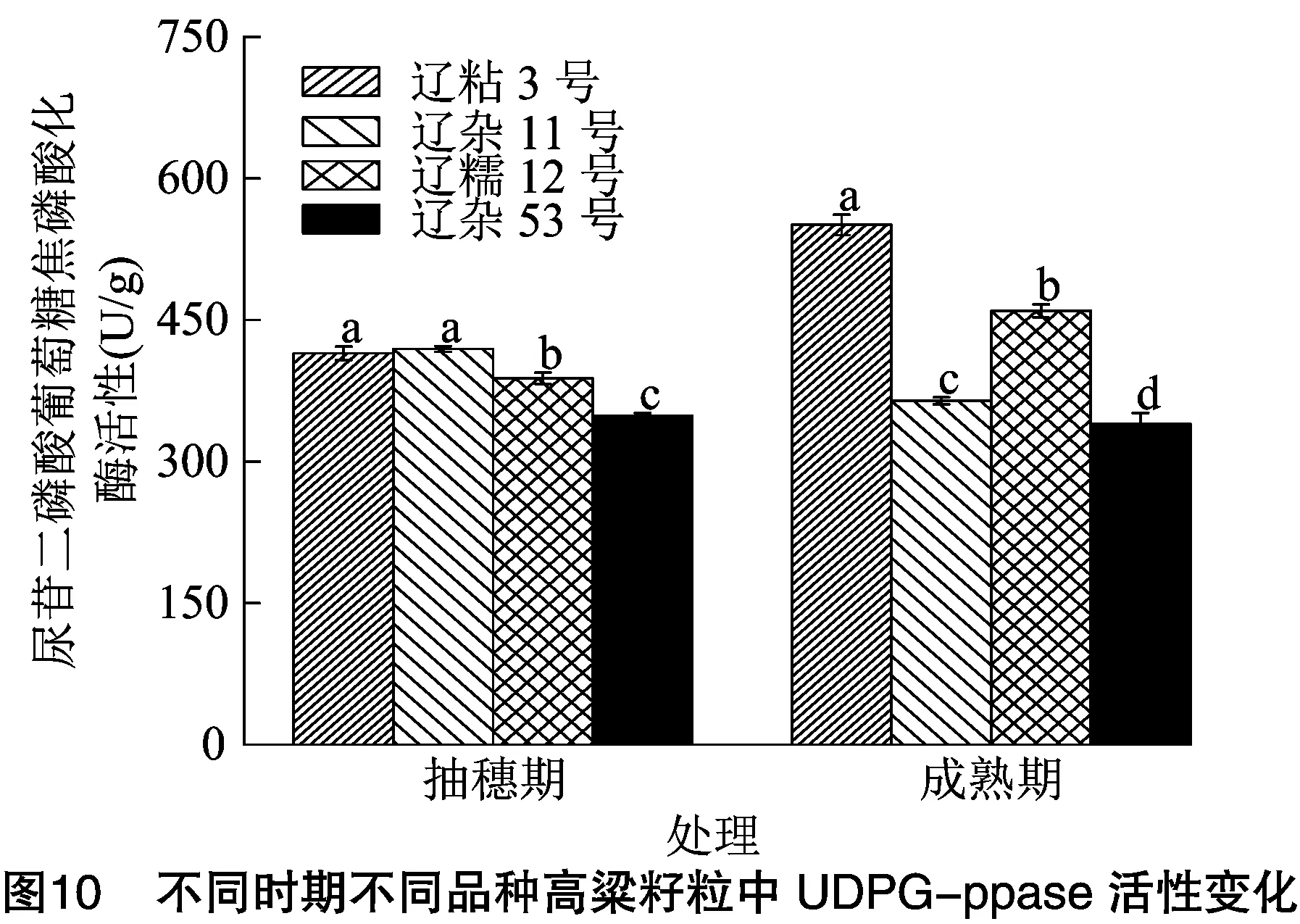
2.5.2 不同时期不同品种高粱籽粒中UDPG-ppase活性比较分析 由图10可知,辽粘3号和辽糯12号成熟期高粱籽粒UDPG-ppase活性比抽穗期高,辽杂11号和辽杂53号成熟期高粱籽粒UDPG-ppase活性比抽穗期低。辽粘3号、辽杂11号、辽糯12号、辽杂53号成熟期高粱籽粒UDPG-ppase活性分别是抽穗期的1.33倍、87%、1.18倍、97%。抽穗期,高粱籽粒UDPG-ppase活性表现为辽杂11号>辽粘3号>辽糯12号>辽杂53号,其中辽杂11号与辽粘3号差异不显著;成熟期,高粱籽粒UDPG-ppase活性表现为辽粘3号>辽糯12号>辽杂11号>辽杂53号,辽粘3号高粱籽粒UDPG-ppase活性显著高于其他品种,分别比辽糯12号、辽杂11号、辽杂53号提高了19.85%、51.21%、62.14%。
2.6 不同时期不同品种高粱SPS基因表达比较分析
2.6.1 不同时期不同品种高粱叶片中SPS基因表达比较分析 对4个高粱品种叶片的SPS基因表达量进行测定,选取辽粘3号高粱品种作为对照,发现苗期4个高粱品种叶片SPS基因表达量表现为辽粘3号>辽糯12号>辽杂53号>辽杂11号,辽粘3号高粱叶片SPS基因表达量显著高于其他品种,分别是辽糯12号、辽杂53号、辽杂11号的2.11倍、4.90倍、7.41倍;拔节期,辽糯12号高粱叶片SPS基因表达量最高,辽粘3号次之;抽穗期辽粘3号、辽糯12号高粱叶片SPS基因表达量要显著高于辽杂53号、辽杂11号;成熟期,4个高粱品种叶片SPS基因表达量表现为辽粘3号>辽杂11号>辽糯12号>辽杂53号,4个高粱品种之间差异均不显著(图11)。

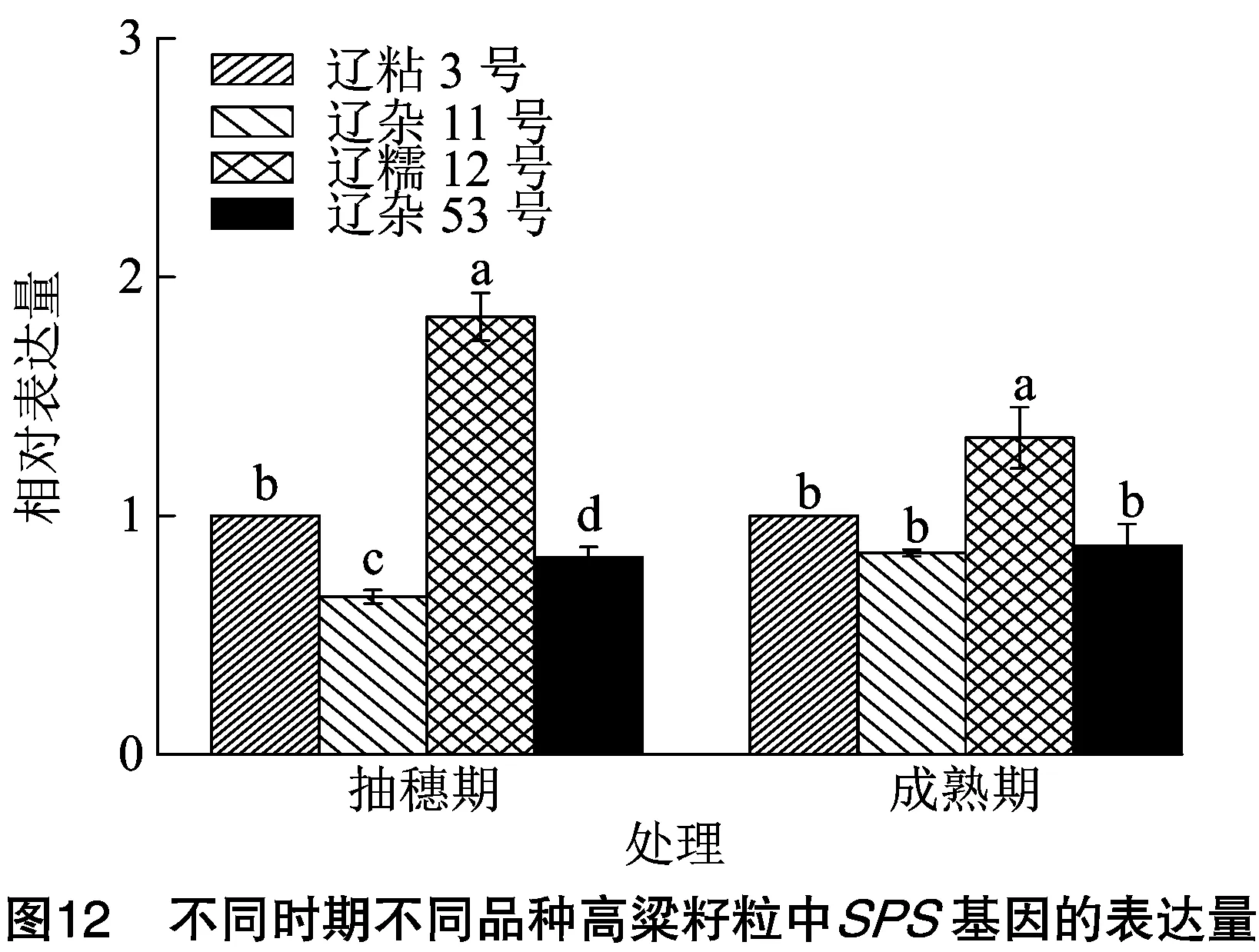
2.6.2 不同时期不同品种高粱籽粒中SPS基因表达比较分析 对4个高粱品种籽粒SPS基因表达量进行测定,选取辽粘3号高粱品种作为对照,发现抽穗期和成熟期4个高粱品种籽粒SPS基因表达量均表现为辽糯12号>辽粘3号>辽杂53号>辽杂11号,抽穗期4个品种之间差异比较显著,辽糯12号高粱籽粒SPS基因表达量分别是辽粘3号、辽杂53号、辽杂11号的1.83倍、2.22倍、2.78倍(图12)。
3 讨论与结论
3.1 不同高粱品种碳代谢关键酶活性的比较
蔗糖代谢和淀粉代谢是2种重要的糖代谢途径,代谢途径不同,所需要的关键酶也会有所差异。与蔗糖代谢相关的酶主要包括SS、SPS等[19];与淀粉代谢相关的酶主要包括SSS、ADPG-ppas、UDPG-ppase 等。其中UDPG-ppase可以催化三磷酸尿苷(UTP)和葡萄糖-1-磷酸生成尿苷二磷酸葡萄糖(UDPG),UDPG和6-磷酸果糖在SPS催化下生成二磷酸尿苷(UDP)和6-磷酸蔗糖,6-磷酸蔗糖可以在磷酸酯酶脱磷酸作用下生成蔗糖[20];UDPG和果糖在SS催化作用下也可以生成蔗糖和UDP。葡萄糖-1-磷酸和三磷酸腺苷(ATP)在ADPG-ppas作用下可以生成淀粉合成的前体物质ADPG,ADPG经过SSS催化作用可以合成直链淀粉[21]。以上多种碳代谢相关酶相互合作协调,共同调节蔗糖代谢和淀粉代谢过程。牛俊奇等对甘蔗研究发现,SS、SPS活性的提高有利于蔗糖的积累[22]。王芳等研究发现,ADPG-ppase、UDPG-ppase的活性与小麦籽粒中淀粉的积累速率呈正相关关系[23]。
本研究发现,整个时期4个品种高粱叶片SS、SPS活性均呈先降后升的变化趋势,拔节期活性最低,成熟期最高,这与李春阳等的研究结果[8]一致;4个高粱品种叶片的SSS、ADPG-ppase、UDPG-ppase活性随生长时期的推进变化趋势不大相同,但是SSS、UDPG-ppase活性均在成熟期最高,除辽杂11号外,其他高粱品种ADPG-ppase活性均在抽穗期达到峰值。抽穗期到成熟期是高粱籽粒逐渐生成并积累有机物的过程,叶片经过光合作用等过程将产生的糖类等物质源源不断地运往籽粒,以供籽粒生长发育,所以抽穗期和成熟期对碳代谢产物需求更大,相关酶活性更高。
对同一时期不同高粱品种碳代谢相关酶活性比较发现,抽穗期和成熟期辽粘3号高粱叶片和籽粒的SS活性均高于其他3个高粱品种,苗期和拔节期辽糯12号高粱叶片SS活性最高,辽粘3号次之;拔节期、抽穗期、成熟期辽粘3号高粱叶片和成熟期籽粒的SPS活性显著高于其他品种;辽粘3号高粱叶片在苗期、抽穗期、成熟期的SSS活性均显著高于其他3种高粱品种,成熟期籽粒SSS活性也是最高;苗期和抽穗期辽粘3号高粱叶片ADPG-ppase活性显著高于辽杂11号、辽杂53号、辽糯12号,抽穗期、成熟期高粱籽粒的ADPG-ppase活性均表现为辽粘3号>辽糯12号>辽杂11号>辽杂53号;抽穗期高粱叶片、成熟期高粱叶片和籽粒的UDPG-ppase活性均表现为辽粘3号>辽糯12号>辽杂11号>辽杂53号。整体上来说,辽粘3号高粱品种叶片和籽粒在各个时期的碳代谢相关酶活性都处于较高水平,有利于蔗糖、淀粉等物质的积累,从而提高高粱的产量和品质。
3.2 不同高粱品种SPS基因表达的比较
SPS基因是作物蔗糖合成中重要的调节基因[24-25]。刘洋等采用同源克隆的方法,首次克隆了SPS3-1,可为高粱糖代谢分子机制的研究奠定基础[26]。SPS基因在组织器官表达、蔗糖代谢、转录调控等过程中具有重要意义[24]。杨明等检测了高粱中SPS蛋白的表达,认为蔗糖积累与SPS的表达密切相关[27]。吕佳红等研究发现,翠冠果实中3个SPS基因变化趋势与蔗糖积累一致,表明SPS基因与蔗糖积累关系非常密切[28]。
本试验研究发现,苗期、抽穗期、成熟期辽粘3号高粱叶片SPS基因相对表达量最高,辽粘3号拔节期叶片和抽穗期、成熟期籽粒SPS基因相对表达量仅次于辽糯12号。同时,辽粘3号在抽穗期、成熟期叶片的SPS活性均显著高于其他高粱品种,在抽穗期籽粒中的SPS活性仅低于辽糯12号,这与基因表达结果大体一致。
综上所述,辽粘3号高粱品种叶片和籽粒在各个时期的SS、SPS、SSS、ADPG-ppase、UDPG-ppase均具有较高的活性;苗期、抽穗期、成熟期辽粘3号高粱叶片SPS基因相对表达量均为最高,抽穗期、成熟期辽粘3号高粱籽粒SPS基因相对表达量仅略低于辽糯12号,并且辽粘3号SPS基因相对表达量与SPS活性测定结果大体一致。因此,辽粘3号高粱品种可作为高粱生产中的首选品种,为筛选高产高效的高粱品种提供了重要依据。

