PAAc-NHS酯/明胶复合水凝胶口腔贴剂的性能研究
敦芷悦,孙川越,张志豪,舒 菲,张青红,刘 梅
口腔溃疡作为口腔高发疾病,其治疗方法以局部给药为主[1]。常用的局部治疗剂型主要包括含漱剂、喷雾剂、凝胶、软膏等液体式和涂抹式半固体制剂,但是均存在易受唾液影响、药物作用时间短、疗效低等不足。为克服这些传统剂型的不足,口腔黏膜贴剂从21世纪初作为一种新型口腔黏膜治疗手段,被深入研究以提高治疗效率[2]。
口腔黏膜贴剂是一种生物黏附性制剂(bioadhesion drug de-1ivery system),利用高分子材料和黏膜所产生的黏附性,延长在病变部位的滞留时间,在利于发挥疗效的同时还对伤口起到覆盖保护作用。此类研究近年来被广泛关注,但多停留在实验室阶段[3]。目前临床上常见的是透明质酸水凝胶薄膜制剂(Gengigel®),由于唾液的流动性和挥发性,往往会偏离患处,使其有效性受到限制。
明胶是一种蛋白质类天然高分子材料,具有良好的生物降解性和生物相容性,存在力学性能较差、质脆、耐水性差、无生物黏附性等缺点[4-7]。由n-羟基琥珀酰亚胺酯接枝的聚丙烯酸(PAAc-NHS酯)是一种已被研究证明的黏膜黏附聚合物[8]。得益于其富含的羧酸基团和亚胺酯基团,可以在潮湿的组织表面快速形成强韧而持久的黏附[9]。因此,本研究尝试利用PAAc-NHS酯与明胶两者的优势,并将其复合,制备复合水凝胶贴剂进一步检测其性能。
1 材料与方法
1.1 试剂与仪器
明胶(A型)、丙烯酸(Sigma,美国),丙烯酸-N-琥珀酰亚胺酯(AAc-NHS酯)、α-酮戊二酸、磷酸盐缓冲液(PBS)、杜氏磷酸盐缓冲液(DPBS)(Aladdin,中国),L929细胞系(P14~17,中国科学院细胞库),DMEM培养基(凯基,中国),胎牛血清、青霉素-链霉素双抗溶液(Gibco,美国),0.25%胰酶/EDTA(Gibco,美国),CCK-8试剂盒(Tongren,日本),光固化仓(SFD,395 nm,中国),5982电子万能材料实验机(Instron,美国),IS50傅里叶变换红外光谱仪(Thermo fisher,美国),LGJ-10冷冻干燥机(北京松源华兴科技发展有限公司,中国),SpectraMax M2e多功能酶标仪(Melecular Devices,德国),扫描电子显微镜(SEM)、倒置显微镜(Tescan,捷克)。
1.2 PAAc-NHS酯/明胶复合水凝胶的制备与表征
1.2.1 PAAc-NHS酯/明胶复合水凝胶的制备 按照表1配比,称取明胶溶于去离子水中,在磁力搅拌器上于80 ℃、600 r/min条件下使明胶充分溶解获得明胶溶液。待明胶溶液温度下降至37 ℃时,按比例加入丙烯酸、AAc-NHS酯、甲基丙烯酰胺基明胶(gelMA)以及α-酮戊二酸,并在磁力搅拌器上37 ℃、600 r/min避光混匀,得到各组PAAc-NHS酯/明胶复合水凝胶预聚物。取140 μL预聚物注满定制的聚四氟乙烯模具,于紫外光固化仓中于395 nm下光照固化300 s,最终获得3组PAAc-NHS酯/明胶复合水凝胶。

表1 水凝胶分组及其组成Tab.1 Grouping and composition of hydrogels
1.2.2 SEM 为避免结构塌陷,将水凝胶在-80 ℃下保存至少12 h后冷冻干燥[10],将冻干样品在真空下用金溅射20 min,以确保样品的电导率,然后使用SEM观察冻干后各组PAAc-NHS酯/明胶复合水凝胶表面的微观结构。
1.2.3 傅里叶变换红外光谱(FT-IR) 用明胶和去离子水制备纯明胶水凝胶(10%明胶)样品,自然干燥形成干明胶[11]。从A、B、C组PAAc-NHS酯/明胶复合水凝胶与干明胶中随机选取样品,各组样品自然干燥后,用傅里叶变换红外光谱仪检测各组干凝胶样品表面的官能团情况。
1.3 PAAc-NHS酯/明胶复合水凝胶的机械性能
每组随机选取3个样品,将样品切割成20 mm×10 mm×1 mm的方块,固定在电子万能材料实验机的两个拉伸夹具之间,以10 mm/min的速度拉伸样品,直至断裂,计算各组样品断裂伸长率和拉伸强度。拉伸强度和断裂伸长率计算公式如下[12]:
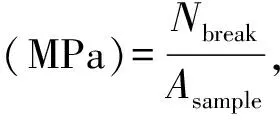
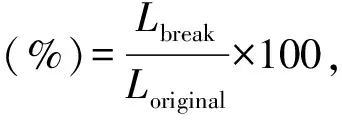
其中Nbreak(N)是破膜所需的最大载荷,Asample(mm2)是样品的横截面积,Lbreak(mm)是断裂点处增加的长度,Loriginal(mm)是原始长度。
1.4 溶胀性能测试
通过吸水率测试水凝胶的溶胀性能[13]。于3组PAAc-NHS酯/明胶复合水凝胶中各随机选取直径1.5 mm、厚度1 mm的3个样品,擦干表面多余液体后测得原始质量(Wi),将各组样品置于PBS中,设置1、2、3、4、6、8、24 h为时间预设点;在每个预设点将样品从PBS中取出,擦干其表面多余的液体称取质量(Wt),每次称重结束后都将样品重新放回PBS中,按照下面的公式计算水凝胶在不同时间的溶胀率:

1.5 保水性能测试
通过保水测试评估PAAc-NHS酯/明胶复合水凝胶中的水分守恒[14]。于3组PAAc-NHS酯/明胶复合水凝胶中各随机选取直径1.5 mm、厚度1 mm的3个样品,擦干表面多余液体后测得原始质量(Wo)。随后将各组样品置于PBS中24 h。然后用滤纸擦拭样品以除去表面多余水分,并置于37 ℃恒温烘箱的培养皿中。设置1、2、3、4、6、8、24、48 h为时间预设点,在各个时间预设点称取样品质量(Ww)。按照下面的公式计算各组样品的保水率:
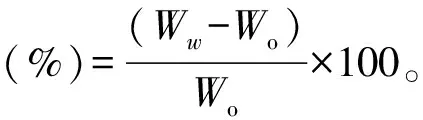
1.6 体外黏附形态观察
按1.2.3制备只含有明胶的明胶水凝胶样品并选取新鲜的湿猪皮肤,清洁去污。为了更好地验证PAAc-NHS酯对水凝胶黏附性能的影响,除上述A、B、C 3组实验组外,增设纯明胶水凝胶组作为对照组。分别取10 mm×20 mm×1 mm的各组水凝胶黏附于湿润的猪皮上,将各组水凝胶黏附于猪皮肤后,用100 g砝码无压力静置5 min,再将猪皮肤进行弯曲和扭曲,观察各组水凝胶的黏附状况。
1.7 细胞学毒性检测
1.7.1 细胞培养及浸提液制备 将冻存的L929细胞系体外复苏后,加入DMEM培养基(含有10%胎牛血清、1%青霉素-链霉素双抗溶液),在37 ℃、95%相对湿度、5% CO2恒温培养箱中静置培养,每2~3 d换液。显微镜下观察细胞生长情况,待细胞密度达80%后进行传代。根据ISO 10993-5:2009,将各组样品事先泡入DMEM完全培养基中24 h以达到溶胀状态,防止制备浸提液时吸收培养基,然后以10 mg/mL的质量浓度将样品浸入DMEM完全培养基中,37 ℃、5%CO2下孵育24 h以获取各组实验样品浸提液[9,15-16]。
1.7.2 CCK-8实验 本实验使用CCK-8试剂盒来检测各组实验样品的细胞毒性。将L929培养至对数生长期后将细胞以2 000个/孔的密度接种于96孔板中,在37 ℃、5% CO2下孵育。待细胞完全贴壁后,向其中加入各组样品浸提液。设空白对照组为D组,即为纯DMEM培养基培养条件。在共培养1、3、5、7 d后,分别向其中加入CCK-8溶液,于孵箱中避光孵育1 h。用酶标仪测量每个孔在450 nm处的光密度值并进行分析。
1.7.3 细胞形态 镜下观察将L929细胞以3×105个/孔的密度接种于六孔板,于37 ℃、5%CO2条件下培养24 h,待细胞完全贴壁后,向其中加入各组样品浸提液。同样设D组为纯DMEM培养基培养的空白对照组。随后于37 ℃、5%CO2下孵育48 h后,使用倒置显微镜观察细胞形态。
1.8 统计学分析
实验结果采用SPSS 22.0软件进行处理;定量数据的表示形式为平均值±标准差;通过单因素方差分析检验组间差异,采用LSD-t检验进行组间两两比较;数据的置信水平为95%,P<0.05为差异有统计学意义。
2 结 果
2.1 理化性能结果
2.1.1 SEM 图1显示了SEM下各组PAAc-NHS酯/明胶复合水凝胶的微观形貌及孔径分布,A、B、C 3组均显示出多孔的网络结构。其中,A组复合水凝胶的孔径最大,结构最为疏松;而C组复合水凝胶的孔径最小。也就是说,随着各实验组中PAAc-NHS酯含量的增加,复合水凝胶的孔径呈逐渐减小趋势,其网络结构变得更加致密。
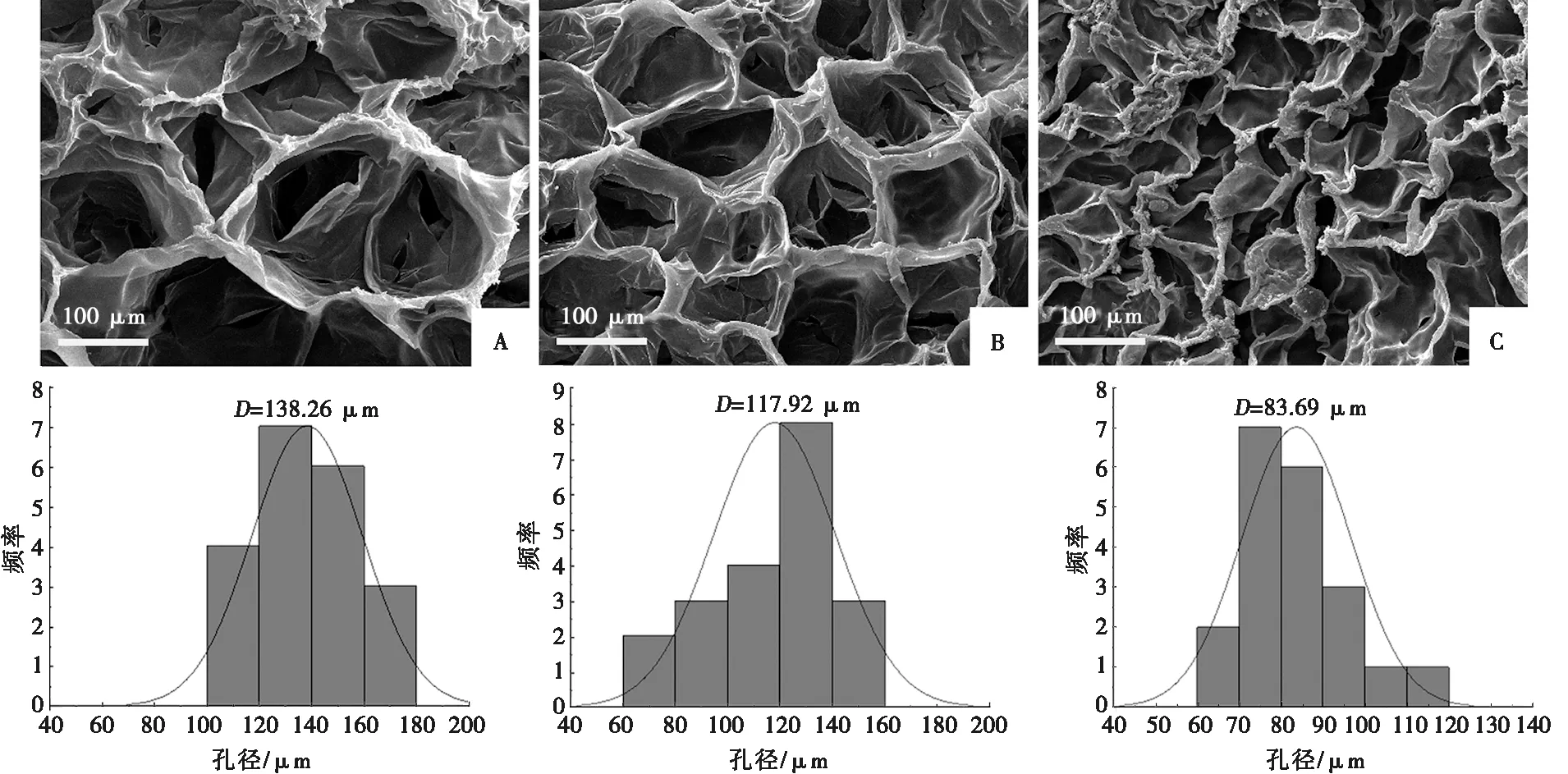
A:A组,10% PAAc-NHS酯;B:B组,20% PAAc-NHS酯;C:C组,30% PAAc-NHS酯

2.2 机械性能结果
各组PAAc-NHS酯/明胶复合水凝胶的拉伸强度与断裂伸长率如表2所示。随着PAAc-NHS酯含量的增加,PAAc-NHS酯/明胶复合水凝胶的拉伸强度与断裂伸长率均呈增长趋势,且当PAAc-NHS酯质量分数增至30%时,C组复合水凝胶的拉伸强度与断裂伸长率与A组相比显著提高 (P<0.05)。拉伸强度的增大意味着材料不易受应力损坏,而断裂伸长率的增加代表着材料韧性的提高。也就是说,当增加PAAc-NHS酯的比例时,会制备出强度更高、更有韧性的水凝胶。
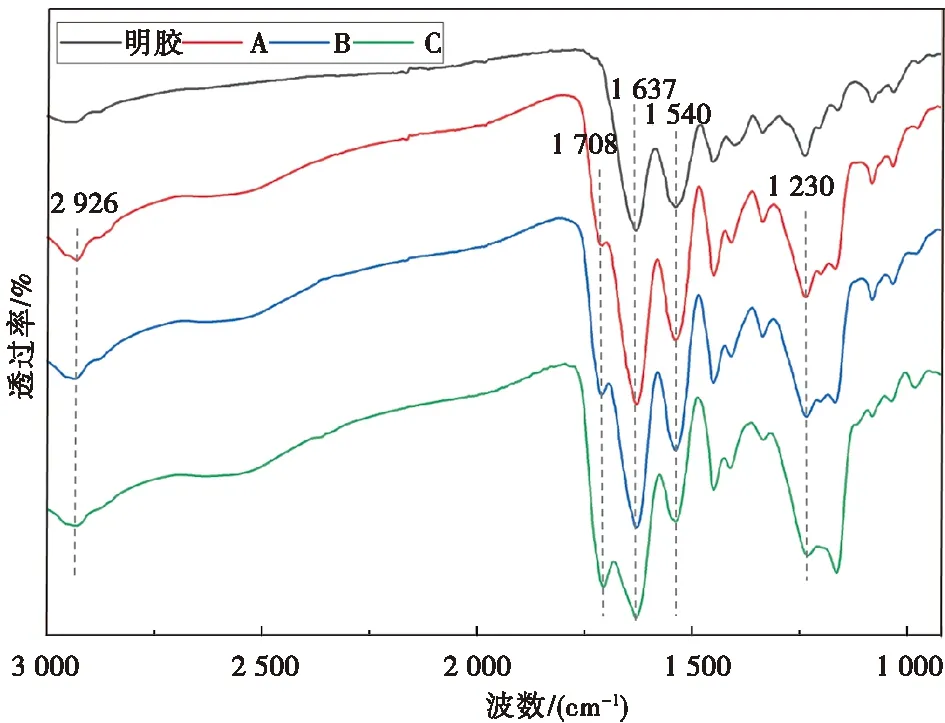
图2 四组水凝胶的红外光谱图Fig.2 FTIR spectra of four groups of hydrogels
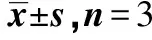
表2 PAAc-NHS酯/明胶复合水凝胶的机械性能Tab.2 Mechanical properties of PAAc-NHSester/gelatin composite hydrogels
2.3 溶胀率
各组PAAc-NHS酯/明胶复合水凝胶的溶胀率随时间的变化如图3所示。在4 h时,A、B、C 3组溶胀率已分别达到821%、571%、483%;而24 h最大溶胀率则分别达到840%、592%、572%。各组水凝胶的溶胀速率均随着时间的增加而减缓。其中,在任一预设的时间点,A组的溶胀率均为最高,且溶胀速率快,在2 h内出现快速的溶胀,2 h后溶胀速率减小,4 h后逐渐进入平衡状态。随着PAAc-NHS酯含量的增加,水凝胶溶胀率及溶胀速度都逐渐降低。C组的溶胀率最小且溶胀速率最低,在8 h后才逐渐进入溶胀平衡状态。本研究中所制备的3组水凝胶均具有较高的溶胀率,这表明PAAc-NHS酯/明胶复合水凝胶具备优秀的吸收伤口表面渗出液的能力。

图3 PAAc-NHS酯/明胶复合水凝胶的溶胀率(n=3)Fig.3 Swelling ratio of PAAc-NHS ester/gelatin composite hydrogels(n=3)
2.4 保水率
3组PAAc-NHS酯/明胶复合水凝胶的保水率随时间的变化见图4。每个预设时间点A组的保水率均为最高,而C组的保水率最低,但在8 h之后,3组的保水率逐渐趋近。即使在48 h,A组、B组、C组的保水率仍然高达130%、122%、117%。
2.5 体外黏附形态观察
本实验中各组水凝胶的可视化黏附性能如图5所示,当皮肤扭曲和弯曲时,A、B、C 3组水凝胶仍然紧紧地黏附在皮肤表面,而且,当PAAc-NHS酯的质量分数发生变化时,并未明显观察到对于水凝胶黏附形态的影响。即使是PAAc-NHS酯质量分数最低的A组复合水凝胶,仍然表现出了对湿润的猪皮表面紧密灵活的黏附,而明胶水凝胶立即与皮肤分离,这显示了PAAc-NHS酯/明胶复合水凝胶优秀的黏附性能。
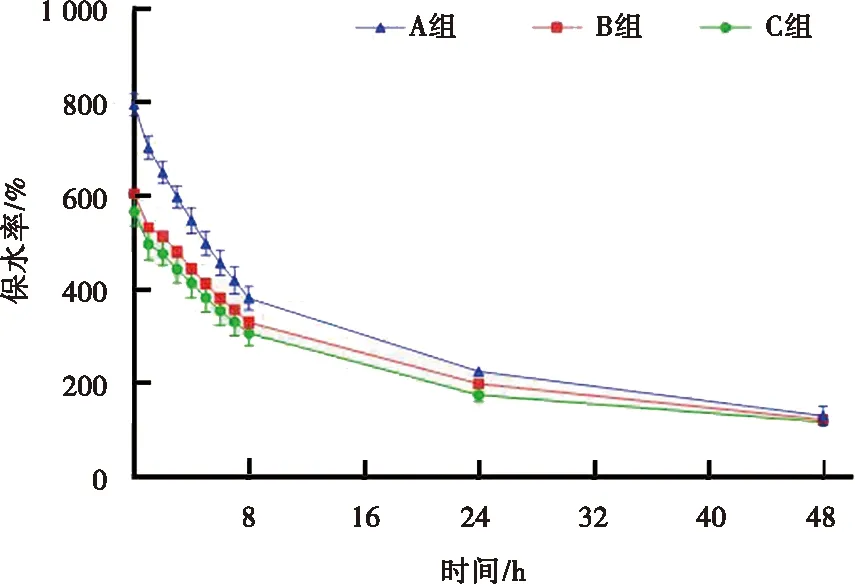
图4 PAAc-NHS酯/明胶复合水凝胶的保水率(n=3)Fig.4 Water retention ratio of PAAc-NHS ester/gelatin composite hydrogels(n=3)

A:A组水凝胶的黏附形态;B:B组水凝胶的黏附形态;C:C组水凝胶的黏附形态;明胶:纯明胶水凝胶的黏附形态
2.6 细胞毒性结果
2.6.1 CCK-8实验 CCK-8实验结果如图6所示。3组实验组中的L929细胞在与样品浸提液共培养1、3、5、7 d后,细胞生长密度均随时间的增加呈递增趋势,且与对照组相比,均未显现出明显的细胞毒性,表明所制备的3组PAAc-NHS酯/明胶复合水凝胶均无细胞毒性。
*:P<0.05,n=3
2.6.2 倒置显微镜观察 细胞形态如图7所示,A~C组细胞均贴壁生长,平铺伸展,呈现正常的长梭形细胞形态,与D组未见明显差异。进一步证明所制备的PAAc-NHS酯/明胶复合水凝胶并未显示出细胞毒性。
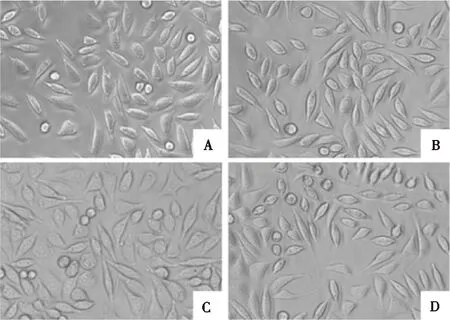
A:A组;B:B组;C:C组;D:D组
3 讨 论
近年来口腔黏膜疾病的多发引起了许多学者对于口腔黏膜治疗方法的关注。关于膜剂、口含片、软膏、凝胶等众多剂型的研究层出不穷,但是,口腔唾液的冲刷、口腔运动产生的机械应力以及口腔内潮湿的环境等不可抗力因素,让此研究领域面临许多挑战。本研究尝试利用PAAc-NHS酯改性明胶合成PAAc-NHS酯/明胶复合水凝胶,旨在开发一种新型口腔黏膜贴剂,为口腔黏膜疾病的治疗探索一条新的思路。

SEM结果显示,制备的PAAc-NHS酯/明胶复合水凝胶口腔贴剂具有多孔的微观结构,这种多孔水凝胶具有水的密封力从而维持潮湿环境,而且有利于气体交换、营养物质的运输、细胞生长和组织重建[4-5]。同时随着PAAc-NHS酯含量的上升,水凝胶的孔径减小,形成了更致密的网络结构,这可能是由于PAAc-NHS酯含量的上升增加了水凝胶的交联度[21]。而同时,可能正是因为孔径的减小,PAAc-NHS酯含量的增高伴随着溶胀率和保水率的降低。但即使出现了溶胀率和保水率的降低,本实验中各组水凝胶的保水率和吸水率也远高于大多数关于伤口敷料类研究的水凝胶[16,22-24]。水凝胶的溶胀率和保水率是覆盖在病变组织表面材料的重要性能,因为良好的吸水性可以允许材料更好地吸收伤口渗出物,从而改善愈合;而良好的保水性能可以更有效地维持潮湿环境,防止伤口床脱水甚至引起感染[6]。而本实验制备的各组PAAc-NHS酯/明胶复合水凝胶均显示出优秀的吸水性和保水性,可以在有效吸收伤口表面渗出物的同时,保持潮湿的环境,防止伤口床脱水,从而促进愈合。
细胞毒性CCK-8实验结果显示各实验组细胞生长密度均随时间的增加呈递增趋势,且细胞增殖数与空白对照组之间差异无统计学意义(P>0.05)。倒置显微镜下观察到的各组细胞也均呈现出良好的生长状况。各组PAAc-NHS酯/明胶复合水凝胶均未显示出明显的细胞学毒性,PAAc-NHS酯含量的增加并未明显影响水凝胶的细胞学毒性。
综上所述,本研究使用PAAc-NHS酯对明胶进行改性,制备了PAAc-NHS酯/明胶复合水凝胶材料。该材料具有良好的机械性能及体外黏附性能,除此之外,PAAc-NHS酯/明胶复合水凝胶还具有优秀的吸水性、保水性以及良好的生物安全性,可以在潮湿组织表面强韧、持久、灵活地黏附,使得它值得作为口腔贴剂进行进一步的被探索。

