CLOCK氧化还原修饰介导内源性H2O2对小鼠细胞呼吸的调节作用
常薇薇,李勋凯,张祝琴,陈厚早,刘德培
中国医学科学院基础医学研究所 北京协和医学院基础学院 医学分子生物学国家重点实验室生物化学与分子生物学系,北京 100005
细胞呼吸通过一系列化学反应将葡萄糖分解产生大量三磷酸腺苷(adenosine triphosphate, ATP)和还原电子载体还原型辅酶Ⅰ(nicokinamide adenine dinucleotide, reduced, NADH)和还原黄素腺嘌呤二核苷酸(flavine ademine dinucleotide, reduced,FADH2)为细胞供能[1-2]。细胞呼吸过程同时也产生过氧化氢(hydrogen peroxide,H2O2),其水平受到生物体内氧化还原系统的控制[3]。内源性H2O2是细胞内重要的信号分子,但其是否可以反馈调节细胞呼吸目前依旧未知。
生物钟是生物体为了适应环境节律性变化而进化出的保守内在计时机制,调节细胞呼吸等多种细胞功能。其核心分子昼夜节律运动输出周期蛋白(circadian locomalor output cycles kaput,CLOCK)缺失会导致肝脏和肌肉线粒体呼吸链受损或ATP合酶表达下降[4],但CLOCK翻译后修饰对细胞呼吸的调节尚不明确。研究发现,CLOCK半胱氨酸195位点可以直接被内源性H2O2氧化修饰并影响下游基因表达[5]。本文利用ClockC195S细胞,探究CLOCK的氧化还原修饰介导内源性H2O2对细胞呼吸的调节作用及其机制。
1 材料与方法
1.1 材料
1.1.1 小鼠:C57BL/6JClockwt和ClockC195S由北京唯尚立德生物科技有限公司提供。
1.1.2 材料:DMEM高糖培养基,PBS(赛维尔生物科技公司);0.25%胰蛋白酶(北京雷根生物技术公司);胎牛血清(GE Healthcare公司);NAD/NADH定量试剂盒(Sigma-Aldrich公司);增强型ATP检测试剂盒、蛋白酶抑制剂(碧云天生物技术有限公司);细胞线粒体压力检测试剂盒、糖酵解检测试剂盒、Seahorse XF Base Medium(Agilent Technologies公司);Trolox(MedChemExpress公司);Amplex® Red H2O2检测试剂盒(Invitrogen 公司);CLOCK抗体(Cell Signaling Technology公司);Biotin-conjugated iodoacetamide, BIAM (Molecular Probes公司); Amicon® Ultra-15 离心过滤装置(Merck公司)。
1.2 方法
1.2.1 小鼠胚胎成纤维细胞(MEFs)和小鼠成体成纤维细胞(MAFs)的提取:按照常规方法提取和培养[6-7]。
1.2.2 细胞线粒体压力的检测:实验前1 d将细胞按1×104接种到Seahorse XF 24孔板中,在DMEM完全培养基中过夜培养,预热仪器并在37 ℃无CO2培养箱水化探针板。实验当天配制Seahorse XF Base Medium检测液,用检测液清洗细胞2遍并在37 ℃无CO2培养箱孵育1 h。将细胞线粒体压力检测试剂盒中寡霉素、解偶联剂(trifluoromethoxy carbonylcyanide phenylhydrazone, FCCP)、鱼藤酮(rotenone)和抗霉素A(antimycin A)按比例稀释并依次加到测试板的A、B、C孔中,放入仪器中校准。校准完成后,替换细胞板进行检测。实验完成后采用wave和Graphpad Prism9.0.0对实验数据进行分析。
1.2.3 生物素碘乙酰胺(biotin-conjugated iodoacetamide, BIAM)标记及Western blot检测CLOCK蛋白:用含有蛋白酶抑制剂和 20 μmol/L BIAM的IP缓冲液收集实验细胞,转移到1.5 mL离心管中。超声5次(每次15 s,间隔45 s)后,将细胞裂解液置于旋转混匀仪在室温孵育60 min。4 ℃,12 000×g离心20 min,用Amicon Ultra-15离心管去除过量BIAM。所得上清液加入60 μL链霉亲和素磁珠,4 ℃旋转混匀孵育过夜。隔天在磁力架上用1 mL IP缓冲液洗涤链霉亲和素磁珠3次,加入60 μL 2× SDS上样缓冲液煮沸,用于Western blot,按照常规实验方法操作[5]。
1.3 统计学分析
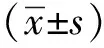
2 结果
2.1 ClockC195S细胞呼吸水平下降
在ClockC195SMEFs和MAFs中,ATP含量显著下降(图1A),细胞氧耗能力受损(图1B),包括基础呼吸速率(basal respiration rate)、氧化磷酸化(ATP link respiration)、质子渗漏(proton leak)、氧耗率(oxygen consumption rate,OCR)、最大氧耗量(maximal respiration)以及呼吸潜力(spare respiratory capacity)(图1C,D)。
A.relative levels of ATP in Clockwt and ClockC195S MEFs and MAFs; B.the Agilent Seahorse XF Cell Mito Stress Test profiles of Clockwt and ClockC195S MEFs and MAFs; C,D.the oxygen consumption rate(OCR) of basal respiration, ATP link respiration, proton leak, maximal respiration, spare respiratory capacity in Clockwt and ClockC195S;C.MEFs and D.MAFs.*P<0.05, **P<0.01, ***P<0.001 compared with Clockwt
2.2 ClockC195S细胞糖酵解和NAD合成受损
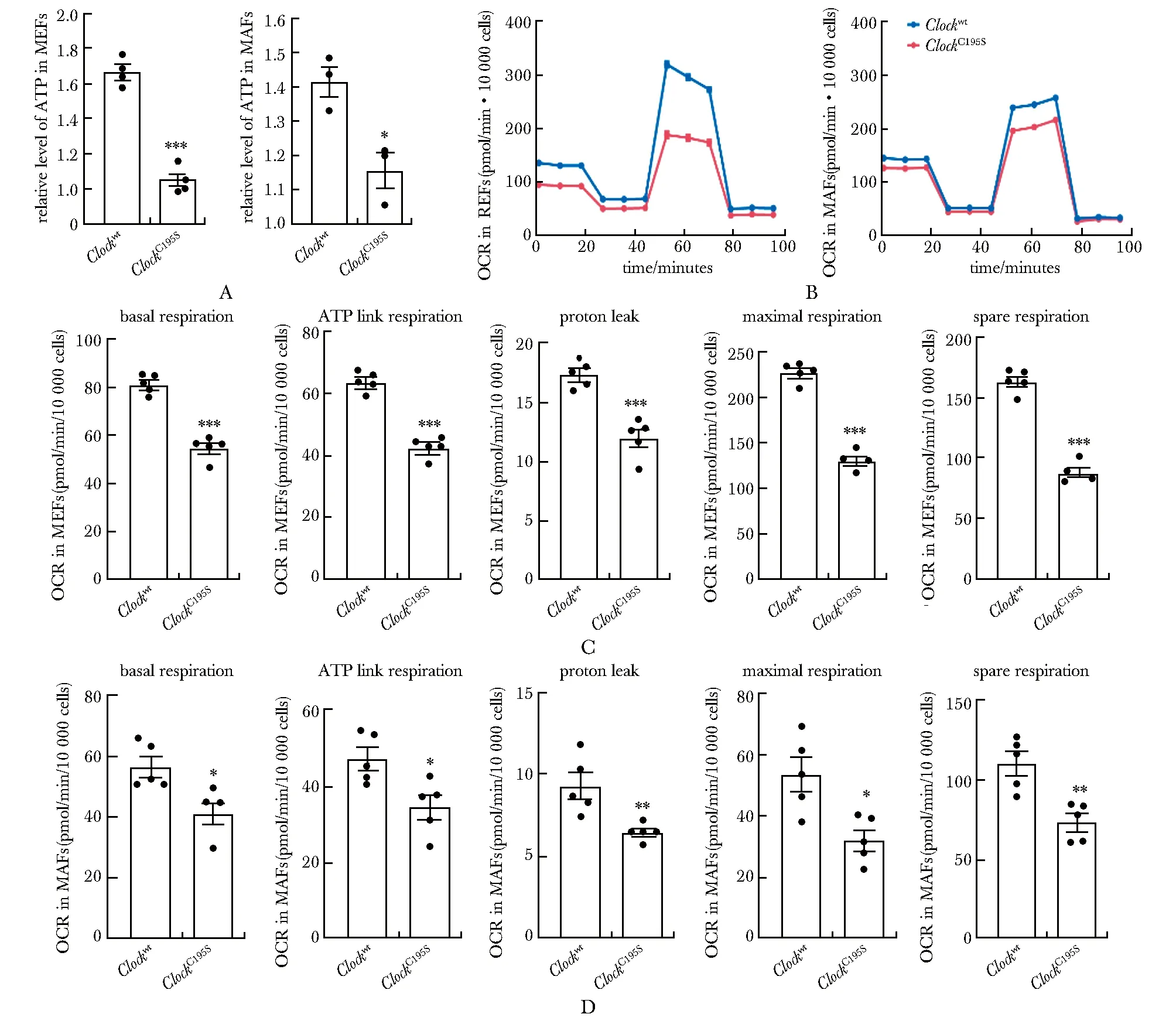
在MEFs(图2A)和 MAFs(图2B)中,ClockC195S导致糖酵解能力受损,酵解容量(glycolytic capacity)和酵解储备(glycolytic reserve)显著下降,糖酵解和TCA循环中产生的主要辅酶因子NADH含量明显降低,其氧化当量NAD+含量也低于野生型细胞(图2C,D)。在哺乳动物中,NAD+合成的一个重要途径是以烟酰胺(nicotinamide,NAM)为起点的补救途径[8]。其中关键酶烟酰胺磷酸核糖基转移酶NAMPT的表达在Clockwt和ClockC195SMEFs中差异无统计学意义,而烟酰胺单核苷酸腺苷转移酶家族(nicotinamide nucleotide adenylyltransfertises,NMNATs)中,Nmnat1和Nmnat3表达没有明显改变,Nmnat2表达明显降低(图2E)。
A, B.extracellular acidification rates (ECAR) of glycolysis, glycolytic capacity, glycolytic reserve in Clockwt and ClockC195S.A.MEFs and B.MAFs; C,D.The NAD+ and NADH levels in Clockwt and ClockC195S.C.MEFs and D.MAFs; E.relative mRNA levels of Nampt, Nmnat1, Nmnat2 and Nmnat3 in Clockwt and ClockC195S MEFs;*P<0.05, **P<0.01, ***P<0.001 compared with Clockwt
2.3 CLOCK蛋白氧化还原修饰介导内源性H2O2对细胞呼吸的调节作用
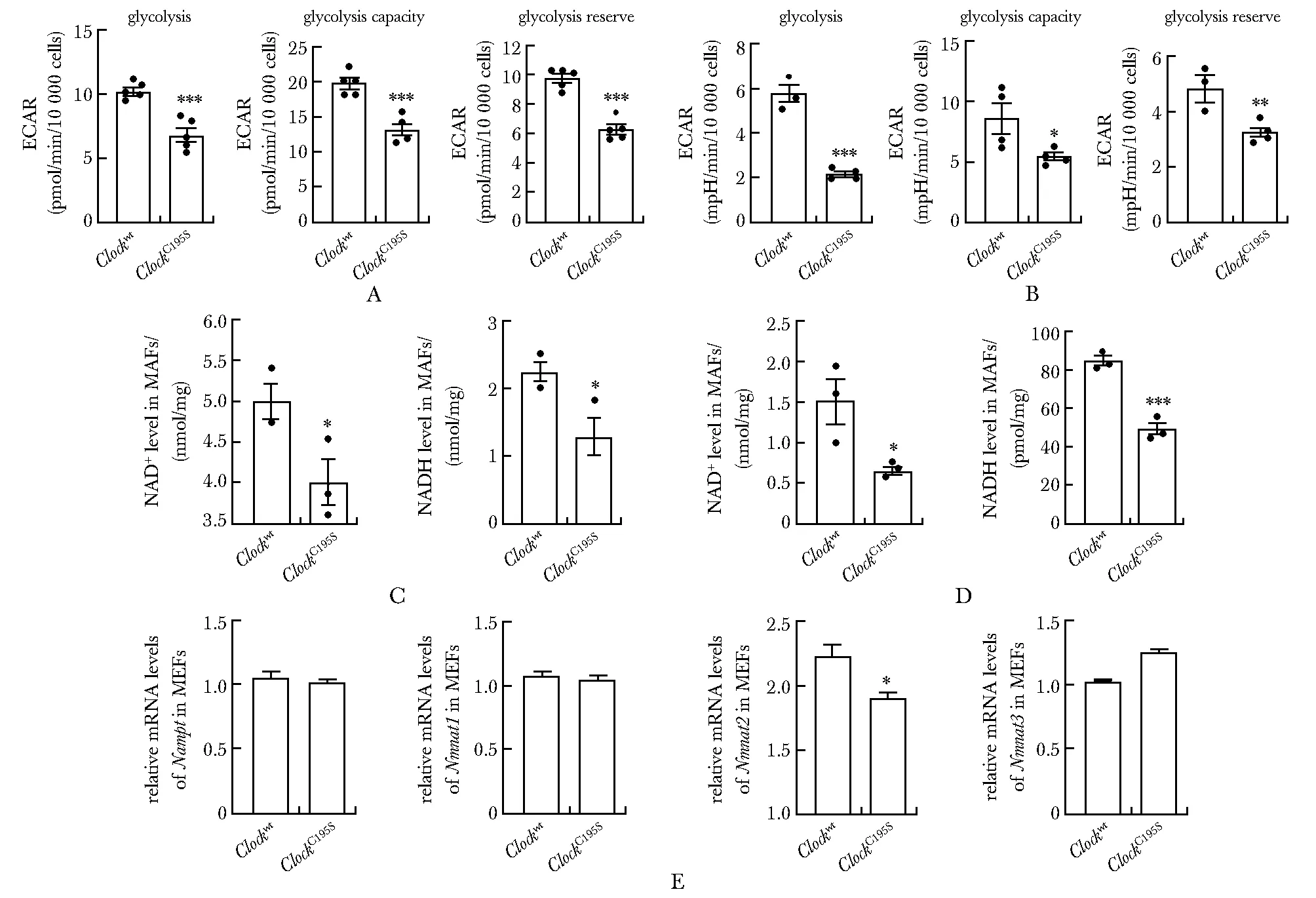
野生型MEFs在100、500 μmol/L和1 mmol/L抗氧化剂Trolox处理12 h后[9],H2O2含量均明显下降(图3A),BIAM标记的还原态CLOCK蛋白含量相应增加(图3B)。野生型MEF细胞在100 μmol/L Trolox处理12 h后,细胞ATP含量、细胞氧耗能力等指标显著降低(图3C~E)。ClockC195SMEFs在相同Trolox处理条件下,ATP含量及细胞氧耗能力无变化无统计学意义(图3C~E)。
A.cellular H2O2 levels in MEFs in the presence of 100 μmol/L, 500 μmol/L and 1 mmol/L Trolox, with DMSO treatment as control; B.a representative Western blot of CLOCK-SH proteins labelled by BIAM from MEFs in the presence of 100, 500 μmol/L and 1 mmol/L Trolox, Western blot of CLOCK-T showing the total content of CLOCK proteins; C-E.relative levels of ATP (C), the Agilent Seahorse XF Cell Mito Stress Test profiles (D) and the oxygen consumption rates (OCR) of basal respiration, ATP link respiration, proton leak, maximal respiration, spare respiratory capacity (E) of Clockwt and ClockC195S MEFs in the presence of 100 μmol/L Trolox for 12 h;*P<0.05, **P<0.01, ***P<0.001 compared with Clockwt DMSO
2.4 CLOCK蛋白氧化还原修饰介导内源性H2O2对Nmnat2的调节
Clockwt和ClockC195SMEFs在100 μmol/L Trolox处理12 h后,Nampt,Nmnat1和Nmnat3表达均没有明显差异;Nmnat2表达量在100 μmol/L Trolox处理的野生型MEFs中明显降低,而在同样处理的ClockC195SMEFs中改变无统计学意义(图4)。
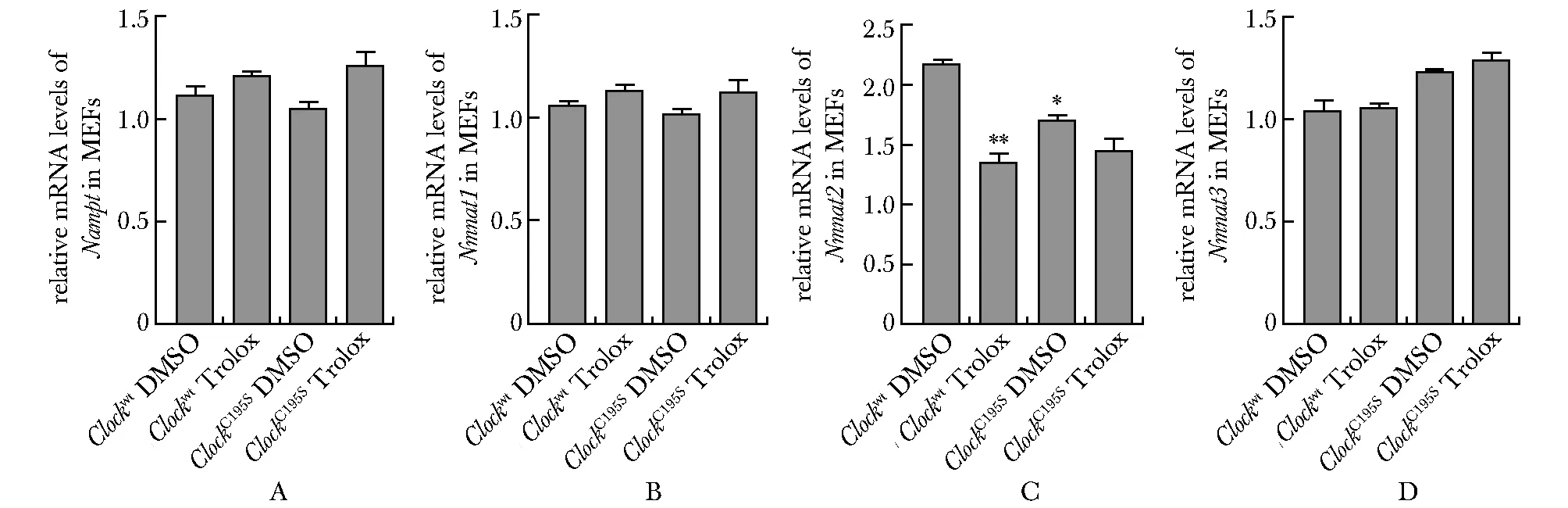
Relative mRNA levels of Nampt(A),Nmnat1 (B), Nmnat2 (C) and Nmnat3(D) in Clockwt and ClockC195S MEFs in the presence of 100 μmol/L Trolox for 12 h; *P<0.05, **P<0.01 compared with Clockwt DMSO
3 讨论
越来越多研究表明生物钟与线粒体功能相关,这些研究主要聚焦在生物钟基因本身的表达对线粒体功能的调节作用。Clock、Arntl、Per1/2、Cry1/2等生物钟核心基因的敲除或敲低改变线粒体呼吸和能量代谢[4]。但生物钟核心元件翻译后修饰对细胞呼吸的调节还存在许多未知。研究发现CLOCK 195位半胱氨酸能被内源性H2O2可逆地氧化修饰并改变其转录功能。在此基础上,本研究利用ClockC195S细胞探究CLOCK氧化还原修饰对于细胞呼吸的调节作用及其机制。研究发现,在MEFs和MAFs中,ClockC195S细胞氧耗能力和糖酵解能力下降,NADH和NAD+水平降低。CLOCK可以调节NAD+补救途径关键基因Nampt节律表达从而导致NAD+含量的节律性振荡[10]。但ClockC195S细胞Nampt水平没有显著变化,进一步发现NAD+补救途径中另一重要代谢酶NMNAT2表达量下降,NMNAT家族主要参与烟酸盐和烟酰胺代谢,有3种亚型:NMNAT1、 NMNAT2和NMNAT3[11]。研究发现NMNAT2可以维持轴突NAD+/NADH氧化还原电位和糖酵解,影响线粒体代谢。ClockC195S细胞Nmnat2表达下降,导致细胞呼吸中关键辅酶因子NADH含量下降,从而影响细胞呼吸,并且内源性H2O2可以通过CLOCK 195位半胱氨酸的氧化还原修饰调节Nmnat2的表达。以上结果证明CLOCK蛋白可以通过195位点半胱氨酸氧化还原修饰调节细胞呼吸,进一步完善昼夜节律与细胞呼吸、线粒体功能的调控网络。
线粒体呼吸与活性氧(reactive oxygen species, ROS)的产生有关,是ROS的重要来源。NADPH氧化酶(NADPH oxidases, NOXs)和线粒体电子传递链(electron transport chain, ETC)中复合物Ⅰ、Ⅱ、Ⅲ产生超氧负离子和H2O2[3];过氧化物酶、谷胱甘肽、硫氧还蛋白等抗氧化蛋白参与ROS的清除,ROS产生和清除的平衡构成线粒体氧化还原稳态,调节细胞关键信号通路和细胞代谢。H2O2作为ROS重要分子之一,在哺乳动物细胞和小鼠肝脏中存在昼夜节律振荡[5]。本研究发现内源性H2O2可以通过CLOCK蛋白195位半胱氨酸的氧化还原修饰调节细胞呼吸,但具体机制仍需更多的实验探究。本研究将生物钟、细胞呼吸和氧化还原稳态联系起来,从氧化还原角度理解生物钟核心元件对细胞呼吸的调节作用,但这种调节方式在时间维度上对细胞呼吸的作用和调节机制还需进一步探究。

