水相Cr(Ⅲ)和Cr(Ⅵ)对豹纹鳃棘鲈(Plectropomus leopardus)肝脏抗氧化指标影响
李钰,叶恒振,李争可,许悦,韦露,郭志强
(海南大学生命科学学院,南海海洋资源利用国家重点实验室,海南 海口 570228)
铬是水体污染的有害重金属之一,每年大约有7×106t 铬废水被排放到自然环境中[1],严重危害水生生物的生理,如抗氧化酶活性、细胞代谢和细胞凋亡等[2-4]。Cr(Ⅵ)进入生物体后还原成Cr(Ⅲ)并产生大量活性氧自由基(ROS),引起组织氧化损伤甚至导致细胞凋亡、突变等[4-7]。在水环境中,铬最稳定的两种氧化态为三价铬Cr(Ⅲ)和六价铬Cr(Ⅵ),Cr(Ⅵ)是一种强氧化剂,对生物体的毒性是Cr(Ⅲ)的1 000 倍,致突变性为100 倍,且由于跨膜方式的不同,Cr(Ⅵ)比Cr(Ⅲ)更加容易被吸收并在组织内累积[2,8,9]。尽管Cr(Ⅲ)的毒性要远低于Cr(Ⅵ),当Cr(Ⅲ)在生物体内累积过量,也会损伤DNA 并造成遗传毒性[10-12]。
抗氧化防御系统作为生物体内基本的生理功能和防御机制,抗氧化酶活指标被广泛应用于研究重金属对鱼体抗氧化防御系统的影响[13-16]。在轻度胁迫下,刺激抗氧化酶活性升高以抵御外界胁迫,而在重度胁迫下,过度消耗抗氧化酶活性,超出机体抵御能力,抗氧化酶活性降低[17-19]。主要的抗氧化防御系统由抗氧化酶以及抗氧化剂共同作用。抗氧化酶包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)等,非酶抗氧化剂如谷胱甘肽(GSH)可与抗氧化酶协同作用以抑制活性氧(ROS)过量产生[19]。例如,抗氧化酶SOD 活性随着Cr(Ⅵ)浓度的升高,草鱼(Ctenopharyngodon idellus)鳃的ROS 含量先升高后降低[20]。尽管有关六价铬对生物体的毒理效应研究已较为充分,但有关三价铬的毒性研较为稀少,且两种不同价态铬差异对比的研究则更为罕见[20,21]。
豹纹鳃棘鲈(Plectropomus leopardus)为一种高观赏价值、高食用价值的经济鱼类而被人类广泛捕捞,导致种群数量逐年下降[23]而被列入《濒危物种红色名录》[24]。目前,关于豹纹鳃棘鲈的研究大多集中在生态、体色、基因等方面[25-27]。未见有关三价铬[Cr(Ⅲ)]和六价铬[Cr(Ⅵ)]对豹纹鳃棘鲈,尤其是其肝脏抗氧化酶活性影响的对比研究。本实验研究了不同浓度的水相三价铬[Cr(Ⅲ)]和六价铬[Cr(Ⅵ)]对豹纹鳃棘鲈幼鱼超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)活性和谷胱甘肽(GSH)含量的影响,为准确衡量水相三价铬[Cr(Ⅲ)]和六价铬[Cr(Ⅵ)]毒性对水生生物健康的影响提供一定的基础数据。
1 材料方法
1.1 主要仪器和试剂
酶标分析仪(雷杜RT-6100 型,上海蔚霆商贸有限公司);可见分光光度计(UV-5100 型,上海元析仪器有限公司);台式高速冷冻离心机(H2050R,湘仪离心机仪器有限公司);电子分析天平(PX85ZH,奥豪斯国际贸易(上海)有限公司)。
氯化铬(CrCl3·6H2O,Cr(Ⅲ),纯度≥99%)和重铬酸钾(K2Cr2O7,Cr(Ⅵ),纯度≥99.5%),购自中国上海Sigma-Aldrich 贸易有限公司(https://www.sigmaaldrich.cn/CN/zh)。蛋白定量(TP)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)和谷胱甘肽(GSH)检测试剂盒购自南京建成生物工程研究所。商业鱼饲料购自中国山东省三通生物工程有限公司。
1.2 方法
体质量(16.5±2.1)g 的豹纹鳃棘鲈幼鱼(n=84)购自中国海南省陵水市蓝海水产养殖场,采用半静态法对幼鱼进行了14 d 和21 d 的水相铬暴露实验。首先将该鱼驯养在实验室水族箱(0.8 m×0.6 m×0.6 m)中驯化15 d,每天投喂两次(9:00 和17:00)[28]。实验室水质条件:总铬浓度<0.034 mg/L,溶解氧5.6~7.4 mg/L,pH 7.4~8.4,水温28.3~29.7℃,光周期12 h(12 L∶12 D)。
幼鱼适应环境后,随机分为7 组7 箱:对照组(Control)、Cr(Ⅲ)处理组(0.05 mg/L、0.1 mg/L 和0.2 mg/L)和Cr(Ⅵ)处理组(0.05 mg/L、0.1 mg/L 和0.2 mg/L)。每缸12 尾鱼,每次取6 尾鱼作为平行。实验期间,自然海水经48 h 暗沉淀处理、二级砂滤,符合海水水质I 类标准,每隔24 h 换一次水;每日8:00 am 和4:00 pm 记录水温,测定氨氮、溶氧含量和水中铬浓度等。水中铬浓度测定平均值分别为:(0.053±0.014)mg/L、(0.132±0.021)mg/L 和(0.216±0.029)mg/L。实验组Cr 质量浓度未包括海水本底值。
饲养期间,分别在第14 d 和第21 d 取样,在冰袋上快速分离肝脏并称重,迅速装入1.5 mL 无菌离心管中置于-80℃冰箱保存。
1.3 酶活性的测定
将肝脏组织按照体积(mL)加入9 倍体积的0.9%生理盐水(4℃预冷),利用匀浆器机械破碎组织样品(60 hz,30 sec),冰水浴制备10%匀浆(2 500 r/min 离心10 min),取上清匀浆液测定酶活性。采用考马斯亮蓝法测定上清液蛋白浓度(TP 试剂盒),利用SOD、CAT、POD 和GSH 检测试剂盒分别测定幼年豹纹鳃棘鲈肝脏组织内的三种酶活性以及GSH含量。
SOD 活力单位定义:每毫克组织蛋白在1 mL反应液中SOD 抑制率达50 %时所对应的SOD 量为一个酶活力单位(U)。CAT 单位定义:每毫克组织蛋白每秒钟分解1 μmol 的H2O2量为一个酶活力单位(U)。POD 单位定义:37℃下,每毫克组织蛋白每分钟催化1 μg 底物的酶量定义为一个酶活力单位。因此,组织匀浆中总SOD、CAT、POD 活力单位为U/mg prot。GSH 单位定义:37℃条下,每毫克组织蛋白每分钟催化1 nmol NDPH 氧化为一个酶活单位。即组织匀浆中GSH 活力单位为mgGSH/g prot。
1.4 数据分析
所有数据以平均值±标准差(SD)表示,分别利用Excel 和GraphPad Prism 8.0(Comparative Graph-Pad Software Inc.,USA)处理、多元统计分析和作图。通过单因素方差分析(One-Way ANOVA)与多重比较Tukey's Method 检验处理组之间三种酶活性以及GSH 含量差异的显著性。若P<0.05,则为显著差异;P<0.01,则为极显著差异;P>0.05,则差异不显著。
2 结果与分析
2.1 水相C r(Ⅲ)和C r(Ⅵ)对豹纹鳃棘鲈幼鱼肝脏超氧化物歧化酶(SOD)活性的影响
14 d 时,Cr 处理组豹纹鳃棘鲈幼鱼肝脏SOD活性显著低于对照组(P<0.05)(图1-A);且随着处理浓度的增加而增加。0.05 mg/L 浓度Cr(Ⅲ)与Cr(Ⅵ)处理下SOD 活性都极显著低于对照组(55.35±5.59 U/m gprot)(P<0.01),平均值分别为(28.56±3.28)U/mg prot 和(23.39±1.79)U/mg prot;0.1 mg/L 和0.2 mg/L 浓度Cr(Ⅲ)下SOD 活性显著高于C(rⅥ)组(P<0.01)。
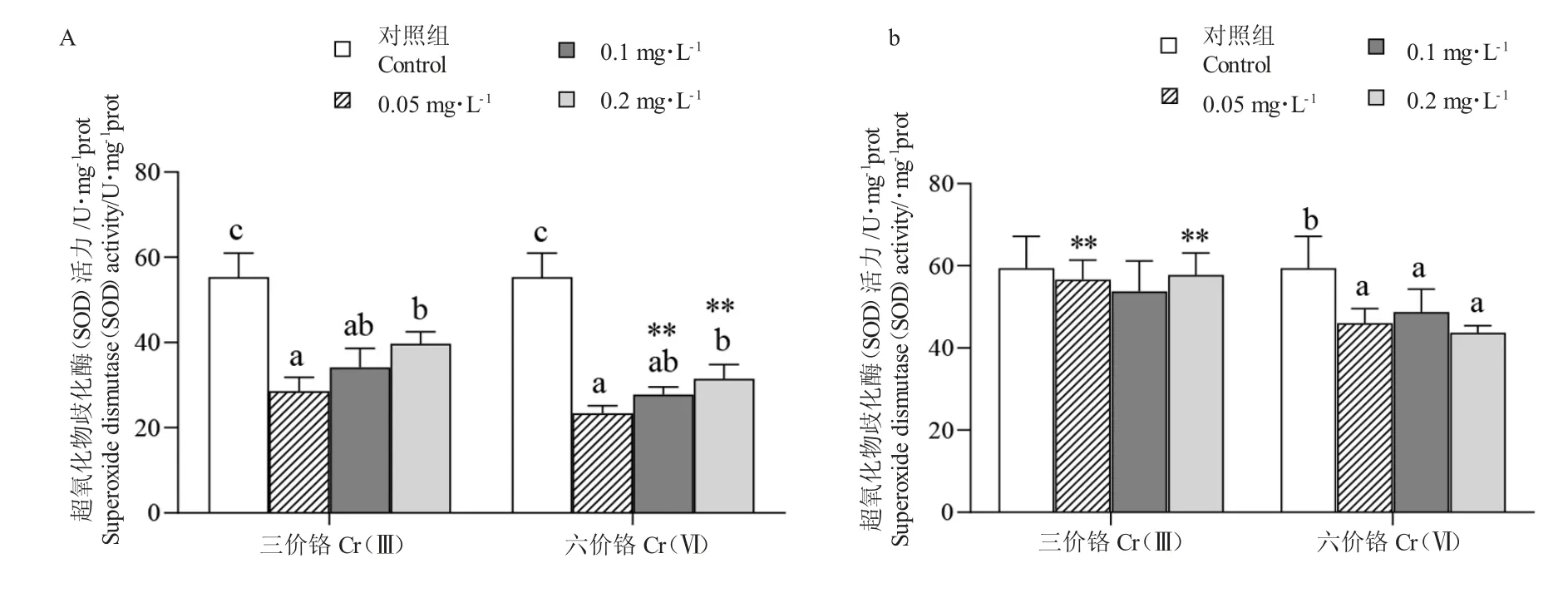
图1 水相Cr 处理14 d(A)和21 d(B)下豹纹鳃棘鲈幼鱼肝脏超氧化物歧化酶(SOD)活性Fig.1 The activity of superoxide dismutase(SOD)in liver of juvenile coral trout(P.leopardus)exposed to aqueous phase Cr for 14 days(A)and 21 days(B)
21 d 时,Cr(Ⅲ)组处理组SOD 活性低于对照组,但无显著性差异(P>0.05)(图1-B);在Cr(Ⅵ)处理下,SOD 活性显著低于对照组(P<0.05);Cr(Ⅲ)处理组的SOD 活性在0.05 mg/L 和0.2 mg/L 浓度下极显著高于Cr(Ⅵ)处理组(P<0.01)。
2.2 水相Cr(Ⅲ)和Cr(Ⅵ)对豹纹鳃棘鲈幼鱼肝脏过氧化氢酶(CAT)活性的影响
14 d 时,Cr 处理组豹纹鳃棘鲈幼鱼肝脏的CAT活性都显著低于对照组(P<0.05)。Cr(Ⅲ)组0.1 mg/L 浓度下,CAT 活性最低,与对照组(16.87±3.95)U/mg prot 差异极显著(P<0.01),且显著低于同浓度的Cr(Ⅵ)处理组(5.64±1.60)U/mg prot(P<0.05);Cr(Ⅵ)处理组的CAT 活性随着Cr(Ⅵ)处理浓度的升高而升高,浓度为0.05 mg/L 时Cr(Ⅵ)处理组(7.15±1.73)U/mg prot 的CAT 活性最低(图2-A)。
21 d 时,Cr(Ⅲ)处理组的CAT 活性与对照组相比无显著性差异(P>0.05);Cr(Ⅵ)处理组的CAT 活性都显著低于对照组(P<0.05),且随着Cr(Ⅵ)处理浓度的升高而下降,浓度为0.2 mg/L 时CAT 活性最低(12.68±2.95)U/mg prot;Cr(Ⅲ)处理组的CAT 活性在0.1 mg/L 和0.2 mg/L 浓度下极显著高于同浓度Cr(Ⅵ处理组(P<0.01)(图2-B)。

图2 水相Cr 处理14 d(A)和21 d(B)时豹纹鳃棘鲈幼鱼肝脏过氧化氢酶(CAT)活性Fig.2 The activity of catalase(CAT)in liver of juvenile coral trout(P.leopardus)exposed to aqueous phase Cr for 14 days(A)and 21 days(B)
2.3 水相Cr(Ⅲ)和Cr(Ⅵ)对豹纹鳃棘鲈幼鱼肝脏过氧化物(POD)活性的影响
14 d 时,Cr(Ⅲ)处理组豹纹鳃棘鲈幼鱼肝脏的POD 活性在0.1 和0.2 mg/L 浓度时显著高于对照组(4.76±0.64)U/mg prot(P<0.05),且极显著高于Cr(Ⅵ)处理组(P<0.01),平均值分别为(7.42±2.83)U/mg prot 和(9.12±1.50)U/mg prot;Cr(Ⅵ)处理组的POD 活性在浓度为0.05 mg/和0.1 mg/L 时与对照组无显著差异(P>0.05),在0.2 mg/L 浓度下Cr(Ⅵ)处理组(2.08±0.41)U/mg prot 显著低于对照组(P<0.05)(图3-A)。

图3 水相Cr 处理14 d(A)和21 d(B)下豹纹鳃棘鲈幼鱼肝脏过氧化物酶(POD)活性Fig.3 The activity of peroxidase(POD)in liver of juvenile coral trout(P.leopardus)exposed to aqueous phase Cr for 14 days(A)and 21 days(B)
21 d 时,Cr(Ⅲ)处理组的POD 活性显著高于对照组(7.22±1.32)U/mg prot(P<0.05),随着浓度的升高而升高;Cr(Ⅵ)处理组的POD 活性在0.05 mg/L和0.1 mg/L 时显著高于对照组(P<0.05),平均值分别为(9.66±0.91)U/mg prot 和(14.45±1.72)U/mg prot;在浓度为0.2 mg/L 时Cr(Ⅵ)处理组(4.56±1.58)U/mg prot 显著低于对照组(P<0.05);Cr(Ⅲ)处理组的POD 活性极显著高于Cr(Ⅵ)处理组(P<0.01)(图3-B)。
2.4 水相Cr(Ⅲ)和Cr(Ⅵ)对豹纹鳃棘鲈幼鱼肝脏谷胱甘肽(GSH)含量的影响
14 d 时,Cr(Ⅲ)处理组豹纹鳃棘鲈幼鱼肝脏的的GSH 含量随着Cr(Ⅲ)处理浓度的升高而升高,在0.1 mg/L 和0.2 mg/L 浓度时显著高于对照组(13.71±1.53)mg GSH/g prot(P<0.05),且极显著高于Cr(Ⅵ)组(P<0.01),平均值分别为(18.70±2.05)mgGSH/g prot 和(22.14±1.64)mg GSH/g prot;Cr(Ⅵ)处理组的GSH 含量随着Cr(Ⅵ)处理浓度的升高而下降,在0.2 mg/L 浓度时Cr(Ⅵ)处理组GSH含量(10.34±2.20)mg GSH/g prot 显著低于对照组(P<0.05)(图4-A)。
21 d 时,Cr(Ⅲ)处理组的GSH 含量随着Cr(Ⅲ)处理浓度的升高而升高,在0.2 mg/L 浓度下Cr(Ⅲ)处理(16.35±1.34)mg GSH/g prot 显著高于对照组(12.02±0.73)mg GSH/g prot(P<0.05);Cr(Ⅵ)处理组的GSH 含量随着Cr(Ⅵ)浓度的升高而下降,在0.1 mg/L 和0.2 mg/L 浓度时Cr(Ⅵ)处理组显著低于对照组(P<0.05),平均值分别为(10.20±0.90)mg GSH/g prot 和(6.17±0.94)mg GSH/g prot;Cr(Ⅲ)处理组的GSH 含量在0.05 mg/L 浓度下显著低于Cr(Ⅵ)处理组(P<0.05),在0.1 mg/L 和0.2 mg/L 浓度下显著高于Cr(Ⅵ)处理组(P<0.05)(图4-B)。

图4 水相Cr 处理14 d(A)和21 d(B)下豹纹鳃棘鲈幼鱼肝脏谷胱甘肽(GSH)含量Fig.4 The activity of glutathione(GSH)in liver of juvenile coral trout(P.leopardus)exposed to aqueous phase Cr for 14 days(A)and 21 days(B)
3 讨论
3.1 Cr(Ⅲ)和Cr(Ⅵ)对豹纹鳃棘鲈幼鱼肝脏组织SOD 和CAT 活性的影响
SOD 可以催化ROS 的超氧阴离子(O2-·)产生H2O2,抑制ROS 以减少胁迫对机体的损伤。轻度胁迫下SOD 活性升高以抵御外界对机体的胁迫刺激,而在重度胁迫下,生物体内受损严重导致过量ROS积累,SOD 活性被过度消耗而降低[29]。CAT 的主要作用是与细胞内的H2O2反应产生H2O[19,29-31],以清除SOD 催化ROS 后所产生的H2O2废物。本研究中,水相Cr(Ⅲ)暴露14 d 时显著抑制豹纹鳃棘鲈幼鱼肝脏SOD 和CAT 活性(P<0.05),但此抑制作用随时间的增长而降低,并在21 d 时与对照组相比无显著差异(P>0.05)(图1、图2),这可能是由于第21 d 水相Cr(Ⅲ)暴露已无法使豹纹鳃棘鲈幼鱼产生氧化应激反应,以产生ROS 消耗SOD 与CAT 的酶活力,即豹纹鳃棘鲈幼鱼可能已逐渐适应0.05 mg/kg、0.1 mg/kg 和0.2 mg/kg 的水相Cr(Ⅲ)暴露环境。在水相Cr(Ⅲ)对金鱼(Carassius auratus)急性(96 h,10 mg/L)暴露实验中,处理组的SOD 和CAT活性在24 h 时与对照组差异显著(P<0.05);在48和96 h 时与对照组差异不显著(P>0.05),这与本研究结果相似[32]。
Cr(Ⅵ)处理组的豹纹鳃棘鲈幼鱼肝脏SOD 和CAT 活性在14 d 和21 d 都显著低于对照组(P<0.05),表明2~3 周的Cr(Ⅵ)胁迫下豹纹鳃棘鲈幼鱼肝脏SOD 和CAT 活性被过度消耗,受到重度胁迫。Chen 等[33]在毒性研究中发现,在0.01 mg/L 的Cr(Ⅵ)对时斑马鱼(Danio rerio)发育畸形;鱼体的抗氧化系统ROS、SOD 等抗氧化酶活性指标都低于对照组,这与本研究结果相符。Cr(Ⅵ)处理组SOD和CAT 活性基本上都低于Cr(Ⅲ)处理组和对照组,表明Cr(Ⅵ)对豹纹鳃棘鲈幼鱼的毒性要高于Cr(Ⅲ)。Kubrak 等[32]的Cr(Ⅲ)与Cr(Ⅵ)对金鱼组织的急性(96 h,10 mg/L)暴露实验表明,两种铬离子都会在金鱼肝脏和肾脏组织中诱导氧化应激,且Cr(Ⅵ)处理下的SOD 和CAT 活性要低于Cr(Ⅲ)。本研究结果与Kubrak 等[32]描述的Cr(Ⅵ)与Cr(Ⅲ)对鱼体的抗氧化酶活影响具有相似性。氧化应激是缓解铬毒性的关键机制。
3.2 Cr(Ⅲ)和Cr(Ⅵ)对豹纹鳃棘鲈幼鱼肝脏组织POD 活性和GSH 含量的影响
POD 存在于真核生物内的H2O2酶体内,能够清除机体内氧化应激产生的过氧化物等有害物质,避免过氧化物在生物体内累积[19]。轻度胁迫下POD会升高以抵御外界胁迫,而在重度胁迫下超出机体抵御能力则表现为POD 降低[17-19]。而GSH 可以与抗氧化酶协同作用清除活性氧及防御膜脂过氧化[34-36]。Cr(Ⅲ)可以与配合物络合增强清除自由基的能力,发挥较强的抗氧化作用,如槲皮素-Cr(Ⅲ)络合物[37]。本研究的Cr(Ⅲ)处理组的豹纹鳃棘鲈幼鱼肝脏的POD 活性和GSH 含量都表现升高趋势(图3、图4),这与低浓度下有毒物质对抗氧化系统的增益作用有关[29]。本研究结果表明Cr(Ⅲ)的低毒性对豹纹鳃棘鲈幼鱼肝脏的抗氧化系统具有诱导作用,以增强豹纹鳃棘鲈幼鱼肝脏的抗氧化能力。
此外,Cr(Ⅵ)处理组POD 活性和GSH 含量基本上都低于Cr(Ⅲ)处理组和对照组,尤其是在0.1 mg/L 和0.2 mg/L 浓度时,Cr(Ⅵ)处理组与Cr(Ⅲ)处理组相比,POD 活性和GSH 含量差异极显著(P<0.01),这与SOD 和CAT 活性结果一致。说明Cr(Ⅵ)处理抑制了豹纹鳃棘鲈幼鱼肝脏的SOD、CAT、POD 活性和GSH 含量,而水相Cr(Ⅵ)的毒性显然要高于对水相Cr(Ⅲ)。这与水相Cr(Ⅲ)和Cr(Ⅵ)暴露下对巴西本土鱼(Piaractus mesopotamicus)的毒性实验结果相似[2],该研究还指出Cr(Ⅵ)具有更高的毒性还会引起不可逆的病变;而Cr(Ⅲ)在推荐水平内施用时,可以安全地用于水产养殖。
3.3 结论
本文研究了两种价态的铬(Cr(Ⅲ)和Cr(Ⅵ))分别在三种浓度(0.05 mg/L、0.1 mg/L、0.2 mg/L)下浸泡14 d 和21 d,对豹纹鳃棘鲈肝脏组织抗氧化酶活的影响。结果表明,暴露14 d 下Cr(Ⅲ)和Cr(Ⅵ)抑制肝脏抗氧化能力,但是暴露21 d 下Cr(Ⅲ)增强了肝脏抗氧化能力,Cr(Ⅵ)依旧为抑制作用且在较低的浓度下也会对豹纹鳃棘鲈幼鱼肝脏抗氧化能力产生一定程度的抑制影响,毒性大于Cr(Ⅲ)。本研究为区分不同价态铬在不同暴露时间段铬下对抗氧化机制影响的差异提供了基础数据。

