木本植物响应干旱胁迫的研究现状
马涛 罗晨梦 李思佳 姜渊忠

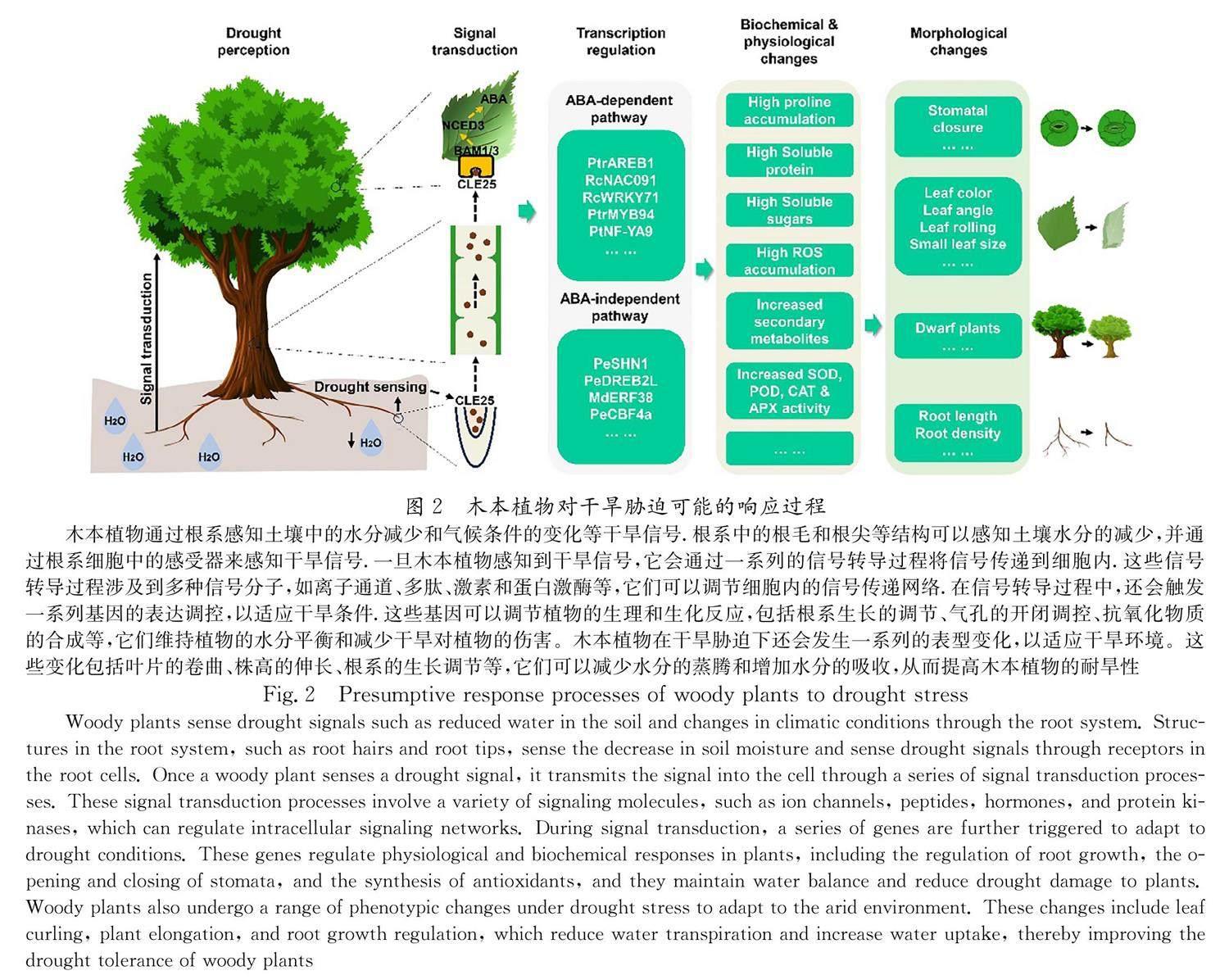
摘要:为深入了解木本植物响应干旱胁迫的分子机理,本文系统的从木本植物对干旱信号的感知、信号转导到转录调控、生理生化反应以及表型变化等方面总结了木本植物对干旱胁迫可能的响应过程. 认为木本植物由于其固着根生的特点,不得不进化出相应的机制来应对不断变化的环境.当遭受干旱胁迫时,木本植物根系细胞膜上的感受器首先感知到土壤水分状态的变化,细胞内的蛋白质和激素调控系统触发相应的干旱适应反应.干旱信号通过细胞间的信号传导路径传递到植物体内的各个部位,主要的信号传导途径包括Ca 2+ 信号、激素信号和转录因子调控等.一些关键基因和信号通路,如脱落酸(ABA)信号通路、DREB蛋白家族等也参与调控植物的干旱适应性.木本植物也会发生形态和解剖上的变化来减少水分蒸发和增强根系的吸水能力.本文可为抗旱型木本植物选育提供见解.
关键词:干旱胁迫; 木本植物; 信号传递; 干旱响应
中图分类号: Q945 文献标识码:A DOI:DOI:10.19907/j.0490-6756.2023.050002
收稿日期: 2023-08-13
基金项目: 国家重点研发计划(2021YFD2201100);国家自然科学基金(31922061)
通讯作者: 马涛.E-mail: matao.yz@gmail.com
Current research status of woody plants responding to drought stress
MA Tao, LUO Chen-Meng, LI Si-Jia, JIANG Yuan-Zhong
(Laboratory of Molecular Ecology and Evolution, College of Life Sciences, Sichuan University Chengdu 610065, China)
This paper systematically summarizes the possible response processes of woody plants to drought stress from the perception of drought signals, signal transduction to transcriptional regulation, physiological and biochemical responses, and phenotypic changes, with the aim of gaining a deeper understanding of the molecular mechanisms of woody plants in response to drought stress. Woody plants are forced to evolve corresponding mechanisms to cope with the ever-changing environment due to their entrenched rhizosphere. When subjected to drought stress, the receptors on the cell membrane of the root system of woody plants first sense the changes in soil water status, and intracellular proteins and hormone regulatory systems in the cell trigger the corresponding drought adaptation responses. Drought signals are transmitted to various parts of the plant body through intercellular signaling pathways, and the main signaling pathways include Ca 2+ signaling, hormone signaling, and transcription factor regulation. Some key genes and signaling pathways, such as the abscisic acid (ABA) signaling pathway and the DREB protein family, are also involved in the regulation of drought adaptation in plants. Woody plants also undergo morphological and anatomical changes to reduce water evaporation and enhance root water absorption capacity. This article can provide insights into the breeding of drought-resistant woody plants.
Drought stress; Woody plants; Signaling; Drought response
1 引 言
干旱胁迫对森林生态系统具有毁灭性打击.水分胁迫会破坏木质部的水分通量,导致空化.由此产生的栓塞限制了植物输送水分的能力,从而限制了树木的生长 [1] .干旱胁迫的过程中伴随着Ca 2+ 、Mg 2+ 、K + 、Na + 等离子在土壤表面富集,致使外界环境的渗透压远高于细胞,引发细胞失水皱缩,最终导致林木死亡,全球变暖和气候变化也使干旱发生的频率和危害程度不断增加 [2] .
木本植物种类繁多,分布广泛,在经济、药用、生态等多方面都具有重要的应用价值.在对木本植物的研究中发现,其通过自身进化可以在复杂多变的环境中正常生长,因此木本植物中必然存在一个连接各种器官和组织,复杂而精密的调控网络响应干旱胁迫 [3] .
2 干旱信号的感知
干旱是一种来自于外界环境的物理刺激,植物感受干旱的实质就是“信号转导”,外界的刺激为“输入信号”,植物所做出的应答为“输出信号”,因此植物需要先识别“输入信号”,经过一系列的生理生化过程的转换和传导才能变为“输出信号” [4] .植物能够通过水信号、化学信号和电信号在植物体内的细胞或者组织器官之间进行干旱信息的传递,当接收到干旱信号时植物则会迅速启动自身的保护机制以保证植物能够维持自身的生理平衡,使植物能够顺利的度过水分缺乏时期 [5] .Blackman所做的玉米分根实验首次证实了根部是植物感知干旱并发出气孔调控初级信号的部位.“盐随水走,水走盐留”,因此土壤中水分的缺失可能首先被感知为渗透势的下降,所以干旱传感器也被称为渗透传感器 [6] .
2014年研究人员筛选了到第一个潜在的渗透传感器OSCA1(Osmotically Sensitive Calcium-permeable Channel 1),OSCA1是植物中一种液泡脱敏Ca 2+ 通道的亚型,主要存在于质膜和内质网膜等细胞器膜上(图1).研究表明,OSCA1通道在渗透逆境下的表达和活性会发生调节.例如,在水分缺乏或盐胁迫等逆境条件下,OSCA1通道的表达水平可能上调,并参与细胞内Ca 2+ 动态平衡的调节,从而调控植物对逆境的响应和适应.据目前的研究,拟南芥基因组中包含大约15个与OSCA1同源的基因.拟南芥中CSC1A(Cellulose Synthase Complex Subunit 1A)家族成员在拟南芥细胞中与液泡脱敏和渗透调节有关.它们在维持细胞内Ca 2+ 浓度、调控渗透压平衡以及响应逆境适应等方面发挥着重要作用 [7] .尽管CSC1A和OSCA1都是离子通道蛋白,但它们的功能和调节机制不完全相同,反映了不同物种在适应环境胁迫的策略(图1).植物的渗透胁迫感知机制与其它真核生物相似,并且可能由相似类型的蛋白质组成.类似于酵母中渗透传感和信号传导的SLN1-YPD1-SSK1 TCS(Two-Component System),ATHK1介导的TCS可能在拟南芥中起作用 [8] .然而,只有OSCA1被认为是真正的渗透传感器,而HKs(Histidine Kinase)在植物渗透传感中的作用仍在争论中,CSCs(Cellulose Synthase Complexes)和RLKs(Receptor-Like Kinases)也是潜在的候选者 [9] .
3 干旱信号转导
干旱应激特异性信号转导是指在干旱条件下,植物通过特定信号转导通路来激活和调控与干旱适应相关的基因表达.这些信号转导通路在正常的生长条件下可能处于休眠状态,但当植物遭遇干旱胁迫时,它们会被激活并触发一系列适应性响应.这个过程涉及各种第二信使,如Ca 2+ 、ROS(Reactive Oxygen Species)、NO和磷脂,以及不同类型的蛋白激酶.信号通过这些第二信使进行传递和放大 [10] .
3.1 Ca 2+ 信号
干旱信号转导过程中的Ca 2+ 信号传导是植物对干旱胁迫的主要响应之一,干旱胁迫时它能够迅速诱导细胞内Ca 2+ 浓度的短暂增加,因为它的特性使其适合作为无处不在的信号分子,是应激信号中普遍存在的第二信使.由于激活的离子通道或膜钙通道的存在,Ca 2+ 浓度在细胞内逐渐上升.这些Ca 2+ 浓度上升可以形成Ca 2+ 梯度,从感知区域开始向周围扩散,形成以Ca 2+ 浓度递减的钙波(Calcium waves)或钙火花(Calcium sparks).细胞内Ca 2+ 浓度上升后,结合到特定的钙信号传感器蛋白上,如钙调蛋白(Calmodulin)和钙依赖性蛋白激酶(Calcium-dependent Protein Kinases,CDPKs) [11] .
拟南芥的SOS(Salt Overly Sensitive)通路是一种重要的Ca 2+ 依赖性信号转导途径,它可以感知和响应特定的胞质Ca 2+ 信号 [12] .该通路通过调节离子通道和离子转运蛋白的活性,实现对环境胁迫的适应.其中,SOS3是一个Ca 2+ 感知蛋白,它能够与胞质中的Ca 2+ 结合并发生构象变化(图1).当Ca 2+ 浓度升高时,Ca 2+ -SOS3复合物会形成,并激活SOS2蛋白激酶.SOS2是一个钙依赖性蛋白激酶,当与Ca 2+ -SOS3复合物结合时,SOS2被激活 [13] .这些蛋白的激活状态会通过磷酸化反应、蛋白相互作用和亚细胞位置变化来调节植物的干旱适应响应.例如,激活的钙调蛋白可以与蛋白激酶、磷酸酯酶和转录因子等下游组分相互作用,并参与调节基因表达、离子通道活性和渗透调节等关键过程 [14] .
3.2 ROS信号
在植物的干旱胁迫响应中,ROS信号起着重要的作用(图1).植物干旱感知机制被激活后,通常会引发一系列反应,这些反应会导致酶、膜蛋白及电子传递链的失活和损伤,这些被损伤的系统会释放出电子,导致ROS的生成 [15] .此外,植物还可以通过激活特定的酶(如NADPH氧化酶)来产生ROS.在植物中,ROS可以在多种细胞器中产生,包括叶绿体、线粒体和过氧化物酶体,也可以通过质膜定位的Rboh NADPH氧化酶产生 [16] .ROS在细胞内扩散,并可以通过跨膜通道进入细胞间隙,在这个过程中,ROS的浓度可以迅速增加,从而形成一个干旱胁迫信号的放大环节.ROS作为重要的信号分子与细胞内的一系列分子相互作用 [17] .例如,ROS可以与蛋白质、酶、磷酸酯酶等发生直接的氧化修饰,从而改变它们的活性和功能.ROS抑制和激活的目标包括激酶、转录因子、离子通道和膜转运蛋白等(图1).这些ROS调控的分子事件可以进一步触发干旱适应相关基因的表达.ROS信号调控的下游响应涉及多个途径,如抗氧化反应、离子通道的活性调节 [18] .
3.3 NO(一氧化氮)
在干旱条件下,植物可能会产生和释放NO作为一种响应信号,它可以触发植物内部的适应性机制以应对干旱的影响.NO参与调节植物的气孔运动、根系生长、抗氧化防御等过程,有助于植物应对干旱压力.在植物中,NO可以通过激活可溶性鸟苷酸环化酶(GC)产生环磷酸鸟苷酸(cGMP) [19] .cGMP作为第二信使参与干旱信号传导,促进蛋白激酶G的激活,进而调控干旱相关基因的表达.NO可以通过调节细胞内Ca 2+ 干旱信号.它可能促使Ca 2+ 释放或增加Ca 2+ 通道的通透性,激活Ca 2+ 相关的信号通路,如CDPK信号通路,从而调节干旱相关基因的表达和植物的适应性反应.NO可以激活线粒体膜蛋白激酶(mitogen-activated protein kinase,MAPK)通路,进而调控干旱响应 [20] .NO激活MAPK酶级联反应,导致下游响应蛋白的磷酸化,从而调节基因表达、激活抗氧化防御系统等 [21] .NO还可以通过与脱亚硝酸还原酶(NIR)相互作用来调节干旱信号.NIR能够还原NO为亚硝酸,从而改变植物内NO的水平.这一过程可能影响植物的气孔闭合、抗氧化性能和干旱适应等方面 [22] .需要注意的是,NO与其他信号分子如植物激素以及其他逆境响应通路(如水通道蛋白等)之间可能存在复杂的交互作用和调控网络.因此,NO调控干旱信号传导的通路图谱仍然在不断研究和探索中 [6] .
3.4 CLE25介导的ABA信号转导
植物根部感知到土壤缺水后,地上部分会通过关闭气孔来响应干旱胁迫,这涉及植物通信系统的运转机制.多肽分子CLE25(CLAVATA3/EMBRYO-SURROUNDING REGION-related25)被干旱诱产生,从根部经过长距离运输转移到叶片中,与叶片中受体蛋白BAM1(Barely Any Meristem1)和BAM3结合后,然后诱导 NCED3 (Nine-Cis-Epoxycarotenoid Dioxygenase 3)表达,进而促进ABA(Abscisic acid)的积累 [23] .ABA进一步调节一系列应答反应来抵御干旱对植物造成的影响(图2).
ABA信号转导由受体(Regulatory Components of ABA Receptors /Pyrabactin Riesistance1/Pyrabactin Riesistance1-Like,RCAR/PYR/PYL)、蛋白磷酸酶(Protein Phosphatase type 2C,PP2C)和激酶(SNF1-related Protein Kinase 2s,包括SnRK2.2、SnRK2.3和SnRK2.6)完成 [24] .之前普遍认为植物遭受干旱刺激后,ABA含量升高,ABA和受体结合后与PP2C形成三聚体复合物,其抑制PP2C的磷酸酶活性.然后SnRK2s从与PP2C的结合抑制中释放.释放的SnRK2s可以通过自磷酸化激活,并且进一步磷酸化下游转录因子(Transcription Factors,TFs)和离子通道蛋白 [25] .2020年1月,中科院上海植物逆境生物学研究中心报道了RAFs(Raf-like Kinases)的B2、B3和B4亚家族在早期渗透胁迫和ABA信号通路中的重要作用 [26] .近日,日本学者又发现,轻度干旱时,SnRK2s的自磷酸化不足以引起下游的一系列胁迫响应,需要上游激酶B2-RAFs(包括RAF7、RAF10、RAF11和RAF12)参与才能激活,且B2-RAFs通过ABA依赖途径激活SnRK2s来调节干旱胁迫应答基因的表达 [27] .当干旱胁迫变得更严重时,同一激酶家族的B3-RAFs(包括RAF3、RAF4和RAF5)亚家族成员被激活,并以不依赖于ABA的方式直接激活SnRK2s,从而增强胁迫响应 [27] (图1).近年来,许多ABA信号转导通路成员被报道参与木本植物的干旱反应.ABA受体 PtPYRL1/5 的过表达均增加了转基因杨树的耐旱性 [28] .转 PtPYRL1/5 基因杨树抗旱性的提高与ABA信号通路决定的关键反应,包括增加气孔关闭和减少叶片水分损失呈正相关 [28] .进一步的分析表明,过表达株系清除活性氧的能力和抗氧化酶的活性均提高了 [28] .过表达杨树 PP2C 基因负调节转基因拟南芥的耐旱性 [29] .
4 转录调控
在植物感应到干旱胁迫后,下游转录调控反应被触发.TFs是基因表达的主要调节因子,通过ABA依赖型和ABA非依赖型途径在干旱响应中发挥关键作用(图2).
4.1 ABA依赖型干旱胁迫响应途径
ABA依赖型干旱胁迫响应途径下游TFs主要有五类,包括bZIP(ABA-Responsive Element(ABRE)Binding Factors/ABA-Responsive Element Binding protein,ABF/AREB)、NAC( N AM/ A TAF/ C UC)、WRKY、MYB(v-myb avian myeloblastosis viral oncogene homolog)和NF-Ys(Nuclear Factor Ys) [30] .属于bZIP家族的ABF/AREB通过识别下游基因启动子区域的顺式元件(例如,ABRE,ACGTGG/TC)发挥作用 [31] .脱水和ABA处理可以诱导胡杨 PeABF3 基因的表达, PeABF3 通过直接调控ADF5(Actin-Depolymerizing Factor-5)促进ABA诱导的气孔关闭,从而增强转基因杨树的抗旱性 [32] .过表达 PtrAREB3 的转基因杨树在干旱条件下表现出较强的耐旱性表型 [33] .PtabZIP1L(ABF/AREB类转录因子)通过增加侧根形成和调节耐旱性相关代谢物的生物合成来增强植物的耐旱性 [34] . PtrAREB1 基因沉默可降低转基因毛果杨的耐旱性,它通过募集HAT(Histone Acetyltransferase)复合物蛋白ADA2b(Alteration/Deficiency Inactivation2b)和GCN5(General Control Non-derepressible5),以增加组蛋白H3第9位赖氨酸残基的乙酰化并结合下游 NAC 基因 PtrNAC006/007/120 启动子的ABRE元件激活其表达.过量表达这些 PtrNACs 基因会影响木质部发育进而提高转基因植株的耐旱性.NAC转录因子(例如,Responsive to Desiccation 26,RD26)也可以与ABF/AREB家族TFs相互作用,在植物干旱响应途径中扮演关键角色 [35] .玫瑰中的一个 NAC 基因 RcNAC091 的表达受干旱和ABA诱导, RcNAC091 沉默导致干旱胁迫耐受性降低,而 RcNAC091 过表达则产生相反的效果 [36] .进一步研究发现RcNAC091直接靶向了 RcWRKY71 的启动子. RcWRKY71 基因的沉默降低了植株的耐旱性 [36] .此外, RcWRKY71 沉默的玫瑰植株对ABA不敏感,而过表达 RcWRKY71 基因的植株对ABA敏感,从而产生耐旱表型,说明 RcWRKY71 通过对ABA的影响正向调节抗旱性 [36] .与此不同的是,毛果杨WRKY家族基因 PtrWRKY18/35 过表达的拟南芥植株对ABA的敏感性降低,一系列ABA相关基因(例如, ABA-insensitive4/5 )在过表达植株中表达水平显著下调,导致植物对渗透胁迫的耐受性降低,死亡率和气孔开度增加,负调控植物抗旱性 [37] .除了这些转录因子,木本植物中报道的参与干旱胁迫响应的还有MYB和NF-Y TFs家族的成员.毛果杨R2R3-MYB转录因子PtrMYB94激活ABA响应基因表达和增加ABA含量,以ABA依赖的方式提高转基因杨树的耐旱性 [38] .过量表达杨树 PtNF-YA9 和 PdNF-YB7 的拟南芥分别通过促进ABA依赖的气孔关闭和提高水分利用效率提高植株对干旱胁迫的耐受性 [39,40] . PdNF-YB21 则通过增强杨树根系的生长来提高耐旱性 [41] .
4.2 非ABA依赖型干旱胁迫响应途径
由于ABA通过AREB/ABF调控其大部分靶基因,ABRE元件被认为是ABA依赖途径调控干旱响应基因的关键标志.而ABA非依赖型干旱响应基因通常在其启动子区含有脱水响应的顺式元件(Dehydration-responsive Element,DRE,TACCGACAT).AP2/ERF(APETALA2/Ethylene Responsive Factor)TF家族(例如,DRE-binding proteins/C-repeat binding factors,DREBs/CBFs)通常通过结合DRE序列来调控干旱适应性基因的表达.欧美杨( Populus × euramericana )AP2/ERF成员 PeSHN1 通过靶向 PeLACS2 (Long-chain Acyl-CoA Synthetase)调节蜡质生物合成提高杨树水分利用效率和耐旱性 [42] .胡杨 PeDREB2a 和 PeDREB2L 在拟南芥中过表达增强了转基因植株的耐旱性 [43,44] .苹果MdERF38与MdMYB1相互作用促进了苹果对干旱的响应 [45] .组成型过表达河北杨 PhCBF4a 和 PhCBF4b 的拟南芥植株具有更强的耐旱性 [46] .胡杨 PeCBF4a 的表达受脱水诱导,过表达 PeCBF4a 的转基因毛白杨的光合速率比对照提高34.7%~165.7%,瞬时水分利用效率比对照提高48.9%~103.7% [47] .除此之外,转基因毛白杨还表现出较高的超氧化物歧化酶(Superoxide Dismutase,SOD)活性和显着降低的丙二醛(Malondialdehyde)水平,在转基因植物中积累了更高水平的脯氨酸(Proline)和可溶性糖(Soluble sugars),表现出更强的耐旱性 [47] .
5 生理生化反应
转录因子通过调节干旱适应相关基因的表达,进而调控植物的生理生化保护机制(图2),主要包括:
(1)促进叶片表面的蜡质积累减少水分散失:为了减少水分损失,木本植物会通过增厚叶片表面的蜡质来减少蒸腾作用 [48] .
(2)激活抗氧化系统减轻氧化损伤:干旱胁迫会导致植物产生过量的活性氧自由基,这些自由基可引发氧化损伤.植物会通过激活抗氧化系统来应对这种氧化应激.抗氧化酶如SOD、过氧化物酶(POD)和抗坏血酸过氧化物酶(APX)等会被激活,帮助清除自由基,减轻氧化损伤 [49] .
(3)积累渗透调节物质,调节离子吸收与运输,维持细胞膨压稳定:植物在干旱胁迫下会积累可溶性糖类、脯氨酸、脂肪酸和脱水蛋白等.它们可以维持细胞的脱水状态、保护细胞膜稳定性和蛋白质结构,并提供额外的能量和碳源.这些渗透性物质还有助于维持细胞膨压和有效的气孔导度,从而使植物更好地吸收叶片的二氧化碳和根系的水分 [50] .其中,作为渗透调节物质之一的脯氨酸,其亲水基团可以与水分子结合,同时疏水基团可以和蛋白质结合,从而使蛋白得到更多的水分,防止脱水.此外,植物在干旱胁迫下还会调节根系吸收和运输离子,并调整其在植物体内的分配.钾离子(K + )和钙离子(Ca 2+ )的调节对于维持细胞内渗透调节和水分运输至关重要.
(4)调节植物激素积累,提高干旱胁迫适应:干旱胁迫会引发植物体内激素的调节反应.ABA在干旱胁迫中被活化,激发一系列干旱响应.ABA的增加可以促使气孔关闭,调节水分平衡,并通过调节转录因子的活性来诱导胁迫相关基因的表达.ABA信号转导通路的重要激酶SnRK2s还会与油菜素内酯(Brassinosteroid,BR)途径下游组分BIN2(Brassinosteroid-insensitive 2)相互作用影响植物根系生长 [51] .维管中的BR受体BRL3(Brassinosteroid-insensitive1-Like3)通过促进渗透调节物在根组织中的积累来协调植物在干旱胁迫下的生长和存活 [52] .此外,生长素响应通路的EXO70A3(Exocyst Sub-unit Exo70 Family Protein A3)通过影响中央根冠细胞中生长素外排载体PINFORMED 4的稳态来进行局部生长素转运进而调节根的结构和深度,以促进其从土壤中吸收水分,从而提高耐旱性 [53] .
这些生理生化反应帮助植物在干旱胁迫下保持水分平衡、维持细胞结构和功能稳定,并提供额外的保护机制,以适应干旱环境.
6 抗旱的相关表型
6.1 根的调节
在面对干旱胁迫时,木本植物的根会发生一系列变化来应对水分的不足和干旱环境的压力(图2).干旱条件下,木本植物的根系生长通常会受到抑制.根的生长速率减缓或停止,以减少对水分的需求和减轻水分蒸腾压力.这有助于保持根系与可用水分的平衡 [54] .研究表明干旱胁迫下松树的根系生长明显减少,根的生长速率下降.这种抑制有助于松树减少水分需求,保持水分平衡并适应干旱环境下的生长 [55] .木本植物的侧根和根毛的发育可能也会受到影响,根毛的数量和长度减少,以降低水分蒸腾速率和提高水分吸收的效率.此外,调整侧根发育的模式,增加侧根的分支与根系增加水分吸收的能力.在干旱条件下,根可能倾向于向下生长,以便获取深层的水分资源.此外,根系可能会通过增加分支根和调整根系的空间布局,以扩展根系的吸水面积,提高水分获取能力 [56] .当木本植物经历了一段干旱胁迫后,一旦水分得到恢复,根毛通常会进行修复和再生.新的根毛的发育和再生有助于提高水分吸收能力,并适应水分胁迫的变化 [57] .
总之,木本植物的根系在面对干旱胁迫时会通过调整根系的生长模式、根毛的发育和修复、根系的分布等方式来应对干旱环境的压力.这些变化有助于减少水分损失、提高水分吸收效率和有效地利用有限的水资源.需要注意的是,不同种类的木本植物和环境条件下,根系的响应和适应特征可能会有所差异.
6.2 叶片变化特征
在面对干旱胁迫时,木本植物的叶片也会发生相应的变化来应对水分的不足和干旱环境的压力(图2).受干旱环境刺激,木本植物的叶片可以通过关闭气孔和卷曲叶片表面来减少水分丧失.关闭气孔可以降低叶片表面的水分蒸腾速率,具有减少水分流失的效果 [58] ;而卷曲叶片表面则可以减少叶片表面积,减少受到干旱环境的暴露面积,进一步降低水分蒸腾.有些木本植物在受到干旱胁迫时,叶片可以通过增厚叶片表皮和表皮角质层、积累水分贮存物质(如脂肪、蛋白质和多糖)等方式进行水分储存和保护.这些适应性机制有助于减少水分丧失和维持细胞的水分稳定性 [59] .一些木本植物会在干旱条件下通过调节叶绿素和其他色素的合成与降解,来调整叶片的色素组成.这可能导致叶片颜色的变化,如叶片的变黄、变红.这种调节有助于减轻光合作用的压力和保护叶片免受干旱胁迫的损伤 [60] .在极端干旱条件下,大部分木本植物为了保护自身,会选择性地凋落叶片,以减少水分的损失.这种凋落与早衰的现象有助于植物将有限的水分资源重定向到更为关键的生长和生存过程 [61] .木本植物的叶片在应对干旱胁迫时,可能会同时采取多种适应策略.这些策略有助于降低水分蒸腾速率、改善水分利用效率,从而使植物能够在干旱环境下生存和继续生长.不同物种和环境条件下,叶片的响应和适应特征可能会有所差异.
7 结论与展望
木本植物由于其多年生的特性,必须承受更多的非生物胁迫.这篇综述系统的从信号感知、信号转导到转录调控、生理生化反应和表型变化等方面总结了木本植物对干旱胁迫可能的响应过程.但由于木本植物复杂的遗传背景和遗传转化的局限性,目前对木本植物响应干旱胁迫的精细调控机制的认识还很有限.要充分认识木本植物对干旱胁迫的响应途径和调控网络还有很长的路要走.
随着高通量测序技术的革新与测序成本的降低,使得利用正向遗传学手段研究木本植物的各种性状形成机制越来越便捷,如全基因组关联分析 [62] .实时活体显微镜技术对细胞过程进行实时可视化监测,单细胞组学和其他细胞特异性和组织特异性的方法,以及在原位成像的分析方法也有助于进一步了解木本植物响应干旱胁迫的空间和时间的复杂的动态分子变化 [63] .机器学习方法与基于图像的表型分析相结合的能力不断增长,这可以为植物胁迫表型在多个尺度上的高维数据分析提供新的见解 [64] .此外,CRISPR系统的精确和多重基因组编辑技术有助于产生可以在各种胁迫下提高植物耐受性的等位基因 [65,66] .从长远来看,这些技术手段协同发展将会加快确定新 的育种目标,以提高木本植物对干旱的耐受性,选育适合恶劣地理环境种植的新品种.
参考文献:
[1] Sitko K, Opala-Owczarek M, Jemiola G, et al . Effect of drought and heavy metal contamination on growth and photosynthesis of silver birch trees growing on post-industrial heaps [J]. Cells, 2021, 11: 53.
[2] Thapa G, Sadhukhan A, Panda S K, et al . Molecular mechanistic model of plant heavy metal tolerance [J]. Biometals, 2012, 25: 489.
[3] Jia H, Guan C, Zhang J, et al . Drought effects on tree growth, water use efficiency, vulnerability and canopy health of Quercus variabilis-Robinia pseudoacacia mixed plantation[J]. Front Plant Sci, 2022, 13: 1018405.
[4] Tariq M, Wright D J, Bruce T J, et al . Drought and root herbivory interact to alter the response of above-ground parasitoids to aphid infested plants and associated plant volatile signals [J]. PLoS One, 2013, 8: e69013.
[5] Wagner-Cremer F, Donders T H, Visscher H. Drought stress signals in modern and subfossil Quercus laurifolia (Fagaceae) leaves reflect winter precipitation in southern Florida tied to El Nino-Southern Oscillation activity [J]. Am J Bot, 2010, 97: 753.
[6] Zhu J K. Abiotic stress signaling and responses in plants [J]. Cell, 2016, 167: 313.
[7] Pei S, Liu Y, Li W, et al . OSCA1 is an osmotic specific sensor: a method to distinguish Ca 2+ -mediated osmotic and ionic perception [J]. New Phytol, 2022, 235: 1665.
[8] Posas F, Wurgler-Murphy S M, Maeda T, et al . Yeast HOG1 MAP kinase cascade is regulated by a multistep phosphorelay mechanism in the SLN1-YPD1-SSK1 "two-component" osmosensor[J]. Cell, 1996, 86: 865.
[9] Fang Y, Xiong L. General mechanisms of drought response and their application in drought resistance improvement in plants[J]. Cell Mol Life Sci, 2014, 72: 673.
[10] Liu H, Song S, Zhang H, et al . Signaling transduction of ABA, ROS, and Ca 2+ in plant stomatal closure in response to drought [J]. Int J Mol Sci, 2022, 23: 14824.
[11] Wan B, Lin Y, Mou T. Expression of rice Ca 2+ -dependent protein kinases (CDPKs) genes under different environmental stresses[J]. FEBS Lett, 2007, 581: 1179.
[12] Chan A S, Wong Y H. Gβγ signaling and Ca 2+ mobilization co-operate synergistically in a Sos and Rac-dependent manner in the activation of JNK by Gq-coupled receptors[J]. Cell Signal, 2004, 16: 823.
[13] Yang Q, Chen Z Z, Zhou X F, et al . Overexpression of SOS (salt overly sensitive) genes increases salt tolerance in transgenic Arabidopsis [J]. Mol Plant, 2009, 2: 22.
[14] Weng H, Yoo C Y, Gosney M J, et al . Poplar GTL1 is a Ca 2+ /calmodulin-binding transcription factor that functions in plant water use efficiency and drought tolerance[J]. PLoS One, 2012, 7: e32925.
[15] Lv X, Li Y, Chen R, et al . Stomatal responses of two drought-tolerant barley varieties with different ROS regulation strategies under drought conditions[J]. Antioxidants (Basel), 2023, 12: 790.
[16] Wang H, Li N, Li H, et al . Overexpression of NtGCN2 improves drought tolerance in tobacco by regulating proline accumulation, ROS scavenging ability, and stomatal closure [J]. Plant Physiol Biochem, 2023, 198: 107665.
[17] Sun G, Dong Z, Li G, et al . Mn(3)O(4) Nanoparticles alleviate ROS-inhibited root apex mitosis activities to improve maize drought tolerance [J]. Adv Biol (Weinh), 2023, 7: e2200317.
[18] Zhang J, Cheng K, Ma B, et al . CaCl 2 promotes the cross adaptation of Reaumuria trigyna to salt and drought by regulating Na + , ROS accumulation and programmed cell death [J]. Plant Physiol Biochem, 2023, 195: 214.
[19] Santisree P, Bhatnagar-Mathur P, Sharma K K. NO to drought-multifunctional role of nitric oxide in plant drought: Do we have all the answers?[J]. Plant Sci, 2015, 239: 44.
[20] Ma H, Chen J, Zhang Z, et al . MAPK kinase 10.2 promotes disease resistance and drought tolerance by activating different MAPKs in rice [J]. Plant J, 2017, 92: 557.
[21] Liu Y P, Zhou G H, Song X, et al . Emodin protects against homocysteine-induced cardiac dysfunction by inhibiting oxidative stress via MAPK and Akt/eNOS/NO signaling pathways [J]. Eur J Pharmacol, 2023, 940: 175452.
[22] Yang J, Matsumoto Y, Etoh T, et al . Nitric oxide NO - dependent and NO - independent signaling pathways act in ABA-inhibition of stomatal opening[J]. Plant Signal Behav, 2008, 3: 131.
[23] Takahashi F, Suzuki T, Osakabe Y, et al . A small peptide modulates stomatal control via abscisic acid in long-distance signalling[J]. Nature, 2018, 556: 235.
[24] Antoni R, Gonzalez-Guzman M, Rodriguez L, et al . Selective inhibition of clade A phosphatases type 2C by PYR/PYL/RCAR abscisic acid receptors [J]. Plant Physiol, 2012, 158: 970.
[25] Liu S, Lu C, Jiang G, et al . Comprehensive functional analysis of the PYL-PP2C-SnRK2s family in Bletilla striata reveals that BsPP2C22 and BsPP2C38 interact with BsPYLs and BsSnRK2s in response to multiple abiotic stresses [J]. Front Plant Sci, 2022, 13: 963069.
[26] Lin Z, Li Y, Zhang Z, et al . A RAF-SnRK2 kinase cascade mediates early osmotic stress signaling in higher plants [J]. Nat Commun, 2020, 11: 613.
[27] Soma F, Takahashi F, Kidokoro S, et al . Constitutively active B2 Raf-like kinases are required for drought-responsive gene expression upstream of ABA-activated SnRK2 kinases [J]. Proc Natl Acad Sci USA, 2023, 120: e2221863120.
[28] Yu J, Ge H, Wang X, et al . Overexpression of pyrabactin resistance-like abscisic acid receptors enhances drought, osmotic, and cold tolerance in transgenic poplars[J]. Front Plant Sci, 2017, 8: 1752.
[29] Arshad M, Mattsson J. A putative poplar PP2C-encoding gene negatively regulates drought and abscisic acid responses in transgenic Arabidopsis thaliana [J]. Trees, 2013, 28: 531.
[30] Yao T, Zhang J, Xie M, et al . Transcriptional regulation of drought response in arabidopsis and woody plants [J]. Front Plant Sci, 2020, 11: 572137.
[31] Li S, Lin Y J, Wang P, et al . The AREB1 transcription factor influences histone acetylation to regulate drought responses and tolerance in Populus trichocarpa [J]. Plant Cell, 2019, 31: 663.
[32] Yang Y, Li H G, Wang J, et al . ABF3 enhances drought tolerance via promoting ABA-induced stomatal closure by directly regulating ADF5 in Populus euphratica [J]. J Exp Bot, 2020, 71: 7270.
[33] Yu D, Wildhagen H, Tylewicz S, et al . Abscisic acid signalling mediates biomass trade-off and allocation in poplar [J]. New Phytol, 2019, 223: 1192.
[34] Dash M, Yordanov Y S, Georgieva T, et al . Poplar PtabZIP1 -like enhances lateral root formation and biomass growth under drought stress [J]. Plant J, 2017, 89: 692.
[35] Fujita M, Fujita Y, Maruyama K, et al . A dehydration-induced NAC protein, RD26, is involved in a novel ABA-dependent stress-signaling pathway[J]. Plant J, 2004, 39: 863.
[36] Geng L, Yu S, Zhang Y, et al . Transcription factor RcNAC091 enhances rose drought tolerance through the abscisic acid–dependent pathway [J]. Plant Physiol, 2023, 26: kiad366.
[37] Guo L, Li C, Jiang Y, et al . Heterologous expression of poplar WRKY18/35 paralogs in arabidopsis reveals their antagonistic regulation on pathogen resistance and abiotic stress tolerance via variable hormonal pathways [J]. Int J Mol Sci, 2020, 21: 5440.
[38] Fang Q, Wang X, Wang H, et al . The poplar R2R3 MYB transcription factor PtrMYB94 coordinates with abscisic acid signaling to improve drought tolerance in plants [J]. Tree Physiol, 2020, 40: 46.
[39] Lian C, Li Q, Yao K, et al . Populus trichocarpa PtNF-YA9 , A multifunctional transcription factor, regulates seed germination, abiotic stress, plant growth and development in Arabidopsis [J]. Front Plant Sci, 2018, 9: 954.
[40] Han X, Tang S, An Y, et al . Overexpression of the poplar NF-YB7 transcription factor confers drought tolerance and improves water-use efficiency in Arabidopsis [J]. J Exp Bot, 2013, 64: 4589.
[41] Zhou Y, Zhang Y, Wang X, et al . Root-specific NF-Y family transcription factor, PdNF-YB21 , positively regulates root growth and drought resistance by abscisic acid-mediated indoylacetic acid transport in Populus [J]. New Phytol, 2020, 227: 407.
[42] Meng S, Cao Y, Li H, et al . PeSHN1 regulates water-use efficiency and drought tolerance by modulating wax biosynthesis in poplar [J]. Tree Physiol, 2019, 39: 1371.
[43] Zhou M L, Ma J T, Zhao Y M, et al . Improvement of drought and salt tolerance in Arabidopsis and Lotus corniculatus by overexpression of a novel DREB transcription factor from Populus euphratica [J]. Gene, 2012, 506: 10.
[44] Chen J, Xia X, Yin W. A poplar DRE-binding protein gene, PeDREB2L , is involved in regulation of defense response against abiotic stress[J]. Gene, 2011, 483: 36.
[45] An J P, Zhang X W, Bi S Q, et al . The ERF transcription factor MdERF38 promotes drought stress-induced anthocyanin biosynthesis in apple[J]. Plant J, 2020, 101: 573.
[46] Wang Z, Liu J, Guo H, et al . Characterization of two highly similar CBF/DREB1 -like genes, PhCBF4a and PhCBF4b , in Populus hopeiensis [J]. Plant Physiol Biochem, 2014, 83: 107.
[47] Tian Q, Chen J, Wang D, et al . Overexpression of a Populus euphratica CBF4 gene in poplar confers tolerance to multiple stresses [J]. Plant Cell Tiss Org, 2016, 128: 391.
[48] Lu Y, Cheng X, Jia M, et al . Silencing GhFAR3.1 reduces wax accumulation in cotton leaves and leads to increased susceptibility to drought stress[J]. Plant Direct, 2021, 5: e00313.
[49] Amini A, Majidi M M, Mokhtari N, et al . Drought stress memory in a germplasm of synthetic and common wheat: antioxidant system, physiological and morphological consequences[J]. Sci Rep, 2023, 13: 8569.
[50] Poormohammad K S, Grieu P, Maury P, et al . Genetic variability for physiological traits under drought conditions and differential expression of water stress-associated genes in sunflower ( Helianthus annuus L.) [J]. Theor Appl Genet, 2007, 114: 193.
[51] Cai Z, Liu J, Wang H, et al . GSK3-like kinases positively modulate abscisic acid signaling through phosphorylating subgroup Ⅲ SnRK2s in Arabidopsis [J]. Proc Natl Acad Sci USA, 2014, 111: 9651.
[52] Fabregas N, Lozano-Elena F, Blasco-Escamez D, et al . Overexpression of the vascular brassinosteroid receptor BRL3 confers drought resistance without penalizing plant growth [J]. Nat Commun, 2018, 9: 4680.
[53] Ogura T, Goeschl C, Filiault D, et al . Root system depth in arabidopsis is shaped by EXOCYST70A3 via the dynamic modulation of auxin transport [J]. Cell, 2019, 178: 400.
[54] Bandurska H. Drought stress responses: coping strategy and resistance [J]. Plants (Basel), 2022, 11: 922.
[55] Tyagi V, Singh S P, Singh R D, et al . Chir pine and banj oak responses to pre-monsoon drought across slope aspects and positions in Central Himalaya [J]. Environ Monit Assess, 2023, 195: 258.
[56] Duddek P, Carminati A, Koebernick N, et al . The impact of drought-induced root and root hair shrinkage on root-soil contact[J]. Plant Physiol, 2022, 189: 1232.
[57] Duan H, Shao C, Luo X, et al . Root relative water content is a potential signal for impending mortality of a subtropical conifer during extreme drought stress [J]. Plant Cell Environ, 2023, 46: 2763.
[58] Zhang Q, Tang W, Xiong Z, et al . Stomatal conductance in rice leaves and panicles responds differently to abscisic acid and soil drought[J]. J Exp Bot, 2023, 74: 1551.
[59] Mkhabela S S, Shimelis H, Gerrano A S, et al . Drought tolerance assessment of okra ( Abelmoschus esculentus [L.] Moench) accessions based on leaf gas exchange and chlorophyll fluorescence [J]. Life (Basel), 2023, 13: 682.
[60] Harfouche A, Meilan R, Altman A. 2014. Molecular and physiological responses to abiotic stress in forest trees and their relevance to tree improvement[J]. Tree Physiol, 2014, 34: 1181.
[61] Silvestre-Carbonell S, Ogaya R, Fernandez-Martinez M, et al . Chlorophyll fluorescence variation in two Mediterranean forest species over a 21-year drought treatment period [J]. Tree Physiol, 2023, 43: 1533.
[62] Chen Z Q, Zan Y, Milesi P, et al . Leveraging breeding programs and genomic data in Norway spruce ( Picea abies L. Karst) for GWAS analysis[J]. Genome Biol, 2021, 22: 179.
[63] Nobori T, Oliva M, Lister R, et al . Multiplexed single-cell 3D spatial gene expression analysis in plant tissue using PHYTOMap[J]. Nat Plants, 2023, 9: 1026.
[64] Singh A, Jones S, Ganapathysubramanian B, et al . Challenges and Opportunities in Machine-Augmented Plant Stress Phenotyping[J]. Trends Plant Sci, 2021, 26: 53.
[65] Sulis D B, Jiang X, Yang C, et al . Multiplex CRISPR editing of wood for sustainable fiber production [J]. Science, 2023, 381: 216.
[66] Alba Burbano D, Cardiff R A L, Tickman B I, et al . Engineering activatable promoters for scalable and multi-input CRISPRa/i circuits [J]. Proc Natl Acad Sci USA, 2023, 120: e2220358120.

