肠道菌群在慢加急性肝衰竭中的变化特征及致病机制
陈桂容 王明刚 林华明 严惠萍 王秀峰

摘要:慢加急性肝衰竭起病迅速而病死率高,预后差,且缺乏特异性药物治疗及手段。近年来,越来越多的证据表明肠道微生物群对维持人体微环境稳态的作用至关重要。利用宏基因组学全面测试肠道菌群特征可证明肠道菌群与慢性肝脏疾病发生发展方面存在交互关联。在慢加急性肝衰竭发病机制研究中,发现肠道微生物群在其致病过程中扮演重要角色。基于此,本文总结了慢加急性肝衰竭发生发展过程中肠道菌群的变化特征及其参与致病的机制途径,以期从肠道菌群调控新视角为慢加急性肝衰竭的临床治疗提供新靶点。
关键词:胃肠道微生物组; 慢加急性肝功能衰竭; 细菌移位
基金项目:广西自然科学基金(2018GXNSFGA281002, 2018GXNSFBA281031); 广西研究生教育创新计划项目(YCSY2022027)
Changes and pathogenic mechanism of intestinal flora in acute-on-chronic liver failure
CHEN Guirong WANG Minggang LIN Huaming YAN Huiping WANG Xiufeng (1. Graduate School of Guangxi University of Chinese Medicine, Nanning 530222, China; 2. a. Department of Scientific Research, b. First Department of Hepatology, The First Affiliated Hospital of Guangxi University of Chinese Medicine, Nanning 530023, China)
Corresponding author:WANG Xiufeng, 52912236@qq.com (ORCID:0000-0003-0841-5908)
Abstract:Acute-on-chronic liver failure (ACLF) has a rapid onset, a high mortality rate, and a poor prognosis, and there is still a lack of specific pharmacotherapy and treatment methods. In recent years, an increasing number of evidence has shown that intestinal flora plays a critical role in maintaining the homeostasis of human microenvironment. Comprehensive testing of intestinal flora profile using metagenomics has demonstrated an interaction association between intestinal flora and the development and progression of chronic liver diseases. Research on the pathogenesis of ACLF has found that intestinal flora plays an important role in the pathogenesis of ACLF. Based on this, this article summarizes the changes in intestinal flora and its pathogenic mechanism in the development and progression of ACLF, so as to provide new targets for the clinical treatment of ACLF from the new perspective of intestinal flora regulation.
Key words:Gastrointestinal Microbiome; Acute-On-Chronic Liver Failure; Bacterial Translocation
Research funding:Natural Science Foundation of Guangxi Zhuang Autonomous Region(2018GXNSFGA281002, 2018GXNSFBA281031); Guangxi Postgraduate Education Innovation Program (YCSY2022027)
據统计[1],肝硬化失代偿期患者中慢加急性肝衰竭(ACLF)全世界患病率为35%,90 d病死率达58%。一般对症支持治疗难以有效缓解疾病进程,人工肝及肝移植作为目前治疗ACLF最有效手段在不发达地区普及度较低。近年来大量研究[2]报道ACLF患者肠道内存在微生态失衡,肝脏与肠道之间通过“肠-肝轴”特殊结构相互影响。探索肠道菌群变化对ACLF发生发展的影响机制以及通过调节菌群平衡治疗和缓解急性肝损伤方面的研究势在必行。
1肠道菌群与人体微环境稳态
肠道微生态与人体健康之间的平衡关系日益得到认可,健康的肠道菌群与宿主之间相互依存,共生共长。人体胃肠道中微生物种类繁多,数量更是高达数万亿,肠道微生物群不仅包括细菌、病毒、真菌,还包括古生菌和原生动物等[3-4]。成千上万种微生物中以拟杆菌、厚壁菌、放线菌和变形杆菌为主要门类,约占肠道内细菌的90%。据统计,肠道菌群在不同肠段其分布与结构也不尽相同,从肠道近端至远端,主要优势菌群多以专性厌氧菌为主,占肠道菌群绝大多数;次要菌群则以兼性厌氧菌和需氧菌为主[5]。肠道菌群在肠道微生态环境中维持着相对动态平衡,有益菌和致病菌形成相互制约的势态,健康的菌群平衡有利于营养吸收,从而调节宿主免疫力[6]。然而,当宿主体内微生态环境或菌群定植位点发生改变时,一些条件致病菌在肠道内快速增殖并破坏肠道菌群稳态,增加了肠道通透性及损坏肠道黏膜屏障,导致机体代谢能力和免疫力的下降,最终诱发炎症反应。由此可知,肠道菌群可以通过调节人体免疫过程,进而控制机体的稳态。2肠道微生态特征性变化与ACLF
2.1肠道微生态屏障破坏在生理状态下,肠道菌群与机体之间维持协调平衡,互不侵扰,这主要依赖肠道微生态屏障的完整性,其可有效阻挡肠道内致病菌向肠道外扩散与移位。肠道微生态屏障主要分为由上皮细胞及黏液凝胶层组成的机械屏障,肠微生物菌群构成的生物屏障,肠道相关淋巴组织形成的免疫屏障以及由黏液、消化液和正常菌分泌的抑菌物质组成的化学屏障[7]。当各个屏障功能稳定存在时,肠上皮细胞之间的紧密连接、肠内外微生物通过相互竞争形成的定植抵抗力及由微生物群产生益于肠道的短链脂肪酸(short-chain fattyacids, SCFA)等共同构成了保护肠黏膜屏障的有效途径[8]。
现有研究[7]发现肠道黏膜屏障破坏与肝病的严重程度具有相关性,肠道微生态失调、炎症反应和细胞紧密连接功能障碍等发生会增加肠道通透性。肠道屏障受损时,移位细菌和微生物毒素可以通过血液循环向远处器官传播,肝脏作为第一个通过肠道屏障遇到细菌代谢产物的器官,肠道内毒素透过屏障可直接作用于肝脏,这便形成诱导肝脏炎症与急性失代偿的驱动因素[9]。故增强肠道定植抵抗力,保护肠黏膜屏障可有效截断肝衰竭疾病进程。肠道树突状细胞在调节肠道免疫屏障功能和肠道定植菌移位方面起重要作用[10-11],当益生菌刺激肠道树突状细胞启动免疫应答时,肠道内内毒素和炎症因子水平降低,肠上皮细胞紧密连接蛋白的表达增加,致使肠黏膜通透性降低,从而有效阻止内毒素弥散入血回流至肝脏,损伤肝细胞。胶质细胞源性神经营养因子作为肠道屏障功能调节因子可以通过抑制IL-8、TNF及髓过氧化物酶等促炎因子的表达扼制肠黏膜细胞的凋亡[12]。短链脂肪酸是肠道细胞的能量来源,可同时激活肠道上皮中的NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎症小体及刺激IL-18的分泌,调节肠上皮细胞对细菌产物的耐受性,从而改善肠黏膜屏障的完整性[13]。保护肠黏膜屏障完整是维持肠道菌群稳态的基础,从根本上避免肠道菌群移位及内毒素血症形成,对于预防ACLF病程发展有着积极作用。
2.2肠道定植菌移位
2.2.1ACLF中肠道菌群结构和功能变化微生物群从肠道共生伙伴到定植者再到病原体的转变始终贯穿着人体健康与疾病的发展过程,肠道菌群稳态失调时从肠道近端到远端的菌群组成、比例也在随之变化。肠道潜在致病菌过度生长及有益菌丰度下降均造成ACLF預后不良[14]。双歧杆菌属、瘤胃球菌属和梭菌属等专性厌氧菌作为肠道优势菌群,与宿主处于共生状态,对宿主发挥着免疫、代谢和营养等生理功能。一项多中心临床研究[15]表明,肝硬化患者发生肝外器官衰竭、疾病恶化及向ACLF进展的风险增高与入院时患者存在肠道微生态失调相关,该研究发现患者肠道内肠球菌科和链球菌科丰度较高,双歧杆菌科丰度较低。在针对ACLF肠道微生物组的研究[16]中,ACLF患者粪便中拟杆菌科、鲁米诺科和淋球菌科的丰度较低,而巴氏杆菌科、链球菌科和肠球菌科的丰度颇高。在胆汁代谢过程中,7α-脱羟基作用可将胆汁酸转化为次级胆汁酸,能产生这种作用的梭菌目(如乳杆菌科、瘤胃球菌科和蓝藻科)被证实在肝硬化患者肠道中显著减少,具有潜在致病性的肠杆菌科丰度呈上升趋势[17]。在ACLF患者中,变形杆菌的丰度变化常伴随不良结局。变形杆菌家族如大肠杆菌、肺炎克雷伯菌和铜绿假单胞菌丰度升高,是导致ACLF细菌感染的主要原因[18]。研究显示有肠道微生物结构改变的ACLF患者病死率极高,这对预防和预测ACLF的发展以及通过各种靶向肠道微生物治疗手段建立短期或长期诊疗计划具有重大意义。菌属的代谢途径或许可成为ACLF的治疗靶点及评估临床预后的疗效指标。
2.2.2肠道定植菌移位并发感染肠道定植菌移位引起肠道感染是一种常见并发症,肠道定植菌移位或内毒素移位主要归因于肠道细菌过度生长,肠道黏膜屏障受损,宿主免疫功能下降三个方面。由于肠道不断接触细菌和细菌产物,局部炎症导致肠道黏膜通透性增加,病原微生物透过肠道屏障,调节免疫细胞进而激活下游因子NF-κB,诱导趋化因子和炎症因子进入血液循环,被激活的病原体相关分子模式与肝源性损伤相关的分子模式相结合,进一步促进ACLF恶化发展[19]。一项研究[20]结果显示肝硬化患者细菌感染后死亡风险较非感染患者升高4倍,病死率为43.5%,而没有细菌感染者的病死率仅为13.6%。另外Mücke等[21]通过筛选出173例符合欧洲肝病学会标准的ACLF住院患者,分别评估细菌感染后30 d内病死率,其中符合欧洲肝病学会标准的3级患者病死率高达62%。
严重细菌感染诱发自发性细菌性腹膜炎(spontaneous bacterial peritonitis,SBP)往往与肠道细菌移位相关。肝硬化失代偿期常伴严重腹水,在腹水中检测到细菌DNA可明确肠道定植菌发生移位,这种移位与全身炎症反应、内毒素血症高度相关[22]。利用16SrDNA高通量测序分析SBP患者粪便中菌群特征,可见ACLF合并SBP患者肠道菌群中大肠杆菌志贺菌属丰度明显高于未发生SBP组,证实临床上ACLF患者并发SBP与特定微生物过度生长并向肠外播散有关[23]。在对腹水培养阳性的失代偿期肝硬化患者进行肠道菌群分离特点分析时,亦发现感染SBP的患者中超半数患者腹水中有革兰阳性菌过度生长[24-25]。预防细菌感染,尽早识别死亡危险因素的增加对于ACLF及失代偿期肝硬化患者改善预后极为重要。
3肠道菌群参与ACLF致病机制途径
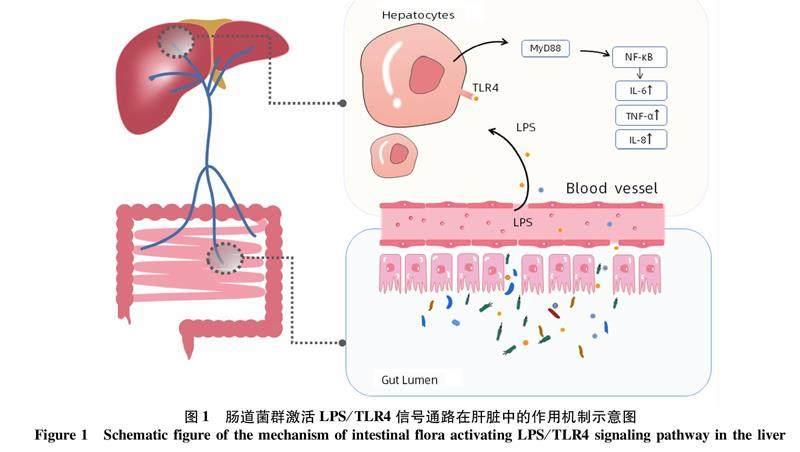
3.1肠道菌群过度激活LPS/ Toll样受体4(TLR4)信号通路肝脏作为重要的免疫调节器官,可调节相关免疫功能对宿主起到防御保护作用。TLR4作为肝细胞上表达的一种模式识别受体,它的主要配体是内毒素脂多糖(LPS)和细胞死亡产物(如裂解核小体、组蛋白、高迁移率族蛋白B1)[26]。当肠道来源的LPS特异性识别肝细胞上的TLR4受体时,LPS和TLR4之间相互作用激活髓样分化因子88(myeloid differentiation factor88,MyD88)依赖途径,MyD88则进一步启动下游NF-κB信号通路,最终导致促炎介质的释放,诱发炎症级联反应[27],这种级联反应的形成促成全身炎症反应综合征以及对肝脏的“二次打击”(图1)。Engelmann等[26]通过检测发现ACLF或急性肝衰竭患者血浆和肝组织中的TLR4表达上调,TLR4配体增加,证明了TLR4是ACLF发病的关键因素。使用TLR4拮抗剂(TAK-242)选择性地破坏TLR4信号通路可减少LPS诱导肝细胞和单核细胞中的细胞因子分泌和细胞凋亡。由此可见肝脏内内毒素水平上升激活TLR4诱导的免疫反应是导致肝损伤的重要机制之一。
3.2肠道菌群参与胆汁酸异常代谢胆汁酸作为胆汁的主要功能成分,在肝脏中合成后储存于胆囊,随后被释放到小肠中。胆汁酸代谢途径经过肠道时,95%的胆汁酸在回肠末端被重吸收,再经门静脉循环系统回流至肝脏重新参与胆汁排泄[28]。此时剩余的初级胆汁酸经肠道共生菌分泌的7α-脱羟基酶及胆盐水解酶(bile salt hydrolase,BSH)转化成次级胆汁酸,当肠道中梭菌属及产BSH的细菌(包括拟杆菌属、梭状杆菌属、乳酸杆菌属及双歧杆菌属等)丰度降低时,7α-脱羟基酶及BSH严重分泌不足,该代谢胆汁酸途径受阻形成肠肝循环障碍,胆汁酸大量储积,加重肝损伤或直接诱导死亡[29](图2)。法尼醇核受体R在该胆汁酸代谢过程中维持肝内胆汁酸的正常水平以及胆汁酸池稳态,能有效防止胆汁淤积性肝损伤。另外肠道中的次级胆汁酸激活G蛋白偶联受体1负调控NF-κB及STAT3通路亦可抑制肝脏炎症反应[30]。
值得关注的是肠道中胆汁酸代谢紊乱也会使肠道通透性增加,致使菌群移位,内毒素进入肝脏产生肠源性内毒素血症,形成肝衰竭并发症的共同物质基础。
3.3肠道菌群激活强氧化应激反应 氧化应激在各种肝脏疾病的病理生理学中占有重要地位[31]。活性氧(ROS)作为体内信号分子参与了多种信号通路并在人体内发挥有益作用,当肠道菌群失调时细菌繁殖并释放毒力因子进入肝脏从而过度激活Kupffer细胞引发氧化应激反应产生大量ROS[32]。肝脏是受氧化应激反应影响的主要器官,肝星状细胞、Kupffer细胞和肠道内皮细胞均对氧化应激反应敏感。高水平的氧化应激参与了炎症性、代谢性及脂肪性肝病的发病机制[33]。肠道菌群还可促进内源性乙醇及其化合物生成,诱导肝星状细胞及Kupffer细胞形成ROS,ROS及LPS共同刺激炎性因子释放,产生一系列炎症反应加重慢性肝病进展[34]。严格控制细胞内ROS水平,并保持氧化剂和抗氧化剂分子之间的平衡有利于延缓氧化应激对肝脏的损害。但目前对于肠道菌群引起的氧化应激反应在ACLF中的作用还需进行不断探索,为ACLF机制方面研究增加新的突破口。
4靶向肠道微生物群防治ACLF
健康的肠道菌群在很大程度上反映了宿主的整体健康状况,对调节营养及药物代谢、维持肠道黏膜屏障的结构完整性、免疫调节和对病原体定植抵抗等方面均具有特定的功能。因此,利用肠道微生物群的生理特性缓解ACLF疾病发展可作为一种预防性治疗思路。通过干预模式合理改变肠道菌群分布及防止肠黏膜屏障受损可有效缓解肝衰竭进程。目前临床应用较为广泛的治疗措施有饮食调理、微生态制剂、抗生素治疗及粪菌移植等。
4.1饮食调理ACLF的治疗可靶向调节肠道微生物群,减少肠道致病菌的产生,饮食调理作为治疗过程的重要一环被广泛应用于临床。高脂、高糖饮食已被证实可影响人肠道中的菌群结构,肠杆菌科、埃希氏菌、克雷伯氏菌和志贺氏菌在高脂肪饮食中处于较高水平,拟杆菌、乳酸和肠球菌显著减少[35]。补充膳食纤维对于ACLF患者肠道菌群紊乱有着明显改善作用,膳食纤维干预可使双歧杆菌和乳酸杆菌属的丰度升高,还可促进肠道SCFA形成及降低肠道LPS释放,其中SCFA在维持肠道屏障及提供能量方面尤显重要[36-37]。
4.2微生态制剂益生菌作为微生态制剂是一种对机体有益的活性微生物,能够预防性的调节肠道菌群紊乱,对維持肠道黏膜完整性和调节免疫系统有重要作用[38]。益生菌亦被证明有利于肠道SCFA的形成,丁酸盐和丙酸盐作为主要的SCFA,除了在维持肠道屏障方面具有重要作用,还能维持机体水电解质平衡、调节肠道pH值和抑制病原微生物活力[39]。Horvath等[40]研究表明使用多种益生菌治疗后的肝硬化失代偿期患者肠道有益微生物群丰度明显增加,并且有效改变了原始微生物群组成及肠黏膜屏障功能。故调整ACLF患者饮食结构或口服益生菌在临床应用中可作为基础治疗手段。除益生菌外,益生元和合生元(由益生元和益生菌合成)同样对调节肠道菌群紊乱和肠黏膜屏障稳固性有较强作用。
4.3抗生素治疗临床上对ACLF并发的感染可常规使用抗生素治疗,正如服用利福昔明治疗肠道菌群失调引起的细菌感染及肝性脑病,一定程度上可对有害致病菌起到打击作用。一项随机双盲对照临床试验[41]表明,利福昔明-α可降低肠道微生物群衍生的内毒素血症及炎症反应,其作用机制可能是利福昔明-α降低了肠道微环境中富含的TNF-α和白细胞介素-17等致炎因子,增强了对入侵性病菌的抗菌反应,并促进了肠道屏障修复。然而,另有部分学者[42]对使用抗生素治疗有着不同的观点,认为过度使用抗生素会对宿主产生持久的负面影响,使肠道菌群产生耐药性,反而不利于预防和缓解ACLF疾病的发展。
4.4菌群移植有关菌群移植的研究在临床中也逐渐被开展,这是一种对重建肠道菌群稳态的较为实用的方法,即通过移植正常肠道菌群至ACLF患者体内从而调整患者肠道菌群的紊乱状态。目前的研究已提供了不少相关依据证明此种治疗方法的可靠性,亦为肝硬化失代偿期患者及ACLF患者的治疗带来更多希望。
5总结与展望
ACLF是全球肝硬化和慢性肝病患者死亡的主要原因,早期诊断、积极预防诱发因素可改善预后,但目前主要局限于支持性治疗,针对ACLF特异性疗法尚未明确。迄今为止,肝移植是最有效的治疗手段,但肝源供应、移植后排斥反应及经济费用成了另一难题。因此通过探索其他靶向治疗手段成了当务之急。肠道一直以来被喻为人体第三大器官,对维持人体健康有巨大贡献。通过肝脏与肠道之间的特殊连接,本文阐述了肠道菌群参与ACLF疾病发展过程中的几种作用机制,肠道黏膜屏障破坏,菌群移位,胆汁酸通路及免疫细胞激活均参与诱导炎症反应和肝细胞凋亡。肠道菌群移位导致细菌感染及SBP是加重ACLF死亡的危险因素。故而以靶向调节肠道菌群为切入点对预防和改善肝硬化失代偿期及ACLF进展尤显重要。但是由于肠道菌群的种类及数量众多,对诱发和加重ACLF疾病的菌群种类研究尚不全面,大量未知菌群的有益或有害方面仍不得而知,未来还需要在这一领域进行大规模、高质量挖掘和探索。此外,肠道微生物组结构及致病菌数量变化可能是预测肝硬化急性失代偿及ACLF发展的有用标志物,但肠道微生物的特征并非一致,仍亟待深化研究。最后,肠道微生物组在失代偿期肝硬化和ACLF病因病机中的作用同样值得进一步探究和改进,这可能成为疾病诊断和治疗策略的理论基础,为后期ACLF治疗提供更合理、更有效的依据。
利益冲突声明:本文不存在任何利益冲突。作者贡献声明:陈桂容、王明刚、王秀峰对文章的思路及设计有关键贡献;陈桂容负责拟定写作框架并撰写文章;林华明、严惠萍均参与了文献检索及论文修订;王明刚、王秀峰负责指导修改并最终定稿。
参考文献:
[1]MEZZANO G, JUANOLA A, CARDENAS A, et al. Global burden of disease: acute-on-chronic liver failure, a systematic review and meta-analysis[J]. Gut, 2022, 71(1): 148-155. DOI: 10.1136/gutjnl-2020-322161.
[2]GIANNELLI V, DI GREGORIO V, IEBBA V, et al. Microbiota and the gut-liver axis: bacterial translocation, inflammation and infection in cirrhosis[J]. World J Gastroenterol, 2014, 20(45): 16795-16810. DOI: 10.3748/wjg.v20.i45.16795.
[3]GOMAA EZ. Human gut microbiota/microbiome in health and diseases: a review[J]. Antonie Van Leeuwenhoek, 2020, 113(12): 2019-2040. DOI: 10.1007/s10482-020-01474-7.
[4]LAN P, YIN SM, HE Z. Research progress of gut microbiota in the prevention and treatment of colorectal cancer[J]. Chin J Dig Surg, 2022, 21(6): 730-736. DOI: 10.3760/cma.j.cn115610-20220402-00176.蘭平, 殷盛梅, 何真. 肠道微生态在结直肠癌预防和治疗中的研究进展[J]. 中华消化外科杂志, 2022, 21(6): 730-736. DOI: 10.3760/cma.j.cn115610-20220402-00176.
[5]OHARA AM, SHANAHAN F. The gut flora as a forgotten organ[J]. EMBO Rep, 2006, 7(7): 688-693. DOI: 10.1038/sj.embor.7400731.
[6]FAN Y, PEDERSEN O. Gut microbiota in human metabolic health and disease[J]. Nat Rev Microbiol, 2021, 19(1): 55-71. DOI: 10.1038/s41579-020-0433-9.
[7]CHOPYK DM, GRAKOUI A. Contribution of the Intestinal microbiome and gut barrier to hepatic disorders[J]. Gastroenterology, 2020, 159(3): 849-863. DOI: 10.1053/j.gastro.2020.04.077.
[8]HIIPPALA K, JOUHTEN H, RONKAINEN A, et al. The potential of gut commensals in reinforcing intestinal barrier function and alleviating inflammation[J]. Nutrients, 2018, 10(8): 988. DOI: 10.3390/nu10080988.
[9]TREBICKA J, BORK P, KRAG A, et al. Utilizing the gut microbiome in decompensated cirrhosis and acute-on-chronic liver failure[J]. Nat Rev Gastroenterol Hepatol, 2021, 18(3): 167-180. DOI: 10.1038/s41575-020-00376-3.
[10]ZHANG Y, ZHANG J, XU T, et al. Allicin ameliorates intraintestinal bacterial translocation after trauma/hemorrhagic shock in rats: The role of mesenteric lymph node dendritic cell[J]. Surgery, 2017, 161(2): 546-555. DOI: 10.1016/j.surg.2016.08.029.
[11]HU Z, WU YS. The role and mechanism of gut microbiota in the occurrence of colorectal cancer[J]. Chin J Dig Surg, 2021, 20(6): 708-712. DOI: 10.3760/cma.j.cn115610-20210323-00142. 胡洲, 武永胜. 肠道菌群在结直肠癌发生中的作用及机制[J]. 中华消化外科杂志, 2021, 20(6): 708-712. DOI: 10.3760/cma.j.cn115610-20210323-00142.
[12]MEIR M, FLEMMING S, BURKARD N, et al. The glial cell-line derived neurotrophic factor: a novel regulator of intestinal barrier function in health and disease[J]. Am J Physiol Gastrointest Liver Physiol, 2016, 310(11): G1118- G1123. DOI: 10.1152/ajpgi.00125.2016.
[13]MACIA L, TAN J, VIEIRA AT, et al. Metabolite-sensing receptors GPR43 and GPR109A facilitate dietary fibre-induced gut homeostasis through regulation of the inflammasome[J]. Nat Commun, 2015, 6: 6734. DOI: 10.1038/ncomms7734.
[14]KIM SE, PARK JW, KIM HS, et al. The role of gut dysbiosis in acute-on-chronic liver failure[J]. Int J Mol Sci, 2021, 22(21): 11680. DOI: 10.3390/ijms222111680.
[15]BAJAJ JS, VARGAS HE, REDDY KR, et al. Association between intestinal microbiota collected at hospital admission and outcomes of patients with cirrhosis[J]. Clin Gastroenterol Hepatol, 2019, 17(4): 756-765.e3. DOI: 10.1016/j.cgh.2018.07.022.
[16]BAJAJ JS, HEUMAN DM, HYLEMON PB, et al. Altered profile of human gut microbiome is associated with cirrhosis and its complications[J]. J Hepatol, 2014, 60(5): 940-947. DOI: 10.1016/j.jhep.2013.12.019.
[17]KAKIYAMA G, PANDAK WM, GILLEVET PM, et al. Modulation of the fecal bile acid profile by gut microbiota in cirrhosis[J]. J Hepatol, 2013, 58(5): 949-955. DOI: 10.1016/j.jhep.2013.01.003.
[18]FERNNDEZ J, ACEVEDO J, WIEST R, et al. European Foundation for the Study of Chronic Liver Failure. Bacterial and fungal infections in acute-on-chronic liver failure: prevalence, characteristics and impact on prognosis[J]. Gut, 2018, 67(10): 1870-1880. DOI: 10.1136/gutjnl-2017-314240.
[19]JENNE CN, KUBES P. Immune surveillance by the liver[J]. Nat Immunol, 2013, 14(10): 996-1006. DOI: 10.1038/ni.2691.
[20]ARVANITI V, DAMICO G, FEDE G, et al. Infections in patients with cirrhosis increase mortality four-fold and should be used in determining prognosis[J]. Gastroenterology, 2010, 139(4): 1246-1256, 1256.e1-5. DOI: 10.1053/j.gastro.2010.06.019.
[21]MCKE MM, RUMYANTSEVA T, MCKE VT, et al. Bacterial infection-triggered acute-on-chronic liver failure is associated with increased mortality[J]. Liver Int, 2018, 38(4): 645-653. DOI: 10.1111/liv.13568.
[22]BRUNS T, REUKEN PA, STENGEL S, et al. The prognostic significance of bacterial DNA in patients with decompensated cirrhosis and suspected infection[J]. Liver Int, 2016, 36(8): 1133-1142. DOI: 10.1111/liv.13095.
[23]LI CQ, GUO JC, XUN YH, et al. Characterization of intestinal flora in chronic plus acute liver failure combined with spontaneous peritonitis[J]. Zhejiang J Integr Tradit Chin West Med, 2021, 31(11): 1012-1015. DOI: 10.3969/j.issn.1005-4561.2021.11.007. 李春青, 過建春, 荀运浩, 等. 慢加急性肝衰竭合并自发性腹膜炎肠道菌群特征分析[J]. 浙江中西医结合杂志, 2021, 31(11): 1012-1015. DOI: 10.3969/j.issn.1005-4561.2021.11.007.
[24]ALEXOPOULOU A, VASILIEVA L, AGIASOTELLI D, et al. Extensively drug-resistant bacteria are an independent predictive factor of mortality in 130 patients with spontaneous bacterial peritonitis or spontaneous bacteremia[J]. World J Gastroenterol, 2016, 22(15): 4049-4056. DOI: 10.3748/wjg.v22.i15.4049.
[25]ZHANG W, WANG GC, ZHANG T, et al. Distribution characteristics and drug resistance analysis of clinically isolated pathogens in patients complicated with decompensated hepatitis B cirrhosis and spontaneous bacterial peritonitis[J]. Int J Lab Med, 2022, 43(19): 2346-2351. DOI: 10.3969/j.issn.1673-4130.2022.19.009.張旺, 王国充, 张甜, 等. 乙型肝炎肝硬化失代偿期并发自发性细菌性腹膜炎患者临床分离菌的分布特点及耐药情况分析[J].国际检验医学杂志, 2022, 43(19): 2346-2351. DOI: 10.3969/j.issn.1673-4130.2022.19.009.
[26]ENGELMANN C, SHEIKH M, SHARMA S, et al. Toll-like receptor 4 is a therapeutic target for prevention and treatment of liver failure[J]. J Hepatol, 2020, 73(1): 102-112. DOI: 10.1016/j.jhep.2020.01.011.
[27]WANG Y, CHEN H, CHEN Q, et al. The protective mechanism of CAY10683 on intestinal mucosal barrier in acute liver failure through LPS/TLR4/MyD88 pathway[J]. Mediators Inflamm, 2018, 2018: 7859601. DOI: 10.1155/2018/7859601.
[28]BIAGIOLI M, CARINO A. Signaling from intestine to the host: how bile acids regulate intestinal and liver immunity[J]. Handb Exp Pharmacol, 2019, 256: 95-108. DOI: 10.1007/164_2019_225.
[29]GRNER N, MATTNER J. Bile acids and microbiota: multifaceted and versatile regulators of the liver-gut axis[J]. Int J Mol Sci, 2021, 22(3):1397. DOI: 10.3390/ijms22031397.
[30]PAN N, DOIGNON I, GARCIN I, et al. The receptor TGR5 protects the liver from bile acid overload during liver regeneration in mice[J]. Hepatology, 2013, 58(4): 1451-1460. DOI: 10.1002/hep.26463.
[31]CICHOZ·-LACH H, MICHALAK A. Oxidative stress as a crucial factor in liver diseases[J]. World J Gastroenterol, 2014, 20(25): 8082-8091. DOI: 10.3748/wjg.v20.i25.8082.
[32]ZHONG W, QIAN K, XIONG J, et al. Curcumin alleviates lipopolysaccharide induced sepsis and liver failure by suppression of oxidative stress-related inflammation via PI3K/AKT and NF-κB related signaling[J]. Biomed Pharmacother, 2016, 83: 302-313. DOI: 10.1016/j.biopha.2016.06.036.
[33]POPA GL, POPA MI. Oxidative stress in chronic hepatitis B-an update[J]. Microorganisms, 2022, 10(7): 1265. DOI: 10.3390/microorganisms10071265.
[34]GUSTOT T, LEMMERS A, MORENO C, et al. Differential liver sensitization to toll-like receptor pathways in mice with alcoholic fatty liver[J]. Hepatology, 2006, 43(5): 989-1000. DOI: 10.1002/hep.21138.
[35]BEAM A, CLINGER E, HAO L. Effect of diet and dietary components on the composition of the gut microbiota[J]. Nutrients, 2021, 13(8): 2795. DOI: 10.3390/nu13082795.
[36]SO D, WHELAN K, ROSSI M, et al. Dietary fiber intervention on gut microbiota composition in healthy adults: a systematic review and meta-analysis[J]. Am J Clin Nutr, 2018, 107(6): 965-983. DOI: 10.1093/ajcn/nqy041.
[37]KOH A, de VADDER F, KOVATCHEVA-DATCHARY P, et al. From dietary fiber to host physiology: short-chain fatty acids as key bacterial metabolites[J]. Cell, 2016, 165(6): 1332-1345. DOI: 10.1016/j.cell.2016.05.041.
[38]KOCOT AM, JAROCKA-CYRTA E, DRABIN′SKA N. Overview of the importance of biotics in gut barrier integrity[J]. Int J Mol Sci, 2022, 23(5): 2896. DOI: 10.3390/ijms23052896.
[39]CONG J, ZHOU P, ZHANG R. Intestinal microbiota-derived short chain fatty acids in host health and disease[J]. Nutrients, 2022, 14(9): 1977. DOI: 10.3390/nu14091977.
[40]HORVATH A, DURDEVIC M, LEBER B, et al. Changes in the intestinal microbiome during a multispecies probiotic intervention in compensated cirrhosis[J]. Nutrients, 2020, 12(6): 1874. DOI: 10.3390/nu12061874.
[41]PATEL VC, LEE S, MCPHAIL M, et al. Rifaximin-α reduces gut-derived inflammation and mucin degradation in cirrhosis and encephalopathy: RIFSYS randomised controlled trial[J]. J Hepatol, 2022, 76(2): 332-342. DOI: 10.1016/j.jhep.2021.09.010.
[42]BECATTINI S, TAUR Y, PAMER EG. Antibiotic-induced changes in the intestinal microbiota and disease[J]. Trends Mol Med, 2016, 22(6): 458-478. DOI: 10.1016/j.molmed.2016.04.003.
收稿日期:2022-10-24;錄用日期:2022-12-08
本文编辑:王莹
引证本文:CHEN GR, WANG MG, LIN HM, et al. Changes and pathogenic mechanism of intestinal flora in acute-on-chronic liver failure[J]. J Clin Hepatol, 2023, 39(8): 1992-1998.

