陆地棉钙依赖蛋白激酶GhCDPK28-A10 参与抗黄萎病的功能分析
邵武奎,赵准,胡文冉,郝晓燕,高升旗,李建平,陈果,刘晓东*,黄全生*
(1.新疆农业大学生命科学学院,乌鲁木齐 830052;2.新疆农业科学院核技术生物技术研究所/新疆农作物生物技术重点实验室,乌鲁木齐 830091)
棉花是全球最重要的经济作物之一。但是,棉花在生长发育过程中常受到许多不利环境条件的限制,包括生物和非生物胁迫。在这些胁迫中,由大丽轮枝菌(Verticillium dahliae)引起的土传性、毁灭性维管束病害黄萎病严重影响棉花的产量和品质[1]。在棉花黄萎病严重暴发期间,棉花减产可能超过30%[2]。黄萎病菌侵染植物的根系引起维管枯萎发病[3],并且形成的微菌核休眠结构在没有宿主的土壤中能存活数年进而感染后续作物[3]。目前,仍没有杀菌剂能够有效控制黄萎病,因此抗病品种的选择和选育是控制黄萎病的根本措施[2]。但是调控棉花黄萎病抗性的关键基因和调控机制尚不清楚,在棉花种质中鉴定抗黄萎病基因,并将其应用到优质棉花品种的选育中具有重要意义[4]。
植物在长期进化过程中,形成了一系列多层次的监测系统。植物用来防御微生物感染的先天免疫监测系统主要有2 个层面:模式触发的免疫(pattern-triggered immunity,PTI)和效应子触发的免疫(effector-triggered immunity,ETI)。模式识别受体(pattern recognition receptor,PRR)识别病原体或微生物相关分子模式 (pathogen or microbial-associated molecular pattern, PAMP/MAMP)和内源性损伤相关分子模式(endogenous damageassociated molecular pattern,DAMP)触发PTI[5]。PRR 能检测到病原体的分子特征,进而激发活性氧(reactive oxygen species,ROS)爆发、次生代谢物的产生和钙离子(Ca2+)流入胞浆,其中ROS 是参与植物生长发育和胁迫反应的关键信号分子[6]。激素介导的信号传导是棉花对黄萎病的重要防御机制之一。其中,茉莉酸(jasmonic acid,JA)、水杨酸(salicylic acid, SA)和乙烯(ethylene,ET)在植物感染病原菌后的应激信号通路中发挥重要作用[6]。植物感染病原体后,PTI 和ETI 引发的免疫反应将调节JA 的合成[7],通常在短时间内JA 含量会增加[8]。与JA 合成相关的JAZ(jasmonate-zim-domain protein,茉莉酸ZIM 结构域蛋白)和AOS(allene oxide synthase,丙二烯氧化物合酶)等蛋白动态调节JA 合成,而JA 能增强拟南芥(Arabidopsis thaliana)对大丽轮枝菌和其他真菌的抗性[9]。
近年来,随着基因组学、转录组学和蛋白质组学的发展。许多与棉花黄萎病抗性相关的基因已被报道,发现转录因子如WRKY、NAC、bHLH、bZIP、ERF/AP2 和MYB 等家族成员参与棉花对黄萎病病菌的防御反应。以往的研究发现,植物免疫反应过程中胞质Ca2+浓度显著增加[10]。在病原体感染期间,细胞质Ca2+是植物细胞中重要的第二信使[11]。植物中钙离子传感器主要有3 种类型:钙调蛋白 (calmodulin,CaM)和CaM 相关蛋白(CaM-related proteins)、钙依赖蛋白激酶(calcium-dependent protein kinase,CDPK)、类似于动物钙调磷酸酶B 亚基蛋白(calcium B-like protein,CBL)。CDPK 蛋白被认为在植物先天免疫中起关键作用,包括参与ROS 调节的免疫应答、防御相关基因表达和信号转导[12-13];CDPK 是各种PAMP 引发的PTI 信号的转导枢纽,而且能够诱导ETI 标志基因的表达。CDPK在病原体感染过程中可以被钙信号激活,诱导构象变化和激活激酶活性,导致CDPK 自身磷酸化和底物磷酸化[14]。现已在拟南芥中发现34 个CDPK基因[15],其中AtCDPK28可以调节ROS 介导的防御信号,参与JA 和SA 相关的组织特异性平衡[16]。AtCDPK28被认为是免疫信号转导的负调控因子,AtCDPK28功能的丧失导致拟南芥对细菌感染的抗性增强[17]。在烟草(Nicotiana attenuata)中,与AtCDPK28同 源 性 较 高 的NaCDPK4和NaCDPK5基因被沉默后,烟草会积累大量的防御代谢产物[18]。与AtCDPK28同源的OsCDPK4和OsCDPK18在水稻(Oryza sativa)中的功能丧失导致免疫信号转导和对病原体的抗性增强[19]。水稻OsCDPK9在稻瘟病反应的信号转导中起着重要的作用。此外,JA 信号通路还与棉花感染大丽轮枝菌早期的防御反应有关[20]。NPR1基因不仅在SA 介导的植物获得性免疫反应中发挥重要作用,而且可与JA 信号通路的关键蛋白相互作用调节植物的免疫反应[21]。前人研究表明,ROS 的爆发是植物识别病原体入侵后最早的防御反应事件之一[22]。ROS 在抵抗病原体入侵时诱导相关防御基因的表达和细胞死亡,从而使植株产生系统获得性抗性[23]。在棉花黄萎病抗性基因的研究中,许多基因的表达调控都与ROS 的信号传导有关[24]。最近发现棉株中GhCDPK28(Gh_A11G186100)在大丽轮枝菌胁迫下表达上调并被磷酸化。敲低GhCDPK28表达导致棉花植株的ROS 含量增加,防御反应增强,对大丽轮枝菌的敏感性降低[25]。
前期在用黄萎病菌接种棉花筛选黄萎病抗性相关基因时,发现陆地棉Gh_A10G086300受棉花黄萎病菌强烈诱导,序列比对分析表明该基因与拟南芥AtCDPK28基因高度同源,而且这个序列在陆地棉中含有其他5 个同源序列,将其命名为GhCDPK28-A10。本研究分析了GhCDPK28-A10同源序列的基因结构、蛋白保守基序和顺式作用调控元件,并进一步分析了黄萎病菌、不同激素以及H2O2胁迫下GhCDPK28-A10基因在陆地棉中的转录水平,然后通过病毒诱导的基因沉默(virus-induced gene silencing, VIGS)技术下调GhCDPK28-A10在陆地棉中的表达,对该基因的抗病功能进行初步分析,为丰富棉花抗病种质资源提供理论基础。


1.1.1棉花品种.供试的棉花品种(系)是陆地棉(Gossypium hirsutumL.)标准品系TM-1,由新疆农作物生物技术重点实验室保存。TM-1 的种子用98%的硫酸溶液脱绒,在清水中多次洗涤晾干。每一盆播种5 株,共90 株,待播种后,置于人工气候室在28 ℃、16 h 光照/8 h 黑暗条件下生长。
1.1.2 黄萎病菌。本研究使用的黄萎病菌为本实验室保存的强致病力的V991 菌株。

1.2.1GhCDPK28 的生物信息学分析。从棉花基因数据库 (https://cottonfgd.net/)中获得陆地棉GhCDPK28的6 个同源基因(Gh_A02G202200,Gh_A10G086300,Gh_A11G186100,Gh_D03G0-09200,Gh_D10G093700,Gh_D11G188500),利用在线网站MEME Suite(http://meme-suite.org/)鉴定GhCDPK28的蛋白基序;通过在线网站Plant-CARE 预测GhCDPK28起始密码子上游启动子区1 500 bp 的顺式作用元件;采用TBtools[26]软件绘制GhCDPK28的基因结构和染色体定位图;通过GeneDoc 软件对GhCDPK28 蛋白进行多序列比对。通过NCBI 数据库(https://www.ncbi.nlm.nih.gov/)获得构建进化树的同源CDPK28 蛋白序列,利用MEGA7.0 软件构建GhCDPK28-A10(Gh_A10G086300)与 水 稻OsCDPK28 (XP_015619927)、玉米(Zea mays)ZmCDPK28(XP_020403601)、雷蒙德氏棉(Gossypium raimondii)GrCDPK28(XP_012443804)、番茄(Solanum lycop ersicum)SlCDPK28(NP_001234607)和 拟 南 芥AtCDPK28(NP_851280)的进化树,自展值设置为1 005。
1.2.2 棉花GhCDPK28-A10 表达分析。将黄萎病菌V991 在28 ℃的马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基上培养2 d。从PDA 培养基中采集菌丝继续在察氏液体培养基(2 g·L-1
NaNO3,1 g·L-1 KH2PO4,1 g·L-1 MgSO4·7H2O,1 g·L-1 KCl,2 mg·L-1 FeSO4·7H2O,30 g·L-1 蔗糖)中以150 r·min-1 的速度在28 ℃条件下培养5 d,用无菌水将孢子悬浮液的终浓度调节至分生孢子106~107 个·mL-1。当棉花幼苗长到三叶期时,用V991 孢子悬浮液进行灌根法处理,以清水为对照,分别采集处理后0 h、0.5 h、2 h、6 h、12 h、24 h、48 h 的根系样品。分别用200 μmol·L-1 茉莉酸甲酯(methyl jasminate,MeJA),2 mmol·L-1 SA和1 mmol·L-1H2O2浸泡根系10 min,以清水为对照(CK),处理后0.5 h、1 h 和3 h,采集根系[27]分析外源SA、MeJA 和H2O2对GhCDPK28-A10表达的影响;采集棉花三叶期的根、茎、真叶,分析GhCDPK28-A10的组织特异性表达,上述所有处理样品均以3 份样本混合作为1 个重复,每个处理每个时间段各设3 个重复,用铝箔纸包裹置于液氮中冻存,并在-80 ℃保存。
使用天根生化科技(北京)有限公司的RNAprep Pure 试剂盒提取总RNA,并用反转录试 剂 盒One-Step gDNA Removal 和cDNA Synthesis SuperMix(北京全式金生物技术有限公司)获得cDNA。使用Primer Premier 5 设计实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,qRT-PCR)引物(表1)。以陆地棉中高度保守的基因GhUBQ7作为内参基因,使用赛默飞世尔科技(中国)有限公司的Applied Biosystems StepOne 荧光定量仪进行qRT-PCR。使用Top Green qPCR SuperMix(北京全式金生物技术有限公司)制备qRT-PCR 反应体系。采用2-△△Ct 法计算GhCDPK28-A10基因的相对表达量[27]。
1.2.3GhCDPK28-A10基因沉默和黄萎病病原菌接种。通过Primer Premier 5 设计GhCDPK28-A10基因特异性VIGS 片段引物(表1),将特异性VIGS 扩增片段与-blunt zero 载体(北京全式金生物技术有限公司)连接。转化至大肠杆菌DH5α 后,筛选阳性菌落进行PCR 检测。然后送至生工生物工程(上海)有限公司测序,测序正确后,使用限制性内切酶KpnⅠ和EcoRⅠ进行酶切,将GhCDPK28-A10基因VIGS 沉默片段和TRV::RNA2 载体连接后转化至DH5α,酶切验证后,将构建成功的TRV2::GhCDPK28-A10载体转化至农杆菌GV3101,并于-80 ℃储存。
待棉花幼苗生长至子叶完全展开时,将含TRV2::00、TRV2::GhCDPK28-A10和TRV2::Gh-CLA1(Cloroplastos alterados1,阳性对照具有明显的白化表型)载体以及TRV::RNA1 载体的农杆菌GV3101 分别在含有卡那霉素、利福平和庆大霉素的液体培养基中培养,28 ℃,200 r·min-1培养至OD600=1.5,5 000 r·min-1离心10 min,弃上清;用悬浮液(10 mmol·L-1MgCl2,10 mmol·L-12-吗啉乙磺酸,200 μmol·L-1乙酰丁香酮)等体积悬浮菌体至OD600=1.5,室温静置3 h 后,将TRV2::00,TRV2::CLA1, TRV2::GhCDPK28-A10的悬浮液分别与含TRV::RNA1 载体的农杆菌悬浮液1∶1(体积比)混合;混合后分别注射至棉花幼苗子叶中,黑暗处理24 h 后正常培养(转化的植株分别记作TRV::00,TRV::CLA1和TRV::GhCDPK28-A10)。大约培养14 d 后,当GhCLA1阳性对照的沉默棉花出现白化表型时,检测TRV::00和TRV::GhCDPK28-A10植株中GhCDPK28-A10的表达情况和沉默效率,并将V991 病菌悬浮液使用灌根法接种棉花幼苗。
1.2.4GhCDPK28-A10沉默棉株的抗病性鉴定。在黄萎病菌V991 接菌处理20 d 左右时棉花幼苗叶片变黄、枯萎,参照Hu 等[27]的方法对棉花GhCDPK28沉默植株和对照植株进行表型鉴定和病情指数统计分析,评估幼苗的病害严重程度。
TRV::00和TRV::GhCDPK28-A10植株抗病性鉴定试验中每个重复鉴定90 株棉花,共3 次重复。为了测定棉花幼苗所含黄萎病菌的生物量,在黄萎病菌处理20 d 后分别于沉默植株和对照植株子叶节点下方1 cm 处采集茎段,首先将TRV::00和TRV::GhCDPK28-A10的茎段在PDA 培养基上培养5 d 后观察大丽轮枝菌的生长情况并统计侵染率;然后以对照植株和沉默植株的茎段总DNA 作为模板,利用qRT-PCR 检测真菌DNA 相对丰度,对照植株和沉默植株分别采集30 个茎段,重复3 次,并进行剖秆实验观察维管束中大丽轮枝菌生长情况。以棉花内源基因GhUBQ7为对照,利用真菌特异性ITS1-F 引物与V.dahliae特异性引物ST-VE1-R(表1),进行黄萎病菌DNA 丰度检测。植株病情指数统计和侵染率计算公式如下:

表1 本研究所使用的引物序列Table 1 Primer sequences used in this study
式中,i表示从0 到4 的发病等级,ni是i发病等级的植株数,N是总植株数。
侵染率=发病茎段数/总茎段数×100%.
1.2.5 H2O2的积累,激素相关基因与抗病相关基因的表达水平测定。用3,3’-盐酸二氨基联苯胺(3,3'-Diaminobenzidine tetrahydrochloride,DABHCl)对接菌后TRV::00和TRV::GhCDPK28-A10植株叶片进行染色。沉默植株和对照植株的叶片分别在1 mg·mL-1DAB-HCl(Sigma-Aldrich)pH 为3.8 的溶液中室温黑暗过夜浸泡,并用乳酸、甘油、乙醇混合液(体积比为1∶1∶2)进行脱色。
随机从TRV::00和TRV::GhCDPK28-A10植株中采集第2 片真叶,重复3 次。然后用qRTPCR 分析NPR1(Gh_A08G2190)、PDF1.2(Gh_D01G2290)、PR1(Gh_A12G0274)、PR4(Gh_D13G1816)、JAZ1(Gh_A06G0705)5 个防御标记相关基因的转录表达水平,方法同1.2.2。

用Excel 进行数据整理,采用SPSS 19.0 进行方差分析,使用邓肯氏新复极差法进行多重比较。


选取模式植物拟南芥和其他种植广泛的大田作物的CDPK28 蛋白序列,与GhCDPK28-A10构建进化树(图1A),结果表明:同源的蛋白中,拟南芥和番茄中的CDPK28 与GhCDPK28-A10的序列相似度最高,其次是雷蒙德氏棉、玉米和水稻中的同源蛋白。染色体定位显示陆地棉中GhCDPK28-A10的6 个同源基因分布在不同的染色体上(图1B)。利用陆地棉全基因组GFF 注释文件提取了GhCDPK28-A10外显子和内含子信息,该基因的6 个同源序列均含有12 个外显子,除了Gh_D11G188500外,其余同源序列均有UTR 区域(图1C)。GhCDPK28-A10 蛋白序列的基序分析结果显示:GhCDPK28-A10 同源蛋白含有相似数量和排列的保守基序(图1D),这表明GhCDPK28-A10基因在进化上的保守性和同源性。截取GhCDPK28-A10基因起始密码子上游的1 500 bp 序列,并通过PlantCARE 在线网站预测序列中所包含的顺式作用元件,结果显示GhCDPK28-A10启动子区含有响应JA 的顺式作用元件TGACG 基序和MYB 基序,一些脱落酸(abscisic acid,ABA)和光反应相关的作用元件ABRE 和GT1 基序以及转录表达核心元件和一些响应非生物胁迫的基序如MBS、CTR、ARE 等(图1E)。这些顺式作用元件预测分析表明GhCDPK28-A10不仅可能被JA 诱导,而且可能参与棉花抵抗非生物胁迫的过程。通过蛋白多序列比对,发现GhCDPK28-A10 含有典型的CDPK家族丝氨酸/ 苏氨酸蛋白激酶结构域(S_TKc)和EF 手型结构域(EF-hand)(图1F)。

图1 GhCDPK28-A10 同源序列生物信息学分析Fig.1 Bioinformatics analysis of GhCDPK28-A10 homologous sequences
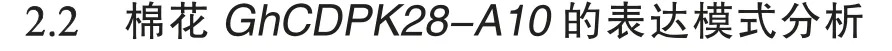
组织特异性表达分析发现GhCDPK28-A10在根、茎和真叶中均有表达,尤其是在叶中的表达量极显著高于根和茎(图2A),推测其可能在不同组织中发挥的功能具有差异性。通过MeJA、SA和H2O2处理,发现MeJA 和H2O2处理后3hGhCDPK28-A10表达量显著升高,而SA 处理的影响不显著(图2B)。用黄萎病菌处理棉花幼苗,发现GhCDPK28-A10的表达量在CK 和V991处理之后均随时间推移而降低,但在接种后0.5 h、2 h、6 h、12 h、24 h 的表达水平均极显著或显著低于CK (图2C)。这些发现表明GhCDPK28-A10受黄萎病菌和H2O2诱导表达,可能通过JA 信号通路参与对黄萎病的防御反应。

图2 棉花GhCDPK28-A10 的表达模式Fig.2 The expression pattern of GhCDPK2-A10 in cotton

为了探究GhCDPK28-A10在棉花抗黄萎病中的作用,利用VIGS 技术沉默GhCDPK28-A10基因后接种V991 来分析沉默植株的抗病性。当TRV::GhCLA1植株新展开的真叶出现白化表型时,表明VIGS 试验是有效的(图3A)。通过qRT-PCR 分析,发现在TRV::GhCDPK28-A10沉默的棉花植株中GhCDPK28-A10的表达量显著降低(图3B)。接种病原菌后对棉花幼苗植株表型分析发现,对照植株的典型黄萎病症状如叶片萎蔫枯黄等表型较GhCDPK28-A10基因沉默植株更为严重(图3C)。病情指数统计发现沉默GhCDPK28-A10植株的病情指数显著低于对照TRV::00植株,分别为32 和51(图3D)。对接种黄萎病菌的GhCDPK28-A10沉默和对照棉花植株的茎段进行黄萎病菌繁殖比较,发现接种5 d后沉默植株大丽轮枝菌侵染率显著低于对照植株(图3E),同时沉默植株有病菌繁殖的茎段数明显低于对照植株(图3F),且对照植株维管束的棕色变化比沉默植株更明显(图3G)。黄萎病菌丰度检测显示,在GhCDPK28-A10沉默的植株中检测到的黄萎病真菌DNA 水平显著低于对照植株 (图3H),此外,DAB 染色发现TRV::GhCDPK28-A10显示更多的ROS 积累和细胞死亡(图3I)。这些结果表明,沉默GhCDPK28-A10的棉花黄萎病抗性增强,GhCDPK28-A10可能负调控棉花对黄萎病的抗性。

图3 抑制GhCDPK28-A10 表达增强了棉花对黄萎病的抗性Fig.3 Inhibition of GhCDPK28-A10 expression enhances resistance to Verticillium wilt in cotton

为了探究沉默GhCDPK28-A10增强棉花对大丽轮枝菌的防御分子机制,检测在接种V991后TRV::00和TRV::GhCDPK28-A10植株体内与防御相关的关键基因GhPR1、GhNPR1、Gh-PDF1.2、GhPR4以及JA 合成相关基因GhJAZ1的表达水平变化。结果表明,清水处理下,相较于TRV::00,TRV::GhCDPK28-A10植 株GhPR1、GhNPR1和GhPR4的表达没有显著变化,而接种V991 后,TRV::00和TRV::GhCDPK28-A10植 株中这些基因的表达量均升高,且沉默植株中的表达量显著高于TRV::00植株(图4A~C),表明沉默GhCDPK28-A10植株接菌后,抗病基因GhPR1、GhNPR1和GhPR4上调表达,从而使得TRV::GhCDPK28-A10植株对黄萎病菌产生更强的抗性。CK 和V991 处理下,GhPDF1.2基因在TRV::00和TRV::GhCDPK28-A10植株中的表达水平没有显著性差异,V991 处理后TRV::00和TRV::GhCDPK28-A10植株中GhPDF1.2的表达均要高于CK (图4D)。在CK 和V991 处理后,GhJAZ1在TRV::00植株中的表达水平均显著高于其在TRV::GhCDPK28-A10植株中的表达水平,但是在V991 处理后,GhJAZ1在沉默植株中的表达量较CK 下降倍数更大。(图4E)。这些防御相关标记基因的表达水平变化暗示沉默GhCDPK28-A10后,解除了植物体对JA 合成上游通路的抑制,使得JA 积累,诱导相关抗病基因的表达,进而增强了棉花对黄萎病的抗性。

图4 黄萎病抗性相关基因的表达分析Fig.4 Expression analysis of genes related to Verticillium wilt resistance

Ca2+作为一种重要的二级信使不仅参与了植物的生长发育过程,而且是响应逆境胁迫重要的信号分子之一。CDPK 被认为是传感器蛋白,能够通过EF 手型结构域结合Ca2+并改变蛋白构象以响应细胞环境的变化。CDPK 广泛参与钙信号转导的不同生物学过程[28-29]。本研究通过生物信息学分析、外源激素处理和VIGS 试验发现GhCDPK28-A10参与调节棉花的生长发育及其对黄萎病菌的应激反应。GhCDPK28-A10 具有典型的钙依赖蛋白激酶家族丝氨酸/ 苏氨酸蛋白激酶结构域和EF 手型结构域,启动子区域存在响应JA、ABA 和一些光反应顺式作用元件,表明其可能通过调节Ca2+信号参与JA 和ABA 等诱导的生物和非生物胁迫应激反应。已有研究结果表明GhCDPK28-A10不仅受到黄萎病菌诱导表达,而且也受JA 和H2O2处理的诱导。由于这些因素通常诱导产生系统性获得性抗性,推测GhCDPK28-A10基因可能参与棉花对黄萎病的响应并通过JA 调控途径发挥作用。VIGS 试验证实GhCDPK28-A10基因沉默棉株对黄萎病菌的抗性显著增强,表明GhCDPK28-A10在抗棉花黄萎病侵染中起负调控作用。
ROS 作为重要的次级免疫激活信号,是植物体感知并阻止病原菌入侵的产物[30]。在本研究中,接种黄萎病菌后,与TRV::00植株相比,TRV::GhCDPK28-A10植株富集了更多的H2O2,表明棉花植株对黄萎病菌抗性的增加可能与坏死性病原体引起的胞外高水平ROS 有关。NPR1作为重要的植物抗病基因,参与SA 和JA 诱导的PR基因表达[31],尽管GhCDPK28-A10不受外源SA 诱导表达,但接菌后TRV::GhCDPK28-A10植株GhNPR1表达升高,暗示了TRV::GhCDPK28-A10植株中GhNPR1表达受JA 诱导。PR1的表达上调对系统性获得性抗性至关重要[32-33]。JA 诱导的PDF1.2基因能够增强植物对坏死性真菌的基础抗性。接菌后TRV::00植株和TRV::GhCDPK28-A10植株GhPDF1.2的表达量均高于CK,然而其在TRV::GhCDPK28-A10植株中的表达水平低于对照植株,这其中潜在的机理仍需要进一步研究解释。PR4 可以穿过病原体的菌丝膜,与真菌凝集素相互作用破坏真菌对植物的侵染[34],GhNPR1、GhPR1和GhPR4在TRV::GhCDPK28-A10植株中表达上调。已有研究发现,JA 广泛参与植株抗病过程,JA 的积累能够有效提高植物的抵抗力。JA 合成相关GhJAZ1基因在TRV::GhCDPK28-A10植株中的表达降低。这些结果表明GhCDPK28-A10沉默植株对黄萎病抗性的提高可能与JA 信号通路及ROS 富集有关,潜在的机制仍需要在未来的研究中进行探索。

本研究探讨了GhCDPK28-A10与棉花黄萎病抗性的关系,发现GhCDPK28-A10(Gh_A10G086300)在大丽轮枝菌胁迫下表达下调。在棉花中沉默GhCDPK28-A10基因,会导致活性氧含量增加,提高一系列抗病相关基因的表达从而增强棉花植株的抗病能力。这些结果说明GhCDPK28-A10可能是负调控棉花黄萎病抗性的重要候选基因,但GhCDPK28-A10调控棉花黄萎病抗性的机制有待进一步阐明。
——紫 苏

