我国新城疫分子流行病学研究进展
连 聪,温肖会,吕殿红,高小鹏,贾春玲,周秀蓉,常 琦,罗胜军
(广东省农业科学院动物卫生研究所/广东省畜禽疫病防治研究重点实验室/农业农村部兽用药物与诊断技术广东科学观测实验站/岭南现代农业科学与技术广东省实验室肇庆分中心,广东 广州 510640)
新城疫(Newcastle Disease,ND)是一种由新城疫病毒(Newcastle Disease Virus,NDV)引起的禽类急性、接触性传染病[1],是严重损害养禽业发展的疾病之一,世界动物卫生组织将其划为A 类传染病,我国将其列为一类传染病。自然条件下,NDV 经受伤皮肤、消化道、呼吸道黏膜等部位侵入机体,也可通过垂直传播导致幼禽感染。新城疫可引起鸡、鸭、鹅、鸽子、鹌鹑等禽类感染,尤其鸡受感染后通常会导致死亡,其他动物的症状一般比鸡轻[2]。ND一年四季均可发生,春秋季多发,临床上可根据发病速度、症状及死亡率将其分为最急性、急性、慢性3 种类型,其中急性ND 普遍流行,死亡率高(可达90%以上)。NDV 存在于病禽的所有组织器官、体液及分泌物中,脑、脾、肺含毒量最高,故病禽会出现转脖、站立不稳等神经症状,脾脏充血、出血,亦可见明显的呼吸困难、咳嗽和气喘等呼吸道症状[3]。
ND 自1926 年在印度尼西亚被首次发现,至今已引发4 次全球性大规模流行[4],从病毒流行史上看,ND 一直是家禽的毁灭性疾病,目前该疾病在许多国家仍然是影响家禽养殖业发展的主要问题之一。即使在ND 已经得到控制的国家,依然有较重的经济负担,主要用于疫苗接种和维持严格的生物安全措施[5]。目前市场上存在多种活疫苗和灭活疫苗,包括易于保存、运输的耐热NDV 疫苗[6],国内普遍使用灭活疫苗防控ND。ND 经常被误诊为沙门氏菌病、螺旋体病、喉气管炎和某些出血性疾病,故对其诊断需要密切的监测,以迅速、特异性地识别病原。血清学检测和分子生物学检测是NDV 检测的标准方法,血清学检测可短时间内检测到NDV 的存在,从而可迅速采取行动控制疫情传播;分子生物学检测则确定其基因分型,为后续疫苗研发提供方向。血清学检测主要采用血凝抑制试验与ELISA 检测。血凝抑制试验主要测量NDV 特异性抗体抑制NDV颗粒对红细胞凝集的能力,因其成本较低及操作简便而成为目前主要的检测方法。ELISA 检测高度敏感,产生的结果与血凝抑制试验结果基本一致,也是常用的检测方法。近年来,分子生物学检测方法迅速发展,各新型技术的研发取得了重大成果,其中微阵列杂交技术、生物传感器和下一代测序最受关注,但因成本高、技术复杂等原因尚未被广泛使用,而普遍使用的技术是逆转录聚合酶链式反应(RT-PCR)和荧光定量聚合酶链式反应(qPCR)。qPCR 技术使用最广,相较于传统检测技术,该技术更便捷且具有更高的病毒检测灵敏度。分子生物学技术的进步对分子流行病学的研究提供了有利条件,本文就NDV 流行病学及其基因型的遗传进化等方面研究进展进行综述,以期为NDV 的防控和疫苗研发提供参考。
1 NDV 病原学
NDV 对外界抵抗力较强,在自然环境中可生存较长时间;对低温抵抗力强,低温下可存活数月;60 ℃环境下经45 min 可灭活,紫外线照射30 min 被灭活[7];对乙醚等有机溶剂敏感。
NDV 是单股负链RNA 病毒,为副黏病毒科新城疫样病毒属的禽副黏病毒Ⅰ型[8]。NDV 多为圆形,直径100~250 nm,有囊膜,单链不分节。NDV 基因组有3 种长度,分别为15 186、15 192、15 198 nt[9],结构为3'-NP-P-M-F-HN-L-5'(图1),编码6 种特异性结构蛋白[10],分别为核衣壳蛋白(NP)、磷蛋白(P)、基质蛋白(M)、融合蛋白(F)、血凝素-神经氨酸酶蛋白(HN)和大蛋白(L)。每个特异性结构蛋白的基因都存在起始因子和终止因子序列,各蛋白基因之间通过基因间序列将彼此分隔开,保证其表达的准确性。

图1 新城疫病毒结构示意图[3]Fig.1 Schematic diagram of the structure of Newcastle disease[3]
1.1 血凝素-神经氨酸酶蛋白(HN)
HN 蛋白和F 蛋白为刺突糖蛋白,刺突长度约为8 nm,分别以三聚体和四聚体的形式存在,位于囊膜表面,在病毒感染过程中参与病毒的入侵,可诱导保护性免疫[11],它们均为病毒热稳定性的决定因素[12]。HN 是一种Ⅱ型整合膜蛋白,蛋白分子量为74 kD,可使病毒吸附在细胞表面的唾液酸受体,并通过血凝素、神经氨酸酶的生物学活性破坏受体功能,参与病毒入侵。HN的受体识别位点和神经氨酸酶活性位点均位于球状头部,并且高度保守,球状头部区域也被认为是抗体结合位点[13]。由于终止密码子位置不同,自然界中存在不同长度的HN 蛋白,最短的HN蛋白含571 个氨基酸,存在于速发菌株中;最长的HN 蛋白含616 个氨基酸,存在于缓发菌株中。HN 蛋白中扩展羧基末端的长度和序列可影响蛋白功能,但尚未明确其对NDV 毒力的作用[5]。
1.2 融合蛋白(F)
F 蛋白是存在于NDV 包膜上的表面糖蛋白,参与病毒穿入、细胞融合等过程。其基因组序列用于对NDV 毒株基因型进行分类,切割位点处序列是世界动物卫生组织(OIE)公认的毒力指标。NDV 系统性传播及其毒力大小取决于F 蛋白在组织中的裂解。根据OIE 相关标准,位于112~116位氨基酸之间的F 蛋白切割位点具有多个碱性氨基酸残基,并在117 位具有苯丙氨酸残基的毒株被认为是强毒株;在117 位具有一元F 切割位点和亮氨酸残基的毒株被认为是弱毒株[2]。
1.3 基质蛋白(M)
M 蛋白本质为疏水蛋白,位于核衣壳和脂质膜之间,分子量约为40 kD,由364 个氨基酸组成。M 蛋白是一种碱性蛋白质,具有与病毒核酸相互作用的区域(17 bp),包括9 个碱性氨基酸[14],其在RNA 合成及病毒自身装配中起关键作用[15]。M 蛋白在副粘病毒中高度保守,群体发生突变后其存在极少的非同义碱基替代,这可作为对不同地域NDV 分离株进行分类的依据[16]。
1.4 大蛋白(L)
L 蛋白是NDV 基因组中最大的蛋白质,由2 204 个氨基酸组成,分子量为250 kD[9]。L 蛋白属于RNA 依赖性RNA 聚合酶,与病毒组装、合成相关,在病毒感染过程中充当病毒复制酶和转录酶,其合成病毒mRNA 并协助基因组RNA复制,还对新形成的mRNA 进行5'端加帽、甲基化及激活多聚A 聚合酶活性[17]。L 蛋白可调节NDV 的毒力,可能通过增加复制期间病毒RNA的合成速率而发挥有效作用[18]。
1.5 磷蛋白(P)
P 蛋白连接L 蛋白与NP 蛋白,是聚合酶的辅助因子。P 蛋白由395 个氨基酸组成,在特定的丝氨酸和苏氨酸残基处被磷酸化,并作为同源寡聚体发挥作用,其在病毒复制和转录中也具有至关重要的作用[5]。P 蛋白的四聚体介导L 蛋白和N-RNA 模板之间的相互作用,以防止NP 蛋白随机包裹非病毒 RNA。此外,P 蛋白与未组装的NP 蛋白形成复合物,调节逆转录过程。在病毒复制过程中,P 蛋白的不同结构域与NP 蛋白相互作用时发挥不同功能。NDV 的6 个结构蛋白基因中有5 个蛋白基因编码单一的蛋白质,只有P 蛋白基因通过RNA 编辑编码3 个蛋白质,即P 蛋白、V 蛋白和W 蛋白[9]。V 蛋白和W 蛋白是辅助蛋白,仅存在于病毒感染的细胞中,其中V 蛋白属于干扰素(IFN)拮抗剂,对NDV 毒力大小起重要作用[19]。
1.6 核衣壳蛋白(NP)
NP 蛋白含489 个氨基酸,分子量为55 kD,覆盖整个病毒核酸形成核糖核蛋白(RNP),以保护RNA 免受核酸酶的侵害[16]。NP 蛋白是病毒颗粒中最丰富的蛋白质,电子显微镜下可见“人”字形结构,是病毒复制和mRNA 生物合成所需的最小模板,与N 蛋白、P 蛋白、L 蛋白及基因组RNA 结合形成RNP。
2 NDV 分子流行病学进展
2.1 NDV 基因型
F 蛋白是主要的特异性结构蛋白,根据其核苷酸序列划分NDV 的基因型,其基因全长1 792 nt,ORF 长1 662 nt,编码553 个氨基酸,分子量约55 kD[20-21]。根据其基因编码可将NDV 分为I 和Ⅱ两类。若F 蛋白裂解位点的氨基酸组成为112R/K-R-Q-K/R-R-F117,则其为I 类毒株;若裂解位点的氨基酸组成为112G/EK/R-Q-G/E-R-L117,则其为Ⅱ类毒株[22]。I 类毒株主要来源于野生鸟类,大多毒株为低毒力[23],家禽中主要感染鸭、鹅等水禽,鸡群中偶尔出现,但概率较小。Ⅱ类毒株是可引起禽类明显症状的强毒株,具有多种基因型,分为I 型、Ⅱ型、Ⅲ型等,遗传进化距离大于0.1 就被判定为不同基因型[3]。巴基斯坦和孟加拉国曾从鸽子中分离出基因型XXI.1.2 毒株[24-25]。因此,Ⅱ类毒株至少分为Ⅰ~XXI 达20 多种。Ⅱ类毒株在野生鸟类中具有某些特定的基因型,例如基因型Ⅵ型毒株为鸽子、鸬鹚等野生鸟类的特有毒株[26],而至今并无证据表明该型毒株无感染家禽的风险。
我国曾分离出多种基因型NDV毒株。1946年,我国分离到特有的Ⅱ类Ⅸ基因型F48E9 毒株[27],为嗜神经型强毒株,家禽表现出以神经症状为主导的临床特征[28],即出现翅麻痹、跛行、站立不稳、头颈向后侧扭转、伏地旋转等症状;在新城疫第3 次大流行时,主要流行株为Ⅱ类Ⅵ型毒株;20世纪90 年代NDV 的Ⅱ类Ⅶd 型成为我国主要优势基因型[29];2010 年,广东首次监测到Ⅱ类XII型,并证实为强毒株[30]。这些毒株的成功分离为新城疫的诊断与防控提供了巨大帮助。进入21世纪以来,NDV Ⅰ类毒株的致病性有增强趋势,从而引起人们的关注,2008 年首次分离出Ⅰ类病毒Duck China/08-004/2008[31],自此逐渐加强对NDV Ⅰ类病毒的研究,而高致病性的Ⅱ类毒株始终是人们研究新城疫疾病的重点。到目前为止,NDV 的基因型仍在不断改变,掌握其所有基因型并研究有针对性的防治方法才有可能净化NDV。
2.2 分子流行病学
2.2.1 我国NDV 不同基因型流行情况 为了解我国部分地区NDV 流行毒株的基因型情况,本文统计整理了中国知网和PubMed 报道的NDV分子流行病学数据,结果(表1)发现,2008—2020 年间在各地区收集的14 062 份样本中共分离到234 株毒株,其中166 株鉴定出具体基因型,涉及基因 型Ⅰ类1 型(4/166,2.41%)、2 型(3/166,1.81%)、3 型(60/166,36.14%),基因型Ⅱ类Ⅰ型(26/166,15.66%)、Ⅱ型(23/166,13.86%)、Ⅵ型(2/166,1.2%)、Ⅶ型(37/166,22.29%)、Ⅷ型(3/166,1.81%)、Ⅸ(7/166,4.22%)、Ⅻ(1/166,0.6%)。

表1 我国各地区NDV 毒株的基因型统计Table 1 Genotype statistics of NDV strains in various regions of China
由图2 可知,NDV 在鸡流行毒株中,Ⅰ类3 型(37/93,39.78%)占比最高,其次为Ⅱ类Ⅶ型(27/93,29.03%),Ⅱ类Ⅱ型(21/93,22.58%)则占比较少;在鸭流行毒株中,Ⅰ类3型(18/43,41.86%)占比最高,其次为Ⅱ类Ⅰ型(15/43,34.88%),Ⅱ类Ⅶ(7/43,16.28%)占比较低;在鹅流行毒株中,Ⅱ类Ⅰ型(7/16,43.75%)占比最高,其次为Ⅰ类3 型(5/16,31.25%)、Ⅰ类1 型(1/16,6.25%),此外还发现了1 株Ⅱ类Ⅻ型毒株,未发现Ⅱ类Ⅶ型病毒,推测其可能在鹅中感染率不高。Ⅰ类3 型毒株在鸡、鸭、鹅中均有较强感染力,为保证家禽健康,加强对该型毒株研究具有重大意义。

图2 不同家禽的NDV 毒株基因型统计Fig.2 Genotype statistics of NDV strains in different poultry species
2.2.2 遗传进化分析 在我国分离出的NDV 多种基因型毒株中,Ⅱ类Ⅸ型是我国特有的毒株,而Ⅱ类Ⅶ型病毒现已成为我国NDV 流行的主要优势基因型[24]。我国西藏、广西、河北、宁夏及山东、江苏等华东地区都曾分离出Ⅱ类Ⅶ型毒株,其中山东、江苏、河北分离到Ⅶd 亚型。由此表明,在基因Ⅶ型毒株中,Ⅶd 亚型更为流行。
ND 感染病例中,鸡感染最多,以雏鸡尤甚。其影响鸡的消化系统、呼吸系统、神经系统,有时亦影响生殖系统。疾病表现受个体的易感性、病毒依赖性及其他压力因素的影响。感染后所呈现的症状因基因型不同而异。感染Ⅰ类中的弱毒株,多表现为轻型症状,甚至不引起任何临床症状。若感染Ⅱ类中的强毒株,则会引起机体明显的临床症状,甚至导致大批量死亡,故Ⅱ类毒株是研究和预防的主要方向。F 蛋白切割位点是病毒毒力的决定因素。本文选取了NCBI 中15 株不同基因型NDV 的F基因序列,用MEGAX 软件的最大似然法对这些毒株的F基因序列进行分析,构建了基于F基因序列的系统发育树(图3)。当前,基因Ⅱ型与基因Ⅶ型NDV 在鸡群中较为流行,根据系统发育树可知,基因Ⅰ型、Ⅱ型、Ⅸ型与基因Ⅶ型、Ⅷ型相距甚远,针对基因Ⅱ型毒株的疫苗对基因Ⅶ型毒株的预防效果不佳,因此,在疫苗接种时,结合当地及养殖场内实际情况,应选择最完善的接种方案。

图3 NDV 基于F 基因的系统遗传进化树Fig.3 Phylogenetic evolutionary tree of NDV based on F gene
将Ⅱ类Ⅰ型、Ⅱ型、Ⅶ型、Ⅷ型和Ⅸ型毒株的核苷酸序列进行比对(图4),Ⅰ型病毒之间同源性为90.7%~93.8%,与其他基因型病毒的同源性为 85.6%~99.8%;Ⅱ型病毒之间同源性为89.5%~99.6%,与其他基因型病毒的同源性为85.1%~99.8%;Ⅶ型病毒之间同源性为85.2%~99.1%,与其他病毒的同源性为84.5%~95.6%;Ⅷ型病毒之间同源性为95.3%,与其他病毒的同源性为84.0%~94.4%;Ⅸ型病毒之间同源性为84.8%~95.6%,与其他病毒之间的同源性为84.0%~91.3%。各基因型病毒之间同源性相差不大,相比之下,Ⅶ型与Ⅷ型病毒与其他病毒之间同源性较小,Ⅸ型病毒与其他毒株同源性更小。
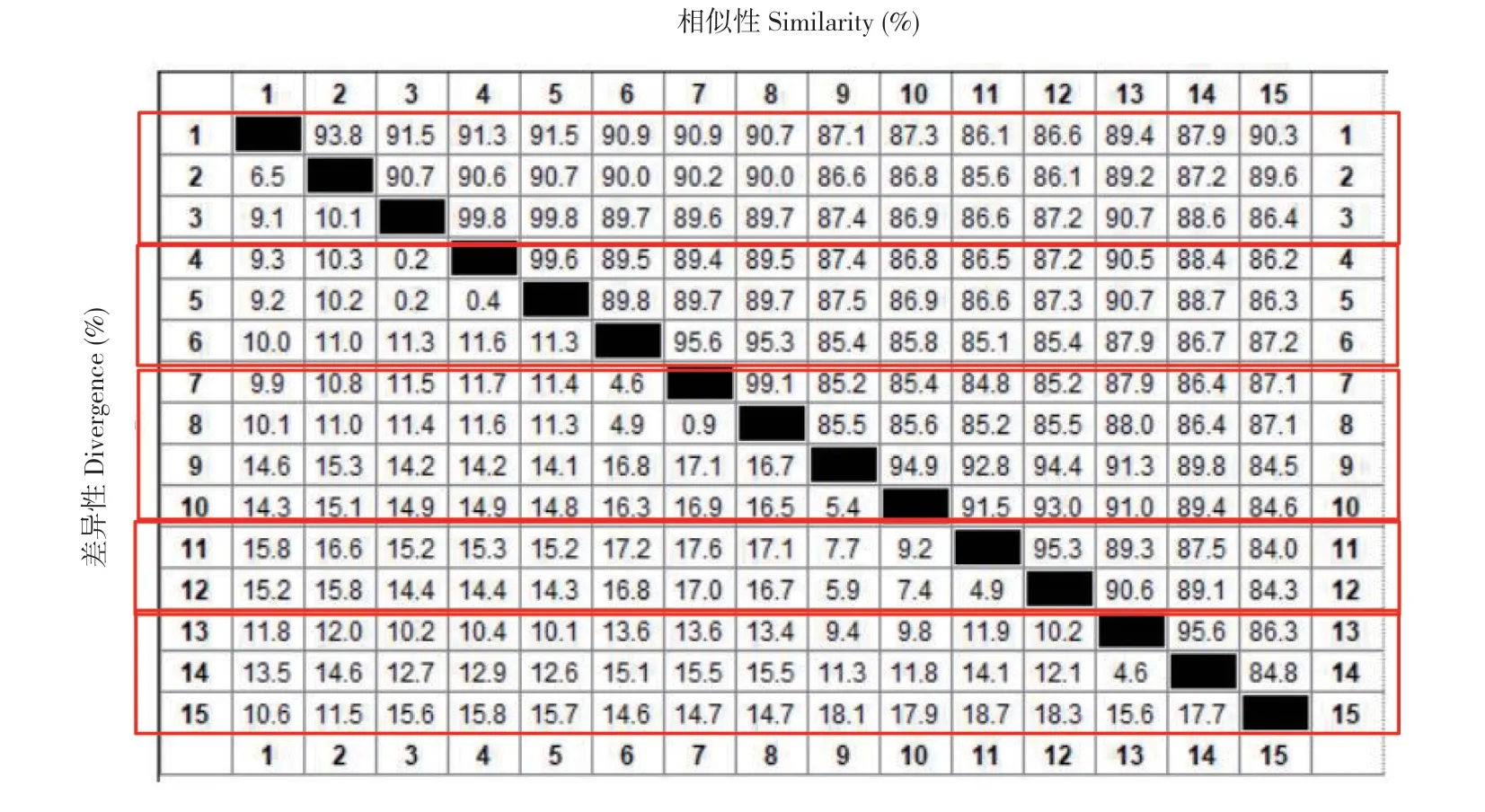
图4 NDV 中F 基因核苷酸序列同源性分析结果Fig.4 Results of nucleotide sequence homology analysis of F gene in NDV
3 我国新城疫流行情况与免疫防控
为了解我国部分地区新城疫流行情况,本文整理2010—2020 年间的相关文献,得到不同省区的NDV 阳性情况。由表2 可知,抗体检测共45 534 份,阳性样本41 698 份,阳性率为91.58%;抗原检测共37 568 份,阳性样本789 份,阳性率为2.10%。抗体检测显示疫苗接种率良好,各地区间抗原阳性率在11.00%以下,具有较大差异,在具有NDV 疫情的地区需结合该地区的流行毒株来筛选疫苗,从而更科学、精准地防控NDV。

表2 NDV 抗原抗体检测结果Table 2 Detection results of antibodies to NDV antigens
我国新城疫目前多为地方性散发流行,NDV中的外源基因具有稳定性[51],故疫苗的广泛使用可有效减少NDV 的传播,使疾病发生率显著下降。目前,常见新城疫疫苗主要为B1、LaSota 和V4 等毒株的减毒活疫苗[52],以及LaSota 和VH等毒株的灭活疫苗[53]。疫苗是预防NDV 发生、传播的有效手段,但由于NDV 的F 基因具有较高变异率,基因型种类也不断增多,疫苗免疫后并不能完全阻止流行毒株的侵袭[54]。因此,临床上NDV 防控中疫苗(种类和基因型)的选择至关重要,免疫方案的制定需要结合本地NDV 的实际流行情况,灭活疫苗和减毒活疫苗联合使用有助于NDV 阳性场的控制,而选择与NDV 流行毒株同源性较高的疫苗株进行免疫,对本场NDV 的净化具有重要意义。此外,我们依然要做好传染源的防控,定期对场内环境进行检疫,提高人员防疫意识,从根源上预防疾病暴发与传播[55]。
Ⅰ类NDV 主要分离自野生鸟类,且大部分是低毒力甚至无毒力的毒株[56],因此,我国NDV的防控措施主要针对Ⅱ类毒株。若能加强对Ⅱ类Ⅱ型和Ⅶ型这两种主要流行毒株的研究,则能使防控工作取得更好成效。掌握主要感染的NDV 基因型有助于了解疾病的流行特征,这为我国NDV防控和新型疫苗研发提供依据。
4 结语
本文通过文献对我国不同地区NDV 流行情况进行统计,发现NDV 主要分布于华南地区、华东地区及部分西北地区,各地区暴发程度具有较大差异,候鸟迁徙区域感染更为明显。2010—2020年间,感染较严重地区的阳性率在11.0%左右,有些地区无阳性记录,针对NDV 防控需结合当地实际情况制定策略。对流行地区的NDV 基因型进行整理,发现Ⅰ类3 型、Ⅱ类Ⅱ型和Ⅱ类Ⅶ型是我国鸡群中NDV 的主要流行基因型,Ⅰ类3 型和Ⅱ类Ⅰ型基因型是水禽(如鸭、鹅)的主要流行株。Ⅰ类毒株为弱毒株,临床表现症状较轻,近年来其症状有加重趋势,而目前对NDV 的研究依然以Ⅱ类毒株为主。Ⅰ类3 型毒株对鸡、鸭、鹅均有较强感染性,且其更易通过野生鸟类进行传播,故加强对Ⅰ类毒株的研究很有必要。通过对不同Ⅱ类毒株的F 基因序列进行比对,发现Ⅱ类Ⅰ型毒株与Ⅱ型毒株间同源性为89.7%~99.8%,Ⅰ型毒株与Ⅶ型毒株间同源性为86.6%~90.9%,Ⅱ型毒株与Ⅶ型毒株间同源性为85.4%~95.6%。
ND 是全球家禽业的主要威胁因素,不同程度毒力的NDV 毒株在禽类中广泛传播。ND 与其他疾病相比传播率更高,传播范围更广。卫生条件差、营养缺乏、疫苗接种不完善、与其他禽类接触等均能促进ND 的传播。在疾病暴发前切断可能感染的途径,进行免疫保护是预防ND 的有效措施[57]。加强对病毒的监测,即使对Ⅰ类中的弱毒株也不能掉以轻心,病毒入侵可使机体防御力显著降低,极可能发生继发性感染。继发性细菌感染是病毒感染的常见后遗症,相比轻型NDV 更具有破坏性。不断完善防御策略是控制NDV 传播的必要手段,由于NDV 传播途径多样,野生鸟类、商业鸟类、宠物鸟类均有病毒传播风险,人们以往对其并无过多关注,这是ND 预防策略中较为薄弱的点,加强对这些鸟类的控制,严格依照生物安全标准进行饲养、检疫,加固对NDV 的防御墙。一种优秀的NDV 疫苗可以有效预防临床疾病,目前可用的灭活和减毒活疫苗只能预防相应的病毒感染,不能避免异源病毒入侵。研制新型疫苗及优化防治策略的工作仍须继续,以期在不久的将来找到有针对性、更简捷精确控制NDV 的方法。

