临床分离粪肠球菌的毒力基因和耐药基因检测及其耐药性研究
王 昕,韩 语,潘纪汶,杨 诺,郑立新,曾纪锋,郭桂英,郑继平
(1.海南大学 生命科学学院,海口 570228; 2.海南大学 校医院 ,海口 570228;3.海南大学 动物科技学院,海口 570228; 4.海南大学 理学院,海口 570228)
女性阴道正常状态下存在大量的菌群,这些阴道微生物与宿主之间保持着动态平衡,而平衡的打破则会导致各种条件致病菌滋生,继而引发感染,如阴道炎、宫颈炎。在不同的报道中,阴道炎患者的粪肠球菌(Enterococcus faecalis)检出率都处于较高的水平[1-2],且随着抗生素的广泛使用,耐药性粪肠球菌也在不断增加。目前,肠球菌(Eenterococcus)在临床上是作为仅次于金黄色葡萄球菌的第二大类革兰氏阳性病原菌[3],而粪肠球菌则是肠球菌中检出率校高的菌种之一。肠球菌除了对一些临床常用抗生素如β-内酰胺类、头孢菌素等固有耐药外,还可通过交换质粒、转座子等方式对大环内酯类、糖肽类、四环素类等产生新的获得性耐药,这将对使用抗生素进行临床治疗带来很大的困难。除此以外,肠球菌本身还具备多种毒力基因,如:(1)cylA 是具有杀菌活性的双肽抗生素,是激活细胞溶素的必要条件之一,可裂解大量真核细胞和革兰氏阳性细胞;(2)gelE 是细胞外金属肽酶,可水解明胶酶,胶原蛋白,血红蛋白和其他生物活性化合物,fsr双组分系统可调控其基因表达;(3)esp是参与免疫逃避的膜结合表面蛋白,其分子量在肠球菌表面最大,与感染有关;(4)efaA 是一种细胞壁粘附素;(5)cpd是一种性信息素,对人类白细胞有趋化作用;(6)asa1 是一种具有凝集作用的蛋白,可起到增强粘附的作用;(7)ace和acm是一种胶原结合蛋白,其可使肠球菌结合在宿主细胞的胶原蛋白上,完成定植,引发致病;(8)hyl可产生具有侵袭性作用的透明质酸酶[4-8]。这些毒力基因可使粪肠球菌通过黏附、定植以及逃避宿主免疫应答等引起一系列的感染[4]。因此,本研究对从女性阴道分离的粪肠球菌进行毒力基因、耐药基因及其耐药性等方面的研究,以便为粪肠球菌的临床治疗提供科学依据。
1 材料与方法
1.1 阴 道 拭子 样 品收 集2017 年3 月 至2018年1 月海南大学校医院妇科门诊188 名临床女性患者阴道分泌物拭子(一次性使用无菌拭子)。
1.2 培养基脑心浸出液(Brain heart infusion,BHI)培养基、法国科玛嘉链球菌显色培养基。
1.3 药敏纸片万古霉素、青霉素、氨苄西林、红霉素、环丙沙星、左氧氟沙星、庆大霉素、链霉素、四环素、利奈唑胺、替考拉宁、呋喃妥因、氯霉素,均购于杭州滨和微生物试剂有限公司。
1.4 试剂革兰氏染色试剂盒购于南京建成科技 有 限 公 司;2×F8 Fast Long PCR Master mix、2×A8 Fast HiFi PCR Master Mix、PCR 产物纯化回收试剂盒、DL2000 DNA Marker 均购于北京艾德莱生物科技有限公司;细菌基因组DNA 提取试剂盒(Bacterial DNA Isolation Kit)购于北京华越洋生物科技有限公司。
1.5 细菌的分离与鉴定医院用无菌拭子采集女性患者阴道后穹窿内分泌物,立即放入无菌管-4 ℃保存,随即转移至实验室。利用显色培养基接种菌株,将颜色显深蓝、浅紫色且镜检为链球状的单菌落接种于5 mL BHI 液体培养基中37 ℃培养18~24 h,然后用细菌基因组DNA 提取试剂盒提取细菌DNA。以DNA 为模板用PCR 的方法进行16S rRNA 鉴定,16S rRNA 引物序列为:F:AGAGTTTGATCCTGGCTCAG;R: CGGTTACCT TGTTACGACTT。反应体系见表1。PCR 结果经琼脂糖凝胶电泳验证后,送往北京天一辉远公司进行测序,测序结果用BLAST 进行序列比对,同源性>96%的结果判定为该菌株的鉴定结果。利用MEGA X 软件,通过1 000 个重复计算Bootstrap值,用邻接法制备了系统发育树,并与代表物种进行了比较。从NCBI 获得以下菌株的参考基因序列:E.faecalis2358 (MT604811.1)、E.faecalisGX26(KU937389.1)、E.faecalis4358 (MT544896.1)、Enterococcus durans98D (NR_036922.1)、Enterococcus hiraeR (NR_037082.1)、Enterococcus raffinosus1789-79 (NR_026499.1)、Enterococcus pseudoavium47-16 (NR_028705.1)、Enterococcus faeciumLMG-11423 (NR_0 42054.1)、Enterococcus aviumE6844(NR_028748.1)、Enterococcus casseliflavusNBRC 100478 (NR_104560.1)、Staphylococcus aureusATCC12600 (NR_118997.2)、Streptococcus agalactiaeATCC13813 (NR_040821.1)。最终对分离到的粪肠球菌进行编号,对菌株分离时间、分离地点等信息进行记录。然后菌液与30%的甘油以1∶1 的比例存放于-80℃。

表1 16S rRNA 反应体系
1.6 毒力基因的检测参考文献[9 - 12],对分离到的粪肠球菌进行10 种毒力基因[肠球菌表面蛋白基因(enterococcus surface protein,esp)、辅助定植因子基因(accessory colonization factor,ace)、胶原蛋白结合粘附素基因(adhesion of collagen,acm)、明胶酶基因(gelatinase,gelE)、聚集性物质基因(aggregation substance,asa1)、细胞溶素基因(cytolysin,cylA)、双分子调控系统基因(fsr)、透明质酸酶基因(Hyalronidase,hyl)、心内膜炎抗原基因(endocarditis antigen,efaA)、性 信 息 素(sex pheromones,cpd)] 的PCR 扩增,引物详见表2。

表2 毒力基因引物序列
1.7 药敏试验按照Kirby-Bauer (K-B)纸片扩散法进行药敏试验,统计实验菌株对抗菌药物的敏感性。以金黄色葡萄球(S.aureus)ATCC25923为药敏质控菌株,参照美国临床实验室标准委员会(NCCLS)最新标准进行实验。
1.8 耐药基因的检测参考文献[5,13]对分离到的粪肠球菌进行9 种耐药基因[包括糖肽类耐药基因vanA、vanB、vanC;氨基糖苷类药物耐药基因aac(6')/aph(2')、ant(6)-1;大环内酯类耐药相关基因ermB、mefA;四环素类药物耐药基因tetM,β-内酰胺酶基因tem] 的PCR 扩增,引物序列见表3。

表3 耐药基因引物序列
2 结果与分析
2.1 细菌的分离与鉴定从188 名女性阴道分泌物拭子分离出157 株菌,通过颜色(蓝色、浅紫色)、镜检(链球状)挑选符合粪肠球菌特征的57 株菌进行16S rRNA 鉴定。从57 株临床标本菌株中得到22 株粪肠球菌,排除同一患者分离的相同菌株。以16S rRNA 构建的支序图如图1所示。
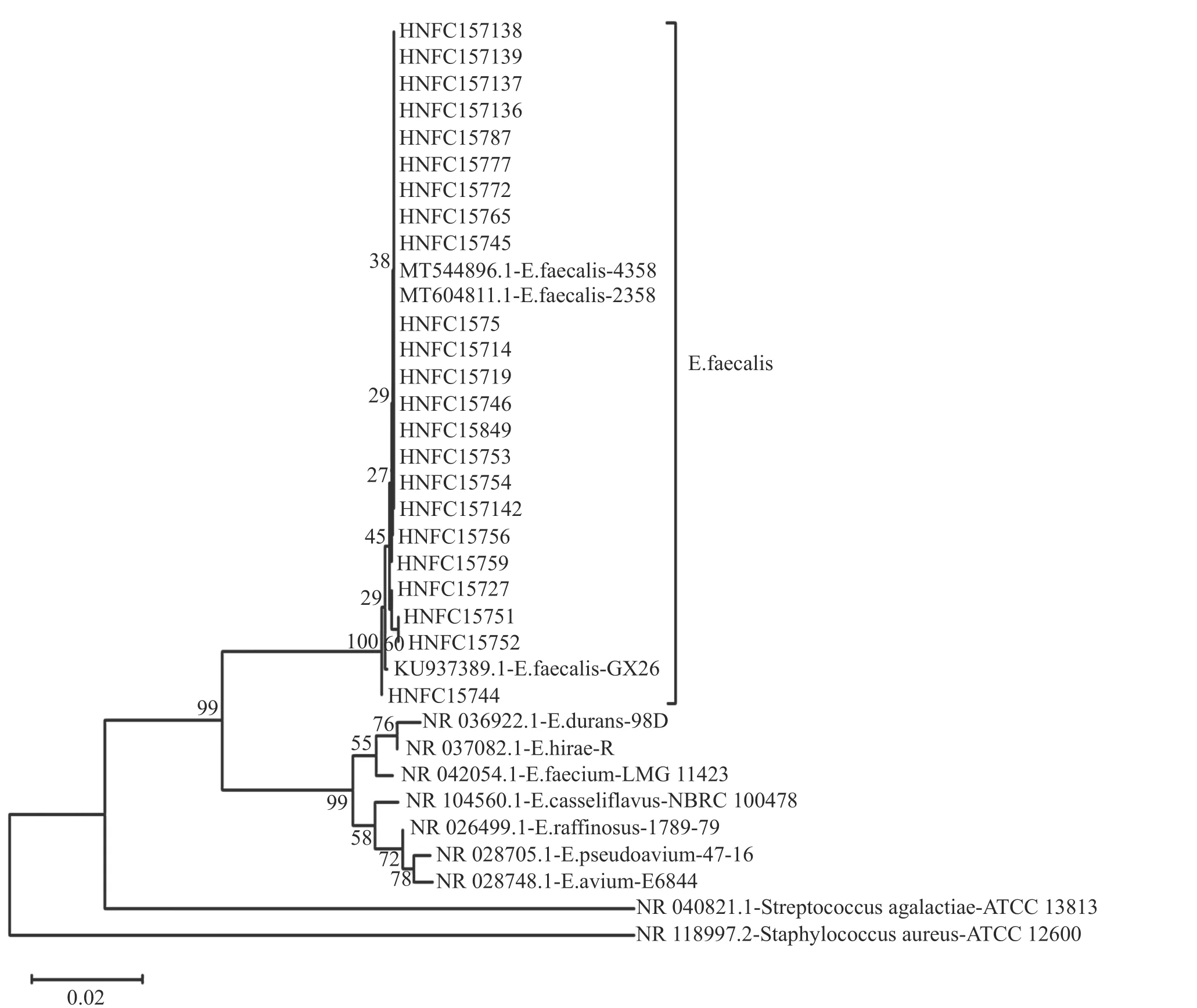
图1 粪肠球菌支序图
2.2 临床标本分布情况在22 株粪肠球菌中,10 株来自阴道炎患者,5 株来自膀胱炎患者,2 株来自尖锐湿庞患者,1 株来自膀胱刺激症患者,1 株来自白塞氏病患者,1 株来自子宫内膜息肉患者,1 株来自备孕人员,1 株来自人流术后人员。这些菌株在这些人体内并没有交叉存在的情况。
2.3 毒 力基因检测结果以DNA 为 模 板 用PCR 的方法进行毒力基因检测,检测结果如图2所示。10 种毒力基因在粪肠球菌中有着很高的检出率,除hyl未被检出外,其余9 种基因的检出率都在50%以上。依检出率由高到低依次是efaA(100%,22/22)、asa1(90.9%,20/22)、cylA(90.9%,20/22)、fsr(90.9%,20/22)、cpd(90.9%,20/22)、acm(86.4%,19/22)、gelE(81.8%,18/22)、esp(68.2%,15/22)、ace(54.5%,12/22)。
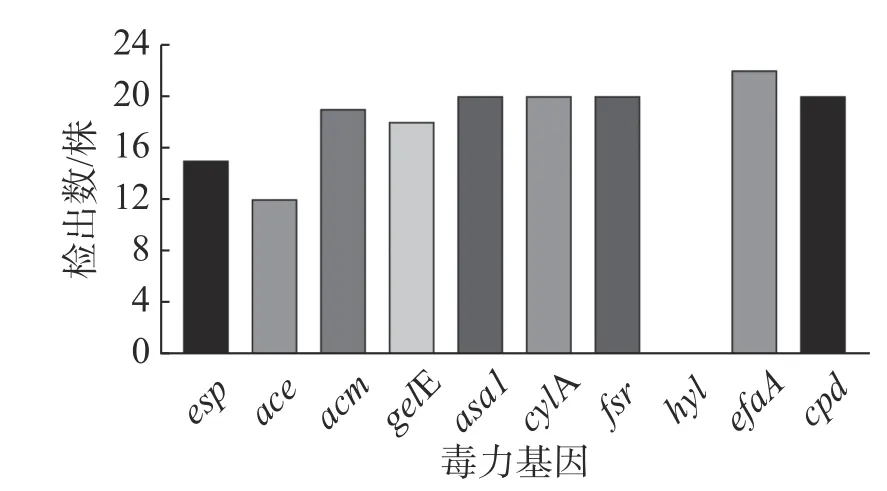
图2 粪肠球菌毒力基因结果
2.4 药敏试验结果13 种抗生素的药敏纸片结果显示,粪肠球菌对万古霉素、呋喃妥因、利奈唑胺、替考拉宁敏感性好,对其他抗菌药物则均表现不同程度的耐药,其中对链霉素和四环素的耐药率较高,具体耐药率见表4。
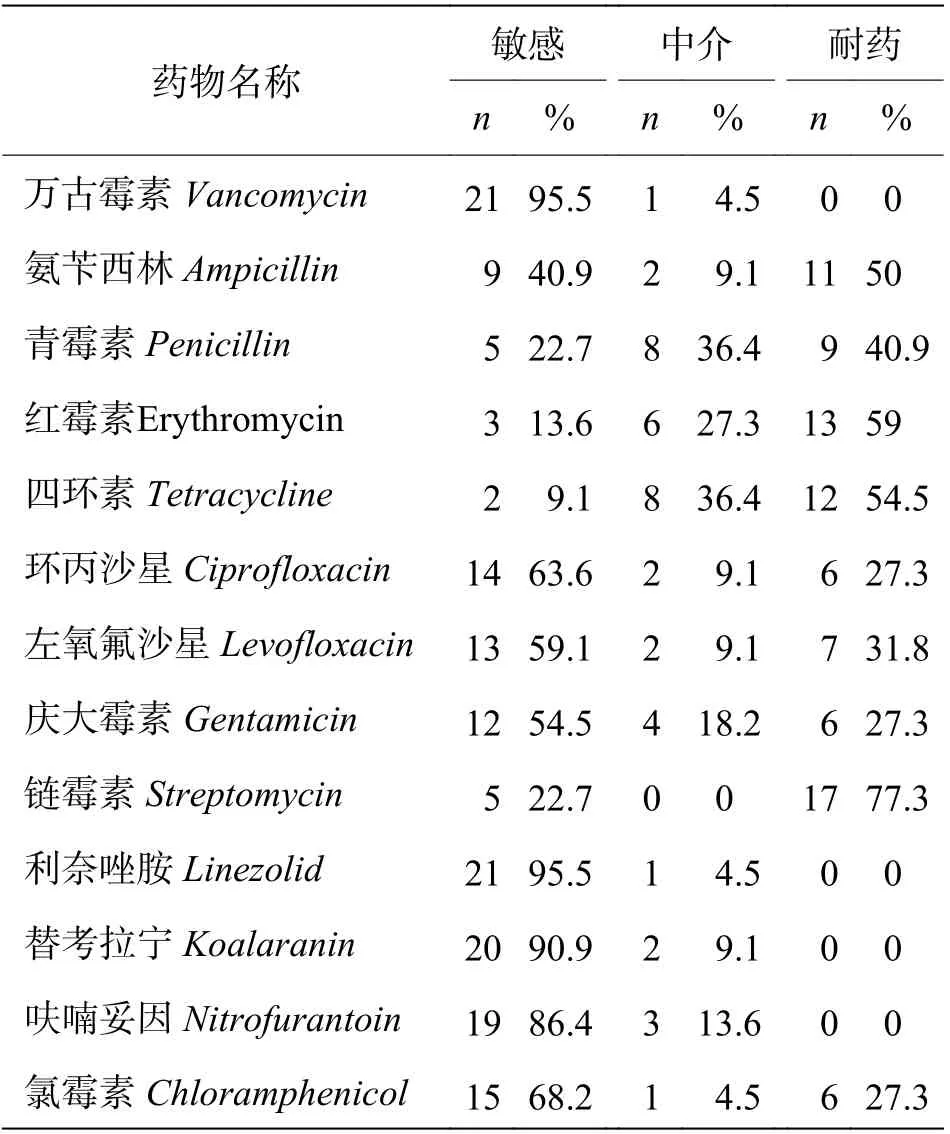
表4 粪肠球菌药敏纸片耐药率结果
2.5 耐 药基因检测结果以DNA 为 模 板 用PCR 的方法进行耐药基因检测,9 种耐药基因在粪肠球菌中的检出结果如图3 所示,除了vanA(0%)、vanB(0%)和vanC(18.2%)有着较低的检出率外,其余6 种基因的检出率分别为aac(6')/aph(2')(40.9%)、ant(6)-1(59.1%)、ermB(68.2%)、mefA(54.5%)、tetM(72.2%)和tem(81.8%),其中四环素类耐药基因和β-内酰胺酶耐药基因都有着很高的检出率。
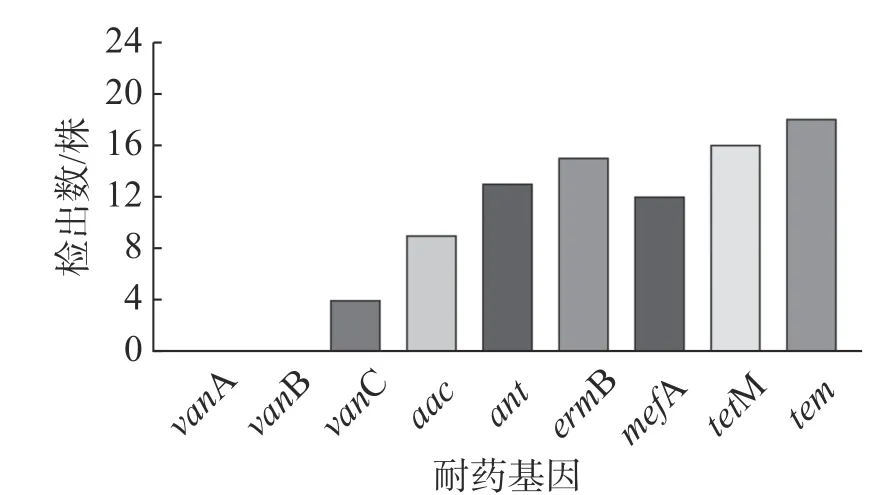
图3 粪肠球菌耐药基因结果
3 讨 论
粪肠球菌是女性阴道中正常菌群之一,但当阴道黏膜受损时,就会导致这些条件致病菌群比例失调引起感染。由于在生理构造上十分接近,增强了细菌从阴道转移到泌尿道的可能,因此阴道炎的产生在很大程度上会引起泌尿生殖系统疾病,尤其是尿路感染(UTI)[14]。根据文献报道,粪肠球菌是引起尿路感染的主要病原菌[15]。因此,研究该菌毒力基因、耐药基因及其耐药性的关系十分重要,可以为临床用药提供参考。近年来肠球菌毒力基因或潜在的毒力基因在粪肠球菌中的分布研究较多,不同来源、不同种粪肠球菌毒力基因检出率存在较大差异,可能是地区、人群、标本等不同造成的。22 株来自海南大学校医院分离的菌株中,其9 种毒力基因的检出率均大于50%,仅有hyl基因未检出。22 株粪肠球菌携带多重毒力基因,所有粪肠球菌可同时表达5 种以上毒力,其中同时含8 种毒力基因的粪肠球菌最多占40.9%,含5 种毒力基因的菌株最少占9.1%,这个结果与祝进[16]的研究结果相同。esp的检出率与许婧[4]的研究结果相符,均在65%左右,且同样的hyl未被检出。gelE具有较高的检出率,这与Sharifi[17]等的研究结果相同。cylA 的检出率一般为40%,而本研究含cylA 的粪肠球菌高达90.9%。祝进[16]的研究样本来自浙江,cylA、esp和gelE 的检出率分别为38.9%、52.2%和47.8%。白耀霞[9]等的研究样本来自江苏,cylA、esp和gelE 的检出率分别为30.77%、56.41%和58.97%。祝进[16]与白耀霞[9]等的研究相比,其毒力基因检出率很是接近。而本研究样本来源于海南,cylA 和gelE 的检出率比文献[9,16]的检出率有较大的上升幅度,其他基因如asa1、acm、cpd和efaA 和文献[9,16]相比差别也很大。由此可以反映出,不同地区粪肠球菌毒力因子的检出率有较大的差异。cpd基因的存在有助于获得相关的性信息素质粒,可以获得相关的毒力和耐药决定因素。因此,笔者推测在本研究的分离株中存在多重耐药可能与cpd基因的高携带率有关[6]。在本研究中efaA 的检出率高达100%,这与Creti等[5]的研究结果一致。Eaton[7]等的研究表明,efaA 基因始终存在于医学粪肠球菌分离物中,并且大多数(89%)来自食品的粪肠球菌菌株具有efaA 决定因子,因此,以efaA 为基因靶,可用于对粪肠球菌的分子检测。
随着抗生素的出现和使用,肠球菌的耐药性逐年升高,已成为主要致病菌。在本实验中,耐药表型与基因型相符程度很高,且81.8%的粪肠球菌携带2 种以上耐药基因。自2005 年以来,粪肠球菌对氨苄西林的耐药率在国内呈现逐年下降的趋势,且维持在10%以下[18]。在临床上,β-内酰胺类抗生素一直被用于治疗各种疾病。本研究中粪肠球菌对氨苄西林的耐药率高达50%,编码β-内酰胺类的基因tem阳性率达81.8%,此结果暗示海南海口地区存在氨苄西林使用过度问题,导致该地区的粪肠球菌对氨苄西林的耐药性增强。因此,在之后的临床治疗中应根据药敏结果选择性使用β-内酰胺类抗生素,以防止粪肠球菌选择性获得该耐药基因,给后续的治疗带来困难。氨基糖苷类抗生素,如庆大霉素整体呈现耐药率降低的现象[19-21],本研究中庆大霉素的耐药率也处于较低的水平。除此以外,其他抗生素的耐药率都与国内现状基本相同。自1988 年首次报道耐万古霉素肠球菌(VRE)后,在世界各地都陆续报道发现了耐药菌[22-23]。VRE 分为9 个表型,vanA、vanB、vanC(C1, C2, C3)、vanD、vanE、vanG、vanL、vanM、vanN,其中VanA 和VanB 是临床上最常见的耐万古霉素基因型且有重要临床意义,且以vanA 最常见[24]。高VRE 的存在给人类的健康带来了严重的威胁,并在部分地区引起较高的死亡率。在国内,除了台湾地区VRE 检出率较高外,其余地区与世界水平相比,仍处于较低的水平[18,25]。在本试验中未检测到携有vanA 和vanB 的耐药基因菌株以及耐万古霉素和耐替考拉宁的菌株,这与其他人的研究结果相同[19-20,26],说明海口地区的粪肠球菌对糖肽类抗菌药物有着高度敏感性。因此,海口地区可采用万古霉素对粪肠球菌进行治疗,但要注意用量且及时检测,以防出现VRE。
本次研究从临床分离得到的22 株粪肠球菌,其毒力基因检出率较高,耐药基因的检出与耐药表型结果基本符合。22 株粪肠球菌对氨苄西林的耐药率与全国水平相比偏高,推测可能是与当地过度使用氨苄西林抗生素有关,应引起注意。但22 株粪肠球菌对万古霉素、呋喃妥因、利奈唑胺和替考拉宁均无耐药情况,这为今后的临床治疗提供了一定的科学用药参考。

