基于胶体金免疫层析法快速检测蓝莓中的百菌清残留
马 琳, 赵 颖, 陈建波, 赵 莉*,
(1.上海市农业技术推广服务中心,上海 201103;2.浙江昊天检测技术服务有限公司,杭州 311122)
蓝莓Semen Trigonellae杜鹃花科(Ericaceae)越橘亚科越橘属(VacciniumLinn.)多年生果树,落叶或常绿性灌木,其风味独特、营养丰富,被联合国粮农组织和世界卫生组织列为“人类五大健康食品之一”和“最佳营养价值水果”[1]。上海于21 世纪初期在金山区开始引种蓝莓,至2020 年底蓝莓种植面积达50 hm2,其经济效益逐渐显现,为上海市推进乡村振兴、加快农业农村现代化树立了典范。随着蓝莓商业化种植面积和年限的不断增加,蓝莓病虫害特别是病害逐年加重,种类增多,呈多元化发生态势,严重影响产量和产业发展,生产上除选用抗病品种、轮作换茬、避雨栽培等常规措施外,药剂防治仍然是主要措施[2]。通过查询中国农药信息网的农药登记数据[3],截止2022 年8 月,我国尚未有农药在蓝莓上获得登记许可,生产中农民只能凭经验施药,导致蓝莓的质量安全风险较高。此外,蓝莓采收期长达3 月余,每日连续采收,且没有外果皮,属于直接入口的鲜食水果,因此给蓝莓的食用安全带来了极大的风险。
百菌清 (chlorothalonil,图式1) 是一种具有多作用位点的保护性广谱杀菌剂,主要用于叶面喷洒,防治多种作物如蔬菜、果树和小麦等的多种病害。鉴于百菌清对鱼类和两栖类动物有较高风险,且降解产物也可能对地下水有较高污染,欧盟于2019 年4 月29 日,发布委员会执行法规2019/677,决定不再批准百菌清原药的续展申请[4]。安雪花等[5]研究表明,在草莓温室中施用百菌清,对田间操作人员存在职业暴露风险。张志恒等[6]研究发现,食用喷施75%百菌清可湿性粉剂 400倍液后7 d内的草莓对2~4 岁儿童以及1 d 内对18~30 岁女性的风险都是不可接受的。因此,研发快速、精准的百菌清残留分析方法,是进行有效监管的重要环节。

图式 1 百菌清结构式Scheme 1 The structural formula of chlorothalonil
免疫分析法是依靠小分子半抗原与抗体或者蛋白抗原与抗体之间特异反应的分析方法。采用各种示踪物如酶、纳米金、荧光素等对抗体或抗原进行标记,通过对示踪物的测定得知免疫复合物的量,从而对免疫反应进行监测[7]。构建农药残留免疫检测方法的关键在于农药抗原和抗体的制备,而由于农药大多分子较小,难以引起生物体的免疫应答,因此通常将它们与大分子蛋白质载体结合,制备出人工抗原来刺激生物体的免疫系统,从而产生抗体。根据标记物的不同,免疫分析技术可以分为酶联免疫吸附分析、荧光免疫分析、化学发光免疫分析、放射免疫分析和胶体金免疫分析等,其中胶体金免疫分析由于价格低廉、方便携带、分析结果可肉眼辨别等优点被广泛应用于各个检测领域[8-10]。
目前,对百菌清基于胶体金免疫层析分析技术 (colloidal gold immuno-chromatographic assay,GICA) 的分析报道不多,仅见邓家军等[11]报道了采用免疫层析法测定圆白菜和苹果中百菌清残留,检出限为0.2 mg/kg;周佳等[12]采用胶体金免疫层析法检测果蔬中百菌清,检出限为3 mg/kg。本研究以前期设计的半抗原制备的抗百菌清高特异性、高亲和力单克隆抗体为材料,建立了半定量胶体金免疫层析试纸条分析方法,实现裸眼观察判断百菌清残留;同时,建立了基于超高效液相色谱-三重四级杆串联质谱仪 (UPLC-MS/MS) 的检测方法,以蓝莓样品为对象进行了方法的验证,表明两种检测方法配合使用可以实现对百菌清的精准、快速检测,优势互补。其中,胶体金免疫层析试纸快速、方便,能用于现场检测,UPLC-MS/MS 方法准确、灵敏,可用于大量样品的高通量定量检测。
1 材料与方法
1.1 主要仪器、试剂与供试材料
Agilent 1290 UPLC-Agilent 6460 MS/MS 超高效液相色谱-三重四级杆串联质谱仪:配APCI 源(UPLC-MS/MS,美国安捷伦公司);离心机(TDL-5-A,上海安亭科学仪器厂);Milli Q 超纯水系统(德国默克公司);旋涡混合器(SCI LoGex MX-S,上海珂淮仪器有限公司);紫外可见分光光度计(UV-7504 PC,上海精密仪器仪表有限公司);透射电子显微镜(Talos F200X S/TEM,赛默飞世尔科技(中国)有限公司) ;金标免疫层析读数仪(杭州和迈科技有限公司)。
百菌清单克隆抗体 (浙江大学研制);1000 mg/L百菌清标准品、1000 mg/L 4-羟基百菌清标准品、1000 mg/L 五氯硝基苯标准品、1000 mg/L 多菌灵标准品和1000 mg/L 腐霉利标准品 (农业农村部环境质量监督检验测试中心 (天津) );乙腈 (色谱纯,德国Merck);盐酸 (国药集团化学试剂有限公司);牛血清蛋白BSA (MW67000)、羊抗鼠IgG、钥孔血蓝蛋白BCP (MW500000) (华美生物工程公司);磷酸氢二钠、磷酸二氢钠、N,N-二环已基碳二亚胺(DCC)、N,N-二甲基甲酰胺 (DMF)、N-羟基琥珀酰亚胺 (NHS) (中国医药 (集团) 上海化学试剂公司);NANO 分散型固相萃取柱(博纳艾杰尔科技有限公司);MAS-QuEChERS 分散型固相萃取柱(博纳艾杰尔科技有限公司)。蓝莓购于当地农贸市场。
1.2 试验方法
1.2.1 试纸条的材料制备及组装检测
1.2.1.1 百菌清全抗原制备 首先,在百菌清苯环上两个 -CN 之间引入氨基己酸基团,替代之前的氯原子,按照文献[13]方法合成百菌清半抗原,如图式2 所示。

图式 2 百菌清半抗原的制备示意图Scheme 2 Schematic of synthesis pathway of the hapten of chlorothalonil
然后,采用活化酯法和混合酸酐法[14]将百菌清半抗原与BSA 偶联制备竞争抗原,与BCP 偶联制备免疫抗原:1) 称取0.022 mmol 百菌清半抗原20 mg,用1.6 mL DMF 溶解后逐滴加入0.2 mL DMF 溶液 (含有1.8 μmol NHS 和12 μmol DCC)中,室温下搅拌过夜,将反应后的混合液于4000 r/min 下离心10 min,取上清液即为半抗原活性酯溶液。2) 先将0.24 μmol BSA[n(半抗原) :n(BSA) =20 : 1]溶解于3 mL 0.05 mol/L 的碳酸盐缓冲液(CBS) 中,另取0.006 μmol BCP[n(半抗原) :n(BCP) = 100 : 1] 溶解于750 μL 0.05 mol/L 的CBS 中,然后分别加入到上述1.6 mL 百菌清半抗原活性酯溶液中,室温条件搅拌下反应4 h。3) 将反应完成后的溶液装入到预处理好的透析袋中,用0.01 mol/L 的磷酸盐缓冲液 (PBS) 透析3 d。将得到的反应物透析,分装后于120 ℃保存,备用。4) 采用微量板酶标仪测试偶联物、蛋白和半抗原的吸光度,按 (1) 式计算3 种溶液的摩尔吸光系数ε,按 (2) 式计算偶联比 (K)。
式中:ε为摩尔吸光系数L/(mol·cm);Abs为吸光度,L/(g·cm);ρ为质量浓度,%;Mr为摩尔分子质量;K为偶联比;IC 为偶联物;pro 为蛋白;hap 为半抗原。
1.2.1.2 胶体金的制备 胶体金的制备采用柠檬酸三钠还原法[15]。将1000 mL 待还原的体积分数为0.01%的氯金酸溶液倒入三口圆底烧瓶中,磁力搅拌器中加热,待氯金酸溶液沸腾时迅速注入12~30 mL 体积分数为1%的柠檬酸三钠溶液,搅拌反应8 min,待反应液变为鲜亮的酒红色时停止加热,制备得到胶体金溶液,置于试剂瓶中4 ℃保存。采用紫外分光光度计对胶体金颗粒进行扫描,测定400~600 nm 波长范围内的最大吸收峰,并采用透射电子显微镜观察鉴定胶体金颗粒的粒径及分散性。
1.2.1.3 胶体金标记抗体探针的制备 用浙江大学提供的百菌清单克隆抗体对上述制备的胶体金进行标记:用10 mmol/L 碳酸钾溶液将10 mL 胶体金溶液调节至合适的pH 值后,将3 μL 50 mg/L的百菌清单克隆抗体用双蒸水 (dd H2O) 稀释至1 mL后逐滴加入,边加边搅拌使抗体与胶体金颗粒均匀混合,室温条件下静置60 min;加入1.25 mL封闭液[m(BSA) :m(PEG) :m(ddH2O) = 10 : 1 :89] 进行60 min 的封闭反应;通过离心 (4 ℃、10000 r/min、30 min) 除去游离抗体,用洗涤液复溶,将复溶液[m(BSA) :m(PEG) :m(ddH2O) =1 : 0.1 : 98.9]再次离心,用储存液[m(蔗糖) :m(BSA) :m(PEG) :m(ddH2O) = 5 : 1 : 0.1 : 93.9]定容至1 mL,4 ℃保存,保存期为30 d。
1.2.1.4 胶体金免疫试层析纸条的组装 完整的试纸条包括聚氯乙烯 (PVC) 底板、吸水垫、NC 膜、金标垫和样品垫 (图1)。将NC 膜贴在PVC 底板的中间,用喷膜仪在NC 膜上分别喷涂百菌清竞争抗原 (百菌清-BSA) 和羊抗鼠二抗 (IgG),作为检测线 (T) 和质控线 (C),T 线和C 线间隔6 mm;金标抗体结合垫和吸水垫于NC 膜两端重合1~2 mm 贴在PVC 底板上,金标结合垫贴靠近检测线 (T) 端,吸水垫靠近质控线 (C) 端;样品垫与金标结合垫重合1~2 mm 贴在 PVC 底板上,组装完毕后用切条机将整板的试纸切成3 mm 宽的条状,即制成金标试纸条,将试纸条装入带干燥剂的密封袋中,4 ℃密封干燥保存。

图1 胶体金免疫层析试纸条构成截面图Fig.1 Cross section of the colloidal gold immuno-chromatographic test strip
1.2.1.5 胶体金免疫试层析纸条检测结果的判定
向样品垫中滴加约75 μL 待测样品液或不同浓度的百菌清标准品溶液 (20%甲醇-PBS 缓冲液稀释配制),5 min 后裸眼观察判定检测结果,如图2所示。1) 当待测液中不含百菌清或浓度极低不足以检出时,金标抗体与固定于T 线上的竞争抗原结合,形成肉眼可见的红色条带,同时,过量的金标抗体与C 线上固定的羊抗鼠 (IgG) 抗体结合,形成肉眼可见的红色条带,此时T 线与C 线均为红色条带,结果判定为阴性;2) 当待测液中百菌清浓度高于检出限时,百菌清优先与金标抗体结合,导致T 线颜色变浅 (浅于C 线颜色) 或不显色,而免疫复合物或者多余的金标抗体与C 线上固定的羊抗鼠 (IgG) 抗体结合显红色,结果判断为阳性;3) 当C 线不显色时,无论T 线是否显色,均判为试纸条失效。
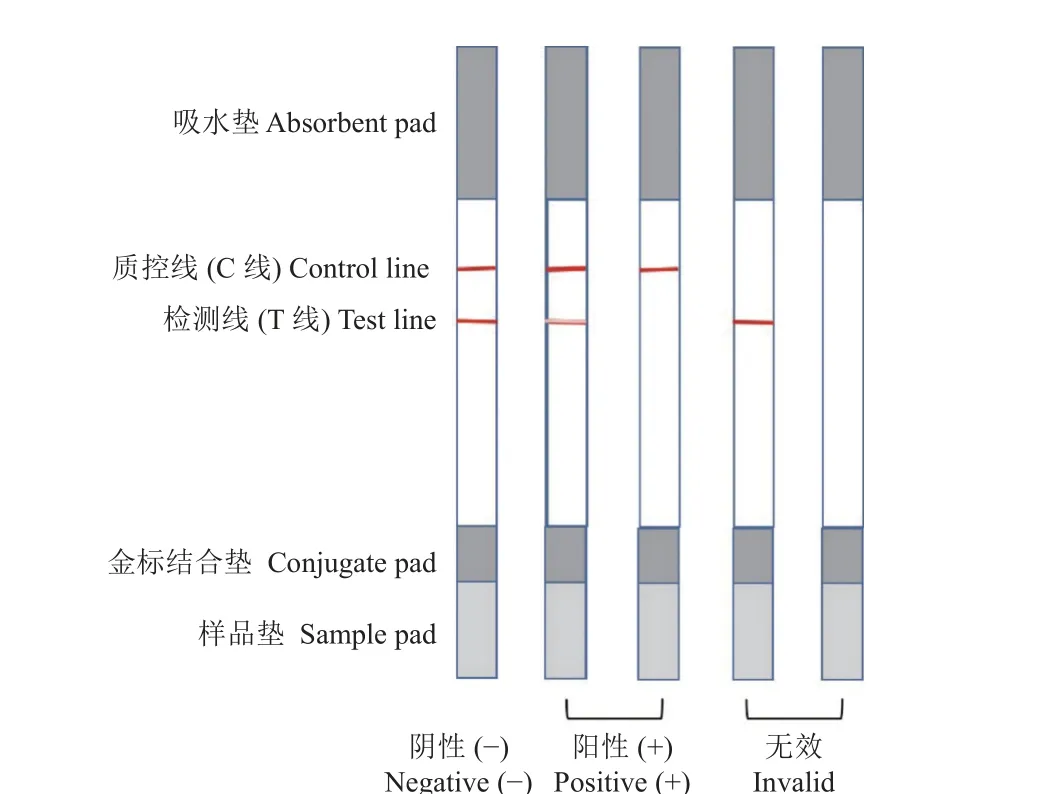
图2 百菌清免疫层析试纸条检测结果判定示意图Fig.2 Schematic diagram for determination of test results of chlorothalonil immuno-chromatographic strip
1.2.2 试纸条参数及检测条件的优化 为了实现最佳的检测灵敏度、稳定性与显色效果,分别对几个重要参数进行优化,包括胶体金颗粒的粒径、标记pH 值、抗体的标记浓度、探针的标记量和检测线的包被浓度等 (表1),在优化过程中,分别在无药物以及0.01 mg/L 的百菌清质量浓度下进行测试。
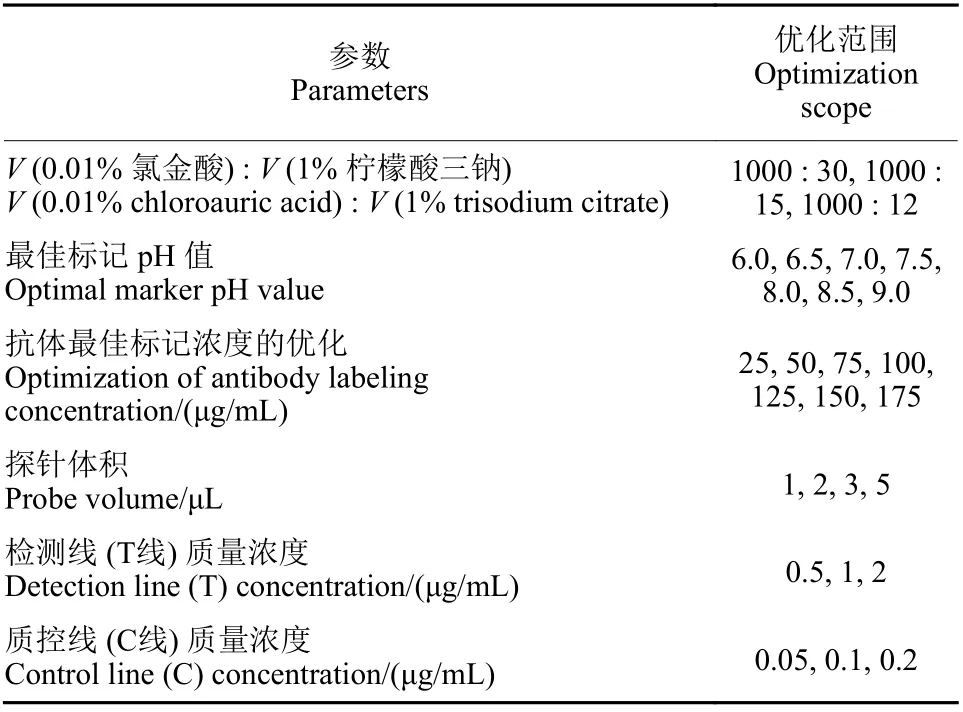
表1 试纸条参数优化表Table 1 Optimization parameters of the test strip
1.2.3 样品检测
1.2.3.1 检测条件 色谱条件:Agilent Proshell 120 EC-C18不锈钢色谱柱 (3 mm × 100 mm,2.7 μm);流动相A 为乙腈,B 为5.0 mmol/L 甲酸铵水溶液;流速0.7 mL/min。梯度洗脱程序:0~0.5 min,10% A~30% A;>0.5~1 min,30% A~50% A;>1~3 min,50% A~90% A;>3~5 min,90% A;>5~5.5 min,90% A~10% A。进样量10 μL。
质谱条件:APCI 源;负离子扫描模式;多反应监测模式;鞘气温度325 ℃;鞘气流量4 L/min;雾化气压力0.4 MPa;毛细管电压3500 V。百菌清定性离子对 (m/z):244.9/181.9 及244.9/146.8,定量离子对 (m/z) 244.9/146.8,碎裂电压120 V,碰撞能量35/35 V。
1.2.3.2 样品前处理 称取10 g (精确至0.01 g)蓝莓样品至100 mL 具塞塑料离心管内,加入1 mL体积分数为10%的盐酸溶液旋涡混合1 min;加入10 mL 乙腈,高速匀浆1 min 后加入3 g 氯化钠,旋涡混合1 min,以4000 r/min 离心5 min;取2 mL 上清液,过0.22 μm 有机系滤膜后分成两份:一份供UPLC-MS/MS 检测;另一份用ddH2O稀释20 倍后进行胶体金试纸条测试,并与UPLCMS/MS 结果进行对比。
1.2.4 试纸条性能评价
1.2.4.1 灵敏度评价 向蓝莓空白样品中分别添加0、0.01、0.05、0.1、0.2、0.5 和1 mg/kg 7 个水平的百菌清标准溶液,每个水平重复5 次,按照1.2.3.2 节的方法提取样品。分别取75 μL 样品提取液用于试纸条检测,T 线不显色时的百菌清浓度即为试纸条的肉眼观察检出限(LOD)。
1.2.4.2 特异性评价 将百菌清的代谢物4-羟基百菌清、结构类似物 (五氯硝基苯) 及功能类似物(多菌灵和腐霉利) 分别配制成0.1 mg/L 和1 mg/L,用试纸条检测,观察试纸条的交叉反应情况。
1.2.4.3 准确性评价 实验室添加阳性样本的假阴性率:向蓝莓空白样品中分别添加0.1、0.2、0.5 和1 mg/kg 4 个水平的百菌清标准溶液,每个水平重复5 次,测定方法判定的假阴性率。
田间阳性样本的假阴性率:选择在基地生产过程中未喷洒过农药百菌清的蓝莓植株,按照75%百菌清可湿性粉剂有效成分1642.5 g/hm2的剂量施药,于药后3 d 采摘,先用UPLC-MS/MS法对百菌清残留量进行测定,再将样品稀释到产品肉眼观察检出限的0.5、1.0、2.0 倍水平,每个检出水平做10 个重复。
验证结果用《食品快速检测方法评价技术规范》[16]来评价胶体金方法的灵敏度、特异性、假阳/阴性率和与参比方法一致性。
2 结果与分析
2.1 免疫抗原和竞争抗原的鉴定
采用紫外分光光度法 (240~400 nm) 扫描百菌清半抗原、载体蛋白BCP、BSA 及偶联物竞争抗原、免疫抗原。结果表明,竞争抗原 (半抗原-BSA) 和免疫抗原 (半抗原-BCP) 有明显的吸收峰偏移,表明偶联成功。计算竞争抗原和免疫抗原的偶联比分别为18 和36。
2.2 胶体金探针的制备
抗体标记是影响胶体金免疫层析方法性能最为关键的技术要点,因此重点研究了胶体金粒径大小、抗体标记pH 值以及标记量对胶体金探针稳定性与生物活性的影响。
2.2.1 胶体金制备 金纳米颗粒的大小与形状对胶体金颜色、稳定性、试纸条的显色效果以及检测灵敏度有显著影响[17]。本研究用传统的柠檬酸钠盐还原法制备胶体金,通过改变氯金酸与柠檬酸三钠的比例来控制胶体金的粒径大小。设计了3 种不同的投料比,分别在1000 mL 0.01%氯金酸溶液中添加30、15 和12 mL 0.1% 的柠檬酸三钠。通过紫外分光光度计对胶体金颗粒进行可见光范围 (400~600 nm) 扫描,测得其最大吸收波长λmax分别为516、521、525 nm,并用透射电子显微镜测定胶体金颗粒粒径,观察其粒径分布在15、25、35 nm 左右,大小均一性较佳。根据试纸条显色亮度,15 nm 粒径的胶体金显色较浅,而35 nm 粒径显色偏紫黑 (图3),这种容易出现聚沉的现象也导致了较大的批间差异。故从胶体金的颜色、试纸条的显色程度以及灵敏度等方面综合考虑,选择投料比为n(0.01% 氯金酸溶液) :n(0.1%柠檬酸三钠) = 1000 : 15,粒径为25 nm 粒径的胶体金用于标记单克隆抗体。
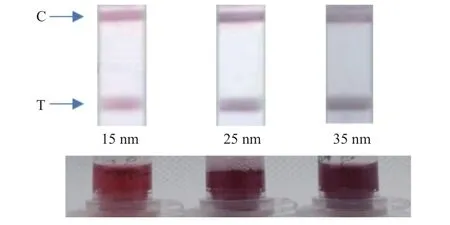
图3 不同粒径胶体金的试纸条显色亮度情况Fig.3 Color development of test strips based on colloidal gold with different particle sizes
2.2.2 最佳标记pH 值的优化 蛋白分子在其标记pH 值为蛋白等电点pI 附近时可最大程度地吸附在金表面上[18]。本研究将百菌清单克隆抗体溶液加入到以10 mmol/L 碳酸钾溶液调节的不同pH 值的胶体金溶液中,然后加入0.1 mL 10% 氯化钠溶液,静置0、15、30、60 min,分别测定氯化钠加入前、后不同静置时间点的吸光度值 (OD521nm)。结果表明,当1 mL 胶体金溶液加入8 μL 10 mmol/L碳酸钾时,胶体金溶液的pH 值为6.5,此时氯化钠加入前后4 个时间点吸光度变化的变异系数(CV) 最小,此即胶体金颗粒与百菌清单克隆抗体结合的最佳标记pH 值。
2.2.3 抗体标记浓度、探针体积与检测线浓度优化
2.2.3.1 抗体最佳标记浓度优化 柠檬酸根保护的胶体金颗粒外层带有负电荷,在静电作用下,胶体金溶液为稳定的胶体状,在加入10% 氯化钠时,由于高浓度盐离子的作用,胶体金溶液发生聚沉,由均一的酒红色变为蓝色。抗体蛋白可通过物理吸附与柠檬酸根包裹的胶体金结合,增加分子间距,在较高浓度盐离子下,使胶体金颗粒仍能保持良好的分散性。盐析诱导沉聚实验表明,当抗体标记质量浓度≥50 μg/mL 时,在盐析作用下,胶体金标记的抗体仍保持稳定,溶液颜色与原胶体金溶液颜色一致,且氯化钠加入前后吸光度变化的CV 值最先低于15%,即百菌清单克隆抗体最佳标记质量浓度为50 μg/mL。
2.2.3.2 试纸条探针体积优化 分别在试纸条金标结合垫上添加1、2、3、5 μL 的百菌清金标抗体溶液,测试空白样品及含0.01 mg/L 百菌清的20%甲醇PBS 溶液,观察试纸条的显色情况与抑制情况。结果 (图4) 表明,百菌清金标抗体溶液用量为3 μL 时,纸条显色较亮且抑制明显易于观察,因此选择3 μL 为金标探针最适附着量。

图4 百菌清金标抗体不同添加量的试纸条显色情况Fig.4 Color development of test strips with different amounts of chlorothalonil gold labeled antibody
2.2.3.3 试纸条检测线与质控线试剂的工作浓度优化 优化了硝酸纤维素膜 (NC 膜) 上的百菌清竞争抗原 (T 线) 和羊抗鼠二抗包被 (C 线) 的工作浓度。当T 线百菌清竞争抗原的质量浓度为1 mg/L、喷涂量为0.9 μL/cm 时,空白对照测试时T 线显色灰度值达到1000 左右,百菌清标准溶液0.01 mg/L测试时T 线显色灰度值≤100,此即最佳抗原工作浓度;当最优C 线羊抗鼠二抗质量浓度为0.1 mg/L、喷涂量为0.9 μL/cm 时,C 线显色效果与测试线显色灰度值最接近,此即最佳二抗包被工作浓度。
2.3 前处理条件的优化
2.3.1 提取溶剂的选择 百菌清在中性条件下稳定性较差,为提高样品提取过程中百菌清的稳定性和回收率,通常在样品中加入硫酸[19]等强酸调节提取环境至酸性。本研究中对传统QuEChERS方法 (AOAC 2007.01) 的前处理步骤进行改进,用盐酸替代乙酸/乙酸钠缓冲盐。比较了加入不同体积酸度调节剂 (10%盐酸) 时目标分析物的回收率。结果 (图5) 显示,当不添加酸度调节剂时,百菌清的回收率不足40%,随着酸度调节剂添加量增大,百菌清回收率逐步改善,当添加量高于1 mL 时百菌清平均回收率可以稳定在90%以上。故最终选择以1 mL 10%的盐酸溶液为酸度调节剂加入10 g 蓝莓样品。
2.3.2 样品提取液净化 蓝莓中含有大量花青素,提取液颜色较深,如果不进行适当的净化处理,会严重影响试纸条的显色。常用增大基质稀释倍数或固相吸附净化等方法降低提取液中色素干扰。本研究以百菌清添加浓度为0.1 mg/kg 的蓝莓样品为例,考察了不同稀释倍数和不同固相吸附剂的净化效果。试验设计了5 倍、10 倍、20 倍ddH2O 稀释;加入质量体积比为2%、5%、10%的PSA 净化,离心后上清液用ddH2O 稀释20 倍;以及使用NANO 和MAS-QuEChERS 两种商品化固相吸附净化管进行净化,离心后上清液用ddH2O稀释20 倍,结果如图6 所示。提取液用ddH2O稀释5 倍和10 倍时,由于待测液中乙腈含量偏高导致试纸条失效,当ddH2O 稀释20 倍时,试纸条C 线显色正常且T 线消失,检测结果为阳性;比较不同质量体积比PSA 对样品净化效果及灵敏度影响发现,当PSA 用量超过5%时,试纸条T 线不消失,考虑是净化剂用量过多对目标农药有吸附;使用两种商品化净化管结果显示,NANO 净化管对色素的净化效果与MAS-QuEChERS 相当,但由于MAS-QuEChERS 净化剂填料过多,对目标农药有吸附,因此造成结果假阴性。综上,选取ddH2O 稀释20 倍为样品提取液净化方法,该方法简单易操作,且成本相对较低。
2.4 试纸条性能的评价
2.4.1 灵敏度 按照1.2.4.1 节方法,向蓝莓空白样品中添加不同水平百菌清标准溶液,并按照1.2.3 节的方法提取样品,检测结果如图7 所示,蓝莓基质在稀释20 倍后对试纸条均无影响,肉眼观察检出限为0.1 mg/kg,表明添加水平 ≥ 0.1 mg/kg时,样品经酸化后乙腈提取,纯水稀释20 倍后,检测结果为阳性。
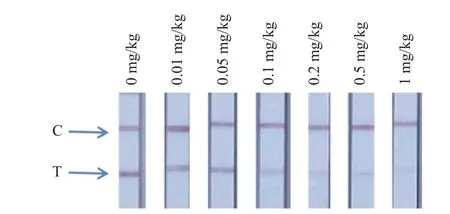
图7 添加样品中百菌清的试纸条检测结果Fig.7 Results of strip test for chlorothalonil in spiked samples
2.4.2 特异性 在上述的最佳条件下,按照1.2.4.2 节方法采用百菌清试纸条百菌清、百菌清的代谢物 (4-羟基百菌清) 及其结构与功能的类似物 (五氯硝基苯、多菌灵、腐霉利)。通过试纸条显色情况评估此速测方法的交叉反应情况。结果表明,只有测试0.1 mg/L 和1 mg/L 的百菌清标准溶液时,T 线消失 (图8),表明此试纸条对百菌清有较高的特异性,可用于百菌清的特异性检测。
2.4.3 准确性
2.4.3.1 UPLC-MS/MS 方法验证 按照1.2.3 节的方法提取样品,得到空白基质溶液,用该空白基质溶液将标准工作溶液稀释成0.01、0.1、0.2、0.5、1 mg/L 的系列基质匹配标准溶液,进行UPLCMS/MS 分析,外标法定量。以百菌清的峰面积为纵坐标 (y),质量浓度为横坐标 (x),绘制基质匹配标准曲线。结果如表2 所示,百菌清在0.01~1 mg/L 范围内线性关系良好,决定系数 (R2) 均大于 0.99。

表2 采用UPLC-MS/MS 法测定百菌清的添加回收率、相对标准偏差、线性方程、决定系数和定量限Table 2 Recoveries, RSDs, linear equations, R2 and LOQs for chlorothalonil by UPLC-MS/MS
向蓝莓空白样品中分别添加0.01、0.1、0.2、0.5 和1.0 mg/kg 5 个水平的百菌清标准溶液,每个水平重复5 次。结果 (表2) 表明:百菌清的平均回收率为81%~96%,相对标准偏差 (RSD) 为8.9%~13.9%,方法定量限0.01 mg/kg。本研究所建立的残留检测方法可满足《农作物中农药残留试验准则》[20]的要求,适用于百菌清在蓝莓中的残留分析研究。
2.4.3.2 免疫层析方法验证
1) 实验室添加阳性样本的假阴性率
按照1.2.4.3 节方法,向蓝莓空白样品中添加不同水平百菌清标准溶液,用于实验室添加阳性样本的假阴性率检测。结果 (表2)表明,使用百菌清试纸条检测蓝莓中百菌清残留时无假阴性现象,假阴性率均为0。
2) 市场监测假阳性率
市场随机抽检40 份蓝莓样品,并用UPLCMS/MS 确认浓度低于胶体金的最低检出含量,再用胶体金试纸条进行检测以验证其假阳性率。结果显示,40 份蓝莓样品未有百菌清检出,胶体金法假阳性率均为0。
3) 田间阳性样本的假阴性率
本试验在基地选择生产过程中未使用过百菌清的蓝莓,喷洒主要药效成分为百菌清的农药产品,于喷洒后3 d 采摘新鲜果实,先用UPLCMS/MS 法对百菌清残留量进行测定,再分别将样品稀释到百菌清试纸条最低检出限的0.5 倍、1.0 倍、2.0 倍水平。每个检出水平做10 个重复。验证结果用《食品快速检测方法评价技术规范》[15]来评价胶体金方法的灵敏度、特异性、假阳/阴性率和与参比方法的一致性,结果如表3 所示。田间阳性样品验证百菌清的假阳性率和假阴性率均为0,与参比方法均无显著性差异 (χ2<3.84)。

表3 百菌清的田间阳性样品的验证结果Table 3 Verification results of positive field samples of chlorothalonil
3 结论与讨论
本研究构建了快速准确检测蓝莓中百菌清残留的胶体金免疫层析试纸条方法,肉眼观察检出限为0.1 mg/kg,相比于邓家军等[11]报道的采用免疫层析法测定圆白菜和苹果中百菌清残留 (检出限0.2 mg/kg) 及周佳等[12]报道的采用胶体金免疫层析法检测果蔬中百菌清残留 (检出限为3 mg/kg),本方法灵敏度更高,分析时间更短,整个过程能在15 min 内完成。此外,与UPLC-MS/MS 测试结果比对表明,方法的假阳性率、假阴性率都能满足快速检测方法评价要求,结果准确可靠。本研究的百菌清胶体金免疫层析试纸条方法特异性高,对样品中4-羟基百菌清、五氯硝基苯、多菌灵和腐霉利的检测不存在交叉反应。该方法耗时短、操作简便,无需大型设备仪器,适合上市前自测及基层农产品监督,具有应用价值。

