斯高威尔刺盘孢菌次生代谢产物分离纯化及其对大斑凸脐蠕孢菌的抑制作用
于惠源, 张爱民,2, 陈明卿, 席雪冬, 于志国*,
(1.沈阳农业大学 植物保护学院,沈阳 110866;2.贵州省农业科学院辣椒研究所,贵阳 550000;3.辽宁省辽阳市文圣区罗大台镇人民政府,辽宁 辽阳 111000)
大斑凸脐蠕孢菌Exserohilum turcicum属真菌界子囊菌门座囊菌纲格孢菌亚纲格孢菌目(腔菌目)格孢菌科毛球腔菌属真菌,能够引起严重的玉米大斑病害,其致病范围遍布全球。目前多选用化学农药对该病进行防治[1],然而由于农药的不合理使用及其消解的不确定性,常会导致环境污染、人畜中毒和农药残留等问题,亟需开发环境友好型的新型农药。
以天然产物作为先导化合物研发新农药是国内外研究热点之一[2-3]。大量研究表明,同一种菌株因为生态环境不同,其次生代谢产物也会有所不同[4]。而植物病原真菌与植物长期处于竞争关系当中,生存环境较为特殊,并且二者会发生复杂的、多层次的相互进化及相互作用,从而产生特殊的次生代谢产物[5]。刺盘孢属(Colletotrichumsp.)植物病原真菌,隶属于子囊菌门(Ascomycota)粪壳菌纲(Sordariomycetes)[6],可致炭疽病害的发生,广泛寄生于谷类、豆类、果树、蔬菜等多种植物中。迄今为止,人们已经从刺盘孢属菌中分离得到100 余种化合物,其中许多化合物不仅结构新颖,并且具有较强的生物活性。例如mycosporin alanine[7]、ferricrocin[8]、colletofragarones[9]及monocerin[10]具有很强的植物毒活性;piperin[11-13]、ergosterol peroxide[14]及colletotricones[15]具有较强的细胞毒性;2-(2-aminophenyl)-acetic acid[16]和3b-hydroxy-ergosta-5-ene[17]具有良好的植物生长调节活性;2-phenylethyl-1H-indol-3-yl-acetate 与4-hydroxy-benzamide[18]具有较好的抗真菌活性;colletotric acid[19]、piperin[18]及3b-hydroxy-ergosta-5-ene[17]具有较强的抗细菌活性。本研究从斯高威尔刺盘孢菌Colletotrichum scovillei中分离得到两个化合物,对其化学结构进行鉴定,并研究了二者对大斑凸脐蠕孢菌的抑制作用,旨在为新型环保型农药的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 供试菌株 供试菌株分离自发病辣椒果实,病样采集地为贵州省遵义市播州区(106°98′E,27°73′N)。由张爱民采用形态鉴定、柯赫氏法则及多基因(ITS、ACT、CAL、CHS I、GADPH、β-tub 2、HIS 3)系统发育分析的方法鉴定为斯高威尔刺盘孢菌Colletotrichum scovillei,现保存于沈阳农业大学植物保护学院微生物次生代谢产物研究室;大斑凸脐蠕孢菌Exserohilum turcicum,由沈阳农业大学植物保护学院微生物次生代谢产物研究室提供。
1.1.2 供试培养基 Richard 液体培养基:蔗糖50 g/L、KNO310 g/L、KH2PO45 g/L、MgSO42.5 g/L、FeCl3·6H2O 0.02 g/L,蒸馏水1 L,pH 值自然。
PDA 培养基:马铃薯200 g/L、葡萄糖20 g/L、琼脂粉15-20 g/L,蒸馏水1 L,pH 值自然。
1.1.3 试剂及药剂 分析纯二甲基亚砜(DMSO,美国CIL 公司);色谱纯甲醇(Sigma-Aldrich 公司);柱层析硅胶[筛孔径0.150~0.075 mm (100~200 目)、0.075~0.050 mm (200~300 目)] (青岛海洋化工有限公司);SephadexLH-20 柱层析凝胶(GE 医疗集团,乌普萨拉,瑞典);大孔吸附树脂XAD-16 (罗口哈斯国际贸易有限公司)。其余试剂为分析纯(国药集团化学试剂有限公司)。98.5% 百菌清(chlorothalonil)原药(山东潍坊丰化工股份有限公司)。
1.1.4 仪器 Avance-600 核磁共振仪(德国Bruker公司);Agilent-1260 高效液相色谱仪,分析型C18柱(Agilent ZORBAX Eclipse XDB,4.60 mm ×250 mm,5 μm)和半制备型C18柱(Agilent ZORBAX Eclipse XDB,9.4 mm × 250 mm,5 μm);R-1001-LN 旋转蒸发仪、SHB-Ⅲ循环水式多用真空泵和DLSB-5120 低温冷却液循环泵 (郑州长城科工贸有限公司);KQ-500B 超声波清洗器 (昆山超声仪器有限公司);QUINTIX224-1CN 分析天平 (赛多利斯有限公司);HNY-2102C 恒温振荡培养箱 (天津市欧诺仪器仪表有限公司);ZF-20A 四用紫外分析仪 (上海嘉鹏科技有限公司)。
1.2 斯高威尔刺盘孢菌的培养及发酵
将分离得到的斯高威尔刺盘孢菌接种于PDA培养基中,25 ℃条件下恒温培养7 d。挑取长势较好的6 mm 菌块接种到20 mL 试管中作为一级液体种子,每瓶试管装有灭菌的 5 mL Richard 液体培养基,于28 ℃、180 r/min 振荡培养12 h 以上,待菌液浑浊时取出。将发酵好的一级液体种子全部转接到 250 mL 的三角瓶中作为二级液体种子,于28 ℃、180 r/min 振荡培养 24 h 以上,待菌液浑浊、菌块结成链球状时取出。将二级液体种子以20%体积分数的接种量转接到2 L 三角瓶中,每瓶装有灭菌后的400 mL Richard 液体培养基和18 g 大孔吸附树脂(XAD-16),于28 ℃,180 r/min 振荡培养7 d,总发酵量22 L。
1.3 次生代谢产物的提取、分离和纯化
斯高威尔刺盘孢菌发酵完成后,弃去菌丝菌液,收集树脂并用流动水反复冲洗3 次以上,直至树脂干净。将树脂置于托盘中,28 ℃恒温烘干。烘干后将树脂分批装在分液漏斗中,用甲醇浸泡洗脱3 次以上,每次浸泡4 h,收集甲醇浸液。用旋转蒸发仪浓缩得到甲醇浸膏(3.4 g)。
之后对甲醇浸膏进行分离纯化:一级硅胶柱层析洗脱液通过薄层层析法(TLC)检测结果分析确定,依次选用二氯甲烷,V(二氯甲烷) :V(甲醇) = 100 : 2、100 : 4、100 : 8、100 : 16、1: 1 混合溶剂和甲醇作为正相硅胶柱的梯度洗脱体系。每次流动相均洗脱0.6 L。一级硅胶柱层析结束后按照极性高低将馏分合并为A (767.2 mg) 和B (205.7 mg)两组。A 组分中的化学成分极性较大,先经凝胶柱层析分离(V(甲醇) :V(二氯甲烷) =1 : 1),再经硅胶柱层析分离,洗脱液设计梯度洗脱(V(石油醚) :V(丙酮) = 45 : 55;V(石油醚) :V(丙酮) = 4 : 6;V(石油醚) :V(丙酮) = 3 : 7)除去大部分杂质,最后采用高效液相色谱(HPLC) 分离[V流动相 (33%乙腈和67%水) :V(水相) = 34 : 66,流速为3 mL/min,检测波长为254 nm,保留时间:Rt= 36~39 min],最终分离纯化得化合物1(24.3 mg)。
对B 组分先进行硅胶柱层析梯度分离(V(石油醚) :V(乙酸乙酯) = 7 : 3 和 6 : 4),再采用凝胶柱层析分离(流动相为100%甲醇),最后经硅胶柱层析(V(二氯甲烷) :V(甲醇) = 100 : 4)分离纯化得化合物2 (21.8 mg)。
1.4 化合物结构鉴定
分别通过高分辨质谱(HRMS)、核磁共振氢谱(1H NMR)、碳谱(13C NMR)和二维核磁共振谱(COSY, HSQC, HMBC) 对化合物1 和2 的结构进行分析,并将获得的数据与文献数据进行比对,以鉴定化合物的结构。
1.5 抑菌活性测定
1.5.1 菌丝生长速率法 采用菌丝生长速率法[20]测定两个化合物对大斑凸脐蠕孢菌的抑菌活性。将供试化合物用DMSO 溶解后,采用倍半法稀释为50、25、12.5、6.25 μg/mL 4 个质量浓度梯度,加入等量PDA 培养基制成含药平板(Φ= 90 mm),DMSO 的质量分数为0.4%。将长势一致的大斑凸脐蠕孢菌菌碟(Φ= 6 mm)菌面朝下接入平板中,25 ℃恒温培养。待对照菌落长至平板直径2/3 或3/4 处时,采用十字交叉法测量菌落直径,按(1)式计算菌丝生长抑制率(I)。以只含DMSO 的培养基的处理为阴性对照,以百菌清处理为阳性对照,3 次重复。通过SPSS 软件处理数据,得出毒力回归方程及EC50值等相关数据。
式中:DCK为空白对照PDA 培养基上菌丝平均直径,mm;DPT为处理后PDA 培养基上菌丝平均直径,mm。
1.5.2 离体叶片法 参考文献方法[21-22]进行。收集位置、大小相近的玉米叶片,清洗后用去离子水浸润30 min,晾干备用。用无菌水(含0.4% DMSO)溶解两个化合物和百菌清原药,分别配制成800 μg/mL 和400 μg/mL 的药液。将叶片平铺于含有水-琼脂培养基的培养皿中,叶片背面紧贴水-琼脂培养基。将两种质量浓度的药液分别喷洒至叶片表面,使药液均匀分布。将长势一致的大斑凸脐蠕孢菌菌碟(Φ=6 mm)菌面朝下接种于叶片正中央。以喷施无菌水(含0.4% DMSO)的处理为阴性对照,喷施百菌清处理为阳性对照,3 次重复。置于恒温光照培养箱中,于25 ℃、12 h 光照/12 h 黑暗交替培养72 h 后,观察叶片被侵染后的腐烂情况,按(2)式计算相对防治效果(E)。
式中:A0为对照病斑面积,cm2;A为处理病斑面积,cm2。
2 结果与分析
2.1 化合物的结构鉴定
化合物1 和2 的1H NMR 谱及13C NMR 谱数据见表1。
化合物1 为无色无味油状液体,易溶于甲醇。根据1H NMR、13C NMR 及高分辨HRMS(m/z358.2617 [M + H]+,计算值C19H36NO5,358.2588),确定其分子式为C19H35NO5,不饱和度为3。
通过1H NMR 谱数据可知,分子中存在2 个甲基 [δH0.82 (3H, t,J= 7.4 Hz, H-14), 0.91 (3H, d,J= 6.6 Hz, H-15)],2 对烯烃质子[δH5.92 (1H, d,J= 15.0 Hz, H-2), 7.41 (1H, ddd,J= 15.0, 11.2, 1.1 Hz, H-3)]和[δH6.01 (1H, t,J= 11.2 Hz, H-4), 5.48(1H, t,J= 11.2 Hz, H-5)],再根据两对烯烃质子的偶合常数数值判断,Δ2,3 为反式构型,Δ4,5 为顺式构型;中场区有7 个质子[δH3.19~3.22 (1H, m,C1′-H), 3.29~3.33 (1H, m, H-12), 3.41~3.43 (1H, m,C1′-H), 3.44~3.46 (1H, m, H-3′), 3.50~3.55 (2H, m,H-4′), 3.62~3.65 (1H, m, H-2′)]。通过分析比对13C NMR 谱与HSQC 谱数据,可得知共有 19 个C 信号,其中包括2 个甲基、8 个亚甲基、8 个次甲基(包括4 个烯区次甲基信号)以及1 个酰胺羰基碳。通过分析COSY 谱图和HMBC 谱图并与文献数据[23]比对可知化合物1 存在4-氨基-1,2,3-丁三醇结构。其他信号通过分析COSY 谱图可知H-6/H-7,H-15/H-6,H-11/H-12/H-13/H-14 相关,分析HMBC 谱图得知H-15/C-5,C-6,C-7,H-14/C-12,C-13,H-12/C-10,C-11,C-12,C-13相关;再依据HMBC 谱图中C1′-H 与C-1 相关以及C-1′化学位移值为δC42.3,确定C-1 和C-1′ 通过NH 相连接,同时验证了酰胺键的存在。由化合物平面结构可知C-6,C-12,C-2′,C-3′ 为手性碳原子,因未做相关试验深入研究,暂无法确定其构型。结构式如图式1 所示,主要HMBC 相关见图式2。此结构经SCI Finder 检索,未发现相关报道,确定其为新化合物6-甲基-12-羟基-十四烷基-N-(2′,3′,4′-三羟基丁基)-2E,4Z-二烯酰胺(6-methyl-12-hydroxy-tetradeca-N-(2′,3′,4′-trihydroxybutyl)-2E,4Z-dienamide)。

图式 1 化合物1 的化学结构Scheme 1 The chemical structures of compound 1

图式 2 化合物1 的主要HMBC 相关Scheme 2 Key HMBC (arrows) correlations of compound 1
化合物2 为无色颗状物,根据1H NMR、13C NMR 及高分辨HRMS (m/z454.2968 [M + H]+,理论值453.2879),确定其分子式为C28H40NO4,不饱和度为9。
根据1H NMR 谱表示存在对二取代苯结构[δH7.28 (2H, d,J= 8.5 Hz, H-2′, H-6′), 6.90 (2H, d,J= 8.5 Hz, H-3′, H-5′)],1 个活泼氢质子[δH10.02(1H, s, H-4)]。根据13C NMR 谱结合HSQC 谱表示存在28 个碳信号,包括6 个甲基、4 个亚甲基、11 个次甲基 (包括6 个烯区和芳香区次甲基,2 个氧化次甲基) 和7 个季碳 (其中1 个酰胺羰基碳)。通过分析HMBC 谱图可知H-2′/C-1′,C-4′,C-5相关联以及H-6/C-4,C-5,C-2,C-23,H-23/C-2,C-6,4-OH/C-3,C-4,C-5,H-7/C-2,C-3,C-4,H-8/C-3 的相关信息,分析这些关联信息可以确定存在4-羟基-2-吡啶酮结构片段,并被对羟基苯环取代在C-5 位置。通过搜索上述结构特征片段结合文献数据比对,鉴定化合物2 为已知化合物sambutoxin[24],其结构式见图式3。
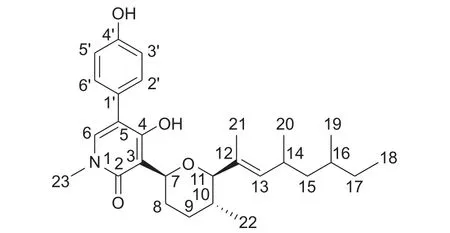
图式 3 化合物2 的化学结构Scheme 3 The chemical structure of compound 2
2.2 抑菌活性
2.2.1 菌丝生长速率法测定结果 菌丝生长速率法测定结果表明,在50 μg/mL 下,化合物1 和2 对大斑凸脐蠕孢菌均表现出较强的抑制效果。经SPSS 计算分析,得到化合物1 和化合物2 的EC50值分别为11.43 μg/mL 和18.42 μg/mL (表2)。各浓度下化合物对大斑凸脐蠕孢菌的抑制率及抑制效果见附件材料图S1 及表S1。
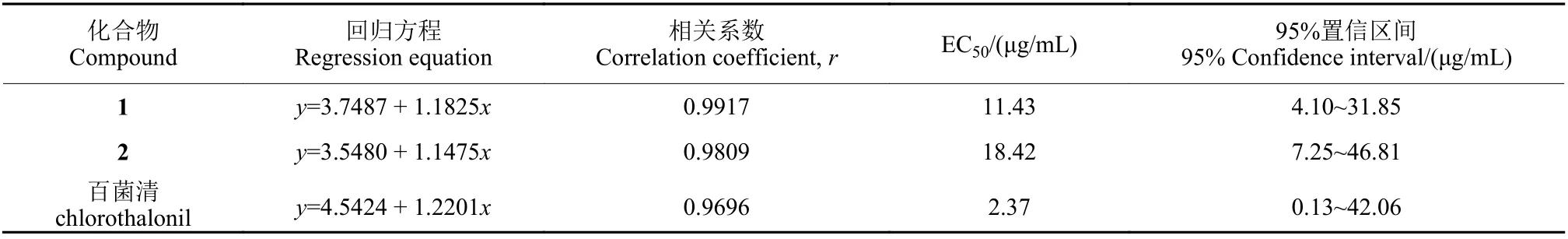
表2 化合物对大斑凸脐蠕孢菌的抑制效果Table 2 The inhibitory effect of compounds on Exserohilum turcicum
2.2.2 离体叶片法测定结果 离体叶片试验结果表明:未经药物处理的叶片被大斑凸脐蠕孢菌菌丝侵染后,病斑巨大且明显,病斑呈现长梭型,中央有开裂迹象,叶片接近枯萎;而经过药剂处理的叶片,只在病斑周围有水渍状腐烂,病斑周围干燥,含药浓度较高的叶片仍然保持比较新鲜的状态。用化合物处理过的叶片病斑面积明显小于未处理过的叶片病斑长度。如图1 及表3 所示,在800 μg/mL 时,化合物1、化合物2和百菌清(阳性对照)对玉米大斑病的相对防效为 84.8%、79.3%和88.9%;在 400 μg/mL 时,化合物1、化合物2和百菌清的相对防治效果分别为 76.3%、69.8%和82.7%。

图1 离体叶片上供试化合物分别在800 μg/mL (A)和400 μg/mL (B)下对玉米大斑病的防治效果Fig.1 Control efficacy of 800 μg/mL (A) and 400 μg/mL (B)compounds on detached leaves against northern corn leaf blight
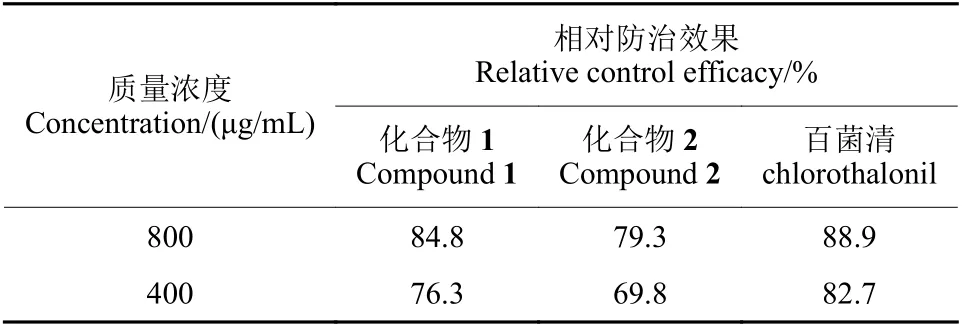
表3 离体叶片法测定化合物对玉米大斑病的相对防治效果Table 3 Relative control efficacy of compounds was determined by in vitro leaf method against northern corn leaf blight
3 结论与讨论
神经酰胺类化合物为神经鞘糖脂中的一种,目前对于神经酰胺类化合物的研究大多数集中于人体或动物细胞的生理生化作用上[25-26]。在农业方面,尤其是抗植物病原菌方面的研究报道很少。高义[27]通过化学合成手段发现一个新的神经酰胺类似物GD-3+,其在100 μg/mL 下对番茄灰霉病菌的抑制率达88.89%。本研究从斯高威尔刺盘孢菌的发酵粗提物中分离得到两个化合物,其中化合物1是新的神经酰胺类化合物,它含有顺式、反式双键,酰胺羰基和多个羟基等官能团,结构一侧是极性较大的羟基头,通过酰胺羰基连接着另一侧的脂肪族长链。另一个生物碱类已知化合物sambutoxin,分子内具备酚、吡啶酮、吡喃环等官能团,具有化学多样性。对于该化合物,有研究者报道了其细胞毒性[24],本研究首次探讨了sambutoxin 在抗植物病原菌方面的应用。通过菌丝生长速率法与离体叶片法测定两个化合物的抑菌活性,发现二者均对大斑凸脐蠕孢菌有较强的抑制作用,化合物1和2的EC50值分别为 11.43 μg/mL 和18.42 μg/mL。离体叶片法测定结果表明,化合物1在800 μg/mL 时的相对防治效果为84.8%,与对照药剂百菌清相当,化合物2的相对防治效果为79.3%。本研究结果表明,从斯高威尔刺盘孢菌的发酵粗提物中分离得到的两个化合物均对大斑凸脐蠕孢菌有较强的抑制作用,具备开发为农药先导化合物的潜力。

