低温胁迫下外源SA对酿酒葡萄幼苗抗氧化酶活性及内源SA含量的影响
王旺田,李 斌,赵俊鹏,王宝强,张 芮
(1. 甘肃省干旱生境作物学重点实验室,甘肃农业大学生命科学技术学院,甘肃 兰州 730070;2. 甘肃省科学院生物研究所,甘肃 兰州 730099;3. 庄浪县自然资源局,甘肃 庄浪 744600;4.甘肃农业大学水利水电工程学院,甘肃 兰州 730070)
低温是限制植物生长发育和地理分布的主要环境因子,但是植物经过长期适应多变的环境温度已经进化出一系列生理和分子机制来抵御低温造成的伤害,例如通过低温驯化过程产生相应的反应,提高自身的耐冷性[1]。当遭受低温胁迫时,植物体内积累大量的活性氧(ROS),通过启动自身的抗氧化防御系统,清除体内过多的ROS物质[2],保护正常的生理代谢[3-4]。植物抗氧化防御系统主要包含抗氧化酶类和非酶类物质。为了减轻低温胁迫引起的水分胁迫和渗透胁迫,植物有时还会显著增加体内的渗透物质积累,对低温信号产生应答,维持细胞稳态及正常生理代谢,从而提高自身的耐冷性及耐寒性[5-8]。
葡萄(VitisviniferaL.)是多年生落叶藤本植物,具有重要的经济价值、营养价值和药用价值,在世界上具有悠久的种植历史[9]。目前我国酿酒葡萄主产区为冬季气候严寒干燥、全年降水较少的北方地区,而主要栽种酿酒葡萄品种是原产于西亚和地中海地区的欧亚种[10],因此低温成为限制酿酒葡萄种植面积扩大的主要因素之一[11]。低温除了影响葡萄细胞膜的稳定性,还会改变保护酶活性和内源物质的含量[12-13]。近年来有大量报道表明激素参与了植物对低温的响应,调控植物在低温下的营养生长、生殖和发育,改善其在多种逆境下遭受的破坏[14-15]。植物激素水杨酸(Salicylic acid, SA)在植物体内分布广泛,被认为是直接或间接影响植物对生物及非生物抗性的信号分子,参与植物对干旱、寒冷和高温等非生物胁迫的防御反应。在植物与生物及非生物胁迫的相互应答中,外源SA的应用是否也起到关键性作用?这个问题逐渐成为研究热点。有研究发现SA及其衍生物处理能通过增强抗氧化酶活性来提高铁皮石斛及椰子在不同程度低温下的抗寒性;同时,适当浓度的外源SA能够诱导苗期植物的冷敏感度降低,使植株耐寒性得到增强[16-17]。研究也发现在不同环境条件下应用高浓度的外源SA会产生不良后果,例如常温下高浓度外源SA的喷施处理会导致玉米幼苗的各光合特征值显著降低,并对幼苗的生长产生不可逆的破坏[18]。所以,外源SA的应用能否对植物产生有利的影响,与植物品种以及环境因素有关。
因此,通过分析低温胁迫下外源SA影响植物内源SA含量的变化来揭示SA响应低温胁迫机制有重要意义。本试验选择炼苗存活率高、低温下稳定性强且应用广泛的酿酒葡萄砧木品种‘贝达’,研究低温胁迫下葡萄幼苗内源SA含量、抗氧化物酶活性以及MDA等生理指标的变化,并分析外源SA处理与低温逆境下葡萄幼苗叶片抗氧化酶与内源SA含量间的应答关系,以期为水杨酸在葡萄逆境胁迫研究机理和应用方面提供一定的试验依据。
1 材料与方法
1.1 试验材料和试验处理
试验在甘肃农业大学生命科学技术学院生物质能实验室进行,采用多因素试验设计。试验材料‘贝达’(Vitisriparia×V.labrusca,Beta)外植体由甘肃省干旱生境作物学重点实验室提供。SA(购自上海源叶科技有限公司)用蒸馏水配制成100 mmol·L-1的母液,4℃保存,试验时根据需要进行稀释。
2021年10月25日利用植物组织培养技术(图1),选用GS培养基离体培养葡萄幼苗30 d(培养条件:温度25℃;湿度65%;光照强度8 000 lx;16 h光照,8 h黑暗)后,挑选生长至6~10片叶子的幼苗进行炼苗,随后移入注有Hoagland营养液的培养盆(10 cm×10 cm×9 cm)内,并用泡沫板固定,置于人工气候培养箱中培育至泡沫板固定处葡萄苗直径达0.8 cm以上备用。

图1 植物组织培养技术获取的试验材料Fig.1 Plant tissue culture technique to obtain experimental materials
组培苗炼苗、水培试验完成后,设置2组试验,第1组为低温胁迫试验,第2组为低温胁迫与外源SA喷施组合试验。其中第1组低温胁迫试验于2021年12月15日开始,选取培养盆中生长一致的幼苗分别转移到温度为4℃和12℃的培养箱进行低温胁迫,以常温(25℃)为对照,共3个处理,每个处理设置3次重复,每个重复10株葡萄幼苗。低温培养4 d后进行常温4 d的恢复生长,分别标记为低温胁迫阶段和恢复生长阶段,在低温胁迫0 d(T)、低温胁迫第4天(T1)和恢复常温生长第4天(T2)分别釆集葡萄幼苗顶端第3片幼嫩叶片,液氮冷冻后储存在-80℃冰箱备用。
第2组低温与外源SA喷施组合试验于2021年12月25日开始,用手摇喷雾器对葡萄幼苗进行外源SA喷施处理,喷施浓度分别为0、0.5、1.0 mmol·L-1,直到叶面喷施液滴开始脱落为止,每个处理3个重复,每个重复10株葡萄。在外源SA处理后,将幼苗转移到人工气候室(培养条件同上),在4℃下处理4 d。分别于第0、2、4天对幼苗顶端第3片叶进行取样,样品置于液氮冷冻后储存在-80℃冰箱,后续进行抗氧化酶活性的测定,对抗氧化酶活性影响最大的对应SA处理低温胁迫第4天的样品进行内源SA浓度的测定。
1.2 试验方法
叶片细胞膜稳定性通过测定电导率,用膜稳定指数来衡量[14];CAT、SOD、POD活性及MDA含量均使用生化试剂盒(购自北京索莱宝科技有限公司,货号分别为BC0200、BC0170、BC0090、BC0020)测定。内源SA含量的测定采用酶联免疫吸附 (ELISA)试剂盒(购自上海酶联生物科技有限公司,货号为ml077224),具体步骤参考试剂盒说明书。
1.3 统计分析
采用IBM-SPSS 23.0统计软件和Excel 2016软件对各参数进行综合分析和绘图。对不同低温胁迫程度下的葡萄幼苗内源SA与保护酶活性及膜的损伤进行逐步回归分析,并得到回归方程,所有比较均在95%的概率水平上进行(P<0.05)。
2 结果与分析
2.1 低温胁迫对酿酒葡萄幼苗叶片细胞膜稳定性和MDA含量的影响
植物遭受逆境时,细胞膜的稳定性会发生显著变化。如图2A所示,不同处理在常温(25℃)下生长的葡萄幼苗膜稳定指数无明显变化。与常温相比,12℃低温胁迫处理显著增加了酿酒葡萄幼苗叶片膜稳定指数,然而4℃低温胁迫处理显著降低了叶片膜稳定指数,并显著低于12℃处理。低温胁迫后的幼苗转移至25℃恢复生长4 d后(第8天),膜稳定指数无明显变化,4℃处理的幼苗膜稳定指数最小,12℃处理的膜稳定指数仍高于常温对照,说明适宜低温增强了膜的稳定性。
如图2B所示,从低温胁迫前、低温胁迫4d到恢复生长4d,常温条件(25℃)下生长的酿酒葡萄幼苗叶片丙二醛(MDA)含量变化不显著。在低温胁迫后,酿酒葡萄幼苗叶片MDA的含量显著增加,说明低温造成膜的损伤。此外,经4℃低温胁迫处理的幼苗MDA含量高于12℃下的含量。低温胁迫后的幼苗转移至25℃恢复生长4 d后(第8天),各温度下MDA的含量均降低,4℃处理的幼苗MDA含量显著降低,但仍高于常温对照及12℃的MDA含量,恢复生长后在25℃、12℃和4℃处理之间MDA含量差异不显著。

注:T为低温胁迫0 d,T1为低温胁迫第4天,T2为恢复常温生长第4天。不同小写字母表示处理间差异显著(P<0.05 )。下同。Note: T is before low temperature treatment, T1 is the 4th day of low temperature stress, T2 is the 4th day after returning to normal temperature.Different letters mean significant difference by Duncan’s multiple range test (P<0.05). The same below.图2 低温胁迫对酿酒葡萄幼苗细胞膜稳定性和MDA含量的影响Fig.2 Effect of low temperature stress on membrane stabilityand MDA content of wine grape seedlings
2.2 低温胁迫对酿酒葡萄幼苗叶片抗氧化酶活性的影响
抗氧化酶具有将体内过氧化物转换为毒害较低或无害物质的功能。如图3A所示,低温胁迫后和恢复生长4 d后,常温条件下酿酒葡萄幼苗叶片的SOD活性无明显变化,但显著高于低温处理前叶片的SOD活性。低温胁迫均提高了酿酒葡萄幼苗叶片SOD活性,但低温胁迫程度不同,叶片SOD活性的增加程度也不同。经低温4℃处理的葡萄幼苗SOD活性显著高于12℃处理。恢复生长4d后(第8天),经过低温处理的葡萄幼苗叶片SOD活性均有所降低,与12℃低温相比,4℃低温胁迫处理的幼苗SOD活性较高,而4℃和12℃处理的幼苗SOD活性显著高于常温生长8 d处理,说明低温程度加剧会诱导更高水平的SOD。
如图3B所示,与低温处理0d相比,低温胁迫4d后和恢复生长4d后常温条件下生长的酿酒葡萄幼苗叶片的POD活性差异不显著。低温胁迫4d增加了叶片的POD活性,并且其活性随着低温程度的加剧而增加,但4℃和12℃低温胁迫处理间POD活性差异不显著。恢复生长4d后(第8天),经过低温胁迫处理的葡萄幼苗叶片POD活性均有所降低,4℃低温胁迫处理的幼苗POD活性仍略高于12℃处理,经低温胁迫后的所有幼苗的POD活性均低于对照组。

图3 低温胁迫对酿酒葡萄幼苗抗氧化酶活性和内源水杨酸含量的影响Fig.3 Effect of low temperature stress on antioxidant enzymes activity and endogenous salicylic acid content of wine grape seedlings
如图3C所示,常温条件下生长的酿酒葡萄幼苗叶片的CAT活性无明显变化,同POD活性变化趋势一致。低温胁迫均提高了酿酒葡萄幼苗叶片CAT活性,但低温胁迫程度不同,叶片CAT活性的增加幅度也不同,经4℃低温处理的葡萄幼苗的CAT活性明显高于12℃处理,12℃处理与常温处理之间CAT活性差异不显著。恢复生长4 d后(第8天),经过4℃低温处理的葡萄幼苗叶片CAT活性降低,而12℃处理的葡萄幼苗叶片CAT活性增加,但同低温胁迫后CAT活性相比差异不显著。低温胁迫处理后和恢复生长4 d后,4℃低温胁迫处理的幼苗CAT活性较12℃低温高,显著高于常温生长8 d下的CAT活性,12℃处理幼苗CAT活性也高于对照组,但差异不显著。这说明不同的低温会诱导不同程度CAT的积累。
2.3 低温胁迫对酿酒葡萄幼苗叶片内源水杨酸含量的影响
如图3D所示,与低温处理前相比,常温条件(25℃,CK)下生长4 d和8 d后的酿酒葡萄幼苗叶片SA含量有所增加,但是差异不显著。低温胁迫显著增加了酿酒葡萄幼苗叶片SA的含量,经4℃低温胁迫处理的幼苗SA含量显著高于12℃处理的含量。低温胁迫处理的幼苗转移至25℃恢复生长4 d后(T2),SA的含量相对于低温胁迫阶段均显著降低,但仍高于常温对照。
2.4 低温胁迫下葡萄幼苗叶片各生理指标的相关性及回归分析
在不同程度的低温胁迫处理后,6项抗寒指标两两相关性分析表明(表1),SA与MDA、POD、SOD、CAT均呈极显著正相关(P<0.01)。MDA与膜稳定指数负相关,与POD、SOD、CAT均呈极显著正相关(P<0.01)。膜稳定指数与CAT显著负相关(P<0.05),与SA、SOD、POD呈负相关但不显著(P>0.05)。其他指标之间的相关性大部分达到极显著(P<0.01)或显著正相关关系。MDA含量、SOD、CAT、POD活性与内源SA含量的回归方程如表2所示,MDA含量、SOD、CAT、POD活性与内源SA含量之间存在线性回归关系,保护酶活性受内源SA和低温信号的共同调控。

表1 葡萄叶片低温胁迫处理后各生理指标间相关系数Table 1 Correlation coefficients among the physiological indicators of grapevine leaves after low temperature stress treatment
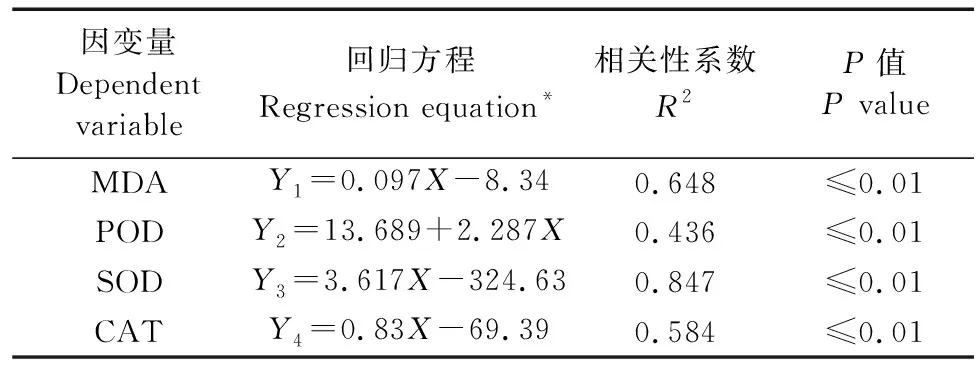
表2 低温胁迫下葡萄幼苗叶片内源SA含量与MDA、抗氧化酶活性间的逐步回归分析Table 2 Stepwise regression analysis between endogenous SA content and MDA and antioxidant enzyme activities in leaves of grape seedlings at low temperature
2.5 外源水杨酸处理对低温下葡萄幼苗叶片抗氧化酶活性的影响
如图4A、4B、4C所示,在葡萄幼苗叶片喷施0.5、1.0 mmol·L-1浓度的外源SA后,低温胁迫导致葡萄幼苗叶片中SOD、POD和CAT活性较对照显著增加。随着外源SA浓度的增加及低温胁迫持续时间的延长,SOD、POD和CAT活性增加,在外源SA浓度为1.0 mmol·L-1时SOD、POD和CAT活性最强。温度、外源SA及两者的交互作用对POD和SOD活性产生了极显著的影响(P<0.001),两者交互作用对CAT活性影响不显著(表3)。常温条件下喷施外源SA促进SOD、POD和CAT活性增加,但SOD活性在外源SA浓度为0.5 mmol·L-1与1.0 mmol·L-1之间差异不显著,与0 mmol·L-1SA浓度处理差异显著(图4A),POD和CAT活性在对照、不同SA浓度之间(常温)差异不显著(图4B、4C)。

表3 温度处理、外源SA及其交互作用对抗氧化酶活性影响的显著性分析Table 3 Significance analysis of temperature, exogenous salicylic acid and their interactions on antioxidant enzyme activity
低温胁迫处理2 d 和4 d,SOD和POD活性在不同浓度SA之间差异显著(图4A、4B),而低温胁迫处理2 d时CAT活性在SA浓度为0.5 mmol·L-1与1.0 mmol·L-1间差异不显著;低温胁迫处理4 d时 CAT活性增加,在SA浓度为0.5 mmol·L-1与1.0 mmol·L-1之间差异不显著(图4C)。低温胁迫4 d时,SOD、POD、CAT活性在SA浓度为1.0 mmol·L-1时比对照分别增加127.63%、190.00%和173.53%,而在SA浓度为0 mmol·L-1时比对照在低温胁迫4 d后SOD、POD、CAT活性分别增加102.88%、60.00%和137.5%,说明外源SA调控SOD、POD、CAT活性响应低温胁迫,其中POD活性增加最多。
2.6 外源水杨酸处理对低温下葡萄幼苗叶片内源水杨酸含量的影响
如图4D所示,在常温及低温条件(4℃)下喷施外源SA均增加了内源SA的含量。在对照组和外源SA处理组,低温胁迫显著增加了酿酒葡萄幼苗叶片内源SA含量,与常温处理相比,对照内源SA含量显著增加53.11%,外源SA处理显著增加80.36%。常温条件下外源SA处理比对照显著增加18.97%,而低温条件下SA处理组比对照组显著增加40.14%。说明在低温胁迫下外源SA处理更能促进内源SA积累。

图4 SA处理对低温下葡萄幼苗叶片抗氧化酶活性及内源SA含量的影响Fig.4 Effect of SA treatment on antioxidant enzyme activity and endogenous salicylic acid content of grape seedling leaves at low temperature
3 讨 论
低温是限制葡萄种植面积扩大的主要因素之一,由于北方冬季极端低温和春季冷害频发造成我国葡萄种植巨大的经济损失[19]。植物的抗寒能力可以通过不同的生理机制得到增强,其中抗氧化酶活性水平很大程度上影响植物对低温的耐受性,这些保护酶例如SOD、POD、CAT等能够通过调节逆境条件下植株体内产生的活性氧水平使其达到正常的平衡状态,进而增强植物抗寒性[20]。此外,活跃在植物体内微量的小分子物质也能诱导植物的耐受性,大量研究表明,外源SA可以诱导植物产生系统获得性抗性,同时还能诱导植物对非生物胁迫的抗性[21-22]。本试验通过研究不同程度低温对酿酒葡萄幼苗内源SA、MDA含量、保护酶活性以及细胞膜稳定性的影响,发现不同程度的低温均会诱导葡萄幼苗叶片细胞膜氧化程度加剧,膜稳定性减弱,抗氧化酶活性和内源SA含量逐渐积累。
MDA和膜稳定指数能够反映低温造成细胞膜完整性破坏的程度[23]。本研究发现低温逆境明显加剧了酿酒葡萄幼苗叶片细胞膜氧化程度,这与前人的研究结果基本一致[24]。此外低温胁迫程度越高,MDA的含量越多,细胞膜稳定指数下降越显著,这说明低温程度越高,细胞膜氧化损伤越大。植物体自身的抗氧化清除系统能够减缓非生物胁迫的危害,这是因为在低温信号的影响下,植物自身会积累超过稳态平衡的活性氧物质,对其生理产生极其严重的损害,此刻植物迅速提高抗氧化酶活性来清除过多的活性氧,但这种调节程度并不是无限制的[21]。本试验中葡萄幼苗在遇到低温胁迫时抗氧化酶SOD、POD、CAT活性显著提高,低温胁迫水平不同变化趋势也不一致,温度越低时酶活性就越高。植株恢复生长后抗氧化酶活性仍高于对照,表明这些保护酶活性受低温的调控,同时在保护植物生长过程中可能发挥了持续性的作用。本研究发现,低温下葡萄幼苗叶片的SA含量显著增加,低温水平越高,SA含量增加越显著。而在幼苗恢复生长时 SA含量显著大于对照,由此表明低温逆境可能会调控葡萄植株体内SA的生物合成,这与李亮等[25]对黄瓜的研究结果基本一致。
叶片上喷施SA显著提高了SOD、POD、CAT活性和内源SA含量。当SA浓度较低时,植物体内氧化和抗氧化作用会短期失衡,从而提高自身的抗氧化能力[26-28]。激素SA是植物线粒体介导的防御信号和程序性细胞死亡(PCD)的关键调节因子,调节植物线粒体活性氧代谢。植物遭受病原菌侵染时,SA参与一系列细胞防御以及非生物胁迫反应,其内源SA含量受到多种因素的调节。在本研究中,低温和外源SA均诱导内源SA的积累,而低温胁迫条件下内源SA与POD、SOD和CAT活性呈正相关,通过提高POD、SOD和CAT的活性来减轻低温胁迫对植物的不利影响,这表明SA通过减少ROS的积累和提高抗氧化酶的活性来影响植物的抗性,使它们能够在低温条件下生存。而外源施用SA引起的内源SA调控植物减缓低温胁迫对葡萄幼苗生长及生理的损伤,提高其抗寒能力还需从叶片微观形态特征、光合作用、渗透调节及内源激素、转录组学测序技术等方面进行后续的深入研究,分析SA信号与低温信号相关联共同调控葡萄抗逆性,揭示SA调控植物抗寒性的分子机制,并与大田试验相结合,细化外源SA喷施时间和喷施方式,确定最佳喷施方案,将是今后北方地区耐寒酿酒葡萄品种精准筛选和科学田间管理的重要研究领域和手段。
4 结 论
低温影响植物正常的生长和生理过程,并引起冷害和植物的死亡。本研究中不同程度低温胁迫导致葡萄幼苗叶片细胞膜稳定性下降,膜的氧化损伤加剧,诱导幼苗叶片抗氧化酶SOD、POD、CAT活性显著增加,内源SA含量积累;抗氧化酶活性和内源SA含量变化受低温胁迫水平的调节,在一定温度范围内,低温胁迫程度越大,幼苗叶片POD、SOD、CAT活性、内源SA含量增加越多。1 mmol·L-1外源性 SA是缓解低温胁迫影响的较佳喷施浓度,外源性SA的应用明显增加了低温下葡萄叶片的SOD、CAT和POD活性和内源SA的积累,有效减轻了低温胁迫对葡萄幼苗伤害。结合低温胁迫及外源SA对抗氧化酶SOD、POD、CAT活性及内源SA含量的影响,本研究认为低温胁迫及外源SA诱导植物积累更多的内源SA调控保护酶活性,SA在葡萄低温胁迫中发挥协同作用,降低ROS对细胞膜的伤害,提高葡萄对低温胁迫的耐受性。

