重度活动性狼疮性肾炎冲击治疗淋巴细胞亚群及血细胞比值变化
张丽君 李远 田芬 邢广群


[摘要] 目的
探讨重度活动性狼疮性肾炎(LN)病人大剂量糖皮质激素(激素)冲击治疗前后淋巴细胞亚群及血细胞比值的变化及其规律。
方法 重度活动性LN病人17例,在排除感染或充分治疗感染后,规范予以大剂量泼尼松龙冲击治疗。监测冲击治疗前后病人淋巴细胞亚群及血细胞比值的变化,评价淋巴细胞亚群及血细胞比值的特点及其与临床事件之间的关系。
结果 冲击治疗后血CD4+T淋巴细胞计数、自然杀伤细胞(NK)和T辅助/诱导细胞比例较冲击治疗前升高,B细胞和T抑制/细胞毒细胞比例、中性粒细胞/淋巴细胞比值(NLR)和血小板/淋巴细胞比值(PLR)较冲击治疗前下降,差异均有显著性(Z=-3.25~2.08,P<0.05)。初入院LN合并感染病人活化T感染细胞比例较未感染者升高,差异有显著性(Z=-2.27,P<0.05);控制感染后行激素冲击治疗,感染组的LN病人活化T感染细胞比例高于无感染病人,血CD4+T淋巴细胞计数及T辅助/诱导细胞比例低于未发生感染病人,差异有显著性(Z=-2.30~-1.97,P<0.05)。经冲击治疗后用淋巴细胞亚群各细胞预测感染时,血CD4+T淋巴細胞计数的受试者工作特征曲线下面积(AUC)最高,截断值为253.50×106/L,其预测LN感染的灵敏度和特异度分别为85.70%、83.30%。
结论 LN病人冲击治疗后血CD4+T淋巴细胞、NK细胞比例、B细胞及T抑制/细胞毒细胞比例、NLR和PLR均发生变化,且血CD4+T淋巴细胞计数对LN感染有一定的预测价值。
[关键词] 淋巴细胞亚群;红斑狼疮,系统性;狼疮肾炎;感染
[中图分类号] R593.241
[文献标志码] A
[文章编号] 2096-5532(2023)06-0802-06
doi:10.11712/jms.2096-5532.2023.59.199
[网络出版] https://link.cnki.net/urlid/37.1517.R.20240104.1649.010;2024-01-05 20:38:08
CHANGES OF LYMPHOCYTE SUBSETS AND BLOOD CELL RATIOS IN PATIENTS WITH SEVERE ACTIVE LUPUS NEPHRITIS AFTER STRESS-DOSED GLUCOCORTICOID TREATMENT
ZHANG Lijun, LI Yuan, TIAN Fen, XING Guangqun
(Department of Nephrology,The Affiliated Hospital of Qingdao University, Qingdao 266555, China)
; [ABSTRACT]ObjectiveTo investigate the changes in lymphocyte subpopulations and blood cell ratios in patients with severe active lupus nephritis (LN) before and after stress dosing of glucocorticoids.
MethodsSeventeen patients with severe active LN were given standardized stress dosing of prednisolone after excluding infection or receiving sufficient anti-infection treatment. The patients were monitored for lymphocyte subsets and blood cell ratios before and after high-dose prednisolone therapy to analyze the changes of lymphocyte subsets and blood cell ratios as well as the relationship between these parameters and clinical events.
ResultsAfter prednisolone treatment, blood CD4+ T lymphocyte count, natural killer cells (NK) percentage, and helper/inducer T cell percentage were significantly increased, while B cell percentage, suppressor/cytotoxic T cell percentage, neutrophil/lymphocyte ratio (NLR), and platelet/lymphocyte ratio (PLR) were significantly decreased (Z=-3.25 to 2.08,P<0.05). The proportion of activated T cells was significantly higher in patients with LN with infection than in those without infection at admission (Z=-2.27,P<0.05). After prednisolone therapy, the infection group showed a significantly higher activated T cell percentage, a significantly lower CD4+ T lymphocyte count, and a significantly lower helper/inducer T cell percentage compared with non-infection group (Z=-2.30 to -1.97,P<0.05). When using lymphocyte subsets to predict infection after prednisolone therapy, blood CD4+ T lymphocyte count had the highest area under the receiver operator characteristic curve, with a cut-off value of 253.50×106/L, sensitivity of 85.70%, and specificity of 83.30%.
ConclusionThere were changes in blood CD4+ T lymphocyte count, the percentages of NK cells, B cells, and suppressor/cytotoxic T cells, NLR, and PLR in patients with LN after stress-dosed glucocorticoid treatment. Blood CD4+ T lymphocyte count shows moderate predictive value for infection in LN.
[KEY WORDS]lymphocyte subsets; lupus erythematosus, systemic; lupus nephritis; infections
系统性红斑狼疮(SLE)是多种免疫机制参与的慢性自身免疫性疾病,病因复杂、机制不明[1],肾脏是SLE常见的受累器官,表现为免疫复合物的沉积和肾脏炎症,称为狼疮性肾炎(LN)。糖皮质激素(简称激素)广泛应用于LN的治疗,大剂量激素冲击治疗在急性肾功能衰竭、神经精神狼疮等重症病人中应用较多[2-3]。淋巴细胞、自然杀伤细胞(NK细胞)在LN发病机制中起着重要作用[4-5],但淋巴细胞亚群在不同治疗节点的意义并不确定。本文研究了经2000年系统性红斑狼疮疾病活动度评分量表(SLEDAI-2000)确定为重度活动LN病人应用大剂量泼尼松龙冲击治疗前后淋巴细胞亚群及血细胞比值的变化,探讨其对疾病活动性的判断价值、治疗决策的指导价值及感染发生的预测价值,以精准指导临床治疗。现报告如下。
1 材料与方法
1.1 一般资料
回顾性分析2015年1月—2021年4月于我院肾病科初治重症LN病人17例临床资料,17例LN病人中,男4例,女13例;发病年龄为18~36岁,平均(24.94±10.58)岁。诊断均符合2019年欧洲抗风湿病联盟/美国风湿病学会制订的SLE诊断标准[6]。以SLEDAI-2000评分作为评价LN活动程度的指标[6],分为轻度活动(SLEDAI-2000评分≤6)、中度活动(SLEDAI-2000评分7~12)、重度活动(SLEDAI-2000评分>12)[7]。病人排除标准:①出院诊断为获得性免疫缺陷综合征、肾移植状态、妊娠状态;②合并其他结缔组织病、其他肾小球疾病、血液系统疾病和恶性肿瘤;③既往曾长期应用激素和免疫抑制剂。
1.2 研究方法
所有病人均给予规范大剂量激素冲击治疗。分别于治疗前及治疗后检测病人血清肌酐(Scr)、血清清蛋白(ALB)、红细胞沉降率(ESR)、C-反应蛋白(CRP)、降钙素原(PCT)、D-二聚体、血常规、尿常规、24 h尿蛋白定量、补体C3、补体C4、ds-DNA、病原学检查等免疫及生化指标,并评估病人SLEDAI-2000评分;同时应用慢性肾脏病流行病学协作公式(CKD-EPI)计算病人估计肾小球滤过率(eGFR)。
1.3 统计学方法
应用SPSS 25.0软件进行统计学分析,计量资料以±s或M(QR)表示,数据间比较采用t检验、Wilcoxon符号秩和检验或Mann-Whitney U檢验;计数资料以率(百分比)表示,数据间比较采用卡方检验或校正的卡方检验。相关性分析采用Pearson相关性分析,采用 GraphPad Prism 8软件绘制相关性图及受试者工作特征(ROC)曲线。以P<0.05为差异有显著性。
2 结 果
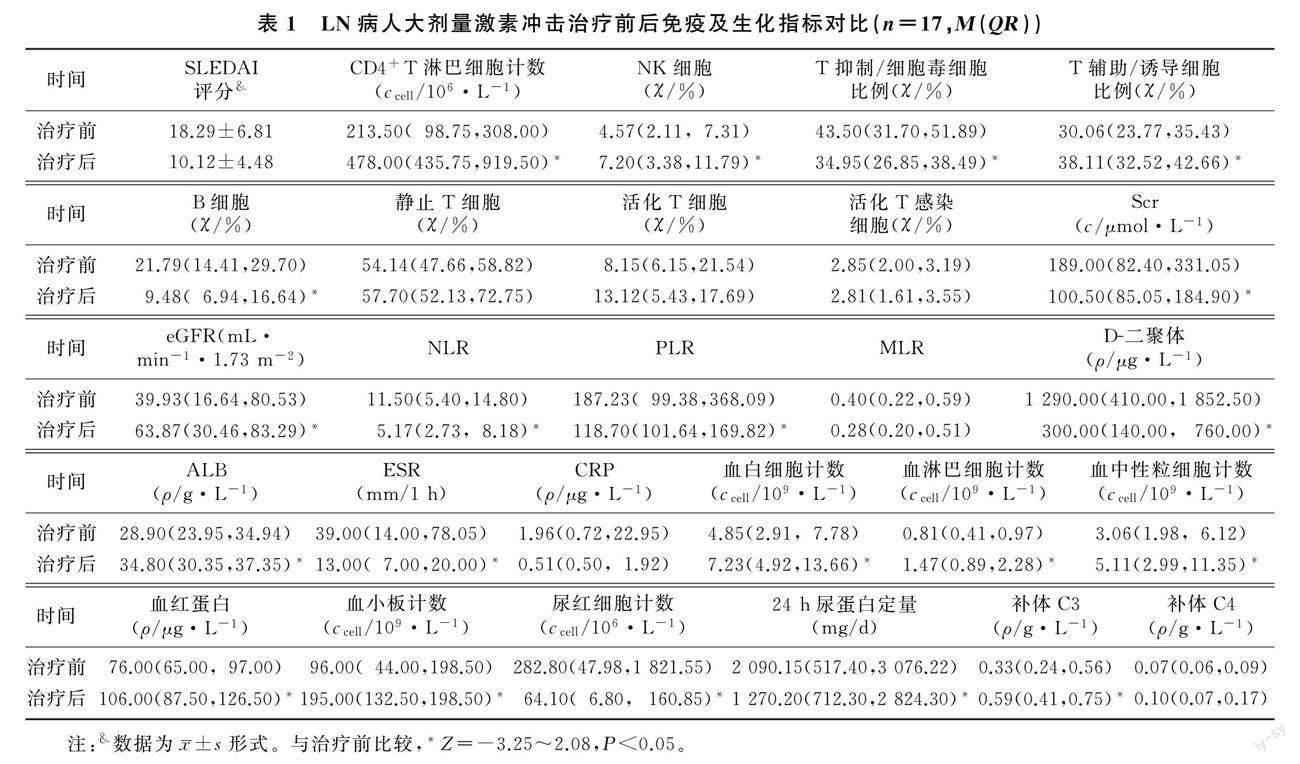
2.1 大剂量激素冲击治疗前后病人免疫及生化指标比较
本文重症LN病人在冲击治疗后B细胞、T抑制/细胞毒细胞比例及中性粒细胞/淋巴细胞比值(NLR)、血小板/淋巴细胞比值(PLR)均低于冲击治疗前,差异有统计学意义(Z=-3.05~2.08,P<0.05);外周血CD4+T淋巴细胞计数、NK细胞及T辅助/诱导细胞比例、ALB、补体C3、血小板计数、白细胞计数、血红蛋白、淋巴细胞计数均高于冲击治疗前,差异有统计学意义(Z=-3.25~-2.43,P<0.05);激素冲击治疗后的eGFR、Scr、D-二聚体较治疗前均显著改善,差异有显著性(Z=-2.43~2.05,P<0.05)。见表1。大剂量激素冲击治疗前LN病人血CD4+T淋巴细胞计数(r=-0.53,P=0.04)、NK细胞(r=-0.85,P=0.01)及T辅助/诱导细胞比例(r=-0.55,P=0.02)与SLEDAI评分均呈显著负相关;B细胞、T抑制/细胞毒细胞比例及PLR与SLEDAI评分均呈显著正相关(r=0.23~0.57,P<0.01);NLR、MLR与SLEDA2评分无相关性(P>0.05)。见图1。
2.2 LN病人感染组与非感染组临床资料比较
初入院治疗前LN合并感染病人活化T感染细胞比例及CRP高于无感染者,差异有显著意义(Z=-2.27、-2.49,P<0.05);积极控制感染进行激素冲击治疗后,发生感染的LN病人血CD4+T淋巴细胞计数及T辅助/诱导细胞比例低于未合并感染病人,活化T感染细胞比例及CRP高于未感染病人,差异有显著性(Z=-2.30~-1.97,P<0.05)。见表2。
2.3 淋巴细胞亚群及血细胞比值对LN合并感染的预测价值
以LN病人大剂量激素冲击治疗后是否发生感染为状态变量,分别以血CD4+T淋巴细胞计数、活化T感染细胞、T辅助/诱导细胞比例、CRP、血淋巴细胞为检验变量绘制ROC曲线,结果显示,以CD4+T淋巴细胞计数的AUC值最高,截断值(cut-off值)为253.50×106/L,其预测LN感染的灵敏度、特异度分别为85.70%、83.30%。见表3和图2。
3 讨 论
LN除了自身反应性B细胞激活,还涉及许多其他类型免疫细胞的失调,包括CD4+T淋巴细胞、NK细胞和中性粒细胞等[8-9]。研究发现,CD4+、CD8+T淋巴细胞亚群分布紊乱和活化异常,可能是导致B细胞活化产生多种自身抗体,自身免疫持续存在的原因[10-11]。
SLE病人中CD4+T细胞和NK细胞亚群减少,其NKG2A和NKG2D表达异常,可能均在SLE的病因中起作用[17]。
近年来研究发现,外周血中NLR、PLR以及MLR的变化与SLE疾病活动密切相关[13-14]。
本研究结果显示,LN活动时CD4+T淋巴细胞计数下降,推測与其异常凋亡及自身抗体的产生有关。研究发现,CD4+T淋巴细胞的异常变化与LN
的发病和疾病进展密切相关[15]。HUGHES等[16]研究显示,CD4+T淋巴细胞的DNA甲基化缺陷可导致SLE的发生,运用2-脱氧-D-葡萄糖和二甲双胍抑制CD4+T淋巴细胞的代谢
可使LN的特异性标志物转阴[17]。
SOLOVIOVA等[18]的研究结果显示,CD8+T细胞主要通过消除活化的B细胞及阻止自身反应性B细胞的再扩增来发挥下调B细胞作用,免疫耐受性被打破后,SLE病人CD8+T细胞功能明显下降,最终无法下调B细胞而使其持续活化产生自身抗体,参与SLE疾病发生及发展[19-20]。本文研究结果显示,LN活动时CD8+T淋巴细胞比例升高,与相关研究结果相一致。
本文研究显示,LN活动期B细胞及细胞毒性T细胞比例升高,这可能是血清中升高的IL-10刺激细胞毒性T细胞和B细胞的生长和分化,促进自身反应性B细胞的存活,进一步刺激自身抗体产生
所致[21-22];NK细胞产生细胞因子及脱颗粒功能受限,使NK细胞的细胞毒性功能障碍[23];CRUZ-GONZLEZ等[24]对SLE病人外周血NK细胞的数量及NK细胞受体和共刺激分子的表达分析发现,循环中NK细胞数量减少,NK细胞调节功能受损。本研究结果与其一致。
本文研究同时检测了3组血细胞比值NLR、PLR以及MLR的变化,结果显示,大剂量泼尼松龙冲击治疗后三者均较冲击治疗前下降。组织中中性粒细胞浸润是弥漫增殖性狼疮肾炎的标志[25],肿瘤的形成可能与dsDNA自身抗原的来源有关[26],活动性LN病人外周血中存在抗淋巴细胞抗体,导致循环中淋巴细胞减少,作为两者比率的NLR升高,NLR作为反映炎症的良好指标,可在一定程度上预测感染。QIN等[27]研究显示,NLR与炎症标志物、自身抗体、LN及SLEDAI评分相关,本文研究结果与其一致,说明NLR可预测LN的活动度。PLT可通过释放可溶性炎症递质或通过与免疫细胞的相互作用来调节免疫系统,活化的血小板进一步促进炎症细胞因子的释放,其与单核细胞结合后表现出协同刺激作用,使抗体的可结晶段(Fc)受体分子上调,IL-10分泌增加促使抗体产生及炎症反应,推测PLR可以反映疾病的活动水平[28]。综上,LN病人重度活动时血CD4+T淋巴细胞计数、NK细胞、T辅助/诱导细胞比例下降,B细胞、T抑制/细胞毒细胞比例及NLR、PLR升高,此时需积极应用激素和免疫抑制剂治疗原发病。经大剂量激素冲击治疗后,免疫失衡得以纠正。
处于疾病活动期的SLE病人更容易发生感染[29],而感染又可诱导SLE病情加重[26],因此临床上鉴别SLE活动期和感染存在一定难度。本研究结果显示,初入院LN合并感染病人活化T感染细胞比例及CRP较无感染者高;冲击治疗后发生感染的LN病人血CD4+T淋巴细胞计数、T辅助/诱导细胞比例低于未合并感染病人,活化T感染细胞比例高于未感染病人,这可能与泼尼松龙的使用有关[31]。本文ROC曲线分析显示,血CD4+T淋巴细胞计数的AUC值最高,cut-off值为253.50×106/L,该指标预测LN感染的灵敏度、特异度分别为85.70%、83.30%。因此,在临床工作中,对于经过激素冲击治疗的病人,血CD4+T淋巴细胞计数、T辅助/诱导细胞比例下降,活化T感染细胞比例升高时,应高度警惕感染的发生。
综上所述,重度活动LN病人初诊及大剂量激素冲击治疗后淋巴细胞亚群的变化如下:①处于重度活动期时,血CD4+T淋巴细胞计数、NK细胞、T辅助/诱导细胞比例下降,B细胞、T抑制/细胞毒细胞比例及PLR升高,是SLE病人重度免疫异常激活的结果,此时CD4+T淋巴细胞水平下降,需要结合症状体征及CRP做出判断,若无感染症状及体征且CRP正常,在初诊时重度活动的LN病人,即使CD4+T淋巴细胞计数低,也应积极应用激素冲击治疗。及时的大剂量激素冲击治疗后,异常激活的B淋巴细胞被抑制,免疫紊乱被纠正,CD4+T淋巴细胞水平逐渐升高。②激素冲击治疗后感染发生的概率增加。合并感染的SLE病人血CD4+T淋巴细胞计数、T辅助/诱导细胞比例均低于无感染者,活化T感染细胞比例高于无感染者。激素冲击治疗后血CD4+T淋巴细胞计数低于253.50×106/L,T辅助/诱导细胞比例低于30.32%时,应格外警惕感染的发生。本文研究选取重度活动的LN病人,通过监测冲击治疗前后两个时间点淋巴细胞亚群及血细胞比值的变化,了解淋巴细胞亚群各细胞在识别疾病活动及感染中的意义。在SLE活动时应果断应用激素及免疫抑制剂治疗,以调节失衡的自身免疫,减轻病损;并通过监测淋巴细胞亚群及血细胞比值的变化早期识别感染易感状态,及时调整后续激素和免疫抑制剂的应用,防止感染发生。
本研究也存在一定的局限性:①虽然本中心诊治的SLE病人较多,但符合纳入及排除标准的研究人群却较少;②本研究纳入的均为重症LN病人,存在选择偏倚,可能会对结果造成一定影响,后期需大样本临床研究进一步证实。
[参考文献]
[1]TEKTONIDOU M G, LEWANDOWSKI L B, HU J X, et al. Survival in adults and children with systemic lupus erythematosus: a systematic review and Bayesian meta-analysis of stu-
dies from 1950 to 2016[J]. Annals of the Rheumatic Diseases, 2017,76(12):2009-2016.
[2]鐵宁. 糖皮质激素冲击治疗对女性系统性红斑狼疮患者代谢及免疫功能的影响分析[J]. 中国医学前沿杂志(电子版), 2017,9(10):149-152.
[3]KUHN A, BONSMANN G, ANDERS H J, et al. The diagnosis and treatment of systemic lupus erythematosus[J]. Deutsches Arzteblatt International, 2015,112(25):423-432.
[4]WIESIK-SZEWCZYK E, RUTKOWSKA E, KWIECIE I, et al. Patients with common variable immunodeficiency complicated by autoimmune phenomena have lymphopenia and reduced treg, Th17, and NK cells[J]. Journal of Clinical Medicine, 2021,10(15):3356.
[5]LIN S J, CHEN J Y, KUO M L, et al. Effect of interleukin-15 on CD11b, CD54, and CD62L expression on natural killer cell and natural killer T-like cells in systemic lupus erythematosus[J]. Mediators of Inflammation, 2016,2016:9675861.
[6]ARINGER M, COSTENBADER K, DAIKH D, et al. 2019 European league against rheumatism/American college of rheumatology classification criteria for systemic lupus erythematosus[J]. Arthritis & Rheumatology (Hoboken, N J), 2019,71(9):1400-1412.
[7]中华医学会风湿病学分会,国家皮肤与免疫疾病临床医学研究中心,中国系统性红斑狼疮研究协作组. 2020中国系统性红斑狼疮诊疗指南[J]. 中华内科杂志, 2020,59(3):172-185.
[8]MAKIYAMA A, CHIBA A, NOTO D, et al. Expanded circulating peripheral helper T cells in systemic lupus erythematosus: association with disease activity and B cell differentiation[J]. Rheumatology (Oxford, England), 2019,58(10):1861-1869.
[9]MOREL L. Immunometabolism in systemic lupus erythematosus[J]. Nature Reviews Rheumatology, 2017,13(5):280-290.
[10]DING Y, LIAO W, HE X J, et al. Effects of 1,25(OH)2D3 and vitamin D receptor on peripheral CD4+/CD8+ double-po-
sitive T lymphocytes in a mouse model of systemic lupus erythematosus[J]. Journal of Cellular and Molecular Medicine, 2017,21(5):975-985.
[11]UGARTE-GIL M F, SNCHEZ-ZIGA C, GAMBOA-CRDENAS R V, et al. Circulating CD4+CD28null and extra-thymic CD4+CD8+ double positive T cells are independently associated with disease damage in systemic lupus erythematosus patients[J]. Lupus, 2016,25(3):233-240.
[12]KIM H A, JUNG J Y, SUH C H. Usefulness of neutrophil-to-lymphocyte ratio as a biomarker for diagnosing infections in patients with systemic lupus erythematosus[J]. Clinical Rheumatology, 2017,36(11):2479-2485.
[13]FALASINNU T, O'SHAUGHNESSY M M, TROXELL M L, et al. A review of non-immune mediated kidney disease in systemic lupus erythematosus: a hypothetical model of putative risk factors[J]. Seminars in Arthritis and Rheumatism, 2020,50(3):463-472.
[14]LAWSON B R, KOUNDOURIS S I, BARNHOUSE M, et al. The role of alpha beta+ T cells and homeostatic T cell proli-
feration in Y-chromosome-associated murine lupus[J]. Journal of Immunology (Baltimore, Md:1950), 2001,167(4):2354-2360.
[15]HUGHES T, SAWALHA A H. The role of epigenetic variation in the pathogenesis of systemic lupus erythematosus[J]. Arthritis Research & Therapy, 2011,13(5):245.
[16]YIN Y M, CHOI S C, XU Z W, et al. Normalization of CD4+ T cell metabolism reverses lupus[J]. Science Translational Medicine, 2015,7(274):274ra18.
[17]LI W X, PAN H F, HU J L, et al. Assay of T- and NK-cell subsets and the expression of NKG2A and NKG2D in patients with new-onset systemic lupus erythematosus[J]. Clinical Rheumatology, 2010,29(3):315-323.
[18]SOLOVIOVA K, PULIAEVA I, PULIAIEV M, et al. B cell depletion in murine lupus using cytotoxic T lymphocytes in vivo: feasibility and benefit[J]. Cellular Immunology, 2020,353:104117.
[19]ICHINOSE K, UMEDA M, KOGA T, et al. The potential role of CD4+CD52lo T-cell populations in systemic lupus erythematosus[J]. Clinical Immunology, 2019,200:35-36.
[20]赵雪峰,郭翎飞,李健,等.系统性红斑狼疮伴肺部感染患者外周血T淋巴细胞和NK细胞水平及其临床意义[J]. 中华医院感染学杂志, 2021,31(3):376-380.
[21]GEGINAT J, VASCO M, GEROSA M, et al. IL-10 producing regulatory and helper T-cells in systemic lupus erythematosus[J]. Seminars in Immunology, 2019,44:101330.
[22]PENG H, WANG W, ZHOU M, et al. Role of interleukin-10 and interleukin-10 receptor in systemic lupus erythematosus[J]. Clinical Rheumatology, 2013,32(9):1255-1266.
[23]HUMBEL M, BELLANGER F, FLUDER N, et al. Restoration of NK cell cytotoxic function with elotuzumab and daratumumab promotes elimination of circulating plasma cells in patients with SLE[J]. Frontiers in Immunology, 2021,12:645478.
[24]CRUZ-GONZLEZ D J, GMEZ-MARTIN D, LAYSECA-ESPINOSA E, et al. Analysis of the regulatory function of natural killer cells from patients with systemic lupus erythematosus[J]. Clinical and Experimental Immunology, 2018,191(3):288-300.
[25]NOWLING T K, GILKESON G S. Mechanisms of tissue injury in lupus nephritis[J]. Arthritis Research & Therapy, 2011,13(6):250.
[26]MOULTON V R, SUAREZ-FUEYO A, MEIDAN E, et al. Pathogenesis of human systemic lupus erythematosus: a cellular perspective[J]. Trends in Molecular Medicine, 2017,23(7):615-635.
[27]QIN B D, MA N, TANG Q Q, et al. Neutrophil to lymphocyte ratio (NLR) and platelet to lymphocyte ratio (PLR) were useful markers in assessment of inflammatory response and disease activity in SLE patients[J]. Modern Rheumatology, 2016,26(3):372-376.
[28]KRAL J B, SCHROTTMAIER W C, SALZMANN M, et al. Platelet interaction with innate immune cells[J]. Transfusion Medicine and Hemotherapy, 2016,43(2):78-88.
[29]李海劍,刘慧,陶雅非,等. 系统性红斑狼疮继发感染患者淋巴细胞亚群及CD64指数的检测意义分析[J]. 中华医院感染学杂志, 2016,26(24):5619-5621.
[30]PEGO-REIGOSA J M, NICHOLSON L, POOLEY N, et al. The risk of infections in adult patients with systemic lupus erythematosus: systematic review and meta-analysis[J]. Rheumatology (Oxford, England), 2021,60(1):60-72.
[31]宋建玲. 大剂量激素冲击治疗重症狼疮患者感染分析[J]. 昆明医科大学学报, 2014,35(10):127-130.
(本文编辑 黄建乡)

