嗜热菌筛选及其促进沼渣和虫粪共堆肥的效果
肖小兰,张 浩,付传僡,刘 皓,阮文权,*
(1.江南大学 环境与土木工程学院,江苏 无锡 214122; 2.英塞克高效生态农业综合开发有限公司,江苏 苏州 215636)
日常生活、餐饮服务和食品生产等活动会产生大量的餐厨垃圾。据报道,我国餐厨垃圾年产量达9 000万t[1]。餐厨垃圾具有含水率高、易腐烂等特点,易对生态环境造成严重危害[2]。餐厨垃圾经高温蒸煮和三相分离后产生有机浆液和有机固渣,其中,有机浆液经厌氧消化可将有机物转化为沼气能量。然而,厌氧消化周期性排泥会产生大量沼渣(即餐厨有机浆液厌氧沼渣)。这些沼渣含水率高,碳氮比失衡,难以处理。有机固渣含有丰富的蛋白质和碳水化合物,可利用黑水虻幼虫将其转化为具有高附加值的昆虫体蛋白[3],并排出代谢产物(即黑水虻虫粪),但虫粪存在盐度高、恶臭和水分含量高等特点[4],仍需进一步处理。共堆肥可将多种有机固体废弃物分解转化为稳定的腐殖质,形成营养丰富的有机肥料[5],是处理餐厨有机浆液厌氧沼渣和黑水虻虫粪的理想方法。
根据堆肥过程中温度的变化,可将堆肥分为4个时期——升温期、高温期、降温期和腐熟期。其中,高温期是有机物降解的主要阶段。其间,蛋白质、多糖、木质纤维素等物质被微生物分解,堆肥体积明显减小,虫卵、病原菌被灭活。高温期的嗜热微生物是决定堆肥质量的关键因素。然而,Nakasaki等[6]报道,细菌和真菌的丰富度和多样性在高温期均降低。这不利于有机物的高效降解。近来,研究人员尝试在堆肥中接种嗜热菌剂,以期提高堆肥质量。李昌宁等[7]发现,向猪粪堆肥中接种耐高温菌剂可使高温期提前2 d,并延长高温期2 d,可加快堆肥腐熟;钱玉婷等[8]向鸡粪堆肥中接种嗜热菌剂,总养分(N+P2O5+K2O)含量提高了5.03%,种子发芽指数提高了21.73%;王玉等[9]在猪粪堆肥中接种极端嗜热菌剂,种子发芽指数和胡富比分别提高了35.9%和21.3%,改善了堆肥品质。由此可见,在堆肥中接种嗜热菌剂可延长堆肥高温期,减少植物毒性,增强堆肥的腐殖化程度,提高产品肥效。然而,也有研究表明,接种菌剂对堆肥没有效果[10]。主要原因是,相较于堆肥原生境的微生物,接种的外源微生物对堆肥环境的适应性较差,无法达到预期效果[9]。为了减少接种菌剂和土著微生物之间的拮抗作用,不少研究直接以原堆肥样品为菌种来源,优选功能微生物制成菌剂进行接种。徐谞等[11]从猪粪堆肥高温期筛选了3株芽孢杆菌并进行接种,有效促进了猪粪堆肥的发酵腐熟;Xu等[12]从牛粪-甘蔗叶堆肥中筛选并复配多功能复合嗜热菌剂,将其接种回牛粪—甘蔗叶堆肥后,提高了细菌和真菌群落的复杂性和多样性。这说明,从堆肥原生境中筛选、富集和培养土著微生物,将其制备成菌剂后再接种到原堆肥中,可能在维持菌剂有效性、提高堆肥质量上具有一定的积极作用。
目前,国内外关于通过共堆肥方式处理餐厨有机浆液厌氧沼渣与黑水虻虫粪的研究较少,而且,这二者在共堆肥的过程中存在高温期较短、降解不充分等问题。为此,本文从餐厨有机浆液厌氧沼渣和黑水虻虫粪共堆肥高温期筛选能够耐高温,同时在降解有机物方面具有优势的细菌和真菌,将其复配成嗜热菌剂接种回共堆肥中,监测共堆肥过程中理化性质、有机质降解率、种子发芽指数、腐殖质组成和含量、三维荧光光谱的变化,探讨其对共堆肥效果的影响,并通过高通量测序分析接种嗜热菌剂对堆肥过程中微生物群落结构的影响,旨在为促进有机固废的优质堆肥提供参考。
1 材料与方法
1.1 试验原料
1.1.1 堆肥原料
沼渣系张家港某餐厨垃圾处理厂餐厨有机浆液厌氧沼渣发酵沼气池(全混式厌氧发酵工艺)内污泥混合液经过离心脱水后的固渣;黑水虻虫粪和水稻秸秆取自张家港某黑水虻养殖场。将水稻秸秆搅碎至1 cm左右长度,用于调节堆肥的碳氮比和孔隙度。
将上述堆肥原料的基础理化性质整理于表1。

表1 堆肥原料的基础理化性质
1.1.2 培养基
LB固体培养基:胰蛋白胨10 g·L-1,酵母浸膏5 g·L-1,氯化钠10 g·L-1,琼脂18 g·L-1。
LB液体培养基:胰蛋白胨10 g·L-1,酵母浸膏5 g·L-1,氯化钠10 g·L-1。
孟加拉红培养基:蛋白胨5 g·L-1,葡萄糖10 g·L-1,琼脂20 g·L-1,磷酸二氢钾1 g·L-1,硫酸镁0.5 g·L-1,氯霉素0.1 g·L-1,孟加拉红0.033 g·L-1。
马铃薯葡萄糖肉汤(PDB)培养基:马铃薯200 g·L-1,葡萄糖20 g·L-1。
1.2 菌种来源与嗜热菌剂制备
1.2.1 嗜热菌分离
取餐厨有机浆液厌氧沼渣和黑水虻虫粪共堆肥高温期样品10 g于250 mL锥形瓶中,加入90 mL经灭菌处理的0.9%氯化钠溶液,振荡30 min,得到浓度为10-1的菌液。随后,在无菌操作台中梯度稀释,得到浓度依次为10-2、10-3、…、10-9的菌液。将菌液涂布到LB固体培养基(筛选细菌)和孟加拉红培养基(筛选真菌)上,50 ℃恒温培养。长出菌落后,挑选形态不同的单菌落进一步划线纯化,获得纯度较高的单菌落。将细菌接种至LB液体培养基中培养(50 ℃,120 r·min-1)至对数生长期,然后置于体积分数50%的甘油中,-20 ℃保存。真菌采用斜面低温保藏法,在-20 ℃条件下保存。
1.2.2 菌株酶活检测
采用糖化酶测试盒、碱性蛋白酶测试盒、脲酶测试盒、纤维素酶/羧甲基纤维素酶测试盒、碱性木聚糖酶测试盒和漆酶测试盒(均购自苏州科铭生物技术有限公司)进行粗酶液提取和菌株相应酶活的检测。其中,糖化酶活性以每1 min分解可溶性淀粉产生1 mg葡萄糖所需酶量为1个酶活单位,蛋白酶活性以每1 min催化水解酪蛋白溶液产生1 nmol酪氨酸为1个酶活单位,脲酶活性以每1 min水解尿素产生1 μg NH3-N为1个酶活单位,纤维素酶活性以每1 min催化水解羧甲基纤维素钠产生1 μg葡萄糖为1个酶活单位,木聚糖酶活性以每1 min分解木聚糖产生1 nmol还原糖所需酶量为1个酶活单位,漆酶活性以每1 min氧化1 nmol底物ABTS[2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐]所需酶量为1个酶活单位。
1.2.3 菌种鉴定
综合酶活指标,优选耐高温菌株送至生工生物工程(上海)股份有限公司测序。其中,16S rDNA数据在核糖体数据库中进行比对,ITS序列信息在NCBI数据库上进行Blast比对。
1.2.4 嗜热菌剂制备
将优选的细菌菌株在LB液体培养基中培养(50 ℃,120 r·min-1)2 d,得到微生物悬浮液。将优选的真菌菌株在PDB培养基中培养(50 ℃,120 r·min-1)5 d,得到微生物悬浮液。将不同微生物悬浮液等体积混合,制得嗜热菌剂,其有效活菌数≥1×108mL-1。
1.3 堆肥设计与样品采集
以餐厨有机浆液厌氧沼渣和黑水虻虫粪为原料,以(水稻)秸秆为调理剂,按照沼渣、虫粪、秸秆质量比3∶1∶4的比例(以湿重计)进行共堆肥[碳氮比(C/N)约为25],补充蒸馏水,调节含水率至60%左右。堆料混合均匀后,放入25 L塑料桶。堆肥共持续30 d,前14 d每隔2 d人工翻堆1次,之后每隔4 d人工翻堆1次,以保证充足的氧气。分别在堆肥的第2天和第8天,按堆料干重的5%接种嗜热菌剂,将其作为接种组(T);空白组(CK)中加入等量的LB液体培养基和PDB培养基混合液(体积比1∶1)。接种组和空白组各设置3组平行。在试验的0、2、5、10、15、20、25、30 d采用五点取样法取样。样品一部分在4 ℃ 贮藏,用于测定pH值、根长、种子发芽率,及有机质、溶解性有机碳(DOC)、腐殖质(HS)、胡敏酸(HA)、富里酸(FA)含量;一部分在-20 ℃贮藏,用于高通量测序。参照文献[13]的方法计算种子发芽指数(GI)。
1.4 分析方法
1.4.1 物理化学性质分析
用T-115型电子温度计(深圳市拓尔为电子科技有限公司)测定堆体温度。将样品在105 ℃条件下烘至恒重,测定含水率。将样品置于马弗炉中,600 ℃持续6 h,测定有机质含量。按照白玲等[14]所用方法提取和测定DOC。参照Zhang等[13]报道,测定pH值、GI,以及总碳(TC)、总氮(TN)、P2O5、K2O含量。其中,测定GI所用种子为黑麦草种子,发芽天数为3 d。腐殖质、富里酸和胡敏酸含量按照Wu等[15]所用方法进行提取和测定。
1.4.2 三维荧光光谱分析
将堆肥样品与去离子水按照1∶10的质量体积比混合,150 r·min-1振荡2 h,然后将悬浮液在4 000 r·min-1离心5 min,用0.45 μm水系膜过滤。所得滤液按相同比例稀释后,用F-7000型荧光分光光度计(日本Hitachi)测定三维荧光光谱。扫描速度设置为12 000 nm·min-1,电压为600 V,激发波长(EX)为200~450 nm,发射波长(EM)为250~550 nm,激发增量均为5 nm,狭缝均设置为5 nm。
1.4.3 高通量测序分析
使用Qiagen DNeasy PowerSoil Kit 试剂盒(上海Qiagen)提取接种组和空白组第5、15、30天样品的微生物DNA。用于细菌高通量测序的引物为341F(5′-CCTACGGGGNGGCWGCAG-3′)和805R(5′-GACTACHVGGTATCTACC-3′),用于真菌高通量测序的引物为ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2(5′-GCTGCGTTCTTCATCGATGC-3′)。PCR反应体系(20 μL):5×FastPfu缓冲液4 μL,2.5 mmol·L-1dNTPs 2 μL,引物(5 μmol·L-1)各0.8 μL, FastPfu聚合酶0.4 μL,模板DNA 10 ng,不足部分用ddH2O补齐。测序平台为Illumina MiSeq。
1.5 数据统计
使用Excel 2016软件整理数据,使用Origin 2018软件作图。
2 结果与分析
2.1 嗜热菌的筛选与鉴定
从共堆肥高温期样品中共分离、纯化得到4株细菌和4株真菌,将得到的细菌菌株分别命名为B1、B2、B3和B4,真菌菌株分别命名为F1、F2、F3和F4。
据报道,嗜热菌产生的降解酶具有较好的热稳定性,能够在高温期更有效地降解有机物和杀死病原微生物[9]。对分享得到的8株嗜热菌的酶活进行测定(图1)。对于分离到的细菌菌株来说,B2和B4的糖化酶、纤维素酶、漆酶、脲酶、蛋白酶和木聚糖酶的活性均高于B1和B3,表明相较于另外2株细菌菌株,B2和B4在堆肥高温期可更高效地降解葡萄糖、蛋白质和木质纤维素等有机物。对于分离到的真菌菌株来说,F1、F2、F3和F4的糖化酶活性分别为13.29、15.03、12.61、11.28 U·mL-1,说明其都具有一定的葡萄糖降解能力。但是,F1和F2的纤维素酶和漆酶活性要高于F3和F4,说明这2株真菌在堆肥高温期可更高效地降解木质纤维素。此外,对比细菌和真菌的酶活发现,细菌在降解葡萄糖、蛋白质、尿素和木聚糖方面更具优势,而真菌降解木质纤维素的能力更强。综上,选择B2、B4、F1和F2为接种菌株用于后续试验。
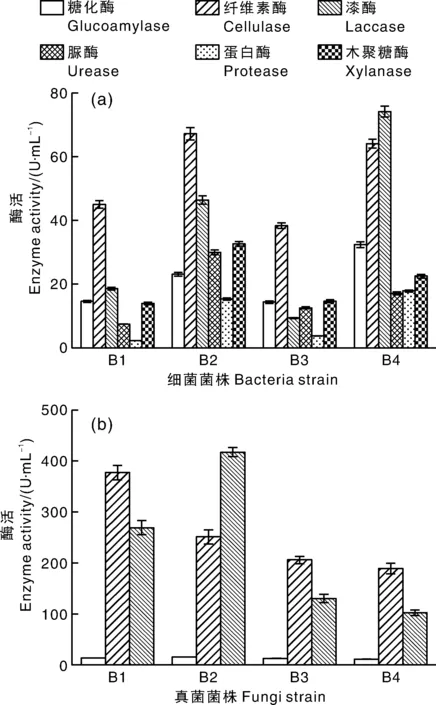
图1 分离到的细菌(a)和真菌(b)菌株的酶活
对上述4株菌株进行菌种鉴定,认定B2为地衣芽孢杆菌(Bacilluslicheniformis),与编号MG593200.1(B.licheniformis)菌株的相似度为100.00%;B4为空气芽孢杆菌(Bacillusaerius),与编号KF879226.1(B.aerius)菌株的相似度为99.66%;F1为疏绵状嗜热丝孢菌(Thermomyceslanuginosus),与编号MT316378.1(T.lanuginosus)菌株的相似度为100.00%;F2为烟曲霉(Aspergillusfumigatus),与编号MW335144.1(A.fumigatus)菌株的相似度为100.00%。
2.2 堆肥过程中温度的变化
堆肥过程中微生物的新陈代谢会产生和消耗能量,从而影响堆肥温度[16]。在堆肥的第2天接种嗜热菌剂后,接种组的升温过程明显加快,温度逐渐高于空白组(图2),并在第7天达到峰值63.8 ℃,而空白组的温度峰值为63.3 ℃。堆肥第8天,接种组和空白组的温度均有所下降,此时进行第二次接种。至第9天,两组温度又再次升高,且接种组的温度比空白组高出2 ℃。这可能是因为:接种组在再次接种菌剂后,嗜热微生物的活性增强,对有机物的降解能力提高,因而温度升高;而在空白组中,培养基的加入只是为堆肥原生境中的微生物提供了额外的养分。在整个堆肥过程中,接种组的温度始终高于空白组,且接种组高温期(>50 ℃)的持续时间(14 d)比空白组(12 d)多2 d,表明接种嗜热菌剂可延长高温期。Yu等[17]研究发现,嗜热菌剂在蛋白质和木质纤维素降解方面具有优势,可在堆肥过程中积累更多热量,从而提高堆肥温度并延长堆肥高温期。随后,当大部分有机物被消耗后,微生物活性降低,接种组和空白组的温度降低,最终接近环境温度,堆肥结束。

图2 堆肥过程中的温度(a)和种子发芽指数(GI)(b)变化

2.3 堆肥过程中有机质和DOC的变化
在堆肥过程中,有机质不断进行矿化和腐殖化,含量不断减少[21]。在本试验的堆肥过程中,各处理组的有机质含量均呈下降趋势(图3)。相对于空白组,接种组的有机质降解速率明显更快。最终,接种组和空白组的有机质降解率分别为15.08%和12.09%。接种组的有机质降解率高于空白组,这可能是因为接种组具有更高的堆体温度和微生物代谢活性,说明接种嗜热菌剂可促进堆肥过程中有机质的生物降解。
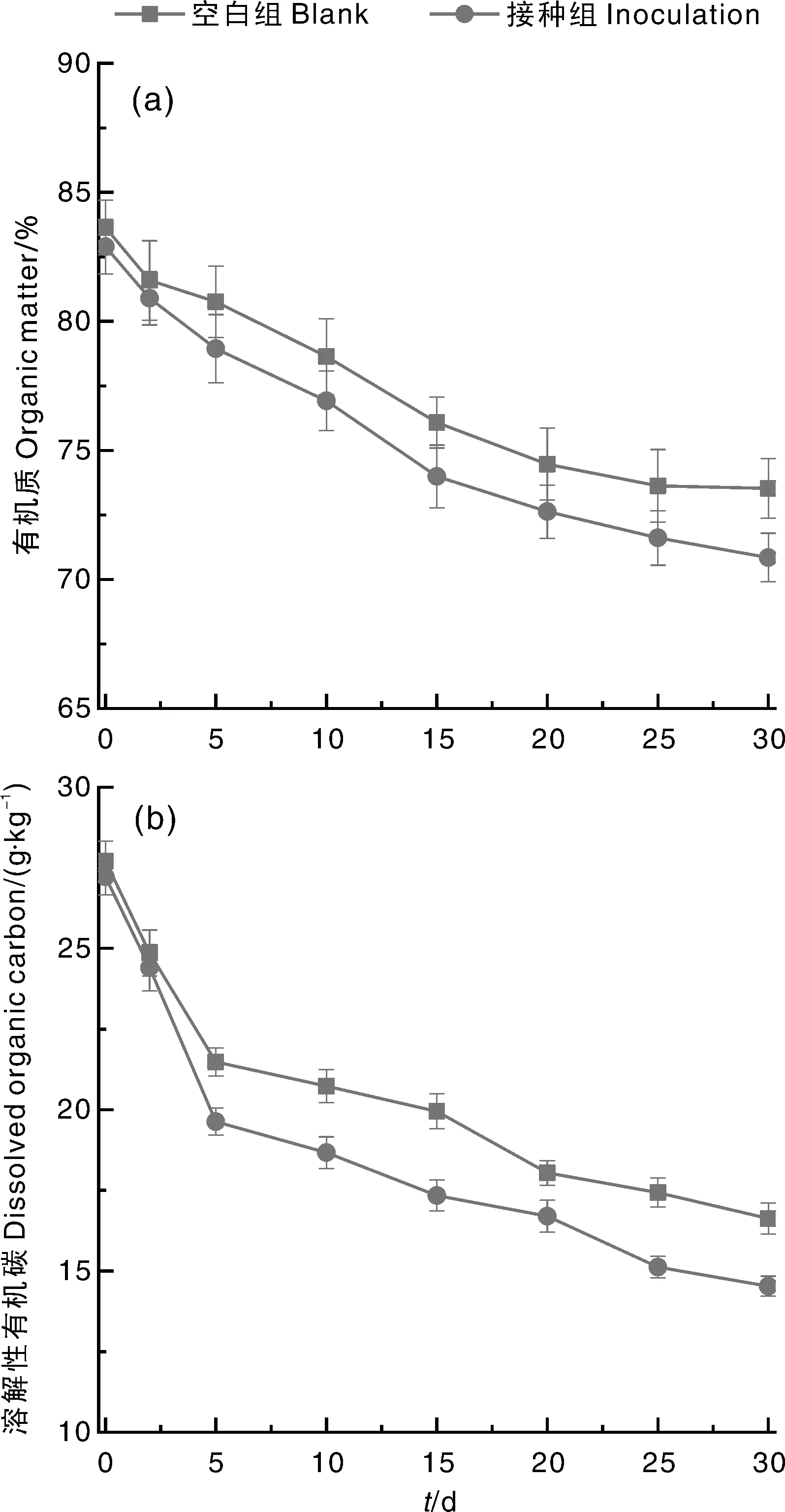
图3 堆肥过程中有机质(a)和溶解性有机碳(DOC)(b)含量的变化
DOC是为微生物代谢提供碳源和能源的重要物质[22]。在堆肥过程中,接种组和空白组的DOC含量均持续下降,最终分别从27.22、27.71 g·kg-1下降到14.53、16.63 g·kg-1。白玲等[14]在研究不同调理剂对秸秆沼渣堆肥的影响时发现,DOC在堆肥的2~5 d快速增加,这与本文结果不同。这可能是因为,虽然木质纤维素等聚合物的降解集中在高温期(可释放更多DOC),但是高温期的微生物活性最强,可快速降解DOC,且DOC的降解速率高于有机质的降解速率,即释放的DOC少于降解的DOC,因而在本试验条件下表现为堆肥过程中DOC含量的持续下降。两组相比,接种组的DOC降解率明显更高,说明接种嗜热菌剂可提高DOC的降解率,有助于促进微生物的生长繁殖[23]。
2.4 堆肥过程中腐殖质组成和含量的变化
腐殖质是堆肥过程中有机物转化的重要产物,主要由富里酸和胡敏酸组成,可影响堆肥产品的肥效和稳定性[24]。由于高温不利于腐殖质的形成,且堆肥原有的腐殖质和在堆肥初期形成的腐殖质易被微生物分解利用[25],接种组和空白组的腐殖质含量在前10 d均维持在较低水平(图4)。第10天后,腐殖质含量迅速升高。至堆肥结束时,接种组的腐殖质含量(117.40 g·kg-1)高于空白组(107.95 g·kg-1)。这是因为,腐殖质形成的前体物质是酚类化合物,而木质素降解可提供酚类化合物[26]。嗜热菌剂具有较强的木质素降解能力,因而能为腐殖质形成提供更多的前体物质。在接种组和空白组中,随着堆肥的进行,富里酸含量均不断减少,至堆肥结束时,分别降至29.27、29.43 g·kg-1。据Zhou等[27]报道,富里酸可通过缩合和聚合转化为分子量更大、结构更稳定的胡敏酸;因此,堆肥过程中胡敏酸含量持续上升。最终,接种组和对照组的胡敏酸含量分别达到88.14、78.52 g·kg-1。显然,接种嗜热菌剂提高了堆肥产品的胡敏酸含量,形成了更为稳定的腐殖质。胡富比(HA/FA)可反映堆肥的腐熟程度[28]。随着堆肥进行,接种组和空白组的胡富比均逐渐升高,说明有机物在向着腐殖质转化,腐殖化程度逐渐增加。最终,接种组和空白组的胡富比分别为3.01和2.67,说明接种嗜热菌剂可强化堆肥的腐殖化程度。

图4 堆肥过程中腐殖质(a)、富里酸(b)、胡敏酸(c)含量和胡富比(d)的变化
2.5 堆肥过程中的三维荧光光谱变化
三维荧光光谱可用于评估和监测堆肥的成熟度和稳定性[29]。据Chen等[30]报道,不同类型的有机物具有不同的荧光特性,通常可以分为5个区域:区域A,EX/EM (260~290) nm/(300~360) nm;区域B,EX/EM (225~230)/(330~340) nm;区域C,EX/EM (220~230)/(300~310) nm;区域D,EX/EM (240~245)/(420~430) nm;区域E,EX/EM (300~350)/(400~450) nm。区域A~E分别代表类酪氨酸物质、类色氨酸物质、可溶性微生物副产物、类富里酸物质和类胡敏酸物质。从堆肥原料,以及空白组和接种组堆肥产品的三维荧光光谱(图5)可以看出,堆肥原料中区域A、B、C的荧光强度较高,说明其主要由简单的芳香蛋白和可溶性微生物副产物组成。在堆肥结束后,接种组和空白组区域A、B、C的荧光强度降低,表明类蛋白物质在堆肥过程中被降解为非荧光物质或转化为其他物质[31];但区域D、E的荧光强度有所增加,且接种组中区域D、E的荧光强度高于空白组,即接种组的类富里酸物质和类胡敏酸物质含量要高于空白组,说明接种嗜热菌剂可以提高堆肥的腐殖化程度。
2.6 堆肥过程中的微生物群落结构变化
微生物群落结构的演变,尤其是细菌群落的演变,在堆肥过程中有机物的转化和腐殖质的形成中发挥着重要作用[32]。在空白组和接种组第5、15、30天的堆肥样品中,在门水平上细菌群落主要由厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)组成(图6)。在堆肥第5天,厚壁菌门在细菌群落中的相对丰度最高,在空白组和接种组中分别占70.99%和76.84%,其次是放线菌门,分别占14.10%和18.12%,变形菌门分别占8.45%和2.90%。拟杆菌门对高温敏感,在堆肥的高温阶段难以生存,因此在第5天的堆肥样品中几乎不存在。值得注意的是,接种组的厚壁菌门和放线菌门的相对丰度均高于空白组。据报道,厚壁菌门可以分泌多种胞外酶来降解蛋白质、果胶和纤维素等大分子底物[33]。同时,大多数厚壁菌门都能产生孢子以适应高温环境。放线菌门在木质纤维素降解方面发挥重要作用,并能通过分泌各种抗生素抑制和杀死堆肥中的病原微生物[34]。从以上结果可以看出,接种嗜热菌剂可以促进堆肥高温阶段碳水化合物和木质纤维素的降解,抑制或杀死堆肥中的病原菌,最终提高堆肥的效率和质量。在堆肥的第15天,厚壁菌门的相对丰度显著降低,在空白组和接种组中分别占41.94%和44.25%。相应地,变形菌门开始变得活跃,相对丰度升高,在空白组和接种组中分别占36.32%和38.59%。据Zhang等[35]报道,变形菌门具有良好的固氮特性,在堆肥中可较其他细菌固定更多的氮。在堆肥的第30天,厚壁菌门的相对丰度进一步降低,在空白组和接种组中分别占7.22%和10.52%;而变形菌门的相对丰度维持在较高水平,在空白组和接种组中分别占39.89%和40.38%。在此阶段,拟杆菌门的相对丰度升高,在空白组和接种组中分别占39.65%和34.55%。这是因为,此时堆体温度已趋近于室温,适宜拟杆菌门的生长繁殖。
除细菌外,真菌群落的演变对堆肥过程中纤维素、木质素等难降解有机物的降解亦发挥着重要作用。对比空白组和接种组第5、15、30天堆肥样品中真菌在目水平上的相对丰度变化情况可以看到,空白组与接种组在真菌群落结构上存在明显差异,说明接种嗜热菌剂深刻影响了堆肥过程中真菌群落的演变。在堆肥的第5天,空白组中酵母菌目(Saccharomycetales)占主导地位,相对丰度达到了59.61%,散囊菌目(Eurotiales)、肉座菌目(Hypocreales)、座囊菌目(Dothideales)、格孢腔菌目(Pleosporales)和假毛球壳目(Trichosphaeriales)的相对丰度接近,在空白组中分别占9.39%、7.52%、4.98%、5.70%和3.72%。然而,在接种组中,酵母菌目的相对丰度仅占1.70%。这意味着,接种嗜热菌剂抑制了酵母菌目的生长。相对地,在接种组中散囊菌目、肉座菌目、座囊菌目、格孢腔菌目和假毛球壳目的相对丰度均得到提升,分别占23.71%、20.24%、15.51%、13.87%和10.74%。这表明,接种嗜热菌剂提高了堆肥高温期真菌群落的多样性。在堆肥的第15天,空白组中酵母菌目的相对丰度进一步升高,达到67.79%,接种组酵母菌目的相对丰度也得到了提升,达到51.49%。这可能是由于嗜热菌剂主要在高温阶段活跃,当堆肥进入降温腐熟阶段,酵母菌目逐渐占据主导地位。此外,粪壳菌目(Sordariales)在此阶段较活跃,在空白组和接种组中分别占11.74%和15.04%。同期,散囊菌目、肉座菌目、座囊菌目、格孢腔菌目和假毛球壳目,在空白组中分别占4.73%、4.59%、2.48%、2.34%和2.19%,在接种组中分别占14.38%、3.62%、2.66%、3.55%和2.06%,整体看,上述菌目在接种组中的占比高于空白组。在堆肥的第30天,酵母菌目的相对丰度降低,在空白组和接种组中分别占6.77%和1.00%,而粪壳菌目的相对丰度升高,在空白组和接种组中分别占34.54%和74.10%。
3 结论
本研究从餐厨有机浆液厌氧沼渣和黑水虻虫粪共堆肥高温期筛选出2株嗜热细菌(分属Bacilluslicheniformis、Bacillusaerius)和2株嗜热真菌(分属Thermomyceslanuginosus、Aspergillusfumigatus)。接种由上述菌株制成的嗜热菌剂可延长堆肥高温期的持续时间,促进有机质和DOC降解,强化堆肥腐殖化进程,提高堆肥产品肥效。在堆肥的高温期,接种嗜热菌剂可提高厚壁菌门和放线菌门的相对丰度,减少酵母菌目的相对丰度,增加真菌群落多样性。

