早卵泡期长方案、拮抗剂方案及黄体期短效长方案对不孕症患者子宫内膜容受性及临床妊娠的影响*
夏婷婷 曾克非
随着社会的不断进步,女性社会化、职业化程度逐渐升高,女性晚婚晚育人群比例不断攀升[1]。然而,女性的卵巢功能会随着年龄的增长处于逐渐衰退的状态,导致女性生育能力低下,子宫内膜容受性差,使女性备受不孕症困扰[2-3]。针对难治性不孕患者辅助生殖技术是其治疗的有效措施,其分为受精-胚胎移植技术(IVF-ET)或卵泡浆内单精子注射术(ICSI)技术,而以上技术成败的关键均受子宫内膜容受性影响[4]。子宫内膜容受性是子宫内膜对胚胎的接受能力,优质的子宫内膜容受性是胚胎实现着床和妊娠的前提[5-6]。但因为不孕患者机体内分泌环境较为复杂,因此,如何选择合适有效的治疗方案,帮助不孕女性促排卵,并改善子宫内环境,这一直是临床妇产科学关注的焦点问题。早卵泡期长方案是利用长效促性腺激素释放激素激动剂(GnRH-a)达到持续降调节作用,适合卵巢储备功能正常的不孕患者,其可在卵泡募集期促使卵泡发育成熟较为同步,同时可抑制多个卵泡发育过程中出现的早黄体生成素(LH)峰,但其降调节时间较长,致使重组人促卵泡激素注射液[果纳芬(Gn)]使用时间较长与使用剂量增加[7]。拮抗剂方案是指在女性不孕患者促排卵过程中利用促性腺激素释放激素拮抗剂竞争性结合垂体促性腺激素释放激素(GnRH)受体,阻滞机体内源性GnRH 对垂体的激动作用,可较快抑制LH 生成,避免早LH峰发生,利于在预期时间内进行取卵,但该方案易导致卵细胞发育不同步[8]。黄体期短效长方案是经过合适的GnRH-a 垂体降调节,抑制内源性卵泡刺激素(FSH)和LH 峰,使卵细胞的生长发育速度减慢,从而使卵细胞直径趋于一致,致使获得卵细胞数目较多,但其会对垂体过度抑制,导致卵泡会过度发育,性激素水平异常升高,卵巢刺激过度,卵巢内膜容受性降低[9]。本文特探讨三种不同治疗方案对不孕症患者子宫内膜容受性及临床妊娠的影响,旨在为不孕女性寻找最佳治疗方案。
1 资料与方法
1.1 一般资料 纳入2021 年5 月-2022 年5 月在井冈山大学附属医院生殖中心首次接受IVF-ET/ICSI 的女性不孕患者210 例。纳入标准:(1)临床确诊为女性不孕症[10];(2)初次接受IVF-ET 或ICSI 技术;(3)年龄≤38 岁;(4)月经周期正常;(5)体重指数18~24 kg/m2;(6)基础FSH 水平<10 IU/mL。排除标准:(1)卵巢反应不良[窦卵泡计数(AFC)<7 个或抗米勒管激素(AMH)<1.1 ng/mL];(2)高催乳素血症;(3)子宫内膜异位症;(4)输卵管积水和子宫解剖学异常;(5)甲状腺疾病。终止标准:治疗过程中主动放弃。按随机对照法,分为研究1 组(n=70,早卵泡期长方案)、研究2 组(n=70,拮抗剂方案)、对照组(n=70,黄体期短效长方案)。本研究经医院医学伦理委员会批准。患者知情且同意。
1.2 促排卵方案 研究1 组采用早卵泡期长方案:在月经周期第2 天或第3 天给予注射用醋酸亮丙瑞林微球(生产厂家:上海丽珠制药有限公司,批准文号:国药准字H20093852,规格:3.75 mg)皮下注射1 次全剂量(3.75 mg)实施垂体降调节。降调节后28~40 d,复查血清生殖激素与阴道B 超:根据AMH、基础AFC、卵泡大小、年龄、体重指数等数据,给予皮下注射促性腺激素重组人促卵泡激素注射液[果纳芬(Gn),生产厂家:Merck Serono S.p.A.,注册证号:国药准字SJ20160040,规格:33 μg(450 U)]100~300 U 促排卵治疗10~12 d,根据患者阴道三维能量多普勒超声检查及血清雌二醇(E2)<50 pg/mL、LH<5 U/mL、孕酮(P)<9.5 nmol/L水平调整Gn 用量,每例患者75~225 U/d。
研究2 组采用拮抗剂方案:在月经周期第2 天或第3 天根据AMH、基础AFC、卵泡大小、年龄、体重指数等数据,给予Gn 100~300 U 促排卵治疗8~10 d,根据阴道三维能量多普勒超声检查及血清E2、LH、P 水平调整Gn 用量,每例患者75~225 U/d。达 到E2≥300 pg/mL并且卵泡≥12 mm 或卵泡≥14/15 mm 标准使用皮下注射拮抗剂醋酸西曲瑞克(生产厂家:深圳瀚宇药业股份有限公司,批准文号:国药准字H20183468,规格:0.25 mg)0.25 mg/d;并维持剂量至扳机日,采用注射用醋酸亮丙瑞林微球(同上)皮下注射0.2 mg,诱导排卵。
对照组采用黄体期短效长方案:在排卵后1 周(如月经周期30 d 者,排卵后1 周为月经周期第21 天),给予皮下注射醋酸曲普瑞林注射液(生产厂家:Ferring GmbH,注册证号:国药准字HJ20160237,规格:1 mL∶0.1 mg)0.1 mg/次,1 次/d,10 d 后,改为0.05 mg/次,1 次/d,4 d 进行垂体降调节,后根据AMH、基础AFC、卵泡大小、年龄、体重指数等数据,给予Gn(同上)100~300 U 促排卵治疗8~10 d,根据阴道三维能量多普勒超声检查及血清E2、LH、P 水平调整Gn 用量,每例患者75~225 U/d。
扳机标准:各组均于月经第10 天行经阴道三维能量多普勒超声技术进行超声卵泡监测,如直径16 mm 以上卵泡数≥3 个或直径17/18 mm 以上卵泡数≥2 个。给予注射用绒促性素(生产厂家:丽珠制药厂,批准文号:国药准字H20033377,规格:1 000 单位)5 000~10 000 单位扳机后36~38 h取卵。
1.3 新鲜胚胎移植与临床妊娠 给予黄体酮注射液(生产厂家:天津金耀药业有限公司,批准文号:国药准字H12020534,规格:1 mL∶10 mg)80 mg/d 肌肉注射至移植日,并于取卵后3 d 选择优胚进行鲜胚移植。优质胚胎的定义为:2 个原核(2PN)发育而来,第3 天卵裂球细胞数6~9 个,碎片数≤20%进行移植。有下列指征取消鲜胚移植:(1)获卵数≥20 个;(2)扳机日P≥1.5 ng/mL;(3)促排期间宫腔回声不均;(4)扳机日E2≥5 000 pg/mL。将取消移植的胚胎进行冷冻。移植成功后继续给予患者黄体酮支持,并于移植后14 d 抽取患者空腹上肢静脉血,离心机分离后,检查患者血清人绒毛膜促性腺激素(β-hCG)值,β-hCG>10 mIU/mL 诊断为生化妊娠,并于移植成功后30 d 做阴道B 超检查,子宫腔内可见卵黄囊与具有胎心搏动,则说明达到临床妊娠标准。
1.4 观察指标及评价标准(1)子宫内膜容受性。三组均于取卵术后第2 天安排VolusonE10 三维能量多普超声(奥地利GE 公司生产)检查。检查前B 超医生提醒患者排空尿液,取截石位,启动能量多普勒血流成像模式及三维模式,RIC5-9-D 经阴道超声探头(奥地利GE 公司生产)扫描显示子宫最大纵切面,测量子宫内膜厚度(ED),使用超声诊断仪配套VOCAL 分析软件,勾勒出子宫内膜轮廓,获得内膜容积(EV)、内膜区血管指数(VI)及血流指数(VFI),每个患者连续监测3 次,取3 次的平均值。(2)卵巢刺激情况。对比三组Gn 用量、Gn 使用天数,扳机日E2、P、LH 水平,周期取消数。(3)胚胎情况。对比三组有效胚胎率(有效胚胎数/正常受精卵裂胚胎数×100%)、优质胚胎率(优质胚胎数/正常受精卵裂胚胎数×100%)、移植胚胎数、新鲜移植周期数、全胚冷冻数与正常受精率(2PN 受精数/获卵数×100%)。(4)临床妊娠。对比三组多胎妊娠率(双胎及以上胎数/妊娠周期数×100%)、流产率(流产数/妊娠周期数×100%)、异位妊娠率(异位妊娠数/妊娠周期数×100%)与临床妊娠率(移植妊娠周期数/新鲜移植周期数×100%)。
1.5 统计学处理 本次研究获得的数据运用Microsoft Office Excel 2010 录入,应用SPSS 21.0 版软件进行分析。计量资料满足正态分布以均数±标准差()表示,组间两两对比应用SNK-q检验;计数资料率(%)表示,三组数据组内、组间比较用χ2检验;P<0.05 为差异有统计学意义。
2 结果
2.1 三组一般资料对比 三组一般资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。

表1 三组一般资料比较
2.2 三组子宫内膜容受性对比 三组干预前ED、EV、VI 与VFI 差异均无统计学意义(P>0.05),干预后研究1 组ED、EV、VI 与VFI 水平均高于研究2 组与对照组(P<0.05),研究2 组均高于对照组(P<0.05),见表2。
表2 三组子宫内膜容受性对比()
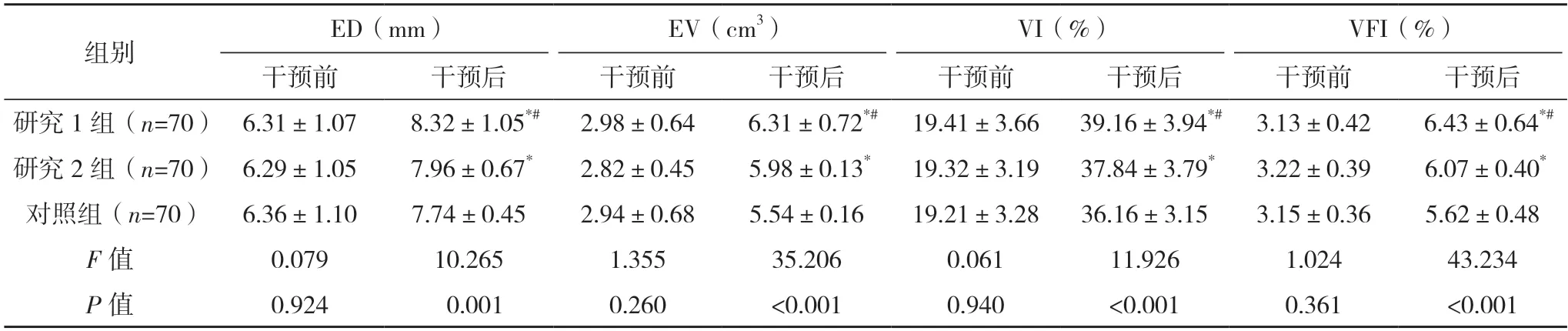
表2 三组子宫内膜容受性对比()
*与对照组对比,P<0.05;#与研究2 组比较,P<0.05。
2.3 三组卵巢刺激情况对比 干预后研究1 组的Gn 使用剂量与使用天数均大于研究2 组与对照组(P<0.05),研究2 组与对照组差异均无统计学意义(P>0.05),研究2 组LH 水平高于研究1 组与对照组(P<0.05),研究1 组与对照组差异无统计学意义(P>0.05),而三组扳机日E2、P 水平与周期取消率差异均无统计学意义(P>0.05),见表3。
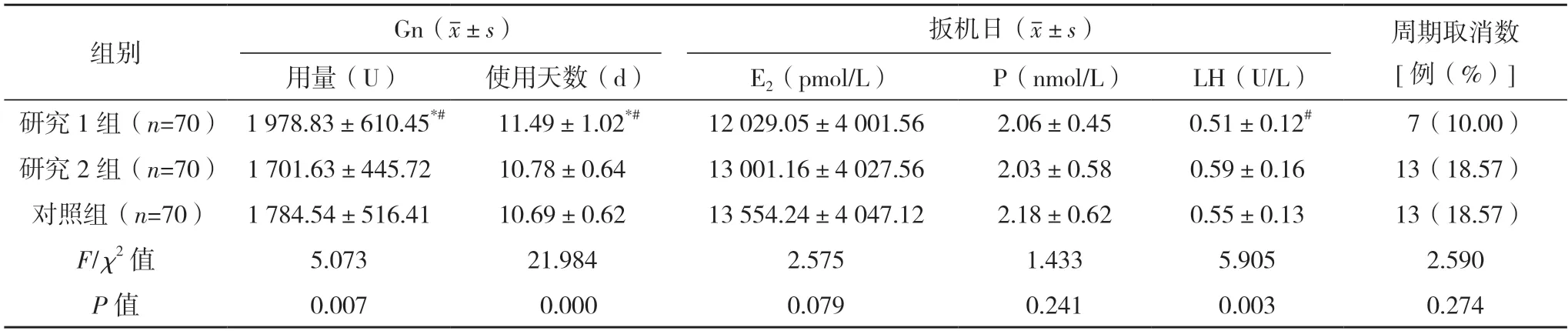
表3 三组卵巢刺激情况对比
2.4 三组胚胎情况对比 干预后研究1 组有效胚胎率、优质胚胎率均大于研究2 组与对照组(P<0.05),研究2 组有效胚胎率、优质胚胎率与对照组差异均无统计学意义(P>0.05),而三组移植胚胎数、新鲜移植周期数、全胚冷冻与正常受精率差异均无统计学意义(P>0.05),见表4。
2.5 三组临床妊娠结局对比 研究1 组临床妊娠率高于研究2 组与对照组(P<0.05),研究2 组临床妊娠率与对照组差异无统计学意义(P>0.05),而三组多胎妊娠率、流产率及异位妊娠率差异均无统计学意义(P>0.05),见表5。
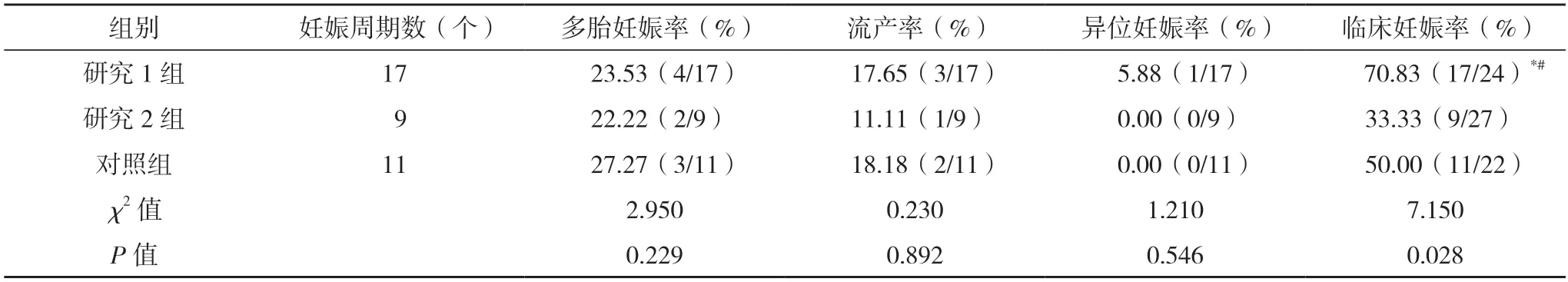
表5 三组临床妊娠结局对比
3 讨论
刘莉等[11]研究发现,早卵泡期长效GnRH-a 长效方案相比于黄体期短效长方案可以提高不孕女性子宫内膜容受性,改善临床妊娠结局。本研究发现,干预后研究1 组ED、EV、VI 与VFI 水平均高于研究2 组与对照组,研究2 组均高于对照组,说明早卵泡期长方案可显著改良女性不孕患者子宫内膜容受性。分析原因可能为,早卵泡期长方案给予不孕患者全剂量注射用醋酸亮丙瑞林微球,其为缓释长效GnRH-a,能够作用于子宫内膜,而子宫内膜细胞中存在GnRH-Ⅱ受体mRNA 的转录与蛋白质的表达,因此,GnRH 可以调控细胞的凋亡与其增殖,影响子宫内膜的内膜增生和分泌功能,并干扰新血管的形成,从而影响子宫内膜的容受性[12];外加可充分降调节垂体-性腺系统,降低机体内雌激素水平,改善女性不孕患者内分泌代谢紊乱对子宫内膜容受性产生的影响,并在确认排卵的基础上再注射卵巢降调节药物,给予子宫内膜充足的时间休息,进而可以提高患者子宫内膜容受性[13]。
赵志明等[14]研究发现早卵泡期GnRH-a 长方案用于治疗多囊卵巢综合征(PCOS)患者Gn 使用量、使用天数与ED 均较黄体组高,且提高子宫内膜容受性效果显著。卢俏俏等[15]研究表明,改良长效GnRH-a 案可以改善PCOS 患者子宫内膜容受性且不会过度刺激卵巢。本研究显示,干预后研究1 组的Gn 使用剂量与使用天数均多于研究2 组与对照组,研究2 组与对照组无区别,但研究2 组LH 水平高于研究1 组与对照组,说明早卵泡期长方案用于治疗不孕患者对其卵巢影响较小。究其原因可能为,早卵泡期长方案利用缓释制剂注射用醋酸亮丙瑞林微球达到持续降调节GnRH-a 的作用,其对垂体抑制作用温和,会在促排过程中造成使用Gn 时间延长及Gn 量增加;而黄体期短效长方案,垂体降调作用更快,故其使用Gn 时间相比其较短,Gn量相比其较少,但拮抗剂方案在促排卵过程中使用GnRH 拮抗剂(GnRH-ant),竞争性的与垂体GnRH受体相结合,从而阻滞机体内源性GnRH 与垂体相结合,起到快速抑制LH 生成的目的,避免早LH峰发生。
刘阳等[16]研究发现,注射用醋酸亮丙瑞林微球可以提高子宫腺肌病合并不孕患者的EV,提高不孕患者2PN 率、优质胚胎率与受精率,有助于改善其改善其妊娠结局。本研究结果表明,干预后研究1 组有效胚胎率、优质胚胎率均大于研究2 组、对照组,研究2 组有效胚胎率、优质胚胎率与对照组无区别,说明早卵泡期长方案可明显改善不孕患者胚胎质量。究其原因可能为,注射用醋酸亮丙瑞林(LE)微球为GnRH-a,应用于IVF-ET 或ICSI,其对垂体的降调节作用增强了卵泡发育的同步性,减少了内源性LH 的升高和晚卵泡期P 的提前上升,为控制性促排卵(COH)提供了有利条件,Gn 作用时间与卵泡的生长发育具有密切的联系,Gn 使用时间短会导致卵泡生长过快,致使卵母细胞胞质的发育和细胞胞核发育不能同步进行,导致卵细胞胞核虽已完全发育成熟但卵细胞胞质却未成熟,造成卵细胞质量下降,有的甚至形成空卵。
白璐等[17]研究表明,对行IVF-ET 的不孕患者应用注射用LE 超长方案有助于抑制其内源性性激素水平,提高胚胎种植率,临床妊娠结局更好。本研究结果显示,研究1 组临床妊娠率高于研究2 组与对照组,研究2 组临床妊娠率与对照组无区别,说明早卵泡期长方案可改善临床妊娠。分析原因可能为,卵泡期长效长方案通过延长了Gn 使用时间,使FSH 水平可在较长时间内维持在阈值之上,从而可助于FSH 受体的生物活性增强,进而使有效胚胎数与优质胚胎数目较多,可利用的优胚数量多,借助IVF-ET 或ICSI 技术下,相对的累积妊娠率和累积活产率就会越高,临床妊娠效果相对较好。尹轶莎等[18]发现,早卵泡期长效长方案对比于黄体期短效长方案可改良不孕患者新鲜周期妊娠结局。
综上所述,早卵泡期长方案可助于改善女性不孕症患者子宫内膜容受性,提高卵子质量,改善临床妊娠,但因其降调节时间较长,致使Gn 使用时间延长、使用剂量增加。但本次研究也存在一定程度上的局限性,如:(1)取样患者来源于单一医疗机构;(2)样本数量仅210 例;(3)临床跟踪时间短;(4)不孕女性年龄≤38 岁;因此本研究结果还有待多中心、大样本、延长跟踪时间与增强不孕女性年龄范围等进一步佐证。

