脑胶质瘤组织中透明质酸合成酶2表达变化及其与临床病理参数和预后的关系
薛正淳,孙强,孟祥龙,张健,张墨轩,衡雪源
1 潍坊医学院研究生院,山东潍坊 261053;2 临沂市人民医院神经外科;3 北京市神经外科研究所 首都医科大学附属北京天坛医院功能神经外科研究室
胶质瘤是最常见的颅内原发性肿瘤,约占颅内恶性肿瘤的81%[1-3]。目前手术切除联合术后放化疗是脑胶质瘤常用的治疗方法[4],但由于脑胶质瘤细胞生长迅速、侵袭性高、易复发或产生耐药,治疗效果仍不理想。研发新的治疗策略是胶质瘤治疗相关研究的重点[5-6]。近年来分子靶向治疗研究进展迅速,许多与胶质瘤诊断、治疗和预后相关的基因被筛选出来。透明质酸合成酶2(HAS2)定位于染色体8q24.13,是透明质酸合成酶家族中的一员。透明质酸连同其表面受体已被证实与恶性肿瘤进展(如侵袭和转移)有关[7-8]。多项研究表明,HAS2 与结直肠癌、胰腺癌、子宫内膜癌的肿瘤分级和患者预后有关[9-11]。一项回顾性分析也显示,HAS2 在浸润性星形细胞胶质瘤中高表达[12]。本研究观察了脑胶质瘤组织中HAS2 的表达变化,探讨HAS2 表达与脑胶质瘤临床病理参数及预后的关系。现报告如下。
1 资料与方法
1.1 临床资料 选取2013 年7 月—2020 年7 月在临沂市人民医院行脑胶质瘤切除术患者的胶质瘤标本70 例纳入病例组,患者男37 例、女33 例,年龄2 ~ 70 岁,WHO 分级1 ~ 2 级32 例、3 ~ 4 级38 例。纳入标准:①经术后病理证实为脑胶质瘤;②患者具有手术指征,且自愿手术;③术前未进行放化疗、免疫治疗等。排除患有其他恶性肿瘤或二次胶质瘤手术的患者,病例资料缺失的患者,围术期死亡者。另选同期行颅脑外伤减压手术的脑外伤患者的正常脑组织10例纳入对照组。对照组患者男6例、女4例,年龄16 ~ 72 岁。两组患者一般资料差异无统计学意义,具有可比性。本研究获得医学伦理委员会批准,患者及家属均签署知情同意书。
1.2 HAS2蛋白检测
1.2.1 免疫组化法 标本组织获取后经多聚甲醛固定,石蜡包埋,4 μm 厚切片,烘片机70 ℃烘烤45 min;切片经常规脱蜡水化,置于柠檬酸盐修复液中进行抗原修复,冷却至室温移至湿盒;加入内源性过氧化物酶阻断剂静置15 min,PBS 冲洗3 次;滴加1∶100 稀释的HAS2 抗体,孵育过夜后PBS 漂洗3 次;滴加反应增强液室温孵育20 min,PBS冲洗3次;滴加抗鼠/兔IgG 二抗,室温孵育40 min;加入新鲜配置的二氨基联苯胺(DAB)显色液,流动水冲洗;苏木素复染,脱水,透明,干燥,中性树胶封片。显微镜下(200×)观察,每个切片随机选取10 个视野,计数阳性细胞数。根据HAS2 染色程度和阳性细胞百分比评估结果:染色程度为无染色、淡黄色、棕黄色、褐黄色分别计0、1、2、3分,HAS2阳性细胞百分比为0、<25%、25% ~ <50%、≥50%分别计0、1、2、3 分,二项评分乘积1 ~ ≤4为HAS2低表达,>4为HAS2高表达。
1.2.2 Western blotting 法 两组组织在液氮作用下研磨,全蛋白提取试剂混匀后提取总蛋白,BCA蛋白定量;配置10%分离胶,4%浓缩胶上样电泳,浓缩胶恒压80 V,分离胶恒压120 V,恒流280 mA转膜70 min;将转膜后的聚偏氟乙烯膜放入新鲜配置的牛奶中封闭2 h,后加入1∶1 000 稀释的HAS2 抗体,放置4 ℃冰箱孵育过夜;次日PBST 洗膜3 次,加入抗兔酶标记二抗,摇床孵育2 h,PBST 洗膜;吸取显影液均匀滴于膜上进行化学发光显影,得到Western blotting条带;用Image J软件分析条带,得到条带灰度值。以目的蛋白条带灰度值与内参GAPDH 蛋白条带灰度值的比值表示目的蛋白相对表达量。
1.3 统计学方法 采用SPSS26.0 软件及Graph-Pad Prism9 软件进行统计分析。符合正态分布的计量资料以-x±s表示,组间比较采用t检验。计数资料用百分比(%)及频数表示,组间比较采用χ2检验。采用Logistic 回归模型分析HAS2 表达的影响因素。采用Kaplan-Meier 曲线描述患者生存情况,生存期差异比较采用Log-Rank 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组HAS2 蛋白表达比较 免疫组化法检测结果显示,HAS2 主要在细胞质中表达,为淡黄色至黄褐色颗粒。见图1。病例组HAS2 高表达38 例(54.2%,38/70),其中1 ~ 2 级、3 ~ 4 级脑胶质瘤组织HAS2 高表达分别为11 例(34.4%,11/32)、37 例(71.1%,27/38);对照组HAS2 高表达1 例(10%,1/10)。病例组HAS2高表达率高于对照组,且3 ~ 4级脑胶质瘤组织中HAS2高表达率高于1 ~ 2级脑胶质瘤组织(P均<0.05)。Western blotting 检测结果显示,病例组、对照组HAS2 相对表达量分别为0.803 ± 0.286、0.243 ± 0.108,其中1 ~ 2 级、3 ~ 4 级脑胶质瘤组织HAS2 相对表达量分别为0.355 ± 0.109、0.765 ± 0.081。病例组HAS2 相对表达量高于对照组,且3 ~ 4 级脑胶质瘤组织中HAS2 相对表达量高于1 ~ 2级脑胶质瘤组织(P均<0.05)。
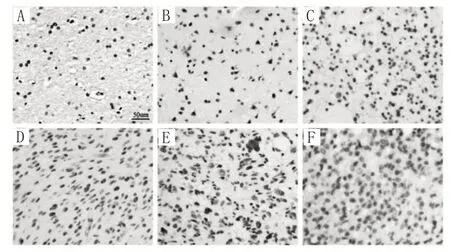
图1 两组HAS2表达情况(免疫组化法)
2.2 HAS2 表达与脑胶质瘤临床病理参数的关系 WHO 分级3 ~ 4 级、突变型p53、Ki-67 高表达脑胶质瘤组织中HAS2 高表达率分别高于1 ~ 2 级、野生型p53、Ki-67 低表达的肿瘤组织(P均<0.05)。HAS2 表达与患者年龄、性别、肿瘤位置、O6-甲基鸟嘌呤-DNA 甲基转移酶(MGMT)表达无相关性。见表1。将WHO 分级、Ki-67 表达、p53 分型、年龄、性别、肿瘤部位和MGMT 表达作为自变量,将HAS2 表达作为因变量,纳入Logistic 回归模型分析,结果显示WHO 分级、Ki-67 表达与p53 分型是脑胶质瘤患者HAS2表达的独立影响因素(P均<0.05)。见表2。
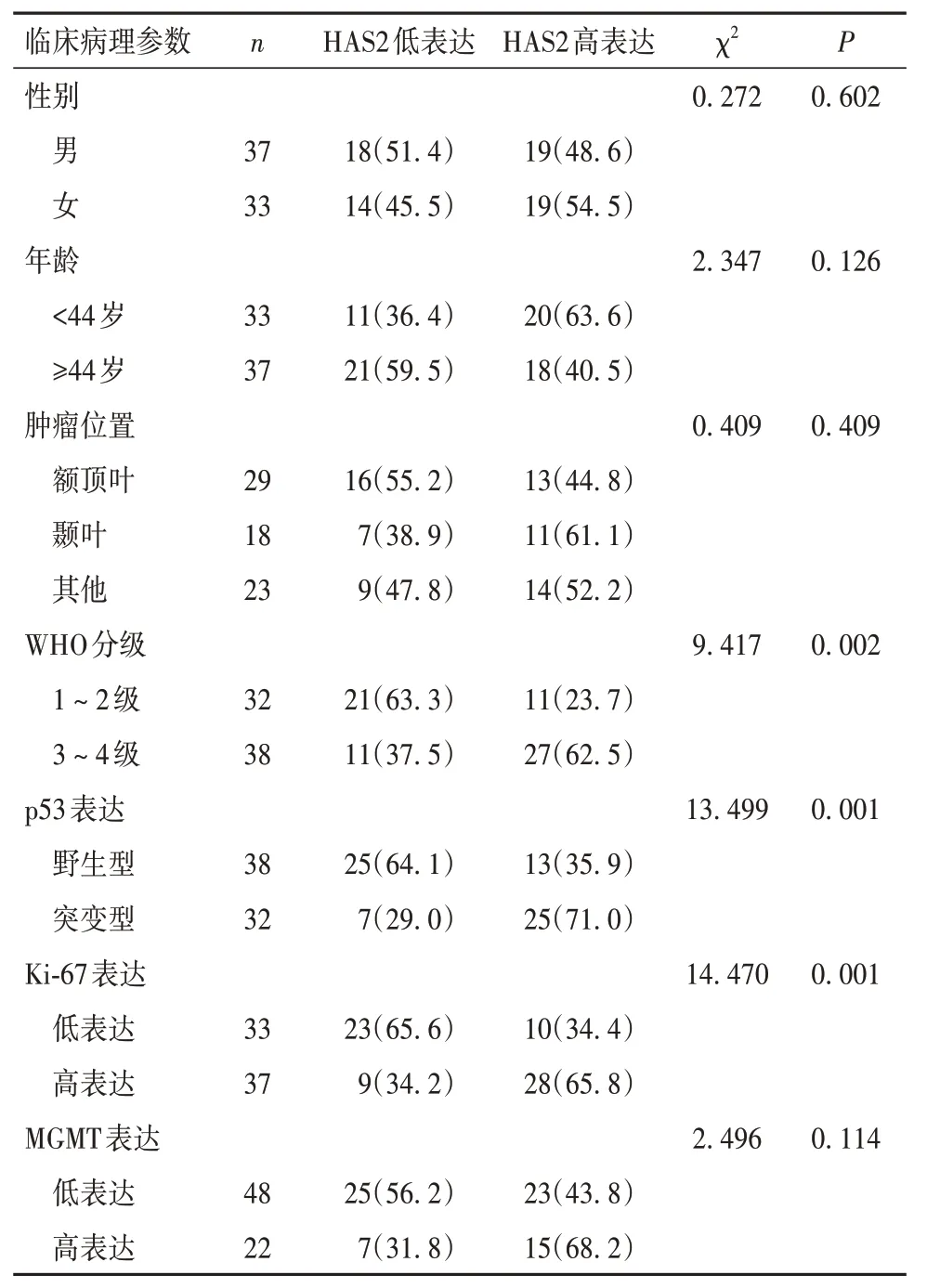
表1 HAS2与脑胶质瘤患者临床病理参数的关系[例(%)]
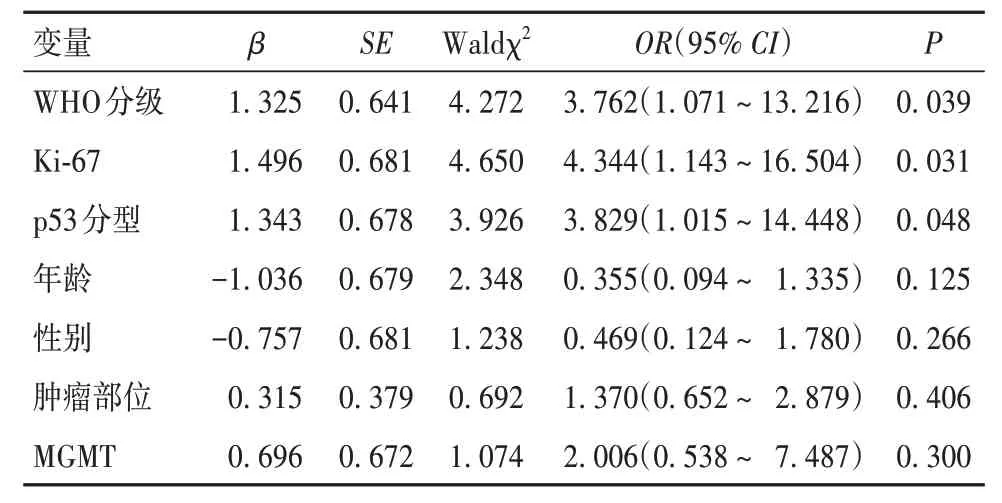
表2 HAS2表达影响因素的Logistic回归分析结果
2.3 HAS2 表达与胶质瘤患者生存时间及预后的关系 随访至2020 年12 月,病例组70 例患者死亡37例、存活33例,存活率为47.1%。HAS2高表达患者的平均生存时间(33.6 个月)、总生存率(28.9%)低于HAS2 低表达患者(分别为43.5 个月、62.5%),P<0.01。见图2。

图2 HAS2低表达与高表达患者预后比较
3 讨论
原发性中枢神经系统肿瘤的发病中位年龄约为60 岁,其中胶质瘤约占26%[13]。尽管胶质瘤有很多治疗方案,包括手术治疗、化疗、放疗和免疫治疗,但胶质瘤患者的生存率仍然很低。可能原因是肿瘤的异质性和表观遗传学的复杂性使胶质瘤的治疗靶点难以确定,生理性血脑屏障的存在也限制了药物的效果。此外,肿瘤的高浸润性也使手术治疗的效果有限。现已明确肿瘤标志物可作为胶质瘤诊断和治疗的分子依据[14]。
近年来与恶性肿瘤相关的细胞外基质成分备受关注。在细胞外基质成分中,透明质酸在脑组织的含量较其他组织丰富,且透明质酸在脑胶质瘤中表达较周围正常脑实质更为丰富,其高表达与胶质瘤患者不良预后密切相关。生理状态下,透明质酸由于其黏性和保水能力,对组织的平衡、生物力学和结构的完整性有重要意义[15]。但在病理状态下,透明质酸在损伤部位表达更加丰富。在胶质瘤中,透明质酸一方面作为机械基质为胶质瘤细胞的侵袭和迁移提供环境基础;另一方面,透明质酸还作为一种信号成分,通过其同源受体(如CD44、透明质酸移动受体、细胞黏附分子1等)为 胶质瘤细胞的侵袭提供条件[16]。因此,探望为脑胶质瘤的靶向治疗研究提供新的方向。
本研究分别通过免疫组化法和Western blotting法检测了脑胶质瘤组织和正常脑组织中的HAS2,结果显示,免疫组化检测结果与Western blotting 检测结果均显示,病例组HAS2 表达高于对照组,且3 ~ 4 级脑胶质瘤组织中HAS2 表达高于1 ~ 2 级脑胶质瘤组织,提示HAS2 与脑胶质瘤发病和恶性程度有关。进一步分析结果显示,WHO 分级3 ~ 4 级、突变型p53、Ki-67 高表达患者脑胶质瘤组织中HAS2 高表达率分别高于1 ~ 2 级、野生型p53、Ki-67低表达的肿瘤组织;WHO 分级、Ki-67 表达与p53 分型是脑胶质瘤患者HAS2 表达的独立影响因素。我们还发现,野生型p53、Ki-67 低表达的脑胶质瘤患者生存率为61.5%,突变型p53、Ki-67高表达的脑胶质瘤患者生存率为36.0%,而突变型p53、Ki-67 高表达、HAS2 高表达的脑胶质瘤患者生存率为仅为28.5%,表明突变型p53、Ki-67 高表达和HAS2 高表达的脑胶质瘤恶性程度更高。上述结果进一步提示,HAS2表达可能与脑胶质瘤恶性程度有关。
有研究表明,HAS2 参与上皮—间充质转化(EMT)过程[17]。EMT 表现为细胞极性、黏附性和紧密性丧失,导致细胞易从基底膜脱落,有助于向远处侵袭转移。野生型p53 可通过帮助细胞保持上皮基因特征来抑制EMT,并且可以通过增强抑制EMT 的miRNA 表达来抑制EMT 核心转录因子的表达。野生型p53缺失在乳腺癌细胞中会引发EMT[18]。另有研究表明,在乳腺癌细胞中上调HAS2 表达会导致间质标志物N-钙黏蛋白和波形蛋白表达增加,从而导致EMT[17]。Ki-67 作为肿瘤增殖相关因子,在G1中期到晚期出现,M 期达到峰值,其半衰期短,在细胞脱离增殖周期后迅速降解。除G0期外的细胞周期都可检测到Ki-67,Ki-67与肿瘤的增殖、迁移和侵袭密切相关[19]。研究表明,Ki-67的促增殖作用可能与EMT 产生协同作用。肺癌相关研究显示,Ki-67过表达者EMT 显著增强,且患者预后更差[19]。本研究结果显示,HAS2 高表达患者的平均生存时间、总生存率低于HAS2 低表达患者,提示HAS2 高表达者预后更差,HAS2 可能通过上述相关机制影响脑胶质瘤的增殖、迁移和侵袭。
综上所述,HAS2 在脑胶质瘤组织中高表达,HAS2 高表达与脑胶质瘤恶性程度有关,并影响患者预后。HAS2 有望作为脑胶质瘤的潜在治疗靶点。HAS2 在脑胶质瘤发生发展中的具体作用机制和相关通路仍需进一步研究。

