血管紧张素Ⅳ类似物Dihexa对脑出血小鼠的神经保护作用及其机制
胡燕,郑晓梅,张佳丽
西南医科大学附属医院神经内科,四川泸州 646000
脑出血是所有卒中类型中致残率、病死率最高的一种[1]。神经细胞凋亡和炎症反应是脑出血后继发性脑损伤的重要病理过程,细胞凋亡可引起血肿周围神经元丢失,导致组织损伤和炎症反应加重[2]。因此,抗炎、抗凋亡治疗对改善脑出血患者预后至关重要。血管紧张素Ⅳ(Ang Ⅳ)是血管紧张素Ⅱ(Ang Ⅱ)C 末端的六肽片段,通过结合其特异性血管紧张素受体4 来发挥作用[3-4]。相关研究表明,Ang Ⅳ及其类似物能在多种动物模型中发挥抗炎、抗凋亡作用[5-6]。Dihexa 是一种可口服的Ang Ⅳ类似物,具有半衰期较长、能透过血脑屏障、给药方便的特点[7]。磷脂酰激醇-3-激酶(PI3K)/丝氨酸/苏氨酸蛋白激酶B(AKT)通路是体内经典的信号转导途径,广泛分布于神经系统,在细胞生长、分化、自噬和凋亡中发挥重要的调节作用[8-9]。2021 年6 月—2022 年9月,本研究观察了Dihexa 对实验性脑出血小鼠的神经保护作用,并通过PI3K-AKT 通路蛋白表达变化探讨相关机制。
1 材料与方法
1.1 实验动物与主要材料 6 ~ 8 周龄C57BL/6J小鼠110 只,体质量20 ~ 25 g,购于湖北省实验动物研究中心,许可证号SCXK(鄂)2020-0018。本研究通过西南医科大学实验动物福利伦理审查。Dihexa购于源叶公司,PI3K 选择性抑制剂wortmannin 购于MCE 公司,RIPA 总蛋白裂解液、BCA 蛋白浓度测定试剂盒、ECL 化学发光检测试剂盒、一抗稀释液、二抗稀释液均购自Aspen 公司,ELISA 试剂盒购于ELK Biotechnology 公司,普通光学显微镜购自Olympus公司。
1.2 动物分组处理及脑出血造模方法 以随机数字表法将小鼠分为假手术组、模型组、药物1 组、药物2组、抑制剂组,每组22只。模型组、药物1组、药物2 组、抑制剂组小鼠采用胶原酶法制备脑出血模型[10]。造模前小鼠适应性喂养7 d,禁食12 h,禁水4 h,常规称重,用6%水合氯醛(0.7 mL/kg)腹腔注射麻醉小鼠,将其固定在脑立体定位仪上,头部备皮,常规消毒,剪开皮肤;以前囟作为原点,向其前0.8 mm、右2.0 mm 处钻一直径为1 mm 小圆孔作为注射孔,将吸入胶原酶的微量注射器固定好;沿注射孔将针头垂直、缓慢插入脑实质,深度约3.5 mm;以0.5 μL/min 的速度注入胶原酶,注射完毕后停针10 min,缓慢向上拔针,每向上拔针1 mm停针5 min,直至全部拔出;最后用骨蜡封闭小孔,手术线缝合伤口,碘伏消毒。假手术组以生理盐水代替胶原酶,其余操作与其他组一致。造模后进行Longa评分,1 ~ 3分视为造模成功。造模成功后,药物1 组、药物2 组分别以Dihexa 1.44、2.88 mg/(kg·d)灌胃;抑制剂组每次给药前予wortmannin 0.5 mg/(kg·d)预处理90 min,再给予Dihexa 2.88 mg/(kg·d)灌胃;假手术组及模型组均给予等体积生理盐水灌胃。共给药3 d。
1.3 神经功能评分及脑组织含水量测定 给药3 d后根据改良Garcia评分评价各组大鼠神经功能障碍程度,评分越低表示神经功能障碍越严重。评分后处死小鼠,取脑组织。采用经典干湿重法测量各组小鼠脑组织含水量。取脑后以电子天平称湿重,置于100 ℃烤箱中,24 h 后测干重。脑组织含水量=(湿重-干重)/湿重×100%。
1.4 脑组织病理观察 每组取4 只小鼠,常规称重,过量麻醉,4%多聚甲醛灌注直至小鼠上半身僵硬,迅速断头取脑组织,脱水后甲醛固定,石蜡包埋,进行HE 染色,普通光学显微镜下观察脑组织病理改变,使用Olympus cell Sens Standard 显微镜图像软件采集图像。
1.5 脑组织炎症因子检测 取各组脑组织制成匀浆,按照ELISA试剂盒说明书操作,测定脑组织中的肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)。
1.6 脑组织神经细胞凋亡及凋亡相关蛋白检测TUNEL 染色观察神经细胞凋亡情况:取各组脑组织冰冻切片,采用0.3% Triton-X100 打孔,室温封闭1 h,PBS 清洗3 次;滴加一抗过夜,滴加TUNEL 反应液及荧光二抗混合液,37 ℃湿盒内避光孵育2 h,PBS 清洗3 次;滴加DAPI 染色液,封片,荧光显微镜下观察;每张切片随机取5个视野,计数横断面中的TUNEL 阳性细胞。Western blotting 法检测脑组织中的凋亡相关蛋白:取各组脑组织,加入蛋白裂解液,用组织匀浆仪匀浆,离心后取上清液,以BCA 蛋白浓度测定试剂盒测定总蛋白浓度;制胶、上样、转膜,以5%脱脂奶粉室温封闭1 h;加入一抗过夜,TBST清洗3次,加入二抗,室温下孵育,TBST清洗4次;滴加ECL 混合液,显色、曝光、显影、定影,保存胶片;以AlphaEaseFC 软件分析条带灰度值,以目的蛋白条带灰度值与内参GAPDH 灰度值的比值表示目的蛋白相对表达量。
1.7 脑组织中P13K/AKT 通路相关蛋白检测 采用Western blotting 法检测脑组织中的PI3K/AKT 通路蛋白,计算p-PI3K/PI3K、p-AKT/AKT,具体方法参考“1.6”。
1.8 统计学方法 采用SPSS25.0 软件进行统计分析。计量资料以±s表示,进行方差齐性检验,方差齐则多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用LSD 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠神经功能评分及脑组织含水量比较 与假手术组相比,模型组、药物1 组、药物2 组、抑制剂组神经功能评分降低,脑组织含水量升高(P均<0.05);模型组、药物1 组、药物2 组神经功能评分依次增高,脑组织含水量依次降低(P均<0.05);抑制剂组小鼠神经功能评分低于药物2组,脑组织含水量高于药物2组(P均<0.05)。见表1。
表1 各组小鼠神经功能评分及脑组织含水量比较(± s)

表1 各组小鼠神经功能评分及脑组织含水量比较(± s)
注:与假手术组相比,*P<0.05;与模型组相比,#P<0.05;与药物1组相比,△P<0.05;与药物2组相比,&P<0.05。
脑组织含水量(%)80.54 ± 0.41*#78.70 ± 0.36*#△81.78 ± 0.34*&82.12 ± 0.29*75.98 ± 0.62组别药物1组药物2组抑制剂组模型组假手术组n 22 22 22 22 22神经功能评分(分)12.45 ± 0.86*#14.13 ± 1.21*#△10.77 ± 1.19*&9.68 ± 0.84*17.36 ± 0.72
2.2 各组小鼠脑组织病理改变比较 各组小鼠脑组织HE 染色结果见图1。假手术组未见出血灶,细胞形态结构清晰、排列整齐。模型组可见大量红细胞,组织排列紊乱,细胞核固缩、溶解,细胞间隙增大,水肿明显。与模型组相比,药物2组大鼠脑组织结构致密,排列整齐,红细胞减少,炎症细胞聚集,细胞核固缩、溶解明显改善。药物1 组改变介于模型组和药物2 组之间。与药物2 组相比,抑制剂组脑组织病理损伤更严重,镜下见大量红细胞,组织排列紊乱,与模型组相比未见明显改善。
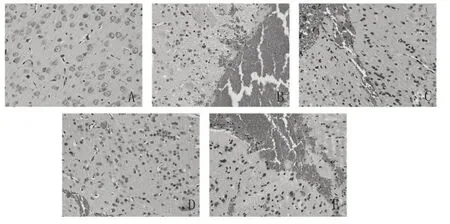
图1 各组小鼠脑组织病理改变(HE染色)
2.3 各组小鼠脑组织炎症因子表达比较 与假手术组相比,模型组、药物1 组、药物2 组、抑制剂组小鼠脑组织TNF-α、IL-1β 表达升高(P均<0.05)。模型组、药物1 组、药物2 组TNF-α、IL-1β 表达依次降低(P均<0.05)。抑制剂组TNF-α、IL-1β 表达低于药物2组(P<0.05)。见表2。
表2 各组小鼠脑组织TNF-α、IL-1β表达比较(pg/mL,± s)

表2 各组小鼠脑组织TNF-α、IL-1β表达比较(pg/mL,± s)
注:与假手术组相比,*P<0.05;与模型组相比,#P<0.05;与药物1组相比,△P<0.05;与药物2组相比,&P<0.05。
IL-1β 290.67 ± 19.28*#225.92 ± 21.02*#△471.28 ± 44.03*△&530.62 ± 59.71*130.41 ± 16.32组别药物1组药物2组抑制剂组模型组假手术组n 22 22 22 22 22 TNF-α 306.10 ± 21.59*#235.66 ± 26.06*#△375.90 ± 43.72*△&394.17 ± 51.50*107.54 ± 13.65
2.4 各组小鼠脑组织细胞凋亡率及凋亡相关蛋白表达比较 各组小鼠神经细胞TUNEL 染色结果见OSID 码图1。假手术组、模型组、药物1 组、药物2 组、抑制剂组小鼠脑组织神经细胞凋亡率分别为1.96% ± 0.26%、40.28% ± 2.76%、19.00% ± 2.25%、8.17% ± 1.12%、28.34% ± 4.52%。凋亡相关蛋白表达比较见表3。与假手术组相比,模型组、药物1 组、药物2 组、抑制剂组神经细胞凋亡率和cleaved-Capase3 表达增高,Bcl-2 蛋白表达降低(P均<0.05)。模型组、药物1 组、药物2 组神经细胞凋亡率及cleaved-Capase3 表达依次降低,Bcl-2 蛋白表达依次增高(P均<0.05)。抑制剂组凋亡率及cleaved-Capase3表达高于药物2组,Bcl-2蛋白表达低于药物2组(P均<0.05)。
2.5 各组小鼠脑组织PI3K-AKT 通路相关蛋白表达比较 与假手术组比较,模型组、药物1组、药物2组、抑制剂组小鼠脑组织中p-PI3K/PI3K、p-AKT/AKT 下降(P均<0.05)。模型组、药物1组、药物2组p-PI3K/PI3K、p-AKT/AKT 依次增高(P均<0.05)。抑制剂组p-PI3K/PI3K、p-AKT/AKT 低于药物2 组(P均<0.05)。见表3。
表3 各组小鼠脑组织凋亡相关蛋白及PI3K-AKT通路相关蛋白表达比较(± s)

表3 各组小鼠脑组织凋亡相关蛋白及PI3K-AKT通路相关蛋白表达比较(± s)
注:与假手术组相比,*P<0.05;与模型组相比,#P<0.05;与药物1组相比,△P<0.05;与药物2组相比,&P<0.05。
组别药物1组药物2组抑制剂组模型组假手术组P-AKT/AKT 0.91 ± 0.22*#1.92 ± 0.25*#△0.19 ± 0.04*△&0.10 ± 0.37*2.18 ± 0.39 n 22 22 22 22 22 cleaved-Caspase3 0.44 ± 0.05*#0.17 ± 0.03*#△0.64 ± 0.07*△&0.77 ± 0.09*0.11 ± 0.02 Bcl-2 0.34 ± 0.06*#0.54 ± 0.08*#△0.12 ± 0.35*△&0.08 ± 0.01*0.79 ± 0.09 P-PI3K/PI3K 0.24 ± 0.59*#0.44 ± 0.86*#△0.06 ± 0.01*△&0.05 ± 0.22*0.79 ± 0.10
3 讨论
脑出血尚无特效治疗手段,在临床上即使进行血肿清除术,大多数患者预后也无法得到明显改善[10]。肾素—血管紧张素系统是重要的酶—神经肽系统之一。Ang Ⅳ是由是Ang Ⅱ经过两次蛋白水解而来的六肽片段,在机体内广泛分布,被认为与神经系统疾病发病密切相关,可能成为神经系统疾病潜在的治疗靶点[3,11-12]。
脑出血后红细胞及其产物被释放到脑组织中,可迅速激活炎症通路,引起炎症细胞募集和激活,TNF-α、IL-1β等炎症因子释放,TNF-α、IL-1β可通过触发黏附分子、趋化因子释放等破坏血脑屏障完整性,加重脑组织水肿,诱导细胞凋亡[13-14]。在本实验中,模型组小鼠神经功能评分显著降低,脑组织含水量增加,HE 染色显示神经细胞核固缩溶解,间隙明显水肿,在血肿周围脑组织中检测到TNF-α、IL-1β明显升高,表明炎症反应参与了脑出血后的病理损伤过程。相关研究表明,在心肌梗死模型中,Ang Ⅳ可以抑制炎症反应,减少心肌细胞凋亡,延缓心肌梗死后的心室重塑[15]。本研究发现,Ang Ⅳ类似物Dihexa 可以剂量依赖性减轻脑组织炎症反应,降低炎症因子TNF-α、IL-1β 在血肿周围组织的表达,具有较好的抗炎效应。
血肿周围神经元凋亡是早期脑损伤的机制之一,脑出血后活性氧、兴奋性氨基酸大量释放、Ca2+内流增加,引起线粒体膜功能障碍,细胞色素C从膜间隙丢失,与凋亡蛋白酶活化因子1结合,促进凋亡小体形成,激活下游Caspase 信号通路,引起神经细胞凋亡增加[16-18]。细胞凋亡又会使外周巨噬细胞、中性粒细胞等向血肿周围浸润,进一步加重组织炎症损伤[19]。本实验中,模型组小鼠神经细胞凋亡率升高,促凋亡蛋白cleaved-Caspase3 表达上调而抗凋亡蛋白Bcl-2 表达下降,不同剂量的Dihexa 作用后,神经细胞凋亡减少,促凋亡蛋白表达降低而抗凋亡蛋白表达增加,提示凋亡相关蛋白表达失衡导致神经细胞凋亡增加可能是脑组织损伤的重要原因,Dihexa可以调节凋亡蛋白表达,抑制神经细胞凋亡。
PI3K-AKT通路是机体内经典的信号转导通路,在细胞生长、分化、自噬和凋亡中发挥重要的调节作用,其生物学效应可能是通过增加抗凋亡蛋白Bcl-2活性、抑制促凋亡蛋白Caspase 家族激活、激活NF-κB、促进细胞增殖、调节线粒体释放细胞色素C和凋亡诱导因子等实现的[20-22]。在脑出血动物模型中,PI3K-AKT 通路蛋白磷酸化水平明显下降,神经细胞凋亡增加,提示调节该通路蛋白表达可能对抑制脑出血早期细胞凋亡有积极作用[23]。本实验中,模型组小鼠血肿周围神经细胞凋亡率升高,脑组织p-PI3K、p-AKT 表达下降,也表明PI3K-AKT 通路参与了继发性损伤过程。大量研究证实,在脑出血早期,许多药物可以通过上调PI3K-AKT 通路蛋白的磷酸化水平从而减轻神经功能损伤,减少细胞凋亡,而PI3K 的选择性抑制剂wortmannin、LY294002等可以阻断药物的抗炎、抗凋亡效应[24-25]。研究表明,在阿尔茨海默病模型小鼠中,Dihexa 可通过上调脑组织中PI3K-AKT 通路蛋白磷酸化水平从而改善认知功能;而且,Dihexa 可降低小胶质细胞标志物Iba-1表达,提示其可能对小胶质细胞的分化也具有调控作用[7]。本研究也发现,Dihexa 作用后,PI3K-AKT通路蛋白磷酸化水平增高,而PI3K 特异性抑制剂wortmannin 能够逆转高剂量Dihexa 的抗炎、抗凋亡作用,提示Dihexa 对脑出血小鼠的治疗作用可能与激活PI3K-AKT 通路、影响其下游信号转导有关。本研究并未深入探讨Dihexa 在脑出血后是否能通过影响小胶质细胞分化极性从而调节炎症因子水平,有待未来进一步探索。
综上所述,Ang Ⅳ类似物Dihexa 可以剂量依赖性减轻脑出血小鼠神经细胞凋亡和炎症反应,保护神经功能,其作用机制可能与调控PI3K-AKT 通路有关。上述研究结果有望为脑出血后继发性损伤的治疗提供新的思路。

