亚精胺对盐胁迫下黄华占水稻幼苗根系抗氧化酶活性及Na+稳态的影响
黄婷婷 郑殿峰 冯乃杰 赵黎明 周鸿凯 沈雪峰*
(1 广东海洋大学 滨海农业学院,广东 湛江 524088;2 国家耐盐碱水稻技术创新中心 华南中心,广东 湛江 524088;*通讯作者)
近年来,土壤盐渍化问题已经引起国内外学者的广泛关注,全球20%以上的耕地受到盐胁迫的影响,且数量还在增加[1]。其中,中国盐渍土总面积为3.6×107hm2,占可耕地总面积的4.88%,且还有9.2×107hm2的耕地正面临着盐渍化的危害[2]。全球农业正面临重大挑战,到2050 年,全世界将新增23 亿人口,粮食作物产量需增加70%[3]。可见,盐胁迫是限制粮食作物生产的重要问题,是世界范围内影响作物产量的最重要环境压力之一。
水稻是全球重要的粮食作物之一,也是对盐胁迫较为敏感的作物,随着全球气候变暖及生态环境不断恶化,水稻生长过程中遭受干旱、高盐等非生物胁迫在增加[4]。盐胁迫作为主要的非生物胁迫之一,严重影响水稻的生长发育[5]。植物盐胁迫一般表现为渗透胁迫和离子毒害两个阶段,引起植株体内活性氧破坏、膜系统损伤、光合和呼吸作用受抑制、酶活性降低等,表现为植株矮小、叶片黄化,最终导致粮食产量、品质的下降[6-7]。多胺(Polyamines,PAs)主要包括腐胺(二胺,Putrescine,Put)、亚精胺(三胺,Spermidine,Spd)和精胺(四胺,Spermine,Spm),是生物代谢过程中产生的一类具有生物活性的低分子量脂肪族含氮碱,广泛作用于高等植物的生长发育、形态建成、防止衰老、抵抗环境胁迫等方面[8]。大量研究表明,外源Spd 能够在一定程度上缓解盐胁迫对植物生长的抑制效应[9-12]。但目前关于盐胁迫条件下施用外源Spd 对水稻根系生长的影响报道较少。本文以水稻为研究对象,探讨在盐胁迫下外源Spd 对水稻幼苗根系的抗氧化防御和Na+稳态的影响,为盐胁迫下水稻的科学栽培提供依据。
1 材料与方法
1.1 试验材料
供试水稻品种为黄华占,由广东省农业科学院水稻研究所提供。化学试剂有:2',7'-二氯二氢荧光素二乙酸酯(2,7 -Dichlorodi -hydrofluorescein diacetate,DCFH-DA)和二氢乙啶(Dihydroethidium, DHE),购于北京索莱宝科技有限公司;羟基苯基荧光素(HPF)和SBFI AM(Na+Indicator)钠离子指示探针,购于上海懋康生物科技有限公司。
1.2 试验设计
本试验于2021 年3 月至7 月在广东海洋大学兴农楼112 室进行。挑选籽粒饱满、大小相似的水稻种子,经5%的过氧化氢消毒15 min 后,用去离子水冲洗3~5 遍,置于恒温培养箱中(28 ℃)培养并催芽1 d,从中挑选露白一致的种子,将其放置于含有1/2 倍Hoagland 营养液发芽盒中进行培养。
试验分为3 部分进行:①NaCl 对水稻幼苗根系的影响。水稻种子催芽1 d 后,取露白一致的种子,分别定植于含有0、25、50、100、150 和200 mmol/L NaCl 浓度梯度的1/2 Hoagland 营养液的发芽盒中进行培养,设置6 次重复,72 h 后取样、测定植株生长指标。②外源Spd 对NaCl 胁迫下水稻幼苗根系生长的影响。水稻种子催芽1 d 后,依据试验①筛选出的盐浓度,分别加入0、0.1、0.2、0.3、0.4 和0.5 mmol/L Spd 溶 液 的1/2 Hoagland 营养液的发芽盒中培养,试验设置5 次重复,72 h 后取样,测定植株生长指标。③外源Spd 对盐胁迫下水稻幼苗根系的抗氧化防御和Na+稳态的影响。水稻种子催芽1 d 后,依据试验①和试验②筛选出的NaCl浓度和Spd 浓度,设置4 个处理:仅用营养液(CK)、0.1 mmol/L Spd、100 mmol/L NaCl、100 mmol/L NaCl + 0.1 mmol/L Spd。每个处理5 次重复,120 h 后测定根长,并取根样进行生理分析和组织化学检测。
1.3 测定指标及方法
1.3.1 组织化学检测
分别采用荧光探针DCFH-DA、DHE、HPF 检测水稻幼苗根尖细胞中的总ROS、·O2-、H2O2含量。应用钠离子指示探针测定幼苗根尖细胞中的Na+含量[13-14]。
1.3.2 生理指标
于水稻培养72 h 后,进行根系取样,立即置于液氮中速冻,移至-20 ℃冰箱保存,待测。通过测定硝基蓝四唑(NBT)的光化学还原测定SOD 活性:反应混合物(3 mL)由酶提液(30 μL)、PBS(50 mmol/L, pH 7.8)、EDTA(3 mmol/L)、核黄素(60 μmol/L)、NBT(2.25 μmol/L)和甲硫氨酸(14.5 mmol/L)组成。测定560 nm 波长下的吸光度,计算SOD 活性(1 单位)作为酶促量,得到最大NBT 还原抑制量的一半。
通过测定CAT 对H2O2的分解能力来测定其活性:将30%的H2O2加入含50 mmol/L、pH 7.8、10 mL 的PBS 和酶提液的反应混合液中,立即记录在240 nm 处的吸光度。CAT 活性以每分钟分解H2O2(1 mol)的酶量来量化。
通过测定POD 对H2O2的氧化能力来测定其活性:将愈创木酚加入PBS(pH 6.0,0.2 mol/L)缓冲液中,于磁力搅拌器上加热搅拌,直至溶解,待溶液冷却后加入19 μL 30%的H2O2。取3 mL 反应液并加入40 μL 酶液后,通过测定470 nm 下吸光值变化,测定过氧化物酶活性。
根据丙二醛(MDA)在高温、酸性条件下与硫代巴比妥酸(TBA)反应,形成在532 nm 波长处有最大光吸收的三甲基复合物。分别于450、532 和600 nm 波长下测定OD 值,确定MDA 含量。
1.3.3 数据处理
采用Image pro-plus 6.0 对荧光图片进行定量分析,经SPSS 23.0 进行方差分析,由Excel 2013 作图,进行单因素方差(ANOVA)的Duncan 显著性分析(p<0.05)。
2 结果与分析
2.1 不同浓度NaCl 和Spd 对水稻幼苗根系生长的影响
由图1 可知,随着NaC1 浓度的升高,水稻幼苗的根长呈现先升高后降低的趋势。其中,25 mmol/L NaC1处理下根长最长,与对照相比,50、100、150 和200 mmol/L NaC1 处理下根长显著降低,分别下降86.95%、91.83%、93.37%和94.24%。盐胁迫条件下,施用外源Spd 水稻幼苗的根长均有不同程度增加,且随着Spd浓度增加呈先上升后下降趋势(图2)。与对照相比,施用0.10 mmol/L Spd 处理的水稻幼苗根长增加13.38%,达到显著水平;而施用0.50 mmol/L Spd 处理抑制作用最强,根长与对照相比显著降低25.75%。因此,选择100 mmol/L NaCl 和0.10 mmol/L Spd 作为后续试验处理浓度。
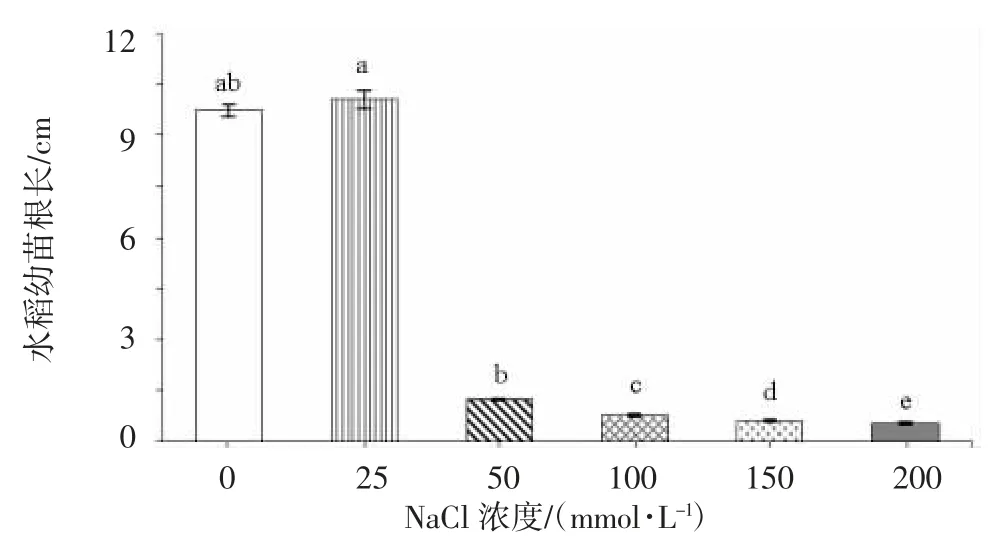
图1 不同浓度NaCl 对水稻幼苗根系生长的影响
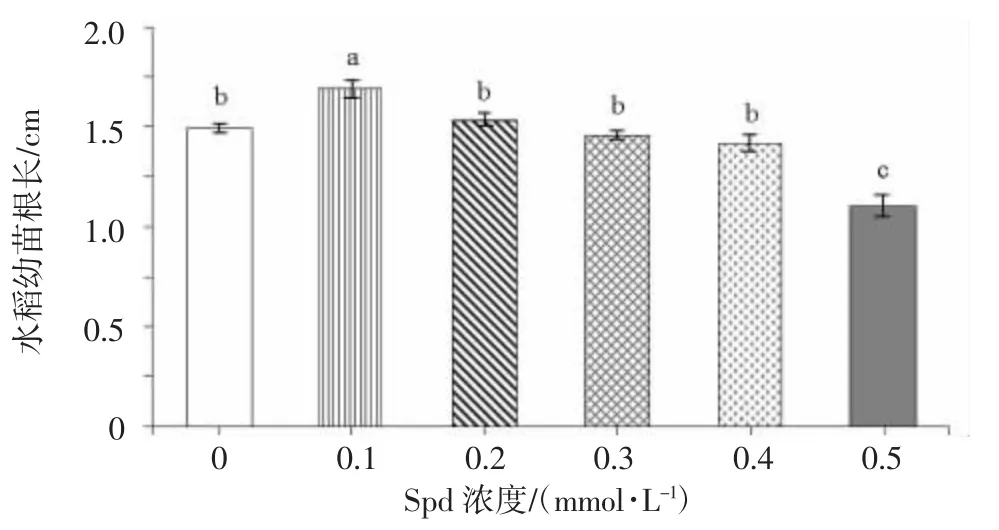
图2 不同浓度Spd 对盐胁迫下水稻幼苗根系生长的影响
2.2 外源Spd 对盐胁迫下水稻幼苗根系生长的影响
由图3 可以看出,与对照相比,NaCl 处理水稻幼苗根长显著下降23.79%。与NaCl 处理相比,Spd+NaCl 处理幼苗根长显著增加14.62%。说明外源Spd 能够缓解盐胁迫对水稻根系生长的抑制作用。
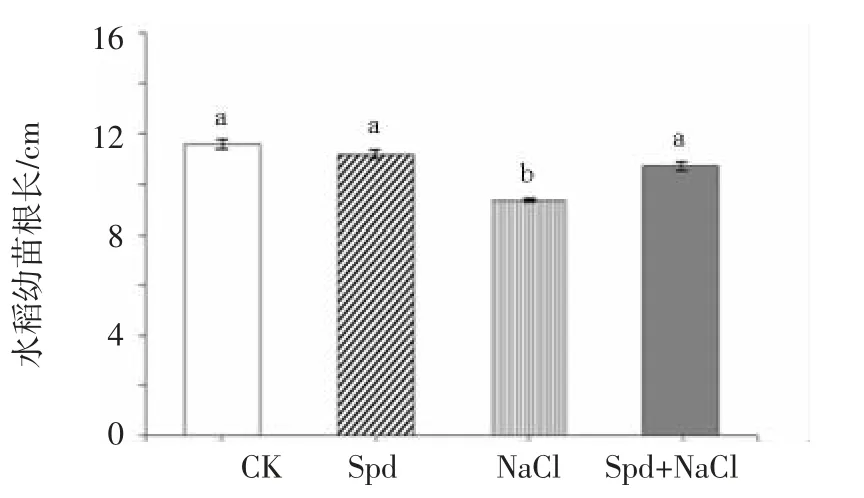
图3 外源Spd 对盐胁迫下水稻幼苗根系生长的影响
2.3 外源Spd 对盐胁迫下水稻幼苗根系中ROS、·O2-、H2O2 生成的影响
由图4 可知,与对照相比,NaCl 处理下水稻幼苗根系的DCF(2',7'-二氯荧光素)荧光密度增加120.51%,幼苗根系中H2O2和·O2-水平分别增加29.52%和18.68%,均达到显著水平;与NaCl 处理相比,Spd+NaCl处理下幼苗根系的DCF 荧光密度显著降低31.54%,H2O2水平和·O2-水平显著降低16.39%和14.36%。可见,外源Spd 能够在一定程度上抑制NaCl 诱导的ROS在水稻幼苗根系中的积累。

图4 外源Spd 对盐胁迫下水稻幼苗根系中H2O2、·O2-和ROS的影响
2.4 外源Spd 对盐胁迫下水稻幼苗抗氧化酶活性的影响
由图5 可以看出,与对照相比,NaCl 处理水稻幼苗根系中的CAT 和POD 活性分别显著降低54.28%和20.36%;与NaCl 处理相比,Spd+NaCl 处理幼苗根系中的CAT 和POD 活性分别显著升高36.21%和22.25%。但不同处理间的SOD 酶活性差异不显著。可见,外源Spd 能够在一定程度抑制NaCl 诱导的水稻幼苗根系抗氧化酶活性,提高其清除体内活性氧能力,有效降低氧化伤害程度。
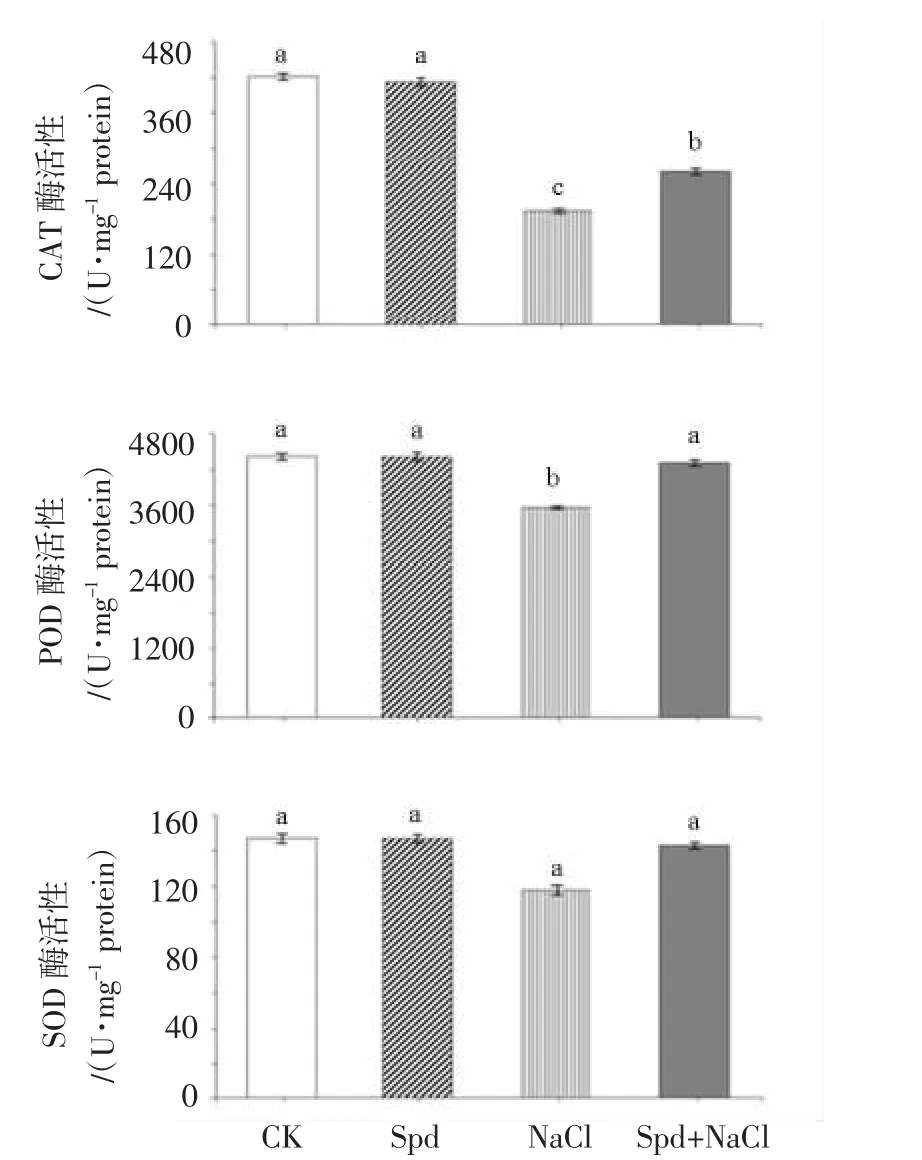
图5 外源Spd 对盐胁迫下水稻幼苗根系抗氧化酶活性的影响
2.5 外源Spd 对盐胁迫下水稻幼苗MDA 含量的影响
由图6 可以看出,与对照相比,NaCl 处理水稻幼苗根系中的MDA 含量显著增加149.88%;与NaCl 处理相比,Spd+NaCl 处理幼苗根系中MDA 含量显著降低31.01%。这说明外源Spd 能有效降低盐胁迫下活性氧引起的伤害,进而缓解膜脂过氧化伤害,降低细胞膜的受损程度。

图6 外源Spd 对盐胁迫下水稻幼苗根系MDA 含量的影响
2.6 外源Spd 对盐胁迫下水稻幼苗Na+的影响
由图7 可知,与对照相比,NaCl 处理水稻幼苗根系中Na+荧光密度显著增加35.52%。与NaCl 处理相比,Spd+NaCl 处理根系中Na+荧光密度显著下降13.31%。说明外源Spd 可以减少根系中过多的Na+,从而维持细胞稳态。
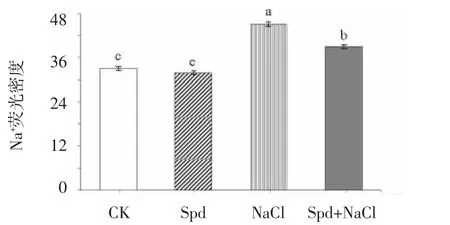
图7 外源Spd 处理对盐胁迫下水稻幼苗根系Na+荧光密度的影响
3 讨论
盐胁迫是限制水稻生长和产量形成的主要非生物胁迫之一[15]。大量研究表明,盐胁迫抑制水稻种子的萌发、幼苗的生长和根系的建成[6-7,11]。本研究中,50 mmol/L及以上浓度NaCl 处理显著降低水稻幼苗的根长,这与王燕等[9]的报道一致。
Spd 作为一种生理活性物质,在参与调控植物各种抗逆性中发挥重要作用[16]。研究发现,施用外源Spd提高幼苗抗氧化和渗透调节能力,维持叶片PSII 的活性和电子传递链的稳定性,提高光合作用,减轻离子毒害,有效提高水稻、燕麦、甜高粱等作物的耐盐性[9-12]。本试验中,在100 mmol/L NaCl 条件下,施加0.10 mmol/L Spd 能够缓解盐胁迫诱导的根系生长抑制效应,这与李瑶等[7]采用调环酸钙提高水稻幼苗盐胁迫的研究结果一致。
在非生物逆境胁迫下,植物体内大量积累活性氧(ROS),而过量的活性氧往往引起蛋白质、脂质、碳水化合物甚至DNA 的破坏,造成植物细胞严重损坏甚至死亡[17-18]。本研究发现,与对照相比,NaCl 处理下水稻幼苗根系的ROS、·O2-和H2O2的含量显著上升,且MDA 水平也随着升高。这与邹芳等[12]盐胁迫处理甜高粱的结果一致。抗氧化酶是植物体内ROS 清除系统,主要通过SOD、CAT 和POD 保护酶发挥作用,平衡细胞内部的ROS[6]。首先由SOD 将·O2-歧化为H2O2和O2,再经CAT 和POD 将H2O2转化为H2O 和O2。本研究中,SOD 酶活性无变化,而CAT 和POD 酶活性显著降低,这与刘玲等[9]研究结果一致。本研究中,在100 mmol/L NaCl 条件下,施加0.1 mmol/L Spd 处理能够显著增强水稻幼苗根系中SOD、POD 和CAT 活性,MDA含量同步下降,这与海霞等[10]的研究结果一致。
在盐胁迫条件下,保持植株体以及细胞内的离子平衡是至关重要的。盐生植物可以通过自身的Na+排除和Na+分隔来解毒过量的Na+[19]。本研究中,在100 mmol/L NaCl 条件下,施加0.1 mmol/L Spd 处理可以显著降低水稻幼苗根系中Na+的含量,这与海霞等[10]的报道一致。
4 结论
综上所述,在100 mmol/L NaCl 条件下,施加0.1 mmol·L-1Spd 处理,显著提高水稻幼苗根系中SOD、POD、CAT 等抗氧化酶活性,降低ROS、·O2-和H2O2含量、MDA 生成量和Na+含量,减轻盐胁迫下的氧化损伤,维持细胞膜稳定性。可见,0.10 mmol/L Spd 处理可以修复水稻幼苗因渗透胁迫和离子毒害引起的伤害,维持生理代谢和生化反应的稳定状态,以增强水稻幼苗根系的抗盐性。

