小鼠颈部异位心脏移植模型的初步探索
刘一纬 杨鹏杰 魏起友
器官移植已成为治疗终末期器官衰竭最有效的方法[1]。2022年1月7日,马里兰大学医学院成功完成了一例猪心异种移植[2]。自1973年Corry等[3]首次建立小鼠心脏移植模型以来,如今常用的移植模型分为两种,即腹部心脏移植和颈部心脏移植[4~6]。颈部解剖结构简单,便于日后观察供体心脏活动状态;颈部创口小,全身反应轻,相比之下腹腔移植创伤大、时间长、感染概率高、肠管粘连可能性大[7]。在颈部移植模型中,袖套法(cuff技术)更适用于初学者,降低了手术难度,有效减少供心缺血时间[8]。因此,笔者对小鼠颈部心脏移植模型进行探索,总结建模经验,分析要点难点,为研究移植免疫学打下基础。
材料与方法
1.材料:选用近交系雄性C57BL/6小鼠和BALB/c小鼠,8~12周龄,体质量为20~22g,购自内蒙古医科大学实验动物中心,并于内蒙古医科大学实验动物中心饲养,环境符合SPF级标准,实验动物生产许可证号:SCXK(蒙)2020-0001,实验动物使用许可证号:SYXK(蒙)2020-0003。单人双目体视显微镜购自深圳奥斯微光学仪器有限公司;显微手术器械购自上海医疗器械有限公司手术器械厂;4-0非吸收缝线购自扬州富达医疗器械有限公司;10-0带针缝合线购自宁波医用缝针有限公司;0.3mm×0.6mm、0.6mm×0.8mm四氟毛细管购自上海俊隆装饰工程有限公司;0.4mm×0.5mm、0.8mm×1.0mm硬塑料毛细管购自南通伊诺精密塑胶导管有限公司;水合氯醛、HE染液试剂盒购自北京索莱宝科技有限公司;肝素钠注射液购自天津生物化学制药有限公司;4%多聚甲醛固定液购自福州白鲸生物科技有限公司。
2.供体手术:小鼠麻醉(采用5%水合氯醛0.07ml/10g腹腔注射)、备皮、固定、消毒、铺单,沿腹正中线剪开皮肤、肌肉,推开肠管找出下腔静脉。下腔静脉注射预冷(4℃)的肝素盐水(100U/ml)1ml,等待1min后小鼠全身血液肝素化,剪断下腔静脉和腹主动脉放血。向上剪开膈肌,沿两侧腋中线剪断肋骨,成倒“U”型打开胸腔暴露心脏,撕开心包膜使用冰盐水(4℃ 0.9%氯化钠溶液)滴注小鼠心脏,心跳逐渐缓慢至暂停。分离主动脉、肺动脉并于远心端分叉处剪断,使用10-0缝合线将上下腔静脉、肺静脉、左心耳集束结扎后剪去相应血管及组织,取下供心放置于4℃ 0.9%氯化钠溶液中保存。
受体手术:小鼠麻醉(采用5%水合氯醛0.07ml/10g腹腔注射)、备皮、固定、消毒、铺单,沿右锁骨中线向上、下方切开颈部皮肤,上至小鼠下颌骨,下至锁骨下0.5cm,暴露下颌腺并摘除。分离脂肪组织,游离颈外静脉,于颈外静脉远心端分叉处用10-0缝合线结扎,近心端分离至锁骨上方,用10-0缝合线打活结备用。去除胸锁乳突肌,游离颈总动脉于远心端分叉处用10-0缝合线结扎,近心端使用微型动脉夹夹闭血流。分别于远心端结扎处剪断颈动、静脉,将血管断端从备好的套管内部穿过,张开血管壁向外翻转使其完全包裹套管,成功后用10-0缝合线结扎固定,使用肝素盐水(100U/ml)冲洗血管套管端口预防血栓形成(图1)。
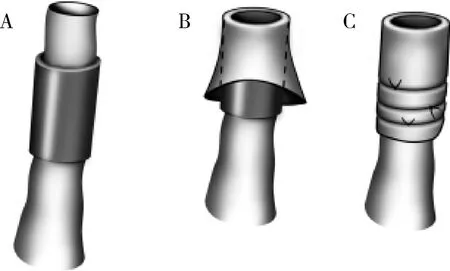
图1 血管套管外翻过程A.血管穿过套管;B.血管壁外翻;C.血管套管结扎
连接与术后:在受体颈动、静脉血管套管下方放置10-0缝合线。将供心移至受体颈部,张开供心肺动脉断端完全包裹受体颈静脉套管端口,使血管套管进入肺动脉内,用预埋的10-0缝合线结扎肺动脉和颈静脉完成静脉连接。动脉连接方法与静脉相同,供心主动脉包裹受体颈动脉端口完成套入,结扎连接。血管连接完成后,松开颈静脉根部活结,打开颈动脉根部微型动脉夹,血液流通,供心滴注37℃ 0.9%氯化钠溶液复温,30~60s后可见供心复跳并逐渐恢复正常节律,用4-0缝线缝合颈部皮肤,伤口常规消毒。若术中出血过多,可皮下注射37℃ 0.9%氯化钠溶液0.5~1.0ml补液,术后将小鼠放置于洁净鼠笼内,25℃恒温复苏, 30~60min后小鼠苏醒,正常饮水饲料喂养,每日观察供心活动情况(心率、节律、强度),详见图2。
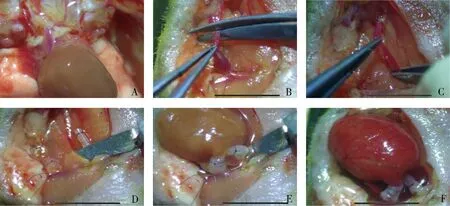
图2 心脏移植过程A.供体心脏;B.剪断颈静脉;C.夹闭颈动脉;D.外翻结扎;E.心脏连接;F.恢复跳动
3.失败原因记录:第1阶段为训练阶段,指从零开始(无显微外科基础、无实验动物模型建立经验)至第1例模型建立成功(术后供心复跳,小鼠活动正常,持续3天以上视为手术成功,3天内供心停跳或小鼠死亡视为手术失败),统计每例小鼠死亡失败原因。
4.分组处理:第2阶段将小鼠按品系随机分为同系组和模型组,同系组:C57BL/6小鼠作为供、受体;模型组:BALB/c小鼠为供体,C57BL/6小鼠为受体。每组完成18对小鼠模型,其中随机选取9只统计供心存活时间,余下9只术后第7日取移植物组织。纳入标准:术后供心复跳顺利,心率、节律、强度正常,小鼠精神状态良好、行为活动正常,持续3天以上视为手术成功,3天内供心停跳或小鼠死亡视为手术失败,不计入统计。
5.心脏移植物存活时间:从术后第1天开始计算移植物存活时间,每天经小鼠颈部触摸移植心脏跳动情况,心脏停跳视为移植物死亡,记录存活时间(n=9)。
6.标本取材及HE染色:术后第7天取出供心,置于4%多聚甲醛固定液中,固定48h后按HE染液试剂盒说明书进行移植物心肌组织染色、封片。根据国际心肺移植学会(ISHLT)2004年修订版的排斥反应诊断标准(表1),光学显微镜下观察并记录移植心脏急性排斥反应组织病理学分级(n=9)[9]。
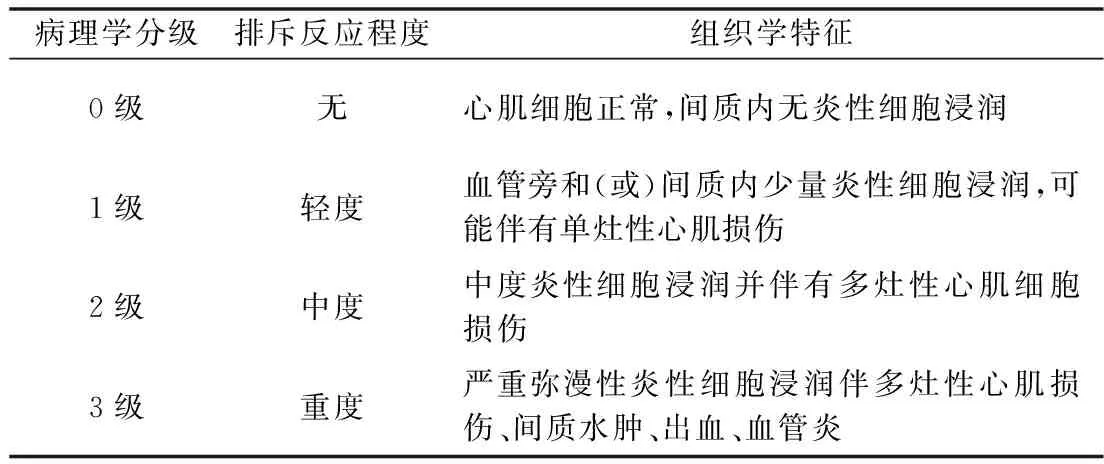
表1 移植排斥反应诊断标准(ISHLT2004年修订版)

结 果
1.失败原因比较:训练阶段共进行119次小鼠心脏移植手术,失败原因按出现前后顺序依次为:麻醉意外(14例,11.76%)、解剖结构不熟和显微外科水平低(总结为手术操作不当,23例,19.33%)、血管套管外翻失败(36例,30.25%)、供心结扎口出血(17例,14.29%)、静脉连接处淤血(15例,12.61%)、环境温度过低(3例,2.52%)、术后感染(9例,7.56%)和其他原因(2例,1.68%),详见表2。
2.移植物生存期比较:生存期观察以30天为终止,同系组9只全部存活,模型组存活时间(7.44±1.01天)较同系组明显缩短,差异有统计学意义(P<0.01),详见图3。
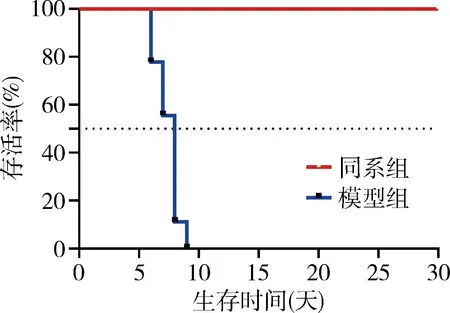
图3 生存曲线
3.移植物排斥反应程度比较:供心组织HE 染色后在 200 倍光学显微镜下观察可见同系组心肌细胞结构基本完整,炎性细胞浸润较少,病理分级多为0~1级(0级6只,1级3只);模型组呈现中到重度急性排斥反应现象,心肌细胞结构受损,间质水肿、出血,大量炎性细胞浸润,病理分级多为3~4级(3级4只,4级5只),其排斥反应病理分级明显高于同系组,差异有统计学意义(P<0.01),详见图4。
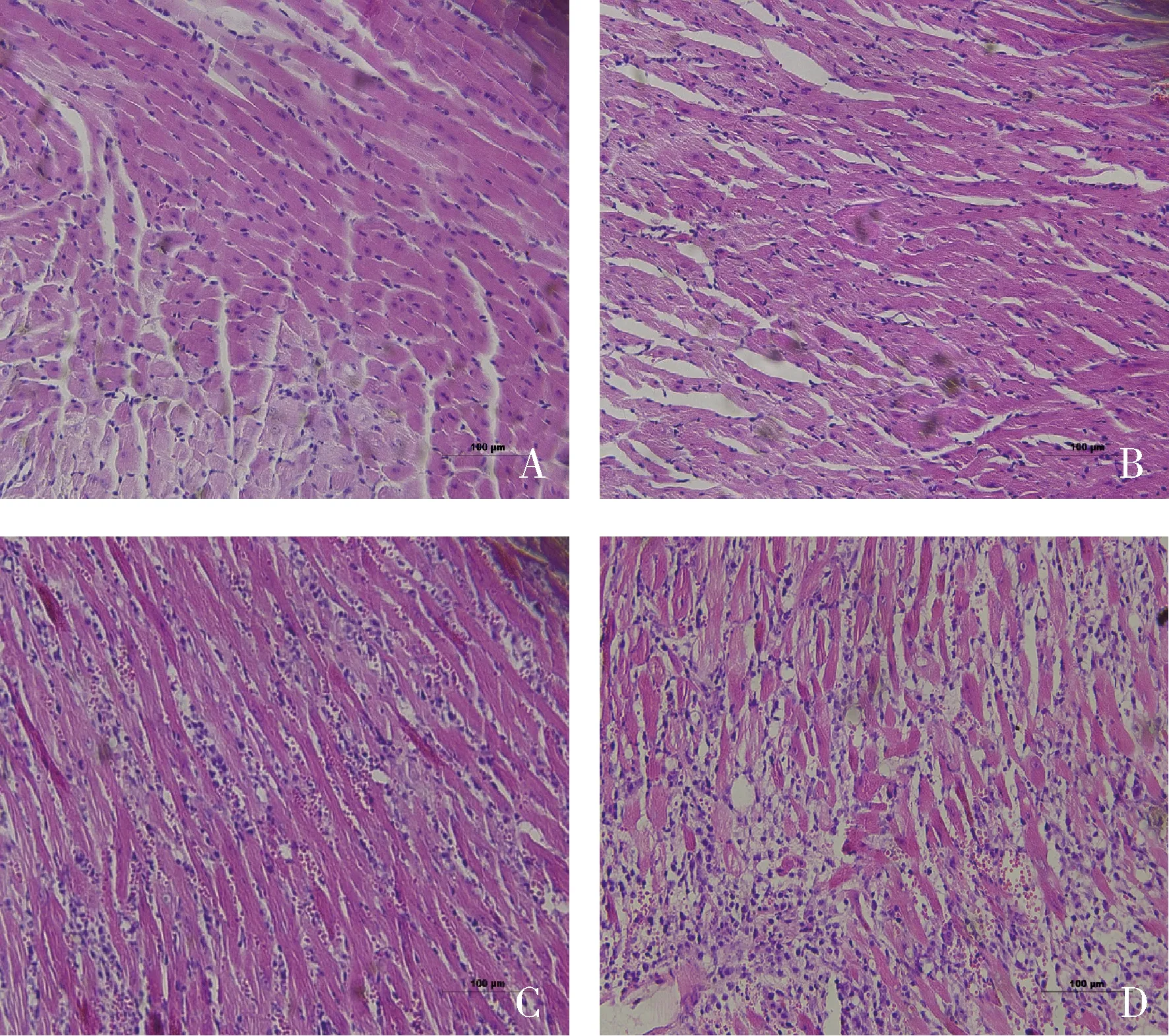
图4 供心排斥反应组织病理学检查(HE染色,×200)A、B.同系组,两图为同一组中不同个体的病理表现;C、D.模型组,两图为同一组中不同个体的病理表现
讨 论
本实验成功建立了小鼠颈部异位心脏移植模型,血管套管外翻是建模的重点难点,特别是颈动、静脉血管的外翻操作[10]。因外翻失败造成小鼠死亡36例,发生率为30.25%,是引起实验失败发生率最高的原因。当下套管常采用静脉留置针导管制作而成,静脉留置针导管外壁光滑,在血管内可自由滑动;导管材质软,可随血管进行一定程度曲折且更注重导管外径,无内径数据[11,12]。颈部血管套管外翻时因套管未固定,始终处于摇摆状态造成外翻困难,若使用静脉留置针导管,无详细内径数据不利于实验研究,导管外壁光滑外翻后易滑动脱出,材质软易曲折,更增加了外翻时晃动、弯折概率。考虑以上原因实验初期选取质地更硬的四氟毛细管,根据血管粗细动脉选用0.3mm×0.6mm套管,静脉选用0.6mm×1.0mm套管。循环血经供心流出后,动脉血变为静脉血,血压较低,若套管内径不足易造成静脉阻塞淤血,供心右心淤血复跳失败,此原因造成小鼠死亡15例,发生率为12.61%。此外实验前期采用微型动脉夹夹闭静脉血流,由于动脉夹张力过大,松开后静脉内壁粘连无法复张,进一步导致静脉淤血,遂后期采用10-0缝合线打活结的方式阻断静脉血流,同时换用硬塑料毛细管,0.8mm×1.0mm套管作为静脉管,0.4mm×0.5mm套管作为动脉管,改善了连接后静脉淤血的情况。更换套管后,外径变小动脉血管外翻时间缩短,也使得供心连接时动脉端口更容易套入主动脉内,节省了供心连接时间。因此在保持套管内径的基础上,选用外径小、管壁薄但材质偏硬的套管,可以使血管外翻更加简单、快速,避免静脉淤血,提高成功率,节省手术时间。
操作过程中可能因解剖不熟练造成下颌腺及胸锁乳突肌出血、供心主肺动脉撕裂、受体颈动静脉破损等情况,此阶段因手术操作不当致死23例,占总数的19.33%,是造成手术失败的第2大原因。显微外科技术(镜下操作感、分离、打结、带线、外翻等)需要花费时间练习,特别是对于没有显微外科基础的初学者,会造成更高的死亡率和失败率。开始可以先在镜下无实物练习,适应操作感后用纱布练习缝合打结等基础操作,最后再使用实验动物进行手术。小鼠解剖结构独特,右下颌腺血管位于腺体右上方,可自左下钝性分离后去除;颈静脉分支较多、胸锁乳突肌深部血管及供心主肺动脉根部分离等均是易造成失败的原因。
供心的摘取方式分为集束结扎和单独结扎两类[13]。集束结扎是指供心切断主动脉、肺动脉后,一次性结扎除这两根血管之外的其余血管,优点在于操作简单,摘取速度快,减少供心缺血时间,利于复跳和长期存活,但缺点在于此法易形成出血。集束结扎一次结扎较多血管,若结扎后剪血管时残端过短,易造成结扎口内有血管、组织脱出,使连接成功后供心出血。单独结扎是指分别结扎上、下腔静脉和左、右肺静脉,优点在于解决了集束结扎易出血的问题,减少失败概率,但缺点在于操作时间较长、供心缺血时间延长。本研究采用集束结扎法,训练阶段因出血致死17例,发生率14.29%,注意结扎时打4~5个结,同时结扎左心耳,且务必在剪断多余血管时保留较长残端,可避免供心出血的情况发生,此法使得供心恢复血流后复跳良好,未出现因冷缺血时间过长而导致的复跳失败。另外供体手术的充分肝素化(预防血栓形成)和整个过程供心的低温状态也是需要注意的细节。
文献中大多数动物模型均采用水合氯醛麻醉,本实验麻醉剂量为5%水合氯醛(0.07ml/10g)腹腔注射[14,15]。从效果来看,麻醉致死14例(11.76%),主要原因在于小鼠个体对水合氯醛的耐受性差异较大,麻醉药物剂量依据小鼠体重而无法做到个体化给药,造成麻醉过深或过浅的结果。同时动物麻醉后,静脉血管扩张回流减少、心率血压下降、体温降低,在手术过程中及术后应注意保温,温度过低可能造成小鼠术中死亡和术后无法苏醒,环境温度过低造成3例死亡,发生率为2.52%,注意保温即可避免此类事件的发生。把握麻药剂量酌情给药,手术环境及术后保温是实施麻醉时应注意的关键点。同时寻找、研发一种新型的,具有更好麻醉效能和更少不良反应的麻醉药物,具有重要意义。
术后感染造成9例小鼠死亡,发生率为7.56%。在小鼠颈部心脏移植模型中,手术部位较清洁,继发感染情况较少,进行无菌手术后无需使用抗生素干预,严格执行无菌操作,提升手术间无菌环境即可。使用袖套法进行心脏移植,术后无血栓生成、无血管漏血渗血等情况发生,避免了吻合法在吻合口附近易继发血栓影响术后血运通畅及血管断端对合不良或针距偏大漏血等影响手术成功率的风险[16]。
第2阶段进行分组对照研究,同系组移植物长期存活,无明显排斥情况,模型组移植物存活时间短,排斥情况严重,其病理表现多为心肌细胞损伤、血管炎,间质水肿、出血,伴大量炎性细胞浸润,是影响移植物早期存活的主要原因。在同种异体移植情况下,急性排斥反应的发生难以避免,且多发生于早期,移植术后5~7天即有明显现象[17,18]。本实验建立的小鼠颈部异位心脏移植模型,能够产生明显的急性排斥反应,为研究移植免疫学打下基础。
综上所述,本实验对小鼠颈部异位心脏移植模型进行探索,分析建模过程中的要点、难点,总结各类致死原因并提出改进策略,为后人学习提供了完整的思路与经验。颈部袖套法无需血管吻合,降低手术难度缩短手术时间,是一种特别适合无基础初学者的术式,其中0.4mm×0.5mm、0.8mm×1.0mm套管的使用值得推广与学习。

