外源硫化氢调控盐碱胁迫下裸燕麦叶片糖和酚酸代谢反应*
刘建新,刘瑞瑞,刘秀丽,贾海燕,卜 婷,李 娜
(甘肃省陇东生物资源保护利用与生态修复重点实验室/陇东学院生命科学与技术学院 庆阳 745000)
目前,世界20%的耕地和50%的灌溉地发生盐渍化,土壤盐碱化成为限制作物生长和产量提高的全球性生态问题[1]。盐碱土在世界各地的半干旱和干旱地区广泛分布,我国内陆地区的盐碱地主要为NaCl、Na2SO4等中性盐(简称盐)和Na2CO3、NaHCO3等碱性盐(简称碱)构成的复合类型[2]。盐碱复合胁迫下,作物遭受渗透胁迫、离子毒害和高pH 胁迫,其受害程度远大于单纯盐胁迫或碱胁迫[3]。因此,提高作物耐受盐碱胁迫的能力,对合理利用盐碱土资源,保障我国农业可持续发展具有重要意义。盐碱复合胁迫下,植物体内活性氧积累导致氧化还原平衡改变[4],碳代谢向氮代谢转移,积累氨基酸等含氮渗透调节物质使碳氮代谢失衡[5]。研究表明,细胞初级代谢产物如糖、氨基酸、多元醇和有机酸等的积累与植物耐盐碱机制密切相关[6]。小麦(Triticum aestivum)根系在碱胁迫下糖酵解、氨基酸合成和细胞膜脂代谢显著受抑,而三羧酸(tricarboxylic acid,TCA)循环明显增强[7]。棉花(Gossypiumspp.)在盐胁迫下活跃的糖代谢为氨基酸代谢提供能量来保障氮素同化; 而碱胁迫下棉花则通过增强TCA 循环供给能量的同时提供大量有机酸应对渗透胁迫和高pH胁迫[8]。酚酸是植物以糖酵解产物磷酸烯醇式丙酮酸和戊糖磷酸途径中间物赤藓糖-4-磷酸为底物经莽草酸途径和苯丙烷代谢合成的一类次生代谢产物。赵琦等[9]研究证明,酚酸积累明显增强紫花苜蓿(Medicago sativa)对盐碱胁迫的耐受能力。外施酚酸通过调控抗氧化酶活性可有效减轻小麦盐诱导的氧化损伤[10]。代谢组学分析已广泛应用于植物盐碱适应和耐盐碱相关机制研究[7-8,11-14],但运用代谢组学方法解析外源活性物质调控细胞代谢与增强植物耐盐碱性关系的研究鲜见报道。
硫化氢(H2S)作为气体传递信号在植物适应盐碱胁迫中发挥着重要调节作用。研究表明: H2S 能够增强植物对盐碱胁迫的适应性[15],内源H2S 参与维持盐胁迫下紫花苜蓿氧化还原平衡,抑制细胞Na+内流和K+外流[16]; 它还作为褪黑素下游信号参与褪黑素缓解黄瓜(Cucumis sativus)盐胁迫过程[17]。外源H2S供体硫氢化钠(NaHS)处理能够提高盐胁迫下大麦(Hordeum vulgare) H+-ATP 酶基因表达和Na+/H+逆向转运体活性,保持Na+、K+平衡[18]; 维持盐胁迫水稻(Oryza sativa)体内矿质离子稳态[19]; 并激活茶(Camellia sinensis)抗氧化酶活性[20]和促进玉米(Zea mays)抗坏血酸-谷胱甘肽循环运转[21]来增强盐胁迫下防御活性氧伤害的能力; 提高番茄(Lycopersicon esculentum)叶片光化学效率,缓解盐胁迫下光抑制对光系统Ⅱ的氧化损伤[22]; 通过促进还原型谷胱甘肽合成和提高抗坏血酸-谷胱甘肽循环关键酶活性从而增强结球甘蓝(Brassica oleracea)对碱胁迫的耐受性[23]。迄今,揭示H2S 增强植物抗盐碱性机理的研究已有不少,但这些研究几乎都以植物幼苗为材料进行单一NaCl 胁迫处理,而对H2S 调控盐碱复合胁迫下作物其他生育期代谢机制的研究少见报道,外源H2S增强植物耐盐碱性的糖和酚酸代谢反应调控机制仍尚不清楚。
裸燕麦(Avena nuda)为禾本科燕麦属(Avena)中籽粒唯一不带稃皮的栽培种,是我国西北广泛种植的一种杂粮作物[24],其籽粒蛋白质和不饱和脂肪酸含量远高于禾本科的小麦、水稻和玉米等作物,且富含β-葡聚糖、黄酮、酚酸和皂苷,具有降低血脂、血糖和血压等保健作用,是第一个被美国食品和药物管理局批准的“具有降低心脏病风险”的谷物保健食品[25]。裸燕麦耐贫瘠、耐盐碱抗旱,是西北地区种植的优势特色作物,低肥盐碱地等边际土壤常首选种植裸燕麦,盐碱胁迫成为其生长发育和产量提升的重要限制因素。喷施NaHS 溶液可增强盐碱复合胁迫下裸燕麦活性氧清除能力[15],且抽穗期喷施50 μmol·L-1NaHS 缓解裸燕麦盐碱胁迫的效果最佳[26]。甘肃省是我国西部地区裸燕麦的主要种植地之一,裸燕麦也是当地农民增收和改善膳食结构的重要杂粮。本研究采用盆栽土培试验,在裸燕麦抽穗期喷施50 μmol·L-1NaHS 溶液,运用代谢组学方法解析外源H2S 对盐碱胁迫下裸燕麦糖分解代谢、氧化还原平衡和酚酸的调控效应,旨在为揭示H2S 提高植物耐盐碱性的生理机制提供理论依据。
1 材料与方法
1.1 材料培养和试验设计
裸燕麦品种‘定莜9 号’由甘肃省定西市农业科学研究院选育,具有丰产和抗旱耐盐特性,是甘肃省主栽品种。NaHS 和NaCl、Na2SO4、NaHCO3、Na2CO3购自上海麦克林生化科技有限公司。
试验采用盆栽土培方法,于2021年4-7月在甘肃省陇东生物资源保护利用与生态修复重点实验室生物与农业科技园露天进行。供试土壤取自陇东黄土高原(107°41′4″E,35°43′50″N) 0~20 cm 耕作层,土壤类型为砂壤质黑垆土,肥力中等,水溶性盐含量为0.768 g·kg-1,pH 7.91。将土壤风干、打碎过3 mm筛,添加N∶P2O5∶K2O=13∶17∶15 复合肥0.5 g·kg-1拌匀后均分为二。其中一份直接装盆(配底托塑料盆口径315 mm,高340 mm),另一份模拟甘肃省中部裸燕麦种植地盐碱含量和组成状况,添加3.0 g·kg-1盐碱(摩尔比NaCl∶Na2SO4∶Na2CO3∶NaHCO3=12∶8∶1∶9)拌匀装盆。每盆均装土22.0 kg。浇自来水至田间持水量(20.8%)沉实3 d 后播种(4月6日),每盆播种大约60 粒,出苗后及时疏苗,5月9日每盆定苗25 株,常规管理,待裸燕麦抽穗期(6月18日)时进行喷施蒸馏水或NaHS 处理。
试验设置4 个处理: 土壤中不添加盐碱+裸燕麦抽穗期喷施蒸馏水(CK)、土壤中添加3.0 g·kg-1盐碱(摩尔比NaCl∶Na2SO4∶Na2CO3∶NaHCO3=12∶8∶1∶9)+裸燕麦抽穗期喷施蒸馏水(SA)、土壤中添加3.0 g·kg-1盐碱(摩尔比NaCl∶Na2SO4∶Na2CO3∶NaHCO3=12∶8∶1∶9)+裸燕麦抽穗期喷施50 μmol·L-1NaHS 溶液(SA+NaHS)、土壤中不添加盐碱+裸燕麦抽穗期喷施50 μmol·L-1NaHS 溶液(NaHS)。每个处理10 盆(5 盆用于代谢物检测,另5 盆统计产量性状),重复4 次,共160 盆。为双向控制误差,采用拉丁方设计排列。每天7:00 和19:00 用手持压缩式喷雾器(成都市鑫桂塑胶有限公司)各喷一次,连续喷3 d,每盆喷施量约150 mL,喷施蒸馏水或NaHS 溶液中添加体积分数0.01%吐温-80 以提高叶面黏附性。喷施结束后第7 d 剪取倒2 叶3 份,用蒸馏水清洁叶面,吸水纸吸干表面水分后装入冻存管,编号后置于液氮中速冻,埋入干冰中快递至苏州帕诺米克生物医药科技有限公司,其中1 份材料用于糖酵解、TCA 循环和戊糖磷酸途径(pentose phosphate pathway,PPP)代谢物和氧化还原物质检测,另外2 份材料用于酚酸组分含量检测。7月20日裸燕麦成熟后收获,进行室内考种。
1.2 糖酵解、TCA 循环、PPP 代谢物与氧化还原物质、ATP 含量检测
糖酵解、TCA 循环、PPP 代谢物和氧化还原物质、腺苷三磷酸(adenosine triphosphate,ATP)含量均由苏州帕诺米克生物医药科技有限公司(中国江苏苏州)利用LC-MS-8050 型(SHIMADZU,USA)超高效液相色谱-串联质谱仪(Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry,UPLCMS/MS)完成标准曲线建立及样品测定,结果以每克鲜质量材料中的微摩尔数表示(μmol·g-1)。用BSA124SCW 型分析电子天平(Sartorius,Germany)精确称取50 mg 鲜叶冻样于2.0 mL 离心管中,加入冷却至-80 ℃体积分数80%高效液相色谱级甲醇1.0 mL,用JXFSTPRP-24 型组织研磨仪(上海净信科技有限公司,上海)低温(干冰)研磨2 min,4 ℃涡旋1 min,-80 ℃孵育4 h 后4 ℃14000 g 离心10 min。转移上清液至2 mL 试管中,在速度真空中冻干样品,将U-13C-谷氨酰胺添加到体积分数80%甲醇提取缓冲液中作内标,进行标准品和样品的UPLC-MS/MS 检测。采用HILIC (Amide 4.6 mm×100 mm ID 3.5 μm)色谱柱,流动相A: 体积分数95%水、5%乙腈、20 mmol·L-1氢氧化铵和20 mmol·L-1乙酸铵,25 ℃调pH 至9.0; 流动相B: 100%乙腈。用100 μL 流动相A 重悬冻干样品。将色谱柱在30 ℃下用15%流动相A 以350 μL·min-1流速平衡3 min。取1 μL 样品进行线性梯度洗脱:0~3 min,15% A; 3~16 min,50% A; 16~20 min,85% A;20~25 min,15% A。质谱分析条件: 离子传输管温度350 ℃,蒸发器温度270 ℃。仪器以负模式运行,喷雾电压为3000 V,鞘气40 arb,辅助气5.0 arb,使用具有最佳碰撞能量多反应监测模式测量不同标准混合物7~8 个浓度以生成标准曲线,使用Labsolution 软件分析数据。
1.3 酚酸化合物含量检测
19 种酚酸化合物由苏州帕诺米克生物医药科技有限公司(中国江苏苏州)完成标准曲线建立及样品含量测定,结果以每克鲜质量材料中的微克数表示(μg·g-1)。称量100 mg 冷冻鲜叶,用2 mL 4 mol·L-1NaOH 40 ℃水解2 h,添加4 mol·L-1HCl 调节pH 至2,加2 mL 正己烷室温摇动20 min,除去正己烷层;用2 mL 乙酸乙酯提取水层2 次,提取物在35 ℃旋转蒸发器上减压浓缩至接近干燥,将残余物溶解在200 μL 50%甲醇中,并转移至配有插入装置的小瓶中。
采用Vanquish 型超高效液相色谱(Thermo,USA)和Q Exactive 高分辨质谱(Thermo,USA)测定系统进行UPLC-MS/MS 检测标准品和样品。液相参数:色谱柱为Waters HSS T3 (50 mm×2.1 mm,1.8 μm);流动相A 相为超纯水(含0.1%乙酸),B 相为乙腈(含0.1%乙酸); 流速0.3 mL·min-1; 柱温40 ℃; 进样量2 μL; 水/乙腈进行0~12.0 min 梯度洗脱。质谱参数: 采用电喷雾离子源,鞘气40 arb; 辅助气10 arb; 离子喷雾电压-2800 V; 温度350 ℃; 离子传输管温度320 ℃。扫描模式为单离子检测模式; 扫描方式为负离子。
1.4 裸燕麦产量性状测定
裸燕麦成熟后以每盆为单位沿盆土面剪取植株地上部,晒干后用精度1%电子天平称量生物学产量,统计穗数量、穗铃数量后脱粒,将脱粒后的籽粒晒干除杂,统计穗粒数量后称量千粒重量和籽粒产量,计算单株穗数量、穗铃数量、生物学产量、籽粒产量和穗粒数量。
1.5 数据统计分析
运用软件SPSS 20.0 多因素方差分析和新复极差法多重比较(P<0.05),在Omicshare (https://www.omicshare.com)平台聚类热图分析; 用Simca14.1 进行偏最小二乘判别分析(partial least squares-discriminant analysis,PLS-DA)和正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA),筛选差异代谢物。
2 结果与分析
2.1 外源硫化氢对盐碱胁迫下裸燕麦叶片糖分解代谢产物的影响
从表1可见,与CK 相比,SA 处理下糖酵解途径中除果糖和磷酸二羟丙酮含量无显著差异外,葡萄糖、葡萄糖-6-磷酸、果糖-6-磷酸、果糖-1,6-二磷酸、3-磷酸甘油醛、3-磷酸甘油酸、磷酸烯醇式丙酮酸、丙酮酸和乳酸含量显著下降(P<0.05); PPP 中6-磷酸葡萄糖酯含量下降不显著,核糖-5-磷酸、赤藓糖-4-磷酸和景天庚酮糖-7-磷酸含量显著下降(P<0.05);TCA 循环中的柠檬酸含量显著提高,α-酮戊二酸含量及与TCA 循环相关的谷氨酸、谷氨酰胺含量显著下降(P<0.05),琥珀酸、延胡索酸、苹果酸、天冬氨酸和天冬酰胺含量变化不显著。这说明盐碱胁迫下裸燕麦呼吸代谢的糖酵解、PPP 和TCA 循环均显著受抑。与SA 处理相比,SA+NaHS 处理显著提高了糖酵解途径葡萄糖、果糖-6-磷酸、3-磷酸甘油酸、乳酸和PPP 中6-磷酸葡萄糖酯、景天庚酮糖-7-磷酸及TCA 循环α-酮戊二酸和相关氨基酸谷氨酰胺含量(P<0.05),表明外源H2S 可以上调盐碱胁迫下裸燕麦糖分解的酵解过程及PPP 和TCA 循环。
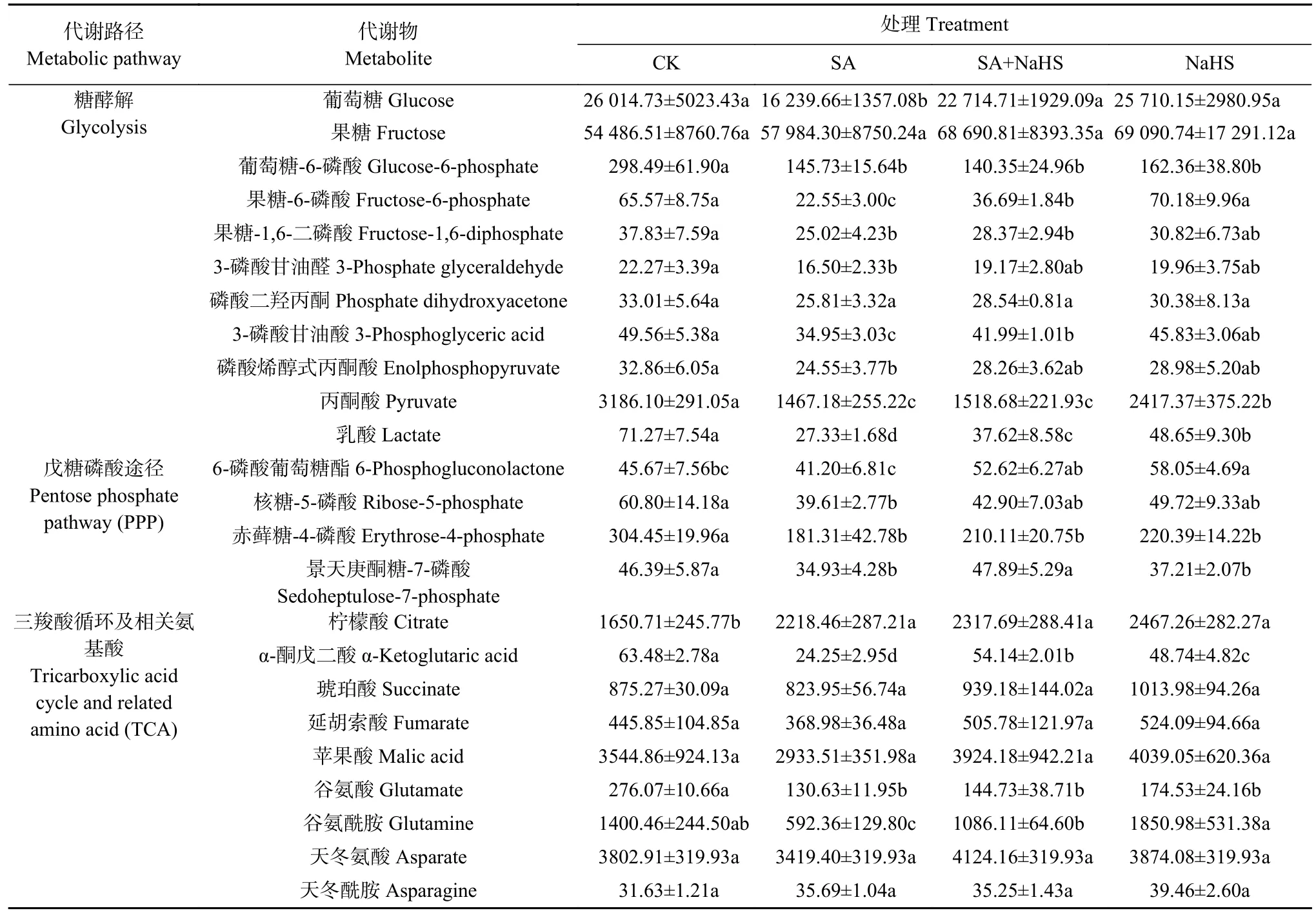
表1 外源硫化氢对盐碱胁迫下裸燕麦叶片糖代谢物含量的影响Table 1 Effects of exogenous H2S on the contents of sugar metabolites in leaves of naked oat under saline-alkali stress μmol·g-1
与CK 相比,单独NaHS 处理的葡萄糖-6-磷酸、丙酮酸、乳酸、赤藓糖-4-磷酸、景天庚酮糖-7-磷酸、α-酮戊二酸、谷氨酸含量显著下降(P<0.05),6-磷酸葡萄糖酯和柠檬酸含量显著升高(P<0.05),说明外源H2S 对非盐碱条件下裸燕麦糖的分解代谢也产生显著影响。
2.2 外源硫化氢调控盐碱胁迫下裸燕麦叶片糖分解代谢物的聚类热图分析
聚类热图分析是能直观观察数据特征的一种多元统计分析方法。CK、SA、SA+NaHS、NaHS 处理的糖分解代谢物聚类热图(图1)显示,不同处理裸燕麦叶片中糖分解代谢物含量存在明显差异。根据糖分解代谢物含量差异首先将SA+NaHS 和NaHS 处理聚为一类,再与SA 聚为一类,最后和CK 聚为一类。表明盐碱胁迫和外施H2S 明显改变正常条件或盐碱胁迫下裸燕麦叶片糖代谢过程。

图1 不同外源硫化氢喷施和盐碱胁迫处理下裸燕麦叶片糖分解代谢物聚类热图分析Fig.1 Hierarchical cluster analysis-heat map of sugar catabolites in leaves of naked oat under different treatments of saline-alkali stress and NaHS spraying
2.3 外源硫化氢对盐碱胁迫下裸燕麦叶片糖分解代谢产物的PLS-DA 分析
PLS-DA 是有监督的判别分析,R2X、RY2和Q2分别代表模型对变量X、Y的拟合度和预测能力。为进一步分析不同处理裸燕麦叶片糖分解代谢物差异,经PLS-DA 分析提取4 个主成分,R2X=0.846,R2Y=0.898,Q2=0.770,表明模型对变量X的解释率为84.6%,对变量Y的解释率为89.8%,预测能力为77.0%,说明模型拟合度好,预测能力高。由PLS-DA 分析得分图(图2a)可知,CK、SA、SA+NaHS、NaHS 处理各自归为一类,说明不同处理糖分解代谢物含量存在明显差异。经200 次置换检验(图2b)随机产生的R2在纵轴上的截距为0.461,Q2值在纵轴上的截距为-0.369。说明PLS-DA 没有出现模型过拟合现象,可依据PLS-DA 分析的变量投射重要度(variable importance for the projection,VIP)筛选差异代谢物。根据VIP>1 且方差分析P<0.05 筛选,景天庚酮糖-7-磷酸、α-酮戊二酸、天冬酰胺、果糖-6-磷酸、谷氨酰胺、柠檬酸、6-磷酸葡萄糖酯和琥珀酸为不同处理含量显著差异的糖分解代谢物,说明不同处理引起裸燕麦糖分解过程中酵解途径、PPP 和TCA 循环关键代谢物水平显著改变。

图2 不同外源硫化氢喷施和盐碱胁迫处理下裸燕麦叶片糖分解代谢物PLS-DA 得分图(a)及200 次模型的置换检验(b)Fig.2 PLS-DA score plot (a) and 200 permutation test of the model (b) of sugar catabolites in naked oat leaves under different treatments of saline-alkali stress and NaHS spraying
2.4 外源硫化氢对盐碱胁迫下裸燕麦叶片糖分解代谢物的OPLS-DA 分析
为进一步提高模型参数对变量X/Y关联度的解释,经OPLS-DA 分析得分图(图3a、b、c)显示: CK、SA、SA+NaHS、NaHS 处理各自聚为一族,充分显示各处理间糖分解代谢物含量存在明显差异。根据OPLS-DA 分析VIP 图(图3g、h、i)中VIP>1 且P<0.05并结合S-图(图3d、e、f)解析可知: 与CK 相比,SA处理没有糖分解代谢物含量显著上调,而导致乳酸(Lactate)、丙酮酸(Pyruvate)、谷氨酸(Glu)、α-酮戊二酸(α-KG)、谷氨酰胺(Gln)、果糖-6-磷酸(F6P)、3-磷酸甘油酸(3PG)、葡萄糖(Glucose)、葡萄糖-6-磷酸(G6P)、赤藓糖-4-磷酸(E4P)、天冬酰胺(Asn)、3-磷酸甘油醛(GAP)、景天庚酮糖-7-磷酸(S7P)、果糖-1,6-二磷酸(FBP)、核糖-5-磷酸(R5P)含量显著下调(图3d)。说明盐碱胁迫显著抑制裸燕麦的无氧和有氧呼吸过程。与SA 处理相比,SA+NaHS 处理下α-酮戊二酸(α-KG)、果糖-6-磷酸(F6P)、谷氨酰胺(Gln)、葡萄糖(Glucose)、3-磷酸甘油酸(3PG)、景天庚酮糖-7-磷酸(S7P)、6-磷酸葡萄糖酯(6PG)、乳酸(Lactate)、延胡索酸(Fumarate)、苹果酸(Malate)含量显著上调,而天冬酰胺(Asn)含量显著下调(图3e)。表明外源H2S 对盐碱胁迫造成的裸燕麦呼吸抑制具有显著缓解效应。与CK 相比,单独NaHS处理下柠檬酸(Citrate)、琥珀酸(Succinate)和6-磷酸葡萄糖酯(6PG)含量显著上调,而谷氨酸(Glu)、赤藓糖-4-磷酸(E4P)、α-酮戊二酸(α-KG)、葡萄糖-6-磷酸(G6P)、乳酸(Lactate)、丙酮酸(Pyruvate)、景天庚酮糖-7-磷酸(S7P)和天冬酰胺(Asn)含量显著下调(图3f)。说明外源H2S 可下调非盐碱条件下裸燕麦的糖酵解,而正负调控PPP 和TCA 循环中关键代谢物水平。

图3 不同外源硫化氢喷施和盐碱胁迫处理下裸燕麦叶片糖分解代谢物OPLS-DA 得分图(a: CK vs.SA; b: SA vs.SA+NaHS; c: CK vs.NaHS)、S 形图(d: CK vs.SA; e: SA vs.SA+NaHS; f: CK vs.NaHS)和VIP 图(g: CK vs.SA; h:SA vs.SA+NaHS; i: CK vs.NaHS)Fig.3 OPLS-DA score plots (a: CK vs.SA; b: SA vs.SA+NaHS; c: CK vs.NaHS),S-plots (d: CK vs.SA; e: SA vs.SA+NaHS; f:CK vs.NaHS) and VIP plots (g: CK vs.SA; h: SA vs.SA+NaHS; i: CK vs.NaHS) of sugar catabolites in naked oat leaves under different treatments of saline-alkali stress and NaHS spraying
2.5 外源硫化氢对盐碱胁迫下裸燕麦叶片氧化还原平衡和ATP 含量的影响
还原型谷胱甘肽(GSH)/氧化型谷胱甘肽(GSSG)、还原型辅酶Ⅱ(NADPH)/氧化型辅酶Ⅱ(NADP)比值反映植物体的氧化还原状态,ATP 是细胞生命活动的能量物质。由表2可知,与CK 相比,SA 处理裸燕麦叶片GSH、GSSG 和NADPH、NADP 含量显著下降,GSH/GSSG 比值显著升高,而NADPH/NADP 比值和ATP 含量无显著变化。说明盐碱胁迫虽造成裸燕麦体内氧化还原物质水平降低,但未引起氧化还原失衡和能量供应下降,通过提高GSH/GSSG 加强活性氧清除可能是其适应盐碱的重要机制[23]。与SA 处理相比,SA+NaHS 处理对叶片GSH、GSSG、NADPH、NADP、ATP 含量和GSH/GSSG、NADPH/NADP 比值无显著影响。与CK 相比,单独NaHS 处理叶片GSSG、NADPH 含量显著下降,GSH/GSSG、NADPH/NADP 比值和ATP 含量无显著变化。表明外源H2S 对盐碱和非盐碱条件下裸燕麦氧化还原平衡和能量供给的影响微弱。

表2 外源硫化氢对盐碱胁迫下裸燕麦叶片还原型谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSG)、还原型辅酶Ⅱ(NADPH)、氧化型辅酶Ⅱ(NADP)含量及比值和腺苷三磷酸(ATP)含量的影响Table 2 Effects of exogenous H2S on the contents and ratios of reduced glutathione (GSH),oxidized glutathione (GSSG),reduced coenzyme Ⅱ (NADPH),oxidized coenzyme Ⅱ (NADP) and adenosine triphosphate (ATP) content in naked oat leaves under saline-alkali stress
2.6 外源硫化氢对盐碱胁迫下裸燕麦叶片酚酸含量的影响
在裸燕麦叶片中检测出没食子酸、苯丙氨酸、原儿茶酸、原儿茶醛、儿茶素、香草酸、咖啡酸、丁香酸、表儿茶素、对香豆酸、4-羟基苯甲酸、香草醛、丁香醛、芥子酸、反式阿魏酸、水杨酸、苯甲酸、氢化肉桂酸、反式肉桂酸等19 种酚酸,其中含量小于1 μg·g-1的是没食子酸、苯丙氨酸、原儿茶酸、儿茶素、表儿茶素、水杨酸、氢化肉桂酸、反式肉桂酸8 种,含量介于1~10 μg·g-1的是原儿茶醛、咖啡酸、丁香酸、丁香醛4 种,含量介于10~50 μg·g-1的是香草酸、4-羟基苯甲酸、香草醛、芥子酸、苯甲酸5 种,含量大于50 μg·g-1的是对香豆酸和反式阿魏酸(表3)。不同处理引起裸燕麦叶片酚酸含量发生改变。与CK 相比,SA 处理显著提高没食子酸、原儿茶醛、丁香酸、反式阿魏酸、苯甲酸和总酚酸含量(P<0.05),降低反式肉桂酸含量(P<0.05),对其他酚酸含量无显著影响。说明裸燕麦体内酚酸参与盐碱胁迫响应。与SA 处理相比,SA+NaHS 处理显著提高了原儿茶酸和原儿茶醛含量(P<0.05),对其他酚酸和总酚酸含量无显著影响。与CK 相比,单独NaHS 处理的氢化肉桂酸和反式肉桂酸含量显著降低(P<0.05),其他酚酸和总酚酸含量无显著变化。表明外源H2S 参与盐碱和非盐碱条件下裸燕麦不同酚酸相互转化调控。

表3 外源硫化氢对盐碱胁迫下裸燕麦叶片酚酸含量的影响 Table 3 Effects of exogenous H2S on the contents of phenolic acids in leaves of naked oat under saline-alkali stress μg·g-1
2.7 外源硫化氢对盐碱胁迫下裸燕麦叶片酚酸组成的PLS-DA 分析
裸燕麦叶片酚酸经PLS-DA 分析得出R2X=0.491,R2Y=0.319,Q2=0.173,说明模型的解释和预测能力中等。从得分图(图4a)可知,CK、SA、SA+NaHS、NaHS处理各自相对聚集,表明不同处理酚酸含量存在明显差异。经200 次置换检验(图4b)得到R2在纵轴上的截距小于0.2,Q2值截距小于0.05,说明模型未出现过拟合,可依据VIP 筛选差异酚酸。根据VIP>1且方差分析P<0.05 筛选,反式肉桂酸(tCA)、氢化肉桂酸(HCA)和反式阿魏酸(tFA)为不同处理含量显著差异酚酸,说明裸燕麦酚酸参与盐碱胁迫响应。

图4 不同外源硫化氢喷施和盐碱胁迫处理下裸燕麦叶片酚酸PLS-DA 得分图(a)及200 次模型的置换检验(b)Fig.4 PLS-DA score plot (a) and 200 permutation test of the model (b) of phenolic acids in naked oat leaves under different treatments of saline-alkali stress and NaHS spraying
2.8 外源硫化氢对盐碱胁迫下裸燕麦叶片酚酸组成的OPLS-DA 分析
经OPLS-DA 分析,不同处理间裸燕麦酚酸含量存在明显差异(图5a、b、c),根据VIP 图(图5g、h、i)中VIP>1 且P<0.05 筛选并结合S-图(图5d、e、f)解析: 与CK 相比,SA 处理显著上调反式阿魏酸(tFA)、苯甲酸(BZA)和对香豆酸(p-HCA),显著下调反式肉桂酸(tCA) (图5d)。与SA 处理相比,SA+NaHS 处理4-羟基苯甲酸(4-HBZA)和香草醛(VNL)显著上调,而水杨酸(SA)和芥子酸(4-HDCA)显著下调(图5e);与CK 相比,单独NaHS 处理反式肉桂酸(tCA)和丁香醛(SGH)显著下调(图5f)。表明外源硫化氢参与裸燕麦酚酸对盐碱胁迫响应的调控。

图5 不同外源硫化氢喷施和盐碱胁迫处理下裸燕麦叶片酚酸OPLS-DA 得分图(a: CK vs.SA; b: SA vs.SA+NaHSl; c:CK vs.NaHS),S 形图(d: CK vs.SA; e: SA vs.SA+NaHS; f: CK vs.NaHS)和VIP 图(g: CK vs.SA; h: SA vs.SA+NaHS; i: CK vs.NaHS)Fig.5 PLS-DA score plots (a: CK vs.SA; b: SA vs.SA+NaHS; c: CK vs.NaHS),S-plots (d: CK vs.SA; e: SA vs.SA+NaHS; f:CK vs.NaHS) and VIP plots (g: CK vs.SA; h: SA vs.SA+NaHS; i: CK vs.NaHS) of phenolic acids in naked oat leaves under different treatments of saline-alkali stress and NaHS spraying
2.9 外源硫化氢对盐碱胁迫下裸燕麦产量性状的影响
从表4可知,不同处理裸燕麦穗数量、穗铃数量、千粒重量和生物学产量无显著差异。与CK 相比,SA 处理下裸燕麦穗粒数量和籽粒产量显著下降(P<0.05); SA+NaHS 处理与SA 处理相比显著提高了穗粒数量和籽粒产量(P<0.05); 单独NaHS 处理的穗粒数量和籽粒产量与CK 相比无显著差异。表明外源硫化氢可显著缓解盐碱胁迫导致的裸燕麦穗粒数量和籽粒产量的下降。
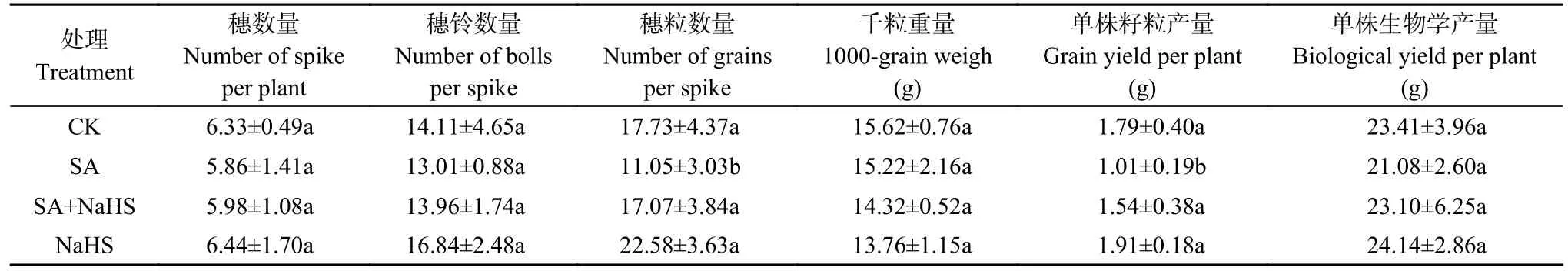
表4 外源硫化氢对盐碱胁迫下裸燕麦产量性状的影响(平均值±标准差)Table 4 Effects of exogenous H2S on the yield traits of naked oat under saline-alkaline stress
3 讨论
3.1 外源硫化氢对盐碱胁迫下裸燕麦叶片糖代谢产物和氧化还原平衡的影响
利用代谢组学分析可揭示植物适应盐碱过程中代谢物组成的变化以及涉及的重要代谢途径。高龙飞等[27]研究发现,蓝莓(Vacciniumspp.)响应盐胁迫过程中光呼吸代谢通路发生显著改变。郭瑞等[7]研究表明,碱胁迫下小麦根系糖酵解、细胞膜脂代谢和氨基酸合成受抑,而TCA 循环增强。本试验结果表明,盐碱复合胁迫下裸燕麦叶片糖酵解和PPP 途径显著受抑,TCA 循环中α-酮戊二酸及相关谷氨酸、谷氨酰胺和天冬酰胺含量显著下降(图3d,图6)。这与棉花遭受盐碱胁迫时蔗糖和淀粉代谢活跃及TCA循环增强[8]的结果有所不同,其可能与盐碱胁迫强度及不同植物响应盐碱胁迫机制存在差异有关。葡萄糖是植物呼吸代谢的起始物,通过光合作用合成。盐碱胁迫导致裸燕麦叶片葡萄糖含量显著下降(图3d),这可能是盐碱胁迫抑制光合作用所致[22],进而造成糖酵解下游物质葡萄糖-6-磷酸、果糖-6-磷酸、果糖-1,6-二磷酸、3-磷酸甘油醛、3-磷酸甘油酸、丙酮酸和乳酸含量显著下调,从而使无氧呼吸过程受到抑制。α-酮戊二酸是TCA 循环中关键物质,其通过氨基移换作用使植物碳氮代谢密切关联和有序转移[5]。盐碱胁迫下裸燕麦显著受抑的糖酵解可能导致下游有氧呼吸TCA 循环中α-酮戊二酸及转氨作用产物谷氨酸、谷氨酰胺和天冬酰胺含量的下降,这将不利于细胞渗透压平衡维持、pH 调节和降低盐离子毒害[4,7]。PPP 途径是无氧和有氧条件下均可进行的呼吸代谢循环,循环中葡萄糖-6-磷酸、果糖-6-磷酸、果糖-1,6-二磷酸和3-磷酸甘油醛是与糖酵解共同的中间物,盐碱胁迫下裸燕麦上述代谢物水平的显著降低可能进而导致PPP 途径中赤藓糖-4-磷酸、景天庚酮糖-7-磷酸和核糖-5-磷酸含量的显著下降。由此可见,盐碱胁迫显著抑制裸燕麦糖的无氧和有氧呼吸代谢,这与陈晓晶等[28]的盐胁迫下燕麦根系呼吸途径显著受抑制的结果一致。

图6 OPLS-DA 分析得出的外源硫化氢调控盐碱胁迫下裸燕麦叶片糖和酚酸代谢途径网络变化图Fig.6 Proposed metabolic pathway network changes of sugars and phenolic acids in naked oat leaves under saline-alkali stress regulated by exogenous H2S obtained from OPLS-DA analysis
H2S 作为信号分子不仅调控植物的生长和生理过程,还参与多种非生物胁迫应答[29]。然而,利用代谢组学解析H2S 增强植物耐盐碱性机制的研究仍少见报道。Wei 等[30]利用蛋白质组学分析发现,外源H2S 可通过调节氧化应激、恢复光合功能和改善能量代谢缓解盐胁迫对水稻造成的伤害。本研究运用代谢组学分析表明,外施H2S 不仅显著下调非盐碱条件下裸燕麦糖酵解中间物葡萄糖-6-磷酸、丙酮酸和乳酸水平,而且使TCA 循环中间物α-酮戊二酸及相关谷氨酸、天冬酰胺含量显著下降,但TCA 循环中柠檬酸、琥珀酸含量显著上调(图3f,图6)。这表明外源H2S 对非盐碱条件下裸燕麦糖酵解产生负调控作用,而对TCA 循环具有正负调控作用。盐碱胁迫下,外源H2S 显著上调裸燕麦糖酵解途径中葡萄糖、果糖-6-磷酸、3-磷酸甘油酸、乳酸含量和TCA循环中α-酮戊二酸、延胡索酸和苹果酸含量(图3e,图6),表明外源H2S 可以提高盐碱胁迫下裸燕麦糖的无氧酵解和有氧氧化分解过程,其原因可能与H2S 参与调控盐碱胁迫下植物细胞防御和信号转导差异基因表达并显著改变代谢酶活性有关[31]。外源H2S 可能促使天冬酰胺脱氨产生天冬氨酸,天冬氨酸通过TCA 循环转换为谷氨酸,进一步合成谷氨酰胺[32],从而显著下调盐碱胁迫下裸燕麦天冬酰胺含量而上调谷氨酰胺含量。糖酵解和TCA 循环中间物主要是有机酸类,有机酸不仅是能量代谢的重要中间物,而且其积累是维持离子平衡和细胞pH 稳定的重要机制[7]。外源H2S 对盐碱胁迫下裸燕麦呼吸代谢途径中有机酸含量的显著提升效应可能在弥补盐碱胁迫引起的负电荷不足和保持细胞pH 稳定方面发挥着调节作用。
植物的PPP 途径是葡萄糖-6-磷酸通过两次连续的脱氢氧化反应产生NADPH 和核酮糖-5-磷酸后不同碳数单糖间通过非氧化相互转化重新生成葡萄糖-6-磷酸的循环过程,它与植物活性氧清除系统抗坏血酸(ASA)-谷胱甘肽(GSH)循环密切联系,并在维持细胞氧化还原平衡和增强抗氧化防御方面发挥着重要作用[33]。本研究中,盐碱胁迫下裸燕麦PPP 途径中赤藓糖-4-磷酸、核糖-5-磷酸、景天庚酮糖-7-磷酸的显著下降可能引起GSH、GSSG、NADPH、NADP含量的显著降低,但GSH/GSSG 显著提高,NADPH/NADP 和ATP 含量变化不大(表2)。表明盐碱胁迫虽对裸燕麦PPP 途径和ASA-GSH 循环产生不利影响,但提高氧化还原平衡和维持能量供给可能是裸燕麦适应盐碱胁迫的重要机制。外源H2S 可能通过促进PPP 途径的氧化阶段使非盐碱条件下裸燕麦葡萄糖-6-磷酸含量显著降低而6-磷酸葡萄糖酯含量显著提高(图3f、图6),氧化阶段产生的NADPH 用于ASA-GSH 循环中GSH 的还原,从而使NADPH 含量显著下降(表2); 外源H2S 对PPP 途径非氧化阶段赤藓糖-4-磷酸、景天庚酮糖-7-磷酸含量的显著降低及对GSH/GSSG、NADPH/NADP 和ATP 含量的微弱影响表明外源H2S 虽对非盐碱条件下裸燕麦PPP 途径非氧化阶段有不利影响,但对氧化还原平衡和能量供给无显著影响。盐碱胁迫下,外施H2S 显著上调裸燕麦6-磷酸葡萄糖酯和景天庚酮糖-7-磷酸含量(图3e、图6),但对GSH、GSSG、NADPH、NADP、ATP 含量和GSH/GSSG、NADPH/NADP 无显著影响(表2)。这说明外源H2S 参与盐碱胁迫下裸燕麦PPP 途径的调控,能够缓解盐碱胁迫对PPP 代谢途径的抑制,并维持细胞氧化还原平衡和能量稳定供给。这与孙晓莉等[34]的干旱胁迫下外源H2S 可减轻板栗(Castanea mollissima)根系呼吸代谢途径抑制的研究结果类似。外源H2S 缓解盐碱胁迫对裸燕麦呼吸抑制的原因可能与它能够上调ATP 合成相关蛋白及能量代谢、硫代谢和细胞防御相关酶活性[30-31]有关。而H2S 调控呼吸代谢的分子机制以及与其他信号分子的协同作用还有待进一步深入探究。
3.2 外源硫化氢对盐碱胁迫下裸燕麦叶片酚酸代谢及产量性状的影响
酚酸是具有酚羟基结构的一类化合物,以磷酸烯醇式丙酮酸和赤藓糖-4-磷酸为底物经莽草酸途径首先合成莽草酸,然后通过苯丙素代谢途径合成多酚类化合物,它在植物生长发育和盐碱适应中发挥着重要作用[9]。因此,莽草酸是植物糖代谢与多酚代谢的关键连接点,也是酚酸类物质生物合成的必经途径。前人研究表明,耐盐的芸苔属作物羽衣甘蓝(Brassica oleraceavar.acephala)和白菜(Brassica oleraceavar.capitata)比大白菜(Brassica rapassp.pekinensis)含有更高水平的总酚酸和羟基肉桂酸。并且,随着盐胁迫强度提高大白菜和羽衣甘蓝中咖啡酸、水杨酸和4-香豆酸含量减少,而羽衣甘蓝中阿魏酸水平增加[35]。本研究表明,盐碱胁迫引起裸燕麦总酚酸和苯甲酸、对香豆酸、反式阿魏酸含量显著提高,反式肉桂酸含量显著下降,而对其他酚酸含量无显著影响(图6)。这与随着盐碱胁迫强度增加紫花苜蓿中阿魏酸与水杨酸含量增加[9]的结果类似。说明总酚酸含量提高及苯甲酸、对香豆酸、反式阿魏酸和反式肉桂酸水平的变化可能在裸燕麦适应盐碱胁迫中发挥着独特调节作用。外源H2S 对植物酚酸物质调控的研究迄今少见报道,本研究发现: 外源H2S 仅使非盐碱条件下裸燕麦丁香醛含量显著下降,而对其他酚酸无显著影响; 盐碱胁迫下,外源H2S 显著提高裸燕麦4-羟基苯甲酸、香草醛含量,却显著降低水杨酸、芥子酸含量,对其他酚酸含量影响微弱(图6)。这说明外源H2S 参与盐碱胁迫下裸燕麦酚酸代谢的调控,它对4-羟基苯甲酸、香草醛含量的显著上调和水杨酸、芥子酸含量的显著下调可能在其增强裸燕麦适应盐碱胁迫中发挥着重要作用,其具体作用有待进一步探究。水杨酸是邻羟基苯甲酸,推测H2S 可能通过催化水杨酸与4-羟基苯甲酸发生异构化来使4-羟基苯甲酸上调而水杨酸水平下降; 它也可能通过抑制反式阿魏酸向芥子酸转化,促进反式阿魏酸转向合成香草酸,进一步合成香草醛,从而使芥子酸水平降低而提高香草醛含量(图6)。有研究表明,多酚化合物与ASA-GSH 循环互补增强水稻在盐胁迫下的氧化还原调节[36]。在裸燕麦适应盐碱胁迫中揭示H2S 如何协调多酚代谢与依赖于呼吸代谢的ASA-GSH 循环机制将是以后研究中继续关注的重点。
目前,有关H2S 对盐碱胁迫下植物幼苗生长调控的研究报道较为多见,而它对作物产量性状影响的研究鲜见报道。本试验模拟甘肃省裸燕麦主产地盐碱含量和组成,探究盐碱复合胁迫下外源H2S 对产量性状影响的结果表明: 外源H2S 对非盐碱条件下裸燕麦穗数量、穗铃数量、穗粒数量、千粒重量等产量构成因素及生物学产量、籽粒产量无显著影响,而对盐碱胁迫造成的裸燕麦穗粒数量和籽粒产量下降具有显著缓解作用,盐碱胁迫及外源H2S 对盐碱胁迫下裸燕麦穗数量、穗铃数量、千粒重量和生物学产量的影响不显著(表4)。这与外源H2S 能够减轻盐胁迫对植物幼苗生长抑制的结果[18-19,22]类似。表明外源H2S 主要通过增加穗粒数量提高盐碱胁迫下裸燕麦籽粒产量,它能够增强裸燕麦耐受盐碱胁迫的能力。究其原因可能与H2S 参与调控盐碱胁迫下裸燕麦多种代谢有关,而它对呼吸代谢中间物有机酸含量的提高和氧化还原平衡维持,以及酚酸独特的调控在缓解盐碱胁迫造成的负电荷亏缺和高pH 伤害中发挥了至关重要的作用。今后还需通过大田试验从多角度揭示H2S 缓解盐碱胁迫对裸燕麦产量抑制的机制,以期探讨H2S 作为一种潜在新型植物生长调节剂的可能性。
4 结论
盐碱复合胁迫显著抑制裸燕麦糖的分解代谢,并使叶片GSH、GSSG、NADPH、NADP 含量显著降低,但GSH/GSSG 显著提高。外源H2S 对盐碱复合胁迫下裸燕麦叶片GSH、GSSG、NADPH、NADP、ATP 含量和GSH/GSSG、NADPH/NADP 无显著影响。外源H2S 显著提高了叶片葡萄糖、果糖-6-磷酸、3-磷酸甘油酸、乳酸、6-磷酸葡萄糖酯、景天庚酮糖-7-磷酸、α-酮戊二酸、延胡索酸、苹果酸和谷氨酰胺含量,显著降低了天冬酰胺含量。表明外源H2S 能够提高盐碱胁迫下裸燕麦糖代谢途径中的有机酸含量,并维持氧化还原平衡和能量供给。
盐碱复合胁迫引起裸燕麦叶片苯甲酸、对香豆酸、反式阿魏酸和总酚酸含量显著升高,反式肉桂酸含量显著降低。外源H2S 可显著提高盐碱复合胁迫下裸燕麦叶片4-羟基苯甲酸、香草醛含量,显著降低水杨酸、芥子酸含量,而对其他酚酸含量影响微弱。表明外源H2S 参与盐碱胁迫下裸燕麦酚酸代谢调控。
外源H2S 对糖代谢途径有机酸含量的显著提高和酚酸代谢的调控可能在其显著缓解盐碱胁迫下裸燕麦穗粒数量和籽粒产量下降,从而增强裸燕麦耐盐碱性中发挥着调节pH 和维持电荷平衡的作用。

