核苷酸结合寡聚化结构域样受体蛋白3炎症小体在脑卒中后认知障碍中的研究进展
李晓晓,白艳杰,王岩,张雍闯,陈淑颖,陈丽敏
脑卒中后认知障碍(PSCI)是指脑卒中患者发病后6个月内出现符合认知障碍诊断标准的系列综合征[1],临床主要表现为执行功能、注意力、记忆、言语、视空间能力等一项或多项认知领域的受损[2],严重影响脑卒中患者的生活质量。研究表明,超过1/3的脑卒中患者存在不同程度的认知功能下降[3],且随着全球社会老龄化问题的日益突出,PSCI患者不断增多,给个人、家庭和社会带来了沉重的负担。目前PSCI的发病机制尚不明确,神经炎症被认为是一个重要因素。大量实验证据表明,核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎症小体的活化在PSCI中起关键作用[4-5]。NLRP3炎症小体被脑卒中后引起的多种细胞内信号激活,介导慢性神经炎性反应、神经元死亡和细胞焦亡等,从而促进PSCI的发生和进展[6]。更重要的是,已有研究证实使用针对NLRP3炎症小体的抑制性治疗可以减轻脑卒中小鼠的认知障碍[5],但具体作用机制尚未完全清楚。因此,本文对NLRP3炎症小体的活化和影响因素及其与PSCI的关系做一总结,以期为PSCI的临床治疗研究提供参考。
本文文献检索策略:计算机检索PubMed、Web of Science、中国知网、万方数据知识服务平台等数据库,并手工检索纳入文献的参考文献,检索时间为建库至2022年5月,中文检索词包括“NLRP3炎症小体”“神经炎症”“脑卒中后认知障碍”,英文检索词包括“NLRP3 inflammasome”“NLRP3”“post-stroke cognitive impairment”。文献纳入的标准:基于调控NLRP3炎症小体改善脑卒中后认知障碍的临床研究、基础研究和文献研究。文献排除的标准:重复发表的文献、无法获取全文和数据的文献、年份陈旧、质量较差的文献等。
1 NLRP3炎症小体表达与活化的影响因素
1.1 NLRP3炎症小体的结构 炎症小体是一种细胞溶质多蛋白复合物,在先天性免疫中起着重要作用,主要由胞质内模式识别受体(PRRs)、衔接蛋白结构域和效应结构域半胱氨酸蛋白酶1前体(pro-caspase-1)3部分组成[7]。在中枢神经系统中,炎症小体主要存在于免疫细胞、神经元、小胶质细胞和星形胶质细胞的细胞质中[8],可以识别病原体相关分子模式(PAMPs)和宿主来源的损伤信号相关分子模式(DAMPs)。NLRP3炎症小体是目前报道中研究最多的炎症小体,与上述炎症小体的结构一样,NLRP3炎症小体包括NLRP3、衔接分子凋亡相关斑点样蛋白(ASC)和效应蛋白pro-caspase-1[9]。这3种蛋白质通过紧密相互作用以调节NLRP3炎症小体的功能。
1.2 NLRP3炎症小体的活化 目前研究已证实的诱导NLRP3炎症小体活化的外源性刺激因子包括脂多糖(LPS)[10]、病毒RNA[11]、棕榈酸酯[12]、二氧化硅[13]等,内源性刺激因子包括活性氧(ROS)[6]、组织蛋白酶B[14]、三磷酸腺苷[15]等。尽管上述因素诱导的NLRP3炎症小体的活化过程已被广泛研究,但其确切的分子机制仍需进一步探索。目前认为有两种激活NLRP3炎症小体的信号通路,一种是涉及pro-caspase-1募集和caspase-1激活的经典信号通路,另一种是与小鼠caspase-11和人类caspase-4、caspase-5激活有关的非经典信号通路。
1.2.1 NLRP3炎症小体的经典活化途径 NLRP3炎症小体的活化包括启动和激活两个步骤[16]。在细胞静止状态下,NLRP3和白介素1β(IL-1β)的基础水平被认为不足以激活炎症小体。因此,启动步骤促进了这些目标的转录。第一个阶段是启动阶段,NLRP3受到危险信号〔如Toll 样受体 4(TLR4)激动剂或内源性分子〕的刺激,诱导核因子-κB(NF-κB)表达,从而促进NLRP3、IL-1β和白介素18(IL-18)基因的转录,使NLRP3、IL-1β前体(pro-IL-1β)和pro-IL-18的蛋白质表达增加[17]。第二个阶段是激活阶段,通常由PAMPs或DAMPs触发,从而完成NLRP3炎症小体的组装步骤。随后pro-caspase-1通过接头蛋白ASC募集,成簇的pro-caspase-1通过自催化和自切割形成活化的caspase-1,后者切割pro-IL-1β和pro-IL-18产生活化形式的IL-1β和IL-18。同时,活化的caspase-1可以通过裂解消化道皮肤素D(GSDMD),引发细胞焦亡[18]。
1.2.2 NLRP3炎症小体的非经典活化途径 在非经典激活途径中,NLRP3炎症小体的活化主要是由小鼠caspase-11或人类caspase-4和caspase-5介导的。革兰阴性菌产生的LPS进入细胞质,可以与小鼠体内的caspase-11结合,从而触发其寡聚化和活化。活化的caspase-11诱导细胞焦亡并产生促炎细胞因子[19]。
1.3 NLRP3炎症小体活化的影响因素 NLRP3炎症小体活化的主要机制包括K+外流、溶酶体破坏后释放的组织蛋白酶B、细胞外Ca2+稳态的变化以及ROS的产生[20]等。最新研究表明,线粒体是NLRP3炎症小体功能的中心调节剂,线粒体活性氧(mtROS)的产生、线粒体DNA(mtDNA)的释放、线粒体介导的细胞凋亡、线粒体钙超载以及线粒体参与NLRP3的定位均与NLRP3炎症小体活性的调节有关[21-22]。因此,本文主要讨论线粒体功能障碍、线粒体相关内质网膜(MAM)、自噬和线粒体自噬在NLRP3炎症小体活化和调控中的作用。
1.3.1 线粒体功能障碍和NLRP3炎症小体活化 线粒体是细胞的代谢中心和能量工厂,提供细胞生物合成所需的底物和能量,对细胞命运起着决定性作用。线粒体在有氧代谢过程中通过呼吸链产生mtROS。当线粒体功能受损时,mtROS水平显著升高,mtROS在细胞质中积累并与NLRP3炎症小体的成分相互作用,从而参与炎症小体的活化。NAKAHIRA等[23]研究发现受损线粒体产生的mtROS是巨噬细胞激活NLRP3炎症小体所必需的。此外,越来越多的证据表明,使用破坏线粒体功能的化学抑制剂可触发NLRP3炎症小体活化。线粒体功能障碍诱导剂,如鱼藤酮(复合物Ⅰ抑制剂)可导致ROS水平升高、NLRP3炎症小体的活化以及小胶质细胞中IL-1β的表达[24]。此外,mtROS清除剂MitoTEMPO可抑制损伤因子诱导的NLRP3炎症小体的活化,并减少IL-1β的分泌[25]。
线粒体功能障碍导致线粒体断裂增加,释放出mtDNA、ATP、热休克蛋白60(HSP60)、线粒体转录因子A(TFAM)、心磷脂等。这些物质可作为DAMPs来诱导NLRP3炎症小体的活化[26],其中mtDNA的研究最为广泛。NAKAHIRA等[23]研究表明mtDNA的释放对于NLRP3炎症小体的活化至关重要,并依赖于ROS的产生。SHIMADA等[27]进一步利用转染mtDNA的293细胞证明mtDNA可以直接与NLRP3结合并介导NLRP3炎症小体的活化。细胞质中氧化mtDNA水平的增加亦可促进NLRP3炎症小体的活化[28]。艾地苯醌是一种众所周知的线粒体保护剂,PENG等[29]在氧葡萄糖剥夺/再灌注(OGD/R)损伤模型中发现,线粒体功能障碍导致mtDNA易位、mtROS产生以及氧化mtDNA的细胞溶质积累,促进其与NLRP3的结合。而通过艾地苯醌治疗能有效阻断这一过程,并减轻OGD/R后NLRP3介导的炎症损伤。
1.3.2 线粒体相关内质网膜对NLRP3炎症小体活化的调控 由内质网的亚结构域、线粒体外膜和一系列蛋白组成的动态连接称为MAM[30],其在物质转移和信号转导中起着重要作用。ZHOU等[31]研究发现在细胞未受刺激时,NLRP3主要位于内质网膜和细胞质中。然而细胞在受刺激后,NLRP3和ASC将重新分布并转移到核周区域的MAM,这使得其更容易感知线粒体损伤信号。MAM也被视为炎性体组装和激活的平台。在炎性体形成过程中,乙酰化的α-微管蛋白可以将线粒体迁移到核周区域,并促进线粒体上的ASC与内质网上的NLRP3组装[32]。线粒体抗病毒信号蛋白(MAVS)是位于线粒体外膜的衔接分子,参与Ⅰ型干扰素的分泌。作为MAM的重要组成部分,MAVS在调节宿主的自然免疫中起着重要作用。研究发现,MAVS可以将NLRP3募集到线粒体,以应对病毒感染。MAVS与NLRP3的N端氨基酸序列相连,这是MAVS与NLRP3相互作用的基础[33]。此外,GUAN等[34]研究证明MAVS能够通过将E3连接酶TRAF3募集到ASC来稳定ASC并诱导胞质斑点的形成。MAVS或TRAF3缺乏会损害ASC泛素化和细胞质斑点的形成,从而降低NLRP3炎症小体的活化。
Ca2+在NLRP3炎症小体活化中起重要作用[35]。MAM是介导Ca2+从内质网向线粒体转运的主要位点。IP3R-GRP75-VDAC-MCU复合物是介导内质网Ca2+通过MAM区域转运至线粒体的经典途径[36]。这些蛋白质也是MAM的组成成分,针对这些蛋白质的抑制剂或基因敲除可能会减弱NLRP3炎症小体的活化。因此认为MAM功能的改变会影响NLRP3炎症小体的活化。
1.3.3 NLRP3炎症小体通过自噬和线粒体自噬负调控
自噬是细胞自身成分如细胞器和异常积累蛋白通过溶酶体系统非特异性降解的过程,对于维持细胞稳态和存活至关重要[37]。自噬已被证实与NLRP3炎症小体活化密切相关。SAITOH等[38]报道了重要的自噬基因Atg16L1调节内毒素诱导的炎症小体活化。在LPS刺激的巨噬细胞中,Atg16L1的缺乏可导致NLRP3炎症小体的活化和IL-1β的产生。自噬诱导剂,如雷帕霉素、二甲双胍等可激活小胶质细胞的自噬,促进细胞内错误折叠的蛋白聚集体的吞噬和降解,从而有效抑制NLRP3炎症小体的过度活化[39]。
线粒体自噬是一个选择性去除受损线粒体的过程。一旦发生线粒体功能障碍,线粒体自噬便可以促进线粒体的更新,从而维持线粒体的质量控制。如上所述,大量证据表明受损的线粒体通过多种方式活化NLRP3炎症小体。因此,线粒体自噬可以被认为是调节NLRP3炎症小体活化的重要途径。LI等[40]研究了线粒体自噬的核心参与者Parkin在宿主抗病毒反应中的作用,发现Parkin缺乏通过增强mtROS介导的NLRP3炎症小体活化来增强先天性抗病毒炎症并促进病毒清除。此外,PENG等[41]研究发现线粒体自噬诱导剂可以增强清除功能失调的线粒体的能力,从而抑制NLRP3炎症小体的活化。综上发现,自噬和线粒体自噬作为一种保护细胞免受过度炎症的自限性方式,对NLRP3炎症小体的活化具有负向调节的作用。NLRP3炎症小体的具体活化和调控过程见图1。
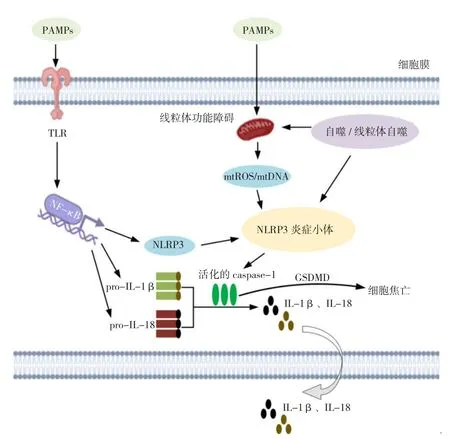
图1 NLRP3炎症小体的活化和调控过程Figure 1 Activation and regulation of NLRP3 inflammasome
2 NLRP3炎症小体与PSCI的关系
2.1 NLRP3炎症小体在PSCI中表达量升高 PSCI发病机制复杂,其中炎性反应在其发生中起着关键作用[42]。脑卒中发生后,一方面,外周淋巴组织释放淋巴细胞分泌炎性因子,淋巴细胞及炎性因子侵入大脑,破坏血-脑脊液屏障,造成神经组织损伤;另一方面,脑缺血后释放趋化因子,促使局部炎性因子和黏附分子等释放,引发炎性反应,进一步造成神经元的损伤[43],引起认知功能障碍。NLRP3炎症小体是脑血管疾病产生的广泛的复合小体之一,在大脑中大量表达。NLRP3炎症小体或通过促进脑卒中后的炎性反应引起PSCI的发生,近年来先后有学者从不同层面证实了NLRP3炎症小体与PSCI的密切关系(表1)。动物实验显示,双侧颈总动脉狭窄(BCAS)模型小鼠与假手术组相比,NLRP3炎症小体在2周和4周显著增加,且在白质和胼胝体的神经胶质细胞中观察到免疫反应,与假手术组相比,模型组中IL-18、IL-1β水平明显升高[44]。同时,通过对HT22细胞进行OGD/R处理构建体外PSCI模型发现,与对照组相比,OGD/R模型NLRP3、ASC、裂解的caspase-1、IL-1β和IL-18水平升高[45]。在临床研究中,吴金波等[46]为了探究NLRP3与高血压脑出血患者发生认知功能损害的关系,分别检测高血压脑出血发生认知障碍患者与高血压脑出血未发生认知障碍患者外周血血清中NLRP3 mRNA水平,与对照组相比,发生认知障碍组血清NLRP3 mRNA水平显著升高。李国丽等[47]比较52例急性缺血性脑卒中后认知障碍患者和61例急性缺血性脑卒中后认知正常患者外周血发现,认知障碍组NLRP3、IL-1β、IL-18水平显著高于认知正常组。此外,赵凤华等[48]发现与正常人群的外周静脉血相比,急性缺血性脑卒中患者的NLRP3、ASC、caspase-1、IL-1β的表达量更高,且NLRP3炎症小体的活化程度越高、认知障碍程度越重。
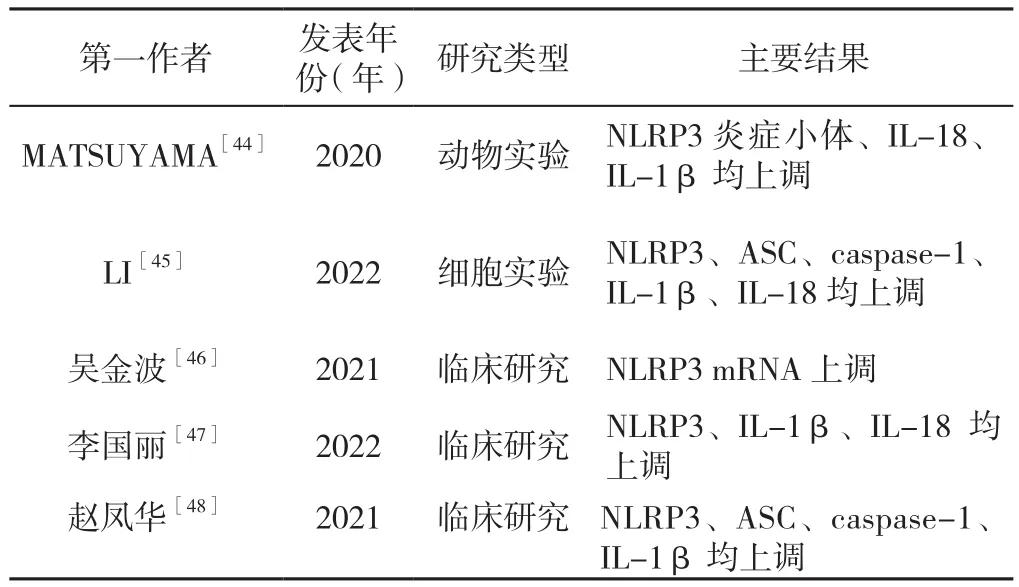
表1 NLRP3炎症小体在PSCI中表达量升高的相关研究Table 1 Studies on the increased expression of NLRP3 inflammasome in PSCI
2.2 抑制NLRP3炎症小体改善PSCI的治疗方法 鉴于NLRP3炎症小体在PSCI发病机制中的重要作用,探索其用于改善PSCI的治疗方法也成为该领域的热门话题。大量研究发现,多种药物及治疗措施通过抑制NLRP3炎症小体的活化来改善PSCI(表2)。
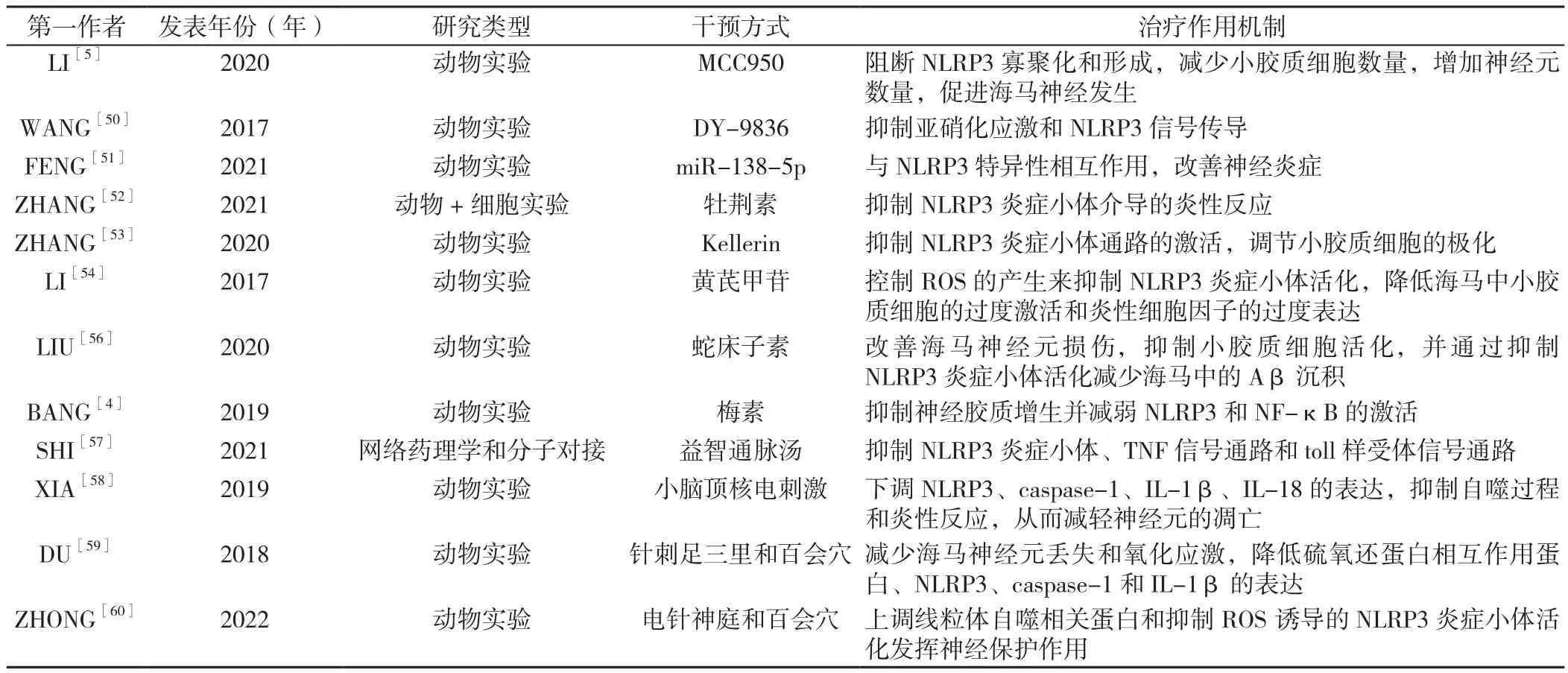
表2 抑制NLRP3炎症小体改善PSCI的研究Table 2 Studies on inhibition NLRP3 inflammasome to improve PSCI
2.2.1 靶向药物治疗 MCC950是一种选择性的NLRP3小分子抑制剂,可直接与NLRP3的NACHT结构域中的walker B基序相互作用,阻断NLRP3 ATPase的活性,使之失去水解ATP的能力,从而阻断NLRP3寡聚化和形成[49]。通过建立光血栓形成脑卒中小鼠模型,发现MCC950可以通过减少小胶质细胞数量,增加神经元数量,促进海马神经发生,最终改善PSCI[5]。
钙调素抑制剂之一的DY-9836被发现可以通过抑制亚硝化应激和NLRP3信号传导显著增强认知功能。WANG等[50]使用双侧颈动脉狭窄小鼠模型,分别给予DY-9836(0.5 mg/kg)、DY-9836(1 mg/kg)、纳米药物传递系统封装的DY-9836(0.25 mg/kg)进行干预,结果显示,DY-9836(1 mg/kg)或纳米药物传递系统封装的DY-9836(0.25 mg/kg)可减轻模型小鼠海马依赖的空间认知功能障碍,其药理作用与过氧亚硝酸盐形成的减少和NLRP3/caspase-1/IL-1β信号传导的下调相关。
FENG等[51]研究发现在LPS处理的大鼠海马和小胶质细胞中,NLRP3、caspase-1和促炎细胞因子(IL-1β和IL-18)的表达上调,而miR-138-5p的表达下调,随后通过预处理补充miR-138-5p可以改善大鼠的神经炎症和认知功能,得出miR-138-5p与NLRP3的3'-UTR位点之间的特异性相互作用,其中NLRP3是miR-138-5p的直接靶标。
2.2.2 中药治疗 ZHANG等[52]研究发现牡荆素通过 降低 NLRP3、caspase-1、IL-1β、IL-6和裂解的caspase-3的表达来改善永久性双侧颈总动脉闭塞模型小鼠的认知障碍,并通过体外试验验证牡荆素能够抑制NLRP3炎症小体介导的炎性反应。
Kellerin是一种从传统中药阿魏中提取的新型化合物,具有强大的抗神经炎症作用。通过双侧颈总动脉阻塞建立PSCI小鼠模型,发现Kellerin可以通过抑制NLRP3炎症小体通路的激活,调节小胶质细胞的极化,从而改善模型小鼠的认知功能[53]。
黄芪甲苷是从中药材黄芪中分离的主要活性成分,LI等[54]研究发现,黄芪甲苷通过控制ROS的产生来抑制NLRP3炎症小体活化,降低海马中小胶质细胞的过度激活和炎性细胞因子的过度表达,通过其抗炎作用对短暂性脑缺血再灌注小鼠发挥改善认知障碍作用。
蛇床子素是来自中药蛇床子的香豆素类化合物,在不同的动物模型中存在神经保护作用[55];通过对双侧颈总动脉闭塞诱导的大鼠模型进行研究发现,蛇床子素能够改善海马神经元病理损伤,抑制小胶质细胞的活化,并通过抑制NLRP3炎症小体活化,减少海马中的β样淀粉蛋白(amyloid β-protein,Aβ)沉积,最终增强模型大鼠空间学习、记忆和工作能力[56]。
SHI等[57]通过网络药理学分析发现,益智通脉汤中的5个核心化合物具有抗血管性痴呆作用,其潜在机制可能是通过抑制NLRP3炎症小体、肿瘤坏死因子(TNF)信号通路和toll样受体信号通路改善其认知障碍。随后,使用分子对接技术将关键化合物与NLRP3炎症小体中的相关蛋白(NLRP3、ASC、caspase-1、IL-18和IL-1β)对接,发现这些化合物自发地与以上蛋白质结合。但益智通脉汤为成方,组方中的有效成分复杂,在抑制NLRP3炎症小体活化中具体起作用的成分有待于深入研究。
2.2.3 现代康复 XIA等[58]发现小脑顶核电刺激治疗可通过下调NLRP3、caspase-1、IL-1β、IL-18的表达,抑制自噬过程和炎性反应,从而减轻神经元的凋亡,改善动脉闭塞法建立模型大鼠的认知障碍。
2.2.4 中医传统技术 DU等[59]通过双侧颈总动脉闭塞建立血管性痴呆模型大鼠,发现针刺足三里和百会穴治疗可以使模型大鼠海马神经元丢失和氧化应激减少,硫氧还蛋白相互作用蛋白、NLRP3、caspase-1和IL-1β的表达降低,从而促进模型大鼠认知功能的恢复。ZHONG等[60]研究表明,电针神庭和百会穴位能够减轻脑缺血再灌注损伤大鼠的认知障碍,其通过上调线粒体自噬相关蛋白和抑制脑缺血再灌注损伤后ROS诱导的NLRP3炎症小体活化发挥神经保护作用。
3 小结与展望
靶向NLRP3炎症小体可能是PSCI治疗的新趋势。目前为止,尽管许多药物和治疗措施已成功鉴定出能够抑制NLRP3炎症小体的活化,但其临床中的治疗效果和安全性仍有待进一步验证,因此本文总结归纳的研究也较为有限。在神经系统疾病中,靶向NLRP3炎症小体的治疗药物的开发还需要通过其在血-脑脊液屏障中的渗透性来评估。更重要的是,在获得理想治疗值的前提下,不会对全身或中枢神经系统产生毒性作用。此外,PSCI是一种慢性进行性疾病,通常需要在早期进行干预。但长期使用炎症小体靶向药物是否会影响PSCI患者的健康还需要进一步评估。鉴于中药和中医特色疗法具有良好的安全性和较小的不良反应,其可能为PSCI的治疗提供新的方向。
作者贡献:李晓晓进行文章的构思、设计与撰写;王岩进行文献、资料收集及可行性分析;张雍闯进行文献、资料的整理与分析;陈淑颖、陈丽敏进行论文修订;白艳杰负责文章的质量控制及审校,并对文章整体负责。
本文无利益冲突。

