芹菜素对Aβ1-42致阿尔茨海默病大鼠海马组织氧化应激和炎症反应的影响*
范红娟,康凯宁,栗志英
1.邯郸市中心医院,河北 邯郸 056000; 2.河北工程大学附属医院,河北 邯郸 056000
阿尔茨海默病(Alzheimer′s disease,AD)是老年人群中较为常见的一种中枢神经系统退行性疾病,是老年痴呆的主要分型,其致死率仅次于心血管疾病、肿瘤、脑卒中,严重影响老年人生活质量和生命健康。AD主要表现为认知障碍、记忆力减退、人格及行为改变等[1]。海马组织是与认知、记忆等密切相关的脑功能区,研究发现,减轻海马神经元损伤能够有效改善AD症状并延缓其进展[2-3]。近年来病理学研究发现,β淀粉样蛋白(beta amyloid,Aβ)病理性沉积是AD最主要的病理改变,氧化应激和炎症反应在其病变过程中发挥着重要作用[4-5]。因此,探索以抑制氧化应激和炎症反应为治疗靶点的新型药物对改善AD具有重要意义。
AD在中医中又称为“老年呆病”,属于“健忘”“呆症”“文痴”等范畴,其病机在于脾胃虚弱、气血亏虚、痰浊血淤、阻塞清窍,为本虚标实之证[6-7]。芹菜具有养血补虚、清热解毒等功效,芹菜素是天然存在于旱芹等植物中的一种黄酮类化合物,具有良好的抗氧化、抗炎活性[8-9]。核因子E2相关因子2/血红素加氧酶1(nuclear factor E2 related factor 2/heme oxygenase 1,Nrf2/HO-1)是氧化应激反应重要的信号通路[10];核转录因子-κB(nuclear transcription factor-κB,NF-κB)对炎症反应具有重要调控作用[11]。研究发现,芹菜素可调控Nrf2/HO-1通路抑制氧化应激进而有效减轻妊娠期糖尿病大鼠肝损伤,调控NF-κB核转位抑制炎症反应进而有效抑制糖尿病肾损伤[12-13]。本实验旨在探讨芹菜素对β-淀粉样蛋白1~42片段(β-amyloid 1~42 fragments,Aβ1-42)致AD大鼠海马组织氧化应激和炎症反应的影响及相关机制。
1 材料
1.1 实验动物8周龄SPF级雄性Wistar大鼠100只,体质量220~250 g,购自河北医科大学实验动物公共服务平台,许可证号:SYXK(冀)2020-001,动物合格证号:20200925006。大鼠分笼饲养于室温23~25 ℃、相对湿度55%~65%的环境中,自由饮水进食,所有大鼠在实验过程中均按照3R原则给予人道主义关怀。本实验通过邯郸市中心医院伦理委员会审批,审批号:HDZXLL(K)2020-024。
1.2 药物与试剂芹菜素(陕西慧科植物开发有限公司,纯度≥98%,批号:191125);吡拉西坦片(石药集团欧意药业有限公司,批号:1200413)。Aβ1-42冻干粉(美国Sigma公司,批号:119M8714V);超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、IL-6检测试剂盒(南京建成生物工程研究所,批号:200127、200319、200114、200407、191230、200319);胞浆胞核蛋白制备试剂盒(北京普利莱基因技术有限公司,批号:0918A20);Nrf2抗体、HO-1抗体、NF-κB p65抗体(北京博奥森生物技术有限公司,批号:bs-1074R、bs-23397R、bs-3485R);β-肌动蛋白(β-actin)抗体(美国Abclonal公司,批号:AC026);IgG二抗(北京中杉金桥生物技术有限公司,批号:180511);增强型化学发光(enhanced chemiluminescence,ECL)试剂盒(上海碧云天生物技术有限公司,批号:P0018AS)。
1.3 仪器MD-3000型动物脑立体定位注射仪(美国BAS公司);ZH-Morris型水迷宫及视频分析系统(安徽正华生物仪器设备有限公司);RM2016型石蜡切片机(上海徕卡仪器有限公司);BMJ-A型包埋机(常州中威电子仪器有限公司);5424R型离心机(德国Eppendorf公司);MK3 型酶标仪(美国Thermo Fisher Scientific公司);DYCZ-24DN型电泳仪(北京六一生物科技有限公司);JY200C型转膜仪(北京君意东方电泳设备有限公司);GelDoc XR型凝胶成像系统(美国Bio-Rad公司)。
2 方法
2.1 动物分组、造模与给药适应性饲养1周后,按照随机数字表法,将100只大鼠随机分为5组,分别为正常组、模型组、芹菜素低剂量组、芹菜素高剂量组和吡拉西坦组,每组20只。除正常组外,其他组大鼠均参照文献[14]报道的方法复制AD大鼠模型,具体如下:以3 mL·kg-1体积腹腔注射10%水合氯醛溶液实施麻醉后,将大鼠固定于脑立体定位注射仪,于前囟后3.0 mm、正中矢状缝左旁和右旁3.0 mm、颅骨表面下3.5 mm处分别缓慢注射 2.5 μL 的Aβ1-42溶液(浓度4 g·L-1),注射时间 10 min;正常组大鼠缓慢注射2.5 μL 9 g·L-1氯化钠溶液,注射时间10 min。造模完成后,芹菜素低剂量组、芹菜素高剂量组大鼠分别以20 mg·kg-1、40 mg·kg-1剂量腹腔注射芹菜素溶液[15],吡拉西坦组大鼠以700 mg·kg-1剂量腹腔注射吡拉西坦溶液(根据人临床剂量换算),正常组和模型组大鼠腹腔注射给予9 ng·L-1氯化钠溶液,注射体积均为5 mL·kg-1,每天1次,疗程28 d。
2.2 Morris水迷宫实验检测大鼠学习记忆能力将Morris水迷宫分为4个象限,平台固定于第4象限的中心位置,水温25 ℃。末次给药24 h后,各组随机取10只大鼠,适应性训练3 d,每天训练4次,分别从4个象限头朝器壁方向将大鼠放入水中并引导大鼠寻找第4象限的平台。定位航行实验:第4天将大鼠分别从4个象限头朝器壁方向放入水中,记录找到位于第4象限平台的时间(120 s内未找到则按120 s计算),即为逃避潜伏期;空间探索实验:第5天撤掉位于第4象限的平台,将大鼠从第2象限头朝器壁方向放入水中,记录120 s内穿越第4象限原平台位置的次数。
2.3 HE染色观察海马组织CA1区神经元病理改变及病理分级Morris水迷宫实验完成后,麻醉、颈椎脱臼处死大鼠,取脑组织并去除小脑、脑干、嗅球后置于10%中性甲醛溶液中固定3 d,石蜡浸润包埋,5 μm厚连续切片,部分切片经梯度乙醇脱蜡水化后行常规HE染色,通过光学显微镜观察海马组织CA1区病理特点。参照文献[16]报道的方法对海马组织CA1区病理改变进行分级:神经元形态和结构正常为“-”;少量神经元形态改变为“+”;部分神经元胞核固缩或溶解、神经元排列疏松为“++”;大部分神经元胞核固缩或溶解、神经元层次紊乱为“+++”。
2.4 海马组织SOD、GSH-Px活性,MDA含量及TNF-α、IL-1β、IL-6水平检测分别取各组剩余的10只大鼠,麻醉后颈椎脱臼处死,冰上取脑组织并剥取海马体,取左侧海马组织,剪碎后加入6倍量4 ℃裂解液研磨匀浆,4 ℃、2 000 r·min-1离心 5 min,离心半径10 cm,取上清液,按照试剂盒说明检测SOD、GSH-Px活性,MDA含量和TNF-α、IL-1β、IL-6的水平。
2.5 Western Blot检测海马组织Nrf2、HO-1、胞浆NF-κB p65、胞核NF-κB p65蛋白表达水平取右侧海马组织100 mg,按照胞浆胞核蛋白提取试剂盒操作说明制备胞浆胞核蛋白,BCA法测定总蛋白含量后经SDS-PAGE电泳分离蛋白,转聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜,50 g·L-1脱脂奶粉封闭处理后,滴加Nrf2抗体(稀释比例1500)、HO-1抗体(稀释比例1500)、NF-κB p65(稀释比例1800)、β-actin抗体(稀释比例11 000),4 ℃ 孵育过夜,滴加IgG二抗(稀释比例 12 000)室温孵育2 h,滴加ECL显影后通过Image J 软件计算蛋白条带灰度值,以目的蛋白条带与β-actin条带灰度值的比值作为目的蛋白相对表达量。

3 结果
3.1 芹菜素对AD大鼠认知功能的影响与正常组比较,模型组大鼠逃避潜伏期显著延长(P<0.05),穿越平台次数显著减少(P<0.05);与模型组比较,芹菜素高剂量组和吡拉西坦组大鼠逃避潜伏期显著缩短(P<0.05),穿越平台次数显著增多(P<0.05);与吡拉西坦组比较,芹菜素高剂量组大鼠逃避潜伏期显著缩短(P<0.05),穿越平台次数显著增多(P<0.05)。见表1。
3.2 芹菜素对AD大鼠海马组织CA1区神经元病理改变及病理分级的影响正常组大鼠海马组织CA1区神经元形态呈圆形或椭圆形,排列整齐,层次清晰。模型组大鼠海马组织CA1区神经元数量减少,形态不规则,排列紊乱,胞体固缩深染。与模型组比较,各给药组大鼠海马组织CA1区神经元病理学改变呈不同程度减轻,芹菜素高剂量组改善效果最为显著。与正常组比较,模型组病理分级显著升高(P<0.05);与模型组比较,芹菜素高剂量组和吡拉西坦组病理分级显著降低(P<0.05);与吡拉西坦组比较,芹菜素高剂量组病理分级显著降低(P<0.05)。见图1,表2。

表1 芹菜素对AD大鼠认知功能的影响

注:A:正常组;B:模型组;C:芹菜素低剂量组;D:芹菜素高剂量组:E:吡拉西坦组图1 芹菜素对AD大鼠海马组织CA1区神经元病理改变的影响(HE,×400)
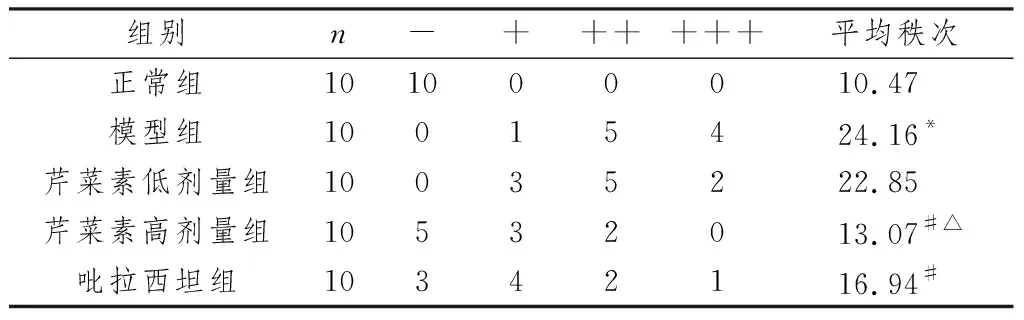
表2 芹菜素对AD大鼠海马组织CA1区神经元病理分级的影响
3.3 芹菜素对AD大鼠海马组织SOD、GSH-Px活性和MDA含量的影响与正常组比较,模型组海马组织SOD、GSH-Px活性显著降低(P<0.05),MDA含量显著升高(P<0.05);与模型组比较,芹菜素高剂量组和吡拉西坦组SOD、GSH-Px活性显著升高(P<0.05),MDA含量显著降低(P<0.05);与吡拉西坦组比较,芹菜素高剂量组SOD、GSH-Px活性显著升高(P<0.05),MDA含量显著降低(P<0.05)。见表3。
3.4 芹菜素对AD大鼠海马组织TNF-α、IL-1β、IL-6水平的影响与正常组比较,模型组大鼠海马组织TNF-α、IL-1β、IL-6水平显著升高(P<0.05);与模型组比较,芹菜素高剂量组和吡拉西坦组大鼠TNF-α、IL-1β、IL-6水平显著降低(P<0.05);与吡拉西坦组比较,芹菜素高剂量组 TNF-α、IL-1β、IL-6水平显著降低(P<0.05)。见表4。

表3 芹菜素对AD大鼠海马组织SOD、GSH-Px活性和MDA含量的影响

表4 芹菜素对AD大鼠海马组织TNF-α、IL-1β、IL-6水平的影响
3.5 芹菜素对AD大鼠海马组织Nrf2、HO-1蛋白表达水平的影响与正常组比较,模型组大鼠海马组织Nrf2、HO-1蛋白表达量均显著降低(P<0.05);与模型组比较,芹菜素高剂量组和吡拉西坦组Nrf2、HO-1蛋白表达量显著升高(P<0.05);与吡拉西坦组比较,芹菜素高剂量组Nrf2、HO-1蛋白表达量显著升高(P<0.05)。见图2、表5。
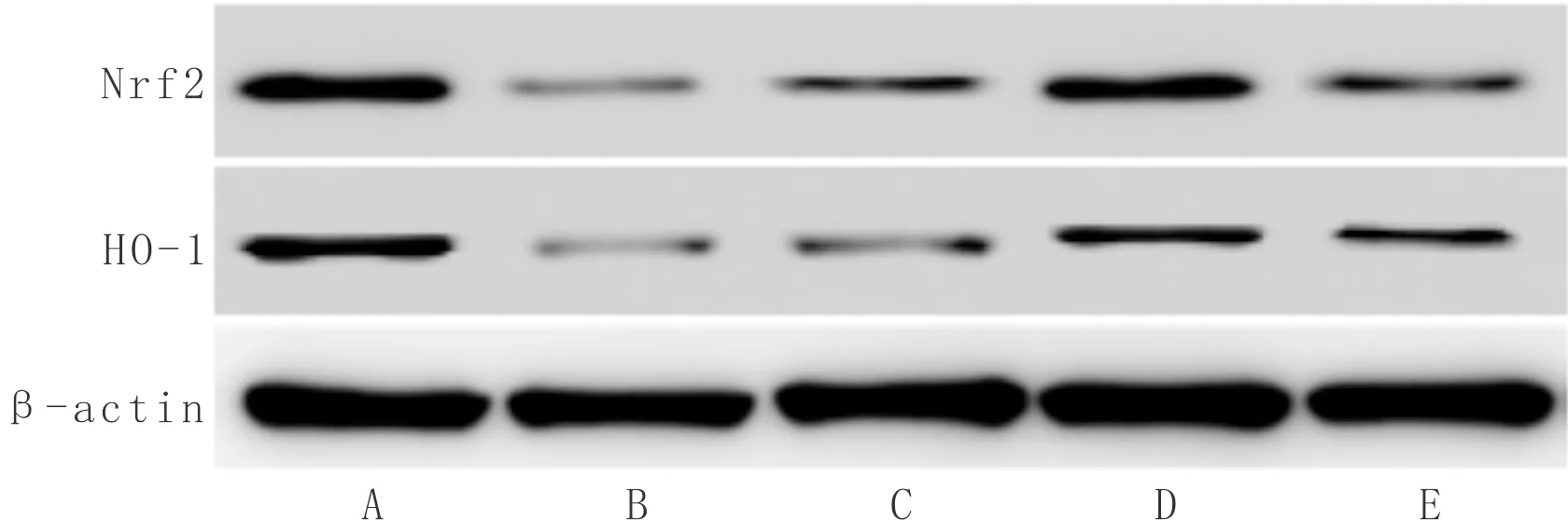
注:A:正常组;B:模型组;C:芹菜素低剂量组;D:芹菜素高剂量组;E:吡拉西坦组图2 大鼠海马组织Nrf2、HO-1蛋白条带图
3.6 芹菜素对AD大鼠海马组织胞浆NF-κB p65、胞核NF-κB p65蛋白表达水平的影响与正常组比较,模型组海马组织胞核NF-κB p65蛋白表达量及胞核NF-κB p65、胞浆NF-κB p65蛋白表达量比值均显著升高(P<0.05);与模型组比较,芹菜素高剂量组和吡拉西坦组胞核NF-κB p65蛋白表达量及胞核NF-κB p65、胞浆NF-κB p65蛋白表达量比值均显著降低(P<0.05);与吡拉西坦组比较,芹菜素高剂量组胞核NF-κB p65蛋白表达量及胞核NF-κB p65、胞浆NF-κB p65蛋白表达量比值均显著降低(P<0.05)。见图3,表6。
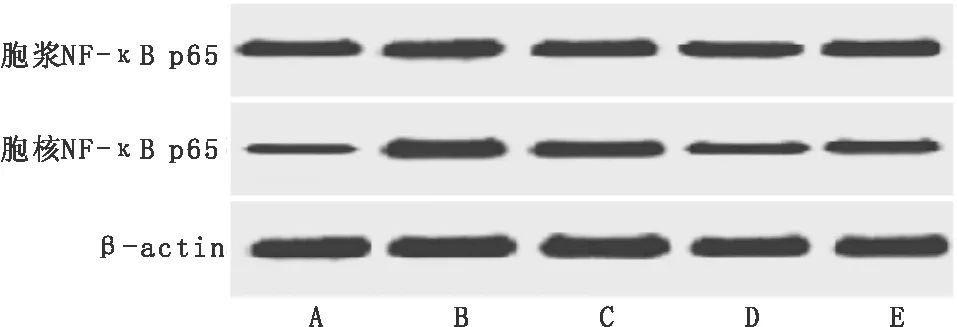
注:A:正常组;B:模型组;C:芹菜素低剂量组;D:芹菜素高剂量组;E:吡拉西坦组图3 大鼠海马组织胞浆NF-κB p65、胞核NF-κB p65蛋白条带图

表5 芹菜素对AD大鼠海马组织Nrf2、HO-1蛋白表达水平的影响

表6 芹菜素对AD大鼠海马组织胞浆、胞核中NF-κB p65蛋白表达水平及比值的影响
4 讨论
AD患病人群主要为65岁以上老年人,随着我国人口老龄化的加剧,AD发病率呈明显上升趋势,已成为我国亟待解决的社会问题和医学难题[17]。中医药具有防治结合、标本兼治的优势,在慢性病防治方面得到广泛关注与认可。芹菜为一年或二年生伞形科植物,其根、茎、叶、籽均可入药,具有养血补虚、清热解毒、防癌抗癌之功效,具有较高的药用价值。芹菜素为芹菜的主要活性成分,具有抗氧化、抗炎等多种药理学作用,涂丰霞等[15]研究发现,芹菜素对脑缺血所致认知功能障碍具有明显改善作用。吡拉西坦是一种神经细胞保护剂,对AD所致认知障碍、思维功能减退等具有明显改善作用,常用做AD新型药物实验研究的阳性对照药物[18]。双侧海马定向注射Aβ1-42制备AD大鼠模型具有操作简单、重复率高、与人类AD病理特点近似等优势,是国内外普遍认可的造模方法。本研究发现,AD模型大鼠学习记忆能力下降,大脑海马组织CA1区呈现神经元数量减少、形态不规则、排列紊乱、胞体固缩深染等病变,与李喜香等[19]研究报道一致,经芹菜素治疗则能够明显提高AD大鼠学习记忆能力,改善海马组织CA1区病变、降低病理分级,并且芹菜素高剂量组效果优于吡拉西坦组,提示芹菜素能够减轻AD大鼠海马组织损伤,改善AD症状。
Li等[20]研究发现,Aβ病理性沉积可导致活性氧(reactive oxygen species,ROS)大量生成,SOD、GSH-Px等抗氧化酶过度消耗,不能及时清除的ROS将攻击生物膜和生物大分子引发氧化应激损伤并诱发细胞凋亡。此外,Aβ病理性沉积将诱发炎症因子大量释放而引起炎症反应,其中具有趋化因子属性的TNF-α、IL-1β、IL-6能够刺激粒细胞等进一步释放炎症因子而加重炎症反应[21]。Nrf2普遍存在于真核细胞中,能够诱导SOD、GSH-Px等抗氧化酶表达而抑制氧化应激,并且Nrf2能够调控其下游基因HO-1的转录与表达,而HO-1则能够催化血红素分解成亚铁、一氧化碳、胆绿素,而胆绿素对ROS具有较强的还原活性,从而降低氧化应激损伤[22]。王珊等[23]研究发现,通过药物激活Nrf2/HO-1通路能够减轻Aβ致AD大鼠海马组织氧化应激损伤。NF-κB是一种以p50/p65二聚体形式存在的核转录因子,生理状态下与特异性酶抑制剂结合而无生理活性;病理状态下,ROS等将诱导 NF-κB 与酶抑制剂解离而使其活化,核转位后p65亚基与DNA特异性位点结合诱导炎性因子表达与释放,进而加重炎症反应[24]。HO-1则能够抑制NF-κB活化与核转位,从而间接抑制机体炎症反应[25]。王海英等[26]研究发现,通过药物抑制 NF-κB活化和核转位能够减轻AD所致炎症反应。本研究发现,经芹菜素治疗能够明显提高AD大鼠海马组织SOD、GSH-Px活性并降低MDA含量,降低TNF-α、IL-1β、IL-6水平,提高Nrf2、HO-1蛋白表达量,降低胞核NF-κB p65蛋白表达量及胞核NF-κB p65、胞浆NF-κB p65蛋白表达量的比值,芹菜素高剂量组作用优于吡拉西坦组,提示芹菜素具有抑制AD大鼠海马组织氧化应激和炎症反应的作用,其机制可能与激活Nrf2/HO-1通路、抑制NF-κB核转位有关。
综上所述,芹菜素能够抑制Aβ1-42致AD大鼠海马组织氧化应激和炎症反应,改善AD症状,该作用可能与激活Nrf2/HO-1通路、抑制NF-κB核转位有关。本研究结果为芹菜素治疗AD提供参考,为AD药物开发提供理论依据。

