体外银屑病样三维皮肤模型的构建
解雨馨,彭慧玲,先德海,钟建桥
银屑病是一种慢性炎症性疾病,与遗传易感性、免疫、炎症、氧化应激、外界环境等因素密切相关,影响全球人群约2%~3%[1]。在组织学上主要表现为角质形成细胞(keratinocytes,KCs)异常增殖、真皮毛细血管增生和炎性细胞浸润。目前银屑病的发病机制仍不完全清楚,但炎症和氧化应激被认为是致其发病的重要促进因素[2-3]。为更好地阐明银屑病的发病机制进而开发相应的药物,各种体内外模型得以快速发展。虽然动物模型能在一定程度上模拟人银屑病,但由于动物和人体的差异性与伦理学争议,使该类模型在发病机制研究和新药疗效观察方面仍受局限。基于此,体外模型得到了很好的发展,尤其是体外三维皮肤模型具有比单层细胞模型更符合人体皮肤结构和功能的特点[4-5]。故本研究通过联合应用肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)和γ-干扰素(interferon-gamma,IFN-γ)干预正常三维皮肤模型,建立具有类银屑病形态学、分子生物学特征的银屑病样三维皮肤模型,为进一步探究银屑病的发病机制以及后续药物研发提供理想的实验模型。
1 材料与方法
1.1材料
1.1.1实验细胞 构建三维皮肤模型的细胞所需要的原代KCs和成纤维细胞(fibroblasts, FBs),均来自西南医科大学附属医院行包皮环切术的2~10岁健康儿童的包皮。该研究获得西南医科大学附属医院伦理委员会的批准(2015016A),同时已获取患儿家属的书面同意,签署知情同意书。
1.1.2主要试剂 Ⅰ型鼠尾胶原蛋白购自北京鸿跃生物科技有限公司;TNF-α和IFN-γ购自美国PROTEINTECH GROUP公司;白细胞介素17(interleukin-17,IL-17)、IL-22、IL-23及活性氧(reactive oxygen species, ROS)试剂盒购自北京安迪华泰科技有限公司;丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)及谷胱甘肽(glutathione, GSH)试剂盒购自南京建成科技有限公司;角蛋白17(keratin-17, K17)、Ki67抗体购自Abcam公司。
1.2方法
1.2.1细胞的分离与培养 参照课题组前期实验方法[6-8],将获取的新鲜包皮组织彻底清洗、消毒,去除皮下血管、脂肪等,然后将其切成0.5 cm2的组织块,以真皮朝下浸没于0.25%中性蛋白酶4 ℃消化过夜。次日分离表皮和真皮,进一步将其剪碎,分别置于0.1%胰酶中37 ℃消化60 min。终止消化后以1 200 r/min速度离心6~8 min。经吸管反复吹打后收集上清,予以40 μm细胞滤器过滤上清,再度离心弃上清后余留表、真皮细胞沉淀。然后予以Dk-SFM培养基(限制性KCs无血清培养基)重悬表皮细胞即KCs沉淀和含10%胎牛血清的DMEM培养基重悬真皮细胞即FBs沉淀。最后分别接种于培养瓶内,在37 ℃、5%CO2孵箱中进行培养。细胞常规传代至2~3代时进行相关研究。因课题组前期已对上述细胞成功进行鉴定,故此处未再行鉴定[6]。
1.2.2正常和银屑病样三维皮肤模型的建立 按照课题组前期构建正常三维皮肤模型方法[6, 8],将200 μL的Ⅰ型鼠尾胶原蛋白、12 μL NaOH和28 μL稀释10倍后的FBs培养基混匀,随后立即加入760 μL FBs细胞悬液,充分混匀后移入Transwell上室,室温静置凝固后,上下室各加1 mL FBs培养基,置于37 ℃,含5%CO2孵箱中培养。3~6 d后待真皮类似物收缩成稳定大小,接种KCs于其表面,以Dk-SFM培养基浸没培养5~7 d,再气-液培养约10~14 d获得正常三维皮肤模型。同时在气-液培养的最后4 d,每天于上室中加入7.5 ng/mL的TNF-α和7.5 ng/mL的IFN-γ,以构建银屑病样三维皮肤模型,肉眼每日观察模型的变化。干预结束后,收集两种三维皮肤模型的组织和上清,行组织病理学观察其形态变化,运用免疫组织化学、分子学方法检测相关蛋白表达以鉴定该模型。
1.3实验室相关指标检测
1.3.1HE染色检测三维皮肤模型的病理组织改变 把经4%多聚甲醛固定、蔗糖溶液脱水后的正常皮肤组织与银屑病样三维皮肤组织,进行石蜡包埋、切片、苏木精-伊红(hematoxylin-eosin, HE)染色,观察所构建的三维皮肤模型结构。
1.3.2免疫组织化学染色检测三维皮肤模型K17和Ki67表达情况 正常与银屑病样三维皮肤模型组织的前期石蜡包埋、切片等步骤同HE染色。制备好的切片经过干燥、脱蜡、水洗后,依次予以3%过氧化氢和5%BSA封闭、一抗孵育过夜。次日二抗孵育0.5~1 h、DAB显色、苏木素复染,脱水、封片完成后在镜下观察K17和Ki67的表达情况。 KCs胞浆显示棕黄色表示K17 阳性,胞核显示棕黄色即Ki67阳性,而未显色则为阴性表达。
1.3.3ELISA实验检测IL-17、IL-23、ROS等表达水平 采用ELISA检测正常与银屑病样三维皮肤模型上清中 IL-17、IL-22、IL-23、ROS、MDA、SOD和GSH的含量。具体操作严格参照试剂盒说明书进行,终止反应后在酶标仪上不同波长处读取两个样本各指标的OD值,最后参照标准曲线量化各指标在不同样本中的浓度。
2 结果
2.1KCs和FBs细胞形态和特征 倒置相差显微镜观察发现,原代人KCs呈贴壁生长,形态为多角形或铺路石样,3~4 d逐渐融合(图1a)。FBs呈贴壁生长,呈梭形外观,逐渐形成密集分布放射状(图1b)。
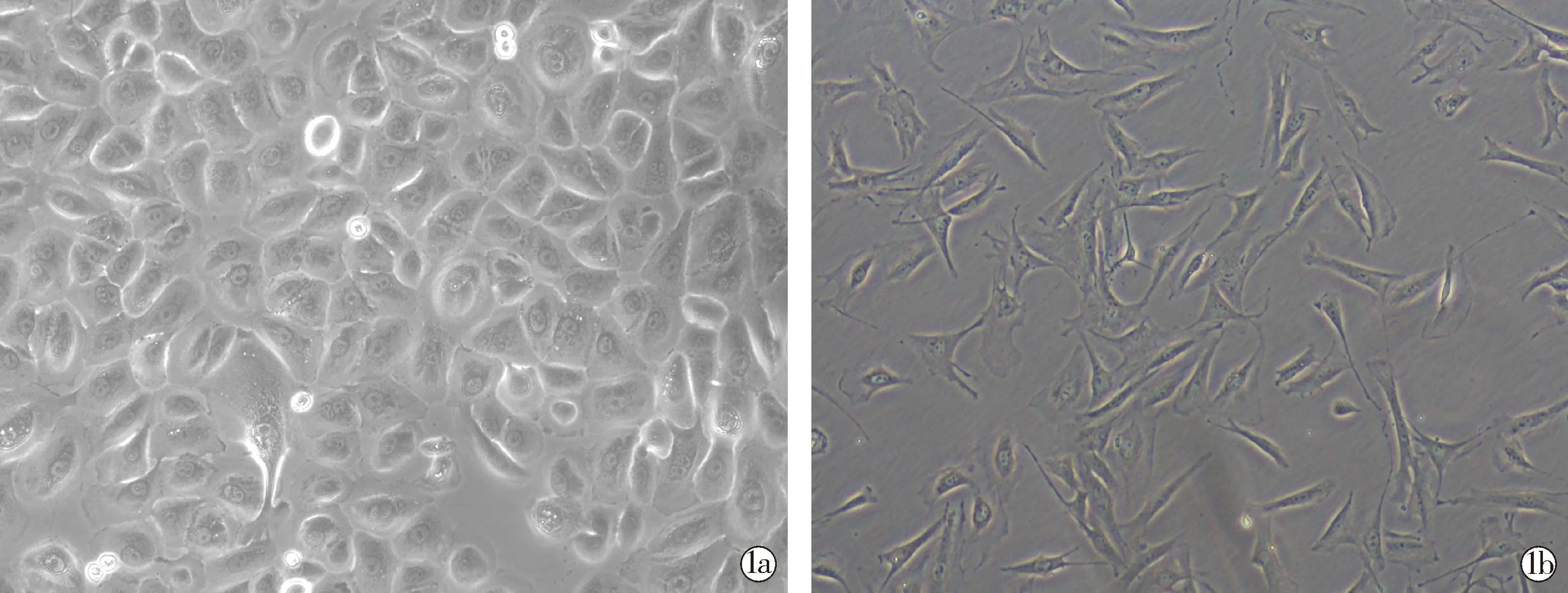
Primary KCs; Primary FBs图1 KC和FBs原代培养形态 (×400)Fig.1 Morphology of KCs and FBs in primary culture (×400)
2.2银屑病样三维皮肤模型外观表现 正常三维皮肤模型外观呈均匀乳白色,半透明状,边缘整齐无卷曲,具有一定的韧性和弹性(图2a)。银屑病样三维皮肤模型则呈乳白色不透明状,边缘卷曲,较正常三维皮肤模型增厚、缩小(图2b)。

Normal three-dimensional skin model; Psoriasis-like three-dimensional skin model图2 两种三维皮肤模型的外观形态Fig.2 Appearance of two three-dimensional skin models
2.3银屑病样三维皮肤模型组织病理学表现 HE染色后光镜下观察,正常三维皮肤模型可见分层的表皮和真皮,表皮层由 1~3 层排列整齐、紧密的 KCs 组成,真皮层见梭形FBs 和红色胶原(图3a)。银屑病样三维皮肤模型的表皮层较正常三维皮肤模型明显增厚,由6~8层KCs组成,真皮层仍可见FBs和红色胶原(图3b)。
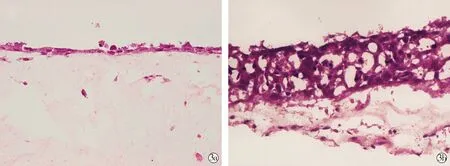
Normal three-dimensional skin model; Psoriasis-like three-dimensional skin model图3 两种三维皮肤模型组织病理学改变 (×400)Fig.3 Histopathology of two three-dimensional skin models (×400)
2.4银屑病样三维皮肤模型高表达K17 和Ki67 免疫组化染色显示,正常三维皮肤模型表皮细胞胞质中几乎不表达K17(图4a),仅见少量胞核表达Ki67(图4b)。银屑病样三维皮肤模型表皮细胞胞质中K17呈强阳性表达(图4c),约70%胞核表达Ki67(图4d)。

Expression of K17 in normal three-dimensional skin model; Expression of Ki67 in normal three-dimensional skin model; Expression of K17 in psoriasis-like three-dimensional skin model; Expression of Ki67 in psoriasis-like three-dimensional skin model图4 两种三维皮肤模型K17和Ki67的表达情况 (×400)Fig.4 Expression of K17 and Ki67 in two three-dimensional skin models (×400)
2.5银屑病样三维皮肤模型炎症因子表达上调 与正常三维皮肤模型相比,银屑病样三维皮肤模型上清中炎症因子IL-17、IL-22和IL-23的表达水平显著升高(P<0.01)(图5)。

IL-17;IL-22;IL-23Note: A indicated normal three-dimensional skin model; B indicated psoriasis-like three-dimensional skin model;compared with the normal three-dimensional skin model, **P<0.01.图5 两种三维皮肤模型炎症因子的表达Fig.5 Expression of inflammatory factors in two three-dimensional skin models
2.6银屑病样三维皮肤模型氧化-抗氧化平衡失调 与正常三维皮肤模型比较,银屑病样三维皮肤模型上清中氧化物ROS和MDA水平升高明显(P<0.01),而抗氧化物/酶SOD和GSH表达明显下降(P<0.01)(表1)。
表1 两种三维皮肤模型上清氧化应激相关指标水平Tab.1 Levels of oxidative stress-related indicators in supernatant of two three-dimensional skin
3 讨论
银屑病是一种免疫介导的慢性炎症性疾病,可出现在任何年龄段,近年发病率呈升高趋势,全球约2%~3%的人群日常生活与身心健康受到其影响[1]。目前银屑病的发病机制尚未完全阐明,炎症和氧化应激可能是促进该病发生发展的重要因素,其中一些关键的促炎因子参与了银屑病的发病过程。由于缺乏一个精准、稳定、可复制又无伦理学争议的银屑病临床前模型,因而对于其发病机制的探究始终难以深入,并且极大地阻碍了新药研发。故在本研究中,笔者通过机械分离结合酶消化法,获得KCs和FBs,并以Ⅰ型鼠尾胶原蛋白作为支架,构建出正常三维皮肤模型。随后予以TNF-α和IFN-γ干预建立银屑病样三维皮肤模型。造模完成后取皮肤模型组织经HE染色后观察其病理学改变,免疫组织化学染色测定K17和Ki67的表达,ELISA和比色法分析两种三维皮肤模型上清液中IL-17、IL-22、IL-23、ROS、MDA、SOD和GSH的水平变化,以探寻出更符合银屑病特征的模型。
既往对银屑病模型的研究主要局限于动物试验或者细胞水平如单层细胞培养的KCs[9]。现今已经成功构建出的多种银屑病模型,如体内动物模型包括直接诱导银屑病样小鼠模型、异种移植小鼠模型、细胞因子注射小鼠模型、Camk4小鼠以及基因工程小鼠模型等[10-13];但因其成本高以及动物伦理、人与小鼠免疫系统间差异等问题,使其应用受限。而体外细胞模型如以HaCaT及人KCs为细胞源,加入相关因子建立的银屑病样细胞模型,虽然构建方法简单、可重复性高,但该类模型难以模拟体内状态,尤其是难以呈现银屑病组织病理学特点[9]。因此在更接近人体皮肤状态下,应用三维皮肤模型进行银屑病的研究尤为恰当。它不仅能真实地模仿人体内环境,还可避免伦理学争议。本研究通过建立体外三维皮肤模型后加入细胞因子以模拟银屑病状态,最终构建出银屑病样三维皮肤模型。
本实验基于课题组前期方法成功分离和培养出KCs和FBs,以Ⅰ型鼠尾胶原为支架混合FBs构建真皮层,再接种KCs重建表皮层,最终获得类似人皮肤的乳白色、半透明状物,其边缘整齐无卷曲,具有一定韧性和弹性;同时组织病理学表现为表皮层由1~3层KCs组成,细胞排列整齐、紧密,真皮层为梭形FBs和胶原构成。这与本课题组前期[8]以及Morin[5]、Mok等[4]构建的三维皮肤模型无论是形态学还是组织病理学特征均一致,证实本研究再次成功培养出人正常三维皮肤模型。尽管所构建的三维皮肤表皮细胞层数略少,细胞之间的连接不够紧密,考虑可能与体外KCs分化不良以及KCs快速增殖使角质透明蛋白和脂质的减少有关;但本实验构建的三维皮肤已具备较完整的表、真皮结构,接近正常皮肤,这为后续银屑病样三维皮肤模型的建立奠定良好基础。
众多研究已证实TNF-α和IFN-γ是银屑病发病的关键因子[9],并与疾病的严重度密切相关[14]。TNF-α可通过增强血管内皮生长因子的表达以促进血管生成,还可激活NF-κB进而促进KCs增殖。而IFN-γ可以诱导抗凋亡蛋白表达,刺激KCs增殖[15],从而加重银屑病皮损[16]。既往的研究[9]常应用这两种因子干预人KCs(如HaCaT细胞)以获得银屑病样细胞模型[17]。因此,在课题组前期三维皮肤模型构建的基础上优化实验条件,分别将7.5 ng/mL的TNF-α和7.5 ng/mL的IFN-γ加入正常三维皮肤模型中进行诱导刺激以构建银屑病样三维皮肤模型。实验结果发现,加入上述因子的三维皮肤较正常三维皮肤增厚、缩小,且皮肤边缘出现卷曲,这可能是与TNF-α和IFN-γ共同刺激后,致KCs快速增殖从而牵拉组织以及表皮生长周期明显缩短有关。同时HE染色显示其表皮层明显增厚约6~8层,与人银屑病组织病理学改变相类似,提示本课题构建的三维皮肤模型具有银屑病的特点。
那么本研究构建的模型是否为银屑病样三维皮肤模型?是否具有银屑病KCs异常增殖、炎症及氧化应激等状态特征?较多研究认为,炎症和氧化应激是银屑病发病的重要促进因素,它们始终贯穿于银屑病的发生发展中[2-3]。银屑病患者血清和皮损中的炎症及氧化应激相关指标表达显著异常,如促炎因子(IL-17、IL-23、IL-22等)以及ROS、MDA等水平升高,而SOD、GSH等降低,使银屑病氧化应激状态持续;在氧化应激状态下,ROS激活MAPK、JAK/STAT等通路,促进KCs和T细胞活化并分泌一系列促炎因子,以及银屑病特异性标志物K17和促增殖因子Ki67等形成炎症级联反应[10],使KCs异常增殖、过多血管形成、炎症持续,最终导致银屑病发生[16-19]。因此结合上述银屑病的发病机制,为进一步证实本研究构建的模型是银屑病样三维皮肤模型,本课题组又检测了相关指标。结果发现,经TNF-α和IFN-γ诱导后的三维皮肤强表达银屑病特异性标记K17和促增殖因子Ki67,而正常三维皮肤无明显表达或表达很弱,提示本实验建立的三维皮肤模型具有银屑病生物学特性,且KCs出现异常增殖。同时IL-17、IL-22、IL-23等炎症因子以及ROS和MDA水平显著升高,而SOD、GSH水平降低,均提示炎症和氧化应激发生,符合银屑病的改变[18],与文献报道一致[10]。以上结果证实本研究已成功构建出银屑病样三维皮肤模型。
综上所述,本研究中经TNF-α和 IFN-γ干预后的三维皮肤模型,无论是外观、组织病理学表现,还是炎症因子和氧化应激相关指标的变化,均符合银屑病改变,表明通过本组实验方法能成功构建出银屑病样三维皮肤模型,为银屑病发病机制的深入研究和新药的开发提供理想的实验载体,值得进一步研究和应用。由于该模型不具备T细胞、神经细胞、血管等结构,仍不能完全模拟人体皮肤结构,因此需要继续完善。

