视蛋白 3调控人真皮成纤维细胞Ⅰ型胶原蛋白生成
牟慧玲,曾雯,董仙,汪宇,张伟,冯江龙,兰应华,罗欢欢,叶藤,陆洪光
胶原蛋白(collagen)是细胞外基质的主要框架结构[1]。人类皮肤胶原蛋白主要由Ⅰ、Ⅲ型胶原蛋白构成,成纤维细胞是合成胶原蛋白的主要细胞。Ⅰ型胶原蛋白(collagen Ⅰ, COL-1)是最常见的胶原蛋白,占正常人皮肤胶原蛋白的70%以上[2-3]。胶原蛋白在皮肤正常生理过程及疾病的发生中有着重要的作用,如伤口愈合、皮肤老化及增生性瘢痕形成等[4-5]。近年来,促进成纤维细胞胶原蛋白合成达到医疗美容目的及抑制胶原蛋白合成治疗瘢痕疙瘩成为研究热点[6]。视蛋白(opsins, OPNs)属于光敏 G蛋白偶联受体(G protein-couped receptors, GPCRs)超家族,通过 GPCR 信号通路介导光转导[7-9]。视蛋白3(opsin3, OPN3)是视蛋白家族中的一员,最近的研究[10]表明,视蛋白存在于包括皮肤在内的眼外组织中。它们不仅在眼内有光传导功能,其在眼外也有非光依赖功能。视蛋白3被发现可参与肝癌细胞的凋亡,在肺腺癌中促进上皮间质转化和肿瘤转移,在皮肤微血管内皮细胞中可以调节血管生成[11];视蛋白3在皮肤中被发现可调控黑素细胞的凋亡和色素形成[12-13],可调控角质形成细胞的分化[14]。视蛋白3在皮肤的多种功能被逐步揭示,本课题组进一步关注视蛋白3是否能调控人真皮成纤维细胞合成胶原蛋白,本文拟对视蛋白3在人真皮成纤维细胞中对Ⅰ型胶原蛋白合成的影响及其可能的机制进行研究。
1 材料与方法
1.1细胞和主要试剂来源 正常人真皮成纤维细胞来自贵州医科大学附属医院小儿外科包皮切除手术患儿的废弃包皮,实验获得患者同意并经过伦理审查;DMEM细胞培养基购自美国Gibco公司;RT-PCR试剂盒购自美国Thermo Fisher 公司;ELISA试剂盒购自美国R&D Systems公司;一抗、 二抗购自中国 Affinity公司、美国Santa Cruz公司及英国Abcam公司;Lipo-fectamine 2000购自美国Thermo Fisher公司;CCK-8 试剂盒购自日本Dojindo公司;EDU细胞增殖检验试剂盒购自南京碧云天生物技术有限公司;Transwell小室购自美国Corning公司;细胞周期与凋亡试剂盒购自上海七海复泰生物科技有限公司;AKT抑制剂(MK-2206 2HCI)购自美国Selleck Chemicals公司。引物由上海捷瑞生物公司合成,本研究中使用了以下人类引物:GAPDH F,5′-GACATCCGCAAAGACCTG-3′;GAPDH R,5′-GGAAGGTGGACAGCGAG-3′;OPN3 F,5′-CAATCCAGTGATTTATGTCTTCATGATCAGAAAG-3′;OPN3 R,5′-GCATT-TCACTTCCAGCTGCTGGTAGGT-3′;COL1A1 F,5′-TGAGCCAGCAGATCGAGA-3′;COL1A1 R,5′-ACCA-GTCTCCATGTTGCAGA-3′。
1.2细胞分离及培养 正常人真皮成纤维细胞(NHDFs)是利用4~12岁小儿包皮手术后废弃包皮,消毒、清洗、去除皮下组织后剪成约1 cm×1 cm皮片,使用0.25% Dispase酶将组织块4 ℃过夜消化,眼科镊分离真表皮,将真皮贴于培养皿中,37 ℃,5% CO2培养箱倒置2 h后加入含10%胎牛血清的DMEM培养基,3~7 d后成纤维细胞从组织块中爬出。待大量成纤维细胞爬出后,移去组织块,0.25%胰酶消化、传代,并于含10%胎牛血清的DMEM培养基中继续培养至第3~5代使用。
1.3细胞免疫荧光 将细胞以1×104个细胞的密度接种到盖玻片上,培养24 h后用PBS洗涤3次。细胞在室温下用95%乙醇固定10 min,然后在室温下干燥。胎牛血清37 ℃封闭 30 min,4 ℃孵育一抗过夜。次日,PBS洗涤3次后,加入荧光标记的二抗,常温孵育1 h,最后使用DAPI核复染剂染色10 min,在统一曝光条件下,用荧光显微镜下观察细胞并拍照。
1.4实时荧光定量PCR分析 将细胞收集好,使用总RNA抽取试剂提取总RNA,RNA浓度由分光光度计测得,然后使用逆转录试剂盒将RNA逆转录为cDNA。最后使用荧光定量试剂盒检测所选靶基因的表达水平,计算目的基因的2-ΔC或2-ΔΔCt值分析其表达水平。
1.5蛋白免疫印迹分析 收集细胞并使用含1 mmol/L苯甲基磺酰氟(PMSF)的RIPA裂解缓冲液提取总蛋白,然后使用酶标仪检测总蛋白浓度,将蛋白热变性,加入40 μg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,然后转移到聚偏二氟乙烯膜上。在含5%脱脂奶粉的TBST缓冲液中室温封闭2 h,然后在一抗工作液(β-Tublin,OPN3,COL1A1,PI3K,p-PI3K,AKT,p-AKT)中于4 ℃孵育过夜,洗涤后再与相应的二抗工作液室温下孵育1 h。最后,利用化学发光显影剂ECL曝光显示特定条带。
1.6细胞转染 将第3~5代细胞以4×104个/孔的细胞密度接种在6孔板中,设计针对人视蛋白3的小干扰RNA,将细胞分为对照组RNAi-control组和靶向沉默视蛋白3的RNAi-OPN3组(序列号分别为siRNA-control 5′-UUCUCCGAACGUGUCACGUTT-3′;siRNA-OPN3 5′-GUCACCUUUACCUUCGUGUTT-3′),使用Lipofectamine 2000转染试剂用以协助小干扰RNA(small interfering RNA, siRNA) 转染进入细胞,根据制造商的方案,最终浓度为50 nmol/L,在转染细胞48 h后,使用蛋白质免疫印迹和实时荧光定量PCR检验转染效率。
1.7细胞活力检验 使用CCK-8试剂盒检验细胞增殖活力。细胞沉默视蛋白3后1×104/孔接种在96孔板中,待细胞贴壁后,在0、24、48、72 h,加入10 μL CCK-8溶液并在37 ℃下再孵育2 h,然后使用酶标仪测量450 nm处的吸光度。
1.8EDU检测细胞增殖 细胞沉默视蛋白3后以2×104/孔接种在24孔板中,每孔加入10 mmol/L的EDU在37 ℃下孵育2 h,然后使用4%多聚甲醛室温下固定15 min,在含0.3%的Triton X的通透液中孵育15 min后,与Click反应液一起室温下避光孵育30 min,再与Hocheset33342一起室温下避光10 min。最后,在荧光显微镜下选取5个视野,统计增殖细胞占总细胞的比值进行分析。
1.9Transwell实验 在24孔板中加入400 μL含10%胎牛血清的DMEM培养基,然后放入小室,在小室中以1×104个/孔的细胞密度在200 μL血清的DMEM培养基中种入细胞。在观察时间点(24、48 h)将小室取出,先用4%多聚甲醛在室温下固定细胞20 min,然后用结晶紫染色液染色10 min后在PBS缓冲液中漂洗小室,将小室风干,通过倒置显微镜观察并拍照。对穿过小室的细胞数使用Image J软件进行计数。
1.10酶联免疫吸附测定法 细胞沉默视蛋白3后以4×104个/孔接种在6孔板中,分别在24、48 h收集培养液,离心后取上清液,按照R&D system公司ELISA试剂盒(货号DY6220-05)标准步骤进行实验,最后在450 nm下检测吸光度值,对应标准曲线得到分泌蛋白量。
1.11细胞周期检测 细胞干预后用PBS洗涤细胞,然后用70%乙醇4 ℃固定过夜,最后用RNase及碘化丙啶37 ℃避光孵育30 min后,使用流式细胞仪检测,最后用Flow Jo10软件分析细胞周期分布。
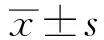
2 结果
2.1OPN3及COL-1在正常人真皮成纤维细胞中表达 在人真皮成纤维细胞(NHDFs)中OPN1~5均有表达,且OPN3表达明显高于其他OPNs(t=20.53、14.59、22.82、19.84,P<0.05),提示OPN3可能在NHDFs中发挥重要作用,见图1。免疫荧光结果显示,OPN3和COL-1在NHDFs中呈阳性染色,OPN3主要分布于细胞膜上,见图2。

Note: OPN3 compared with OPN1,OPN2,OPN4 or OPN5,*P<0.05.The relative mRNA expression level of OPNs were detected by RT-PCR;The relative protein expression level of OPNs were detected by Western blot图1 OPNs在正常人真皮成纤维细胞中的表达Fig.1 Expression of OPNs in normal human dermal fibroblasts
Note:The left panel represented the localization of OPN3(green) at the plasma membrane, and the localization of COL-1(red) at the whole cell, the middle panel represented the nucleus stained with 4′,6-diamidino-2-phenylindole(DAPI)(blue) and the right panel represents an overlay of the middle panel and the phase contrast image.~Representative images showed OPN3 and COL-1 protein expression in NHDFs图2 OPN3及COL-1在正常人真皮成纤维细胞中的表达和定位 (×400)Fig.2 The expression and localization of OPN3 and COL-1 (×400)
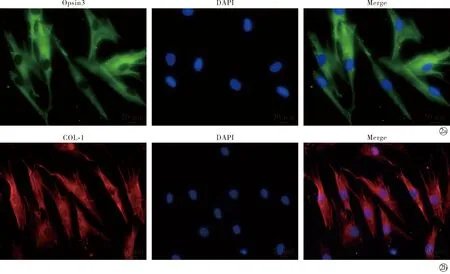
2.2小干扰RNA转染后细胞中OPN3的表达 与对照RNAi-control组(48 h)相比,OPN3基因沉默后RNAi-OPN3组mRNA和蛋白的表达显著下调,差异有统计学意义(t=12.77,P<0.01),见图3。
Note:RNAi-OPN3 compared with RNAi-control,*P<0.05,**P<0.01.The relative mRNA expression level of OPN3 were detected by RT-PCR;The relative protein expression level of OPN3 were detected by Western blot and normalized with β-tublin level;The relative mRNA expression level of COL-1 were detected by RT-PCR; The relative protein expression level of COL-1 were detected by Western blot and normalized with β-tublin level图3 沉默OPN3后OPN3 mRNA和蛋白的表达Fig.3 Relative expression level of OPN3 mRNA and protein after silencing OPN3
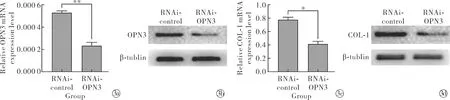
2.3沉默OPN3对NHDFs胶原蛋白合成的影响 与对照组相比,沉默组RNAi-OPN3组COL-1基因表达及蛋白表达量明显降低,其差异有统计学意义(t=16.61,P<0.05);与对照组(24、48 h)相比,沉默组RNAi-OPN3组COL-1上清液中分泌量明显减少,其差异有统计学意义(t24 h=7.55、t48 h=4.98,P<0.05);与对照组相比,沉默组RNAi-OPN3组细胞免疫荧光COL-1明显减弱,见图4。表明OPN3可调控NHDFs中胶原蛋白的合成。
Note: RNAi-OPN3 compared with RNAi-control,*P<0.05.Procollagen secretion level were detected by ELISA; The expression of COL-1 were detected by immunofluorescence (×400)图4 沉默OPN3后COL-1合成水平Fig.4 Relative expression level of COL-1 after silencing OPN3
2.4沉默OPN3对NDHFs增殖活力的影响 与RNAi-control组相比,沉默组RNAi-OPN3从24 h起,细胞增殖活力显著低于对照组,且抑制效率随时间增加而升高(t24 h=6.94、t48 h=15.38、t72 h=13.82,P<0.05),见图5。为验证OPN3对细胞增殖的影响,使用EDU检测细胞增殖状态,48 h时染色可见敲低组RNAi-OPN3增殖细胞比例相比于对照组明显降低,其差异具有统计学意义(t=7.52,P<0.01),见图5。表明OPN3参与调控NHDFs中的增殖活力。
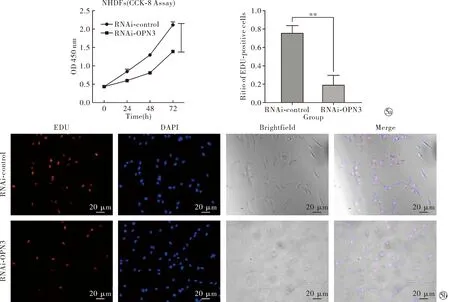
Note: RNAi-OPN3 compared with RNAi-control,**P<0.01.Measure the cell proliferation activity by CCK-8 at 0, 24, 48 and 72 hours; Measure the cell proliferation rate by EDU (×200)图5 沉默OPN3后检测细胞增殖活力Fig.5 Cell proliferation activity was detected after OPN3 was silenced
2.5沉默OPN3对NHDFs细胞周期的影响 与对照组相比,沉默组RNAi-OPN3组NHDFs细胞S期比例降低,而G2期细胞比例升高,其差异具有统计学意义(tS期=5.65、tG2期=3.60,P<0.05),见图6。表明OPN3可以通过抑制S期细胞的百分比来抑制细胞周期进程。
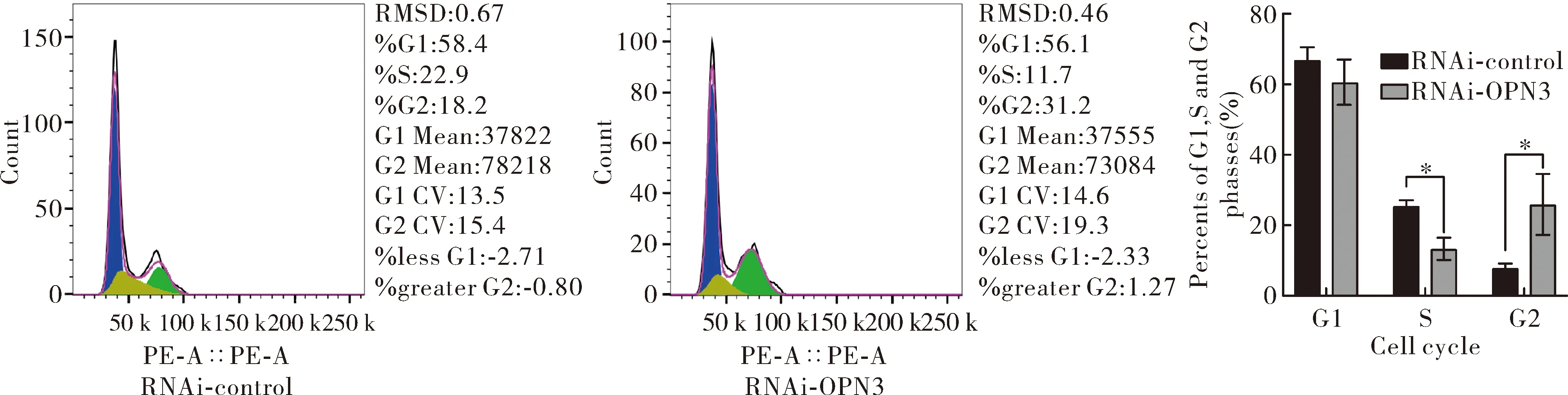
Note: RNAi-OPN3 compared with RNAi-control,*P<0.05,after transfecting cells with OPN3 siRNA and control-siRNA, cell cycle was detected by flow cytometry.图6 沉默OPN3后检测细胞周期Fig.6 Cell cycle was detected after OPN3 was silenced
2.6沉默OPN3对NHDFs迁移能力的影响 与RNAi-control组相比,敲低组RNAi-OPN3迁移细胞数目在24、48 h明显降低,其差异有统计学意义(t24 h=32.94、t48 h=11.41,P<0.01),见图7。
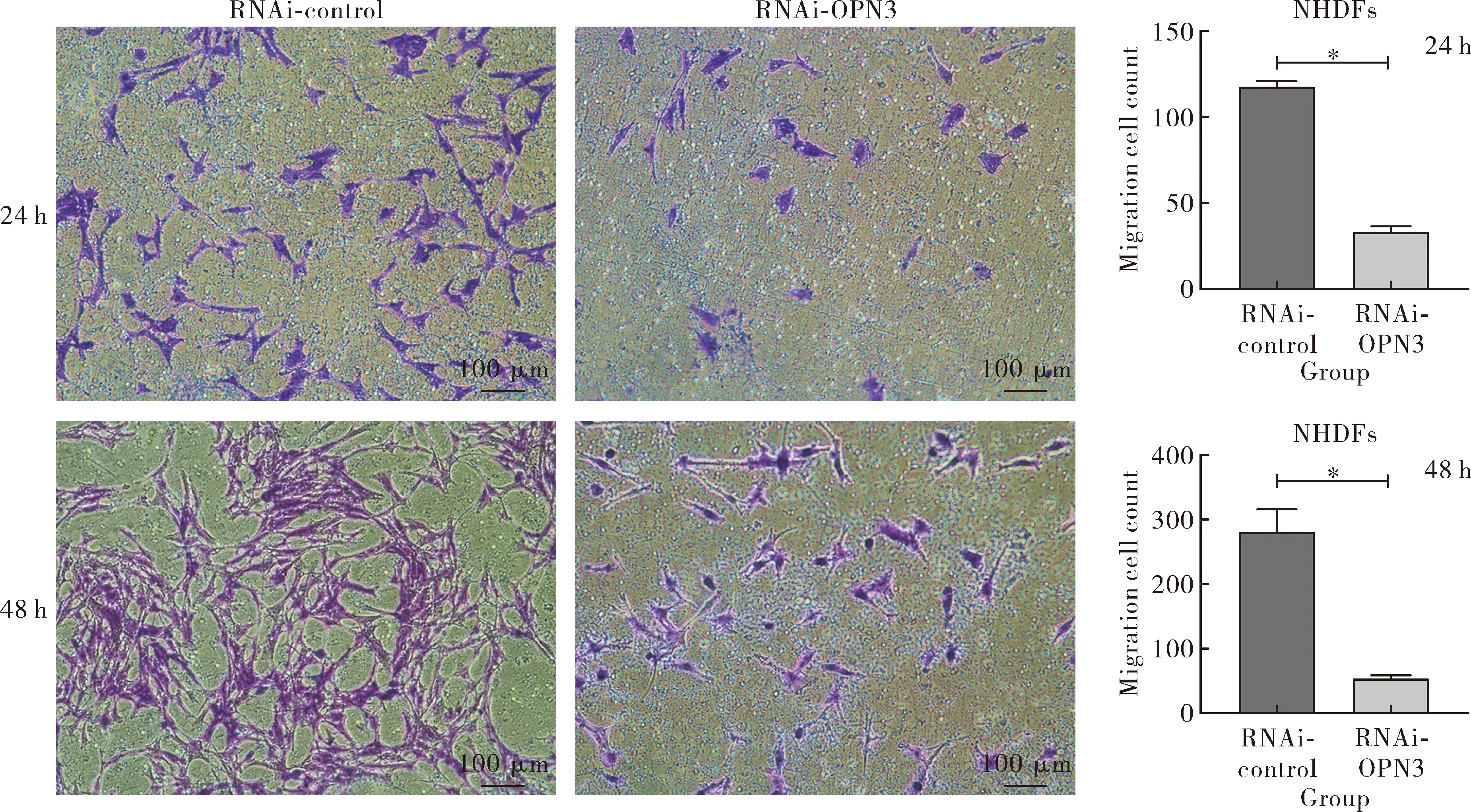
Note:Transfecting cells with siRNA and control-siRNA, cells were stained with crystal violet and counted with Image J at 24 and 48 hours (×100).图7 Transwell检测细胞迁移能力Fig.7 Cell migration detected by transwell
2.7OPN3通过PI3K/AKT信号通路影响胶原蛋白合成 结果如图8所示,与RNAi-control组相比,敲低组RNAi-OPN3中p-PI3K/AKT表达水平明显降低。AKT抑制剂MK-2206 2HCl在20 μmol/L剂量下显著抑制AKT磷酸化,实验表明细胞合成胶原蛋白水平明显低于空白对照组及溶解剂DMSO对照组,见图9。这些数据表明,OPN3可能通过PI3K/AKT信号通路调控成纤维细胞中胶原蛋白的合成。
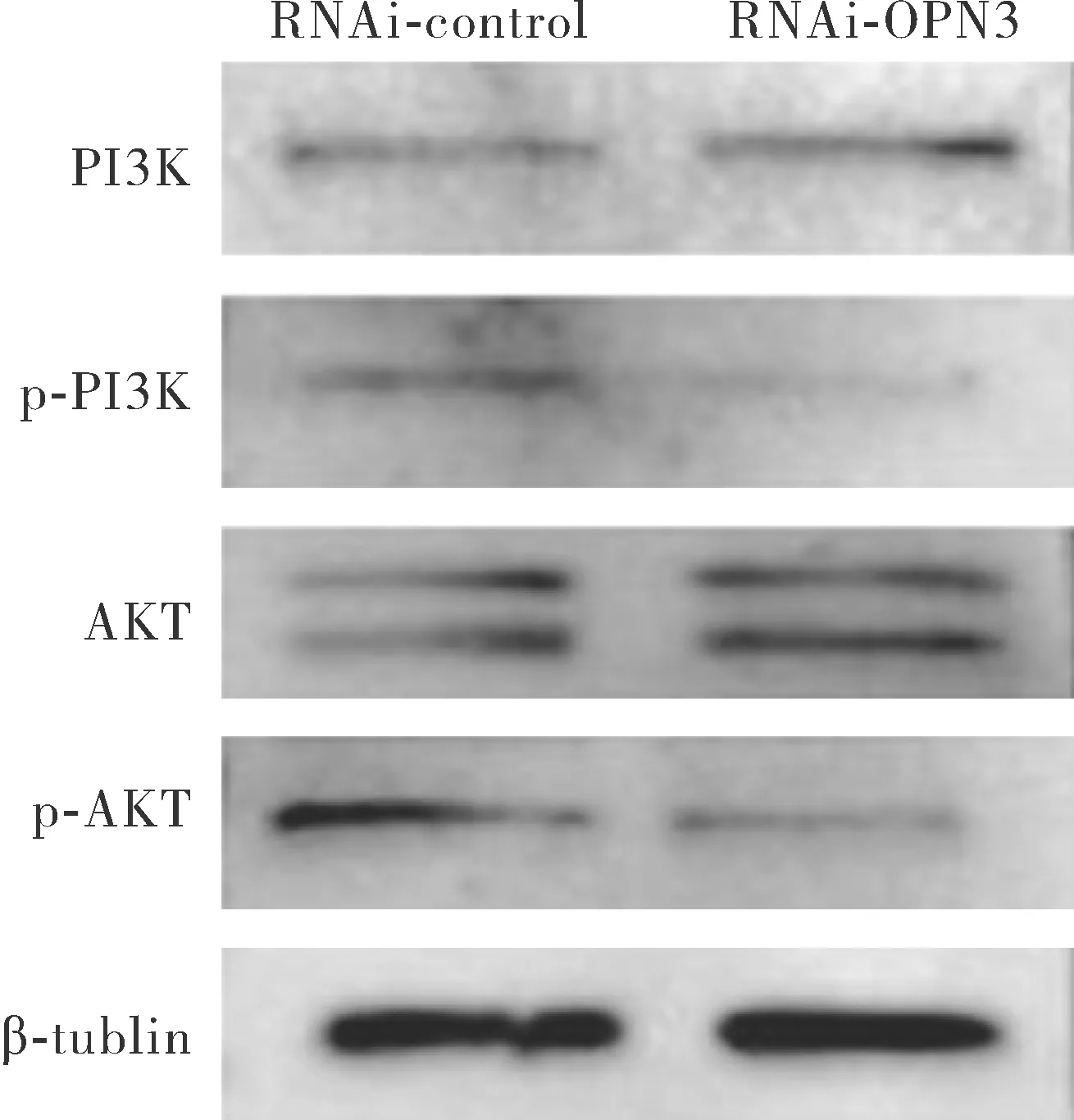
图8 干扰OPN3后PI3K/AKT信号通路相关蛋白的表达Fig.8 Expression of PI3K/AKT pathway related protein after interference with OPN3
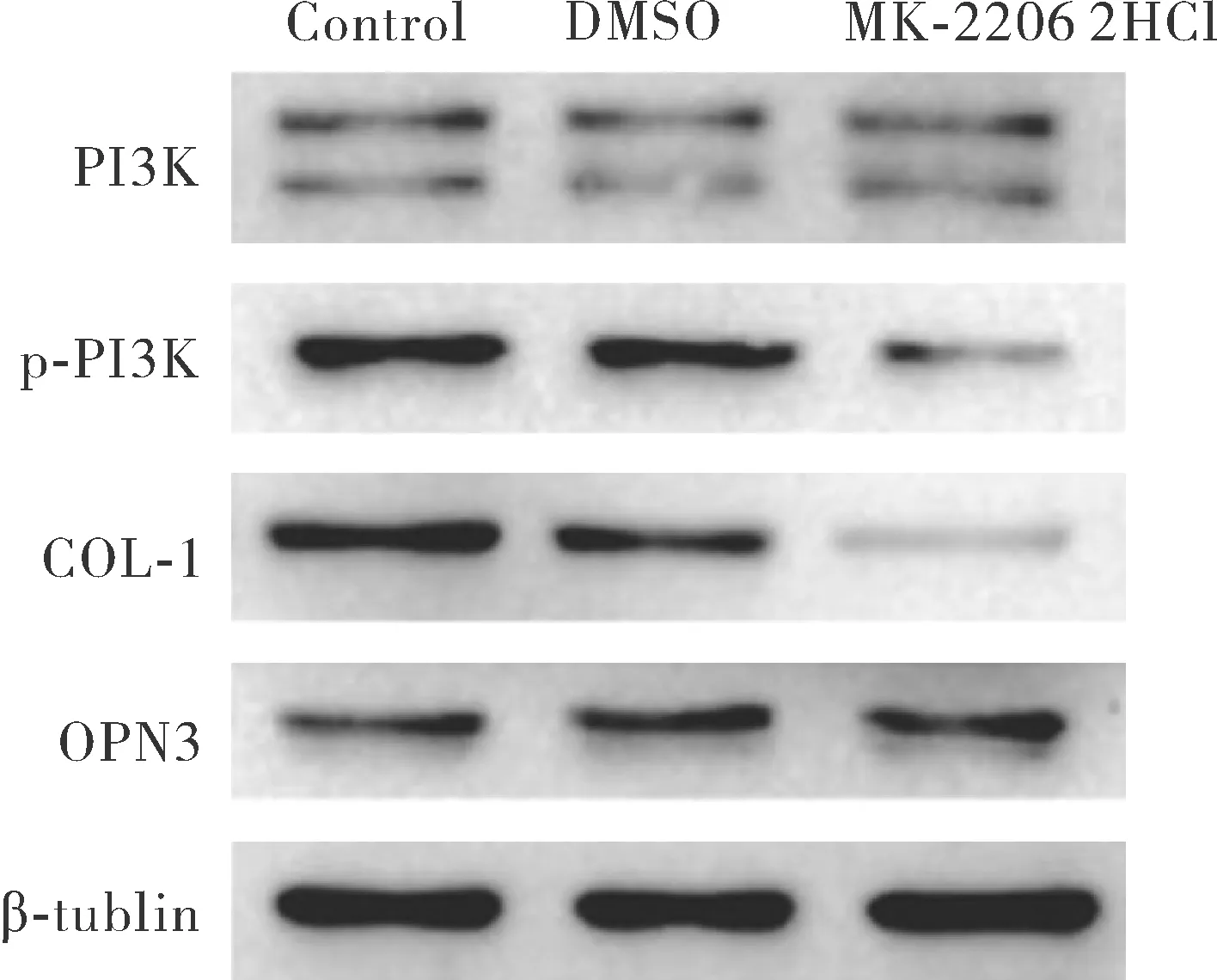
图9 抑制AKT活化后COL-1合成水平Fig.9 Expression level of COL-1 protein after inhibiting AKT phosphorylation
3 讨论
OPNs是一种G蛋白偶联受体超家族中的光敏感受体蛋白,以前报道[8]在人类视网膜的视觉敏感性、昼夜节律和瞳孔光反射中有着重要作用。近来发现[8-10],OPNs不仅分布在眼内,其分布范围广泛,包括人眼、大脑、睾丸、肝脏、肾脏和皮肤。OPN3是视蛋白家族中的一员,最初在小鼠大脑中被发现,近来被证明在皮肤细胞中大量分布[9,14]。笔者的结果证实OPN3在人真皮成纤维细胞中高表达,但它的功能并不完全清楚。OPN3在各种细胞中发挥不同的功能,研究[14]发现,OPN3参与角质形成细胞的分化,OPN3可调节黑素细胞的色素形成及酪氨酸酶活性[13,15],OPN3下调可能通过诱导人表皮黑素细胞和肝癌细胞的凋亡[12],OPN3还在人表皮微血管细胞中发挥不依赖光的作用[11]。那么,OPN3在人真皮成纤维细胞中可能参与什么功能,本研究围绕该问题展开探索。
如前所述,人类皮肤胶原蛋白主要由Ⅰ、Ⅲ型胶原蛋白构成,而Ⅰ型胶原蛋白是最主要的胶原蛋白。在本研究前期预实验中发现,敲低OPN3后,Ⅰ型和Ⅲ型胶原蛋白在转录水平均被抑制,但统计结果发现Ⅲ型胶原蛋白数据无统计学意义,故本实验进一步证明OPN3在人真皮成纤维细胞中调控成纤维细胞中Ⅰ型胶原蛋白合成的功能和可能机制。本实验发现,OPN3敲低后细胞合成的Ⅰ型胶原蛋白转录及翻译水平均明显降低,且ELISA测得分泌胶原蛋白量也明显下降。OPN3同时也影响成纤维细胞中其他的细胞功能,敲低OPN3后,通过CCK-8及EDU检测细胞增殖活力,通过流式细胞术检测细胞周期,发现OPN3敲低细胞的增殖活力明显低于对照组,其S期比例亦明显低于对照组,细胞迁移能力也被明显抑制。所以,笔者推测OPN3参与Ⅰ型胶原蛋白的生成并影响其他细胞功能。
作为G蛋白偶联受体,OPN3在机体细胞中,其功能的发挥涉及多种分子和复杂的级联通路。以往研究[16-18]报告,磷脂酰肌醇-3-激酶(PI3K)/AKT信号通路在细胞中参与调节广泛的细胞机制,包括存活、增殖、生长、凋亡、代谢、细胞周期、基质沉积等。PI3K是一种胞内磷脂酰肌醇激酶,本身具有丝氨酸/苏氨酸(Ser/Thr)激酶的活性,被认为是一个重要的酶家族,涉及多种生物过程,AKT也称为蛋白激酶 B(PKB),作为PI3K的下游信号蛋白,是调节细胞功能(包括生存、生长和代谢)的信号转导中心。近来研究[16-18]发现,抑制AKT信号通路火花可抑制细胞胶原蛋白的合成,而OPN3也被证明可以通过AKT通路调节肝癌细胞的凋亡[19]。那么OPN3是否能通过PI3K/AKT信号通路调节成纤维细胞中胶原蛋白的合成?本研究表明,在敲低OPN3后,p-PI3K/AKT也被显著抑制;而通过抑制剂抑制AKT活化后,胶原蛋白合成水平也被明显抑制。这些结果表明,OPN3是可能通过PI3K/AKT信号通路调节成纤维细胞中胶原蛋白的合成,影响细胞增殖、迁移及细胞周期。
综上,本文主要研究了OPN3在正常人真皮成纤维细胞中对Ⅰ型胶原蛋白生成的影响,发现OPN3可能通过PI3K/AKT信号通路调节Ⅰ型胶原蛋白的合成及分泌。希望本研究能为伤口愈合、医疗美容及纤维化疾病提供潜在的治疗靶点。

