抗冻剂对蒸煮小龙虾虾仁冻融后品质的影响
胡筱波 陈文飞 顾泽茂 邹圣碧 熊善柏 胡 杨
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.华中农业大学水产学院,湖北 武汉 430070;3.湖北莱克现代农业科技发展有限公司,湖北 潜江 433100)
冷链运输是小龙虾虾仁产品最常用的运输方式,这种方式最大程度地减少了微生物的繁殖,保持了产品质量,但运输过程中的温度波动会加速虾肉蛋白质氧化变性,导致品质下降[1]。为了避免上述问题的发生,业界通常在冷冻虾仁中添加抗冻剂[2]。磷酸盐是常用于冷冻虾类产品中的食品添加剂,可改善虾肉的持水能力[3]。糖类抗冻剂(如海藻糖、山梨糖醇等)可抑制冷冻虾内部冰晶的生长,防止蛋白质冷冻变性,保持肌肉组织结构完整[4]。张小利[5]研究了磷酸化海藻糖对冷冻南美白对虾的抗冻效果,Zhang等[6]探究了海藻糖类抗冻剂对冻融过程中南美白对虾冰晶生长的抑制作用,研究发现磷酸盐与海藻糖可显著提高南美白对虾的抗冻能力,抑制冰晶的生长。目前,鲜有关于复合磷酸盐、海藻糖与山梨糖醇等抗冻剂之间的协同作用对小龙虾虾仁抗冻效果的研究。研究拟以蒸煮小龙虾虾仁为研究对象,通过测定冻融后虾仁持水力、蛋白变性与质构特征等指标的变化,探究不同质量分数的复合磷酸盐、海藻糖与山梨糖醇分别对虾仁抗冻能力的影响,并优化3种抗冻剂的复配方式,以期开发可量产的复合抗冻剂,为提升冷冻虾仁的冻藏品质提供技术支撑。
1 材料与方法
1.1 材料与试剂
鲜活克氏原螯虾(20~29 g):华中农业大学双水双绿研究院;
复合磷酸盐:食品级,湖北兴发化工有限公司;
海藻糖:食品级,纯度98%,分子量378.33,河南喜莱客化工产品有限公司;
山梨糖醇:食品级,纯度98%,分子量182.18,广州赛国生物科技有限公司;
蔗糖、氯化钠、磷酸氢二钠、磷酸二氢钠、氢氧化钠、酒石酸钾钠、无水碳酸钠、五水合硫酸铜、福林酚、Tris(三羟甲基氨基甲烷)、尿素、SDS(十二烷基磺酸钠)、盐酸、EDTA(乙二胺四乙酸)、甲醛:分析纯,国药集团化学试剂有限公司;
5,5’-二硫双(2-硝基苯甲酸):分析纯,上海麦克林生化科技有限公司。
1.2 主要仪器设备
分析天平:AUY220型,岛津企业管理(中国)有限公司;
电子天平:TX2202L型,岛津企业管理(中国)有限公司;
冷冻离心机:J-26 XP 型,贝克曼库尔特商贸(中国)有限公司;
离心机:TDL-5-A 型,上海菲恰尔分析仪有限公司;
电热恒温鼓风干燥箱:DHG-9240A型,上海精宏实验设备有限公司;
质构仪:TA-XT2i型,英国StableMicro Systems 公司;
高速分散均质机:IKA2000型,德国IKA公司;
可见分光光度计:772S型,上海精密科学仪器有限公司;
临界点干燥仪:HCP-2型,日本HITACHI公司;
低场核磁共振仪:NMI20-025V-1型,上海纽迈电子科技有限公司;
包埋机:JB-P5型,武汉俊杰电子有限公司;
病理切片机:RM2016型,上海徕卡仪器有限公司;
冻台:JB-L5型,武汉俊杰电子有限公司;
组织摊片机:KD-P型,科迪仪器设备有限公司;
染色机:Giotto型,意大利DIAPATH公司;
扫描电镜:SU8010型,日本HITACHI公司;
真空封口机:DZ400-ZD型,上海余特包装机械制造有限公司。
1.3 方法
1.3.1 材料处理 将20~29 g的鲜活小龙虾沸水蒸煮4 min后,冰水冷却6 min,去头,去壳,去黄,取虾仁,然后按料液比1∶3(g/mL)分别加入蒸馏水(空白组)、复合磷酸盐溶液(0.5%,1.0%,1.5%,2.0%,2.5%)、海藻糖溶液(2%,4%,6%,8%,10%)、山梨糖醇溶液(2%,4%,6%,8%,10%)、氯化钠溶液(0.5%,1.0%,1.5%,2.0%,2.5%)与蔗糖溶液(1%,2%,3%,4%,5%)(均为质量分数)浸泡3 h,浸泡时将温度控制在4 ℃,取出后使用纱布擦干表面水分,装入聚乙烯包装袋中,进行真空包装。
采用冻融循环试验来处理样品:将包装好的虾仁放入-18 ℃冰箱中,冷冻24 h,然后在4 ℃下解冻12 h,冷冻—解冻步骤循环5次,取第5次冻融后的虾仁进行指标测定。
1.3.2 解冻损失率的测定 将浸泡过抗冻剂的新鲜虾仁用纱布拭干水分,记录重量m1。随后,将解冻后的虾仁用纱布拭干水分,记录重量m2。按式(1)计算解冻损失率。
(1)
式中:
X——解冻损失率,%;
m1——解冻前虾肉质量,g;
m2——解冻后虾肉质量,g。
1.3.3 水分含量的测定 按GB 5009.3—2016《食品安全国家标准 食品中水分的测定》执行。
1.3.4 离心持水力的测定 称取2.5 g左右的虾仁,用脱脂棉包好,放入50 mL离心管中,4 000 r/min离心15 min,剥去脱脂棉,再次称重。按式(2)计算离心持水率。
(2)
式中:
Y——离心持水力,%;
m1——离心前虾肉质量,g;
m2——离心后虾肉质量,g。
1.3.5 质构测定 选取大小相近的10个样品,取虾仁2~3节部分,将其切成5 mm×4 mm×3 mm的均匀方块试样。采用TA-XT plus 物性仪进行测定。参数设定为:触发类型Auto(自动)、测试速度1 mm/s、返回速度1 mm/s、压缩比50%、两次压缩之间的停留时间为5 s。使用不锈钢 P/36R 圆柱形压缩探头。
1.3.6 盐溶性蛋白含量的测定 称取5 g虾肉样品于烧杯中,加入10倍体积的高盐磷酸盐缓冲溶液(0.5 mol/L NaCl+0.01 mol/L NaH2PO4+0.03 mol/L Na2HPO4),在10 000 r/min转速下均质90 s,4 ℃下浸提20 h,4 ℃、12 000 r/min离心10 min,取上清液,使用福林酚法测蛋白质含量。
1.3.7 总巯基含量的测定 向1 mL蛋白质溶液中加入9 mL 0.2 mol/L Tris-HCl缓冲溶液(含8 mol/L 尿素、10 mmol/L EDTA、2% SDS,pH 6.8)和1 mL 0.1% DTNB溶液,混合均匀后于40 ℃水浴锅中保温25 min,取样液测定其在412 nm处的吸光值。按式(3)计算总巯基含量。
(3)
式中:
C0——巯基的摩尔浓度,μmol/g;
A——412 nm的吸光值;
D——稀释倍数;
ε——摩尔消光系数,13 600 mol·cm/L。
1.3.8 正交试验设计 选择复合磷酸盐质量分数、海藻糖质量分数、山梨糖醇质量分数,进行三因素三水平的正交试验。按1.3.1方法冻融5次后,以解冻损失率为响应指标研究3种抗冻剂之间的交互作用对小龙虾虾仁抗冻效果的影响。
1.3.9 低场核磁共振的测定 取样品(约2.3 g)用核磁膜包裹放于直径为25 mm 的玻璃管中,使用核磁共振分析软件及CPMG序列对其进行T2信号采集,参数设为:时间点数据(TD)350 002,数据半径(DR)1,90°脉宽(P1)9 μs,180°脉宽(P2)17.52 μs,采样带宽(SW)100 kHz,重复采样等待时间(TW)4 000 ms,弛豫时间(TE)0.500 ms,模拟增益(RG1)3,重复采样次数(NS)4,回波个数(NECH)7 000。
1.3.10 扫描电镜 使用手术刀将虾仁肌肉横截面切成4 mm×4 mm×0.5 mm的薄片,用体积分数为2.5%的戊二醛溶液(溶剂为0.1 mol/L磷酸盐缓冲液,pH 7.2)将虾肉薄片固定24 h,然后使用HCP-2临界点干燥仪对样品进行临界点干燥。离子溅射仪喷金后,使用扫描电子显微镜对样品进行观察,放大倍数为150倍。
1.4 数据处理与分析
采用Office 2019、SPSS 26处理分析数据,使用Origin 2018作图,采用ANOVA进行方差分析,Duncan多重极差检验比较平均值在显著性水平上的差异,P<0.05判定为差异显著。
2 结果与分析
2.1 抗冻剂添加量对虾仁解冻损失率的影响
由图1可知,与空白相比,经过抗冻剂浸泡处理的虾仁在5次冻融循后,解冻损失率均较低。其中复合磷酸盐组最低为14.67%,海藻糖组最低为17.44%,山梨糖醇组最低为16.82%,均低于氯化钠与蔗糖处理的虾仁,氯化钠组最低为18.80%,蔗糖组最低为19.41%。在冻融循环过程中,冰晶的形成与重结晶会破坏肌肉组织结构[7-9],海藻糖拥有较好的吸湿性,可吸附一部分水分[10]。此外,糖醇能束缚小分子水,以此降低冰晶对肌肉组织的物理损伤[11]。磷酸盐则能够增加肌肉结合水的能力,减少冷冻贮藏中的汁液损失[12]。
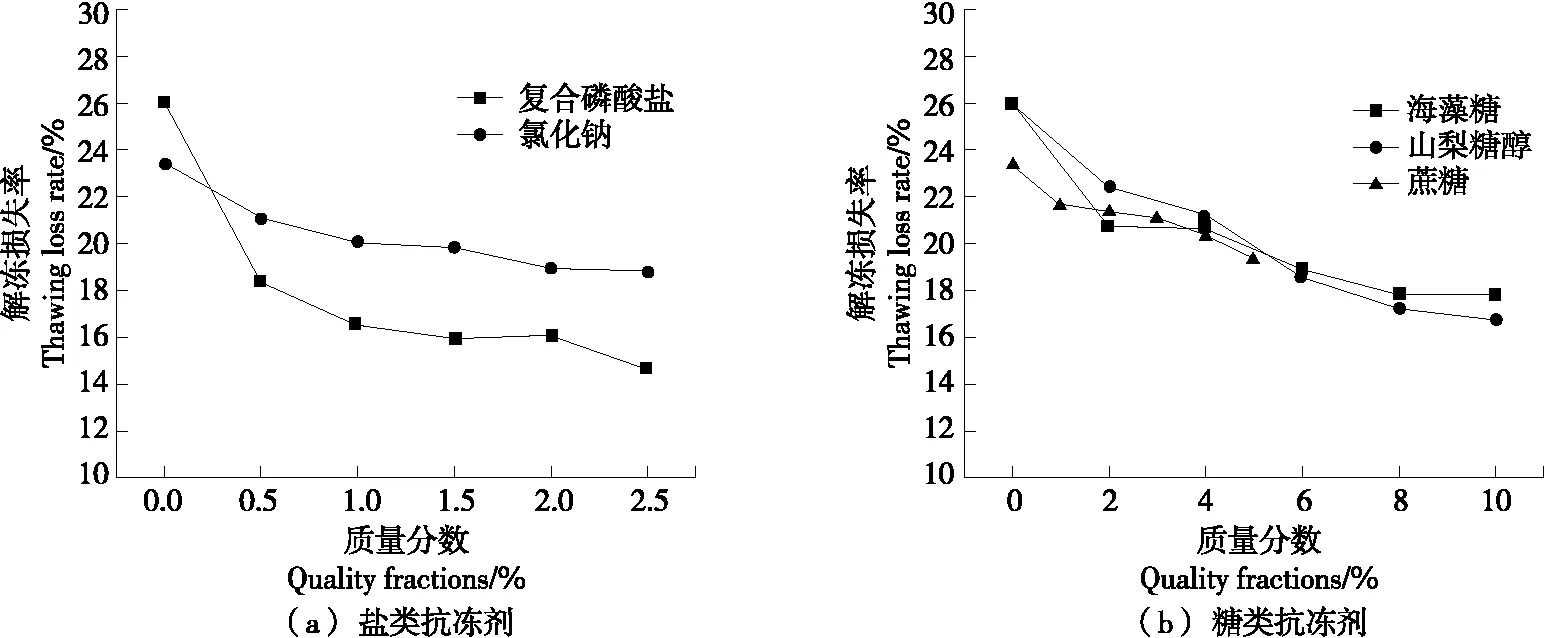
图1 抗冻剂添加量对虾仁解冻损失率的影响
2.2 抗冻剂添加量对虾仁水分含量的影响
由图2可知,复合磷酸盐组的虾仁冻融后仍保持较好的水分含量,均大于空白组的水分含量,因此复合磷酸盐具有较好的保持水产品水分含量的作用,陈秋妹等[13]研究发现浸泡磷酸盐溶液后,水产品的水分含量会增加。随着糖类抗冻剂(海藻糖、山梨糖醇、蔗糖)添加量的增加,虾仁水分含量先上升后下降,与齐贺[14]的研究结果一致,这是由于糖类分子的排阻作用,排出肌肉组织一部分水分,使体系结构更加稳定。

图2 抗冻剂添加量对虾仁水分含量的影响
2.3 抗冻剂添加量对虾仁持水力的影响
由图3可知,与空白组相比,抗冻剂均能显著延缓冻融循环过程中虾仁持水力的下降。当复合磷酸盐添加量为2.5%时,虾仁持水力最高为77.33%;当氯化钠添加量为2.5%,持水力最高为74.67%,当海藻糖添加量为8%时,虾仁持水力最高为75.35%;当山梨糖醇添加量为10%时,虾仁的持水力最高为75.82%,当蔗糖添加量为3%时,持水力最高为74.46%。复合磷酸盐对虾仁持水力的保持效果较佳,但复合磷酸盐添加量过高时,水分和蛋白含量因为渗透作用而减少,导致虾仁持水力下降[15]。糖类可通过与水或冰的相互作用与冰晶结合,防止冻融过程中大冰晶的生成,减少了冻融过程冰晶对虾仁肌肉组织的破坏[16],Hassas-Roudsari等[17]也认为糖类分子是通过与冰晶表面结合来抑制冰晶的生长。此外,海藻糖可替代肌肉蛋白周围的水分子,进一步减少冰晶生长对虾仁肌肉组织的机械损伤。

图3 抗冻剂添加量对虾仁离心持水力的影响
2.4 抗冻剂添加量对虾仁质构的影响
由图4可知,相对于空白组,复合磷酸盐使虾仁的硬度下降,对虾仁的咀嚼性无显著影响,但对虾仁的弹性影响较大,当复合磷酸盐添加量为1%时,虾仁弹性最高,随着添加量增加,虾仁弹性略微下降;氯化钠对虾仁硬度影响较小,略微提高了虾仁的咀嚼性与弹性;海藻糖与山梨糖醇对虾仁硬度无显著影响,增加了虾仁的咀嚼性与弹性,且虾仁弹性随着二者添加量的增加而增加;蔗糖组虾仁的硬度、咀嚼性与弹性随着蔗糖添加量的增加均先上升后下降。复合磷酸盐可促进肌动球蛋白的解离,这可能是导致复合磷酸盐组虾仁硬度下降的原因,与董学文等[18-19]的研究结果一致。用复合磷酸盐溶液浸泡,可显著提高水产品的弹性,且能有效地延缓冻融过程中虾仁弹性的下降[20],但过量的磷酸盐可能会使虾肉的质构特性下降[21]。海藻糖与山梨糖醇能显著维持虾肉的弹性与咀嚼性,这可能是因为肌原纤维蛋白与渗入到肌肉组织中的糖类分子之间形成了稳定的化学键,这种非共价的相互作用抑制了冻融循环对虾肉组织结构的破坏[22]。

图4 抗冻剂浓度对虾仁硬度、咀嚼性与弹性的影响
2.5 抗冻剂添加量对虾仁盐溶性蛋白的影响
由图5可知,虾仁盐溶性蛋白含量随着复合磷酸盐和氯化钠添加量的增加先上升后下降,然后略微上升,其中0.5%复合磷酸盐与1%氯化钠条件下虾仁盐溶性蛋白含量最高,分别为21.01,17.82 mg/g。与盐类抗冻剂不同,随着糖类抗冻剂添加量的增加,虾仁盐溶性蛋白的含量也随之上升,其中8%海藻糖、10%山梨糖醇与5%蔗糖的盐溶性蛋白含量最高,分别为20.15,19.76,19.21 mg/g。盐类抗冻剂可使肌球蛋白从肌原纤维蛋白网状结构中解离出来,促进冻融过程中虾肉的盐溶性蛋白溶出[23],但也可能导致冻融循环过程中盐溶性蛋白的损失,这也是高浓度盐类抗冻剂使盐溶性蛋白含量下降的原因[24-25]。同时,过高浓度的中性盐会抑制蛋白质分子的溶解,甚至较低浓度下也可能抑制盐溶性蛋白的提取[26]。蔗糖、山梨糖醇等小分子糖有较好的抑制肌肉中肌原纤维蛋白冷冻变性的效果[27]。

图5 抗冻剂浓度对虾仁盐溶性蛋白含量的影响将
2.6 抗冻剂添加量对虾仁总巯基含量的影响
由图6可知,随着复合磷酸盐与氯化钠添加量的增加,冻融循环后的虾仁总巯基含量先上升后下降,其中1.5%复合磷酸盐与1.5%氯化钠添加量下的总巯基含量最高,分别为28.03,21.93 μmol/g。1.5%复合磷酸盐组的盐溶性蛋白含量较低,但总巯基含量较高,说明质量分数为1.5%的复合磷酸盐仍有显著抑制蛋白质氧化的效果。虾仁总巯基含量随海藻糖与山梨糖醇添加量的变化趋势与盐溶性蛋白变化一致,8%海藻糖、10%山梨糖醇与5%蔗糖的总巯基含量最高,分别为22.52,21.20,15.06 μmol/g。盐类抗冻剂与糖类抗冻剂均能延缓冻融过程中虾仁总巯基含量的下降。磷酸盐会使虾肉的蛋白质磷酸化,增强了蛋白质巯基与二硫键之间的相互作用,有效降低了冻融过程对巯基数量与蛋白质疏水性的影响[28-29]。海藻糖、山梨糖醇等糖类抗冻剂可抑制冰晶的形成,延缓巯基含量的下降[30]。
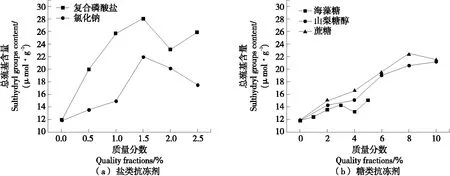
图6 抗冻剂浓度对虾仁总巯基含量的影响
2.7 正交试验
从单因素试验中可以看出,0.5%的复合磷酸盐就有较佳的抗冻效果,海藻糖与山梨糖醇添加量为6%以上时,抗冻效果较佳,且6%,8%,10%海藻糖或山梨糖醇的抗冻效果接近。为减少磷酸盐与糖的用量,响应低糖、低盐的消费者与市场需求并基于成本考量,选用较低浓度的复合磷酸盐、海藻糖与山梨糖醇作为试验因素(见表1),以冻融循环5次后虾仁的解冻损失率为响应指标,进行三因素三水平的正交试验,结果见表2。由表2和表3可知,3个因素对小龙虾解冻损失率的影响大小依次为:山梨糖醇>海藻糖>复合磷酸盐,且3种抗冻剂的添加量对虾仁解冻损失率均有显著影响(P<0.05)。由K值可得,组合A3B3C2为最佳组合,即1%复合磷酸盐+6%海藻糖+6%山梨糖醇。

表1 正交试验因素及水平编码表
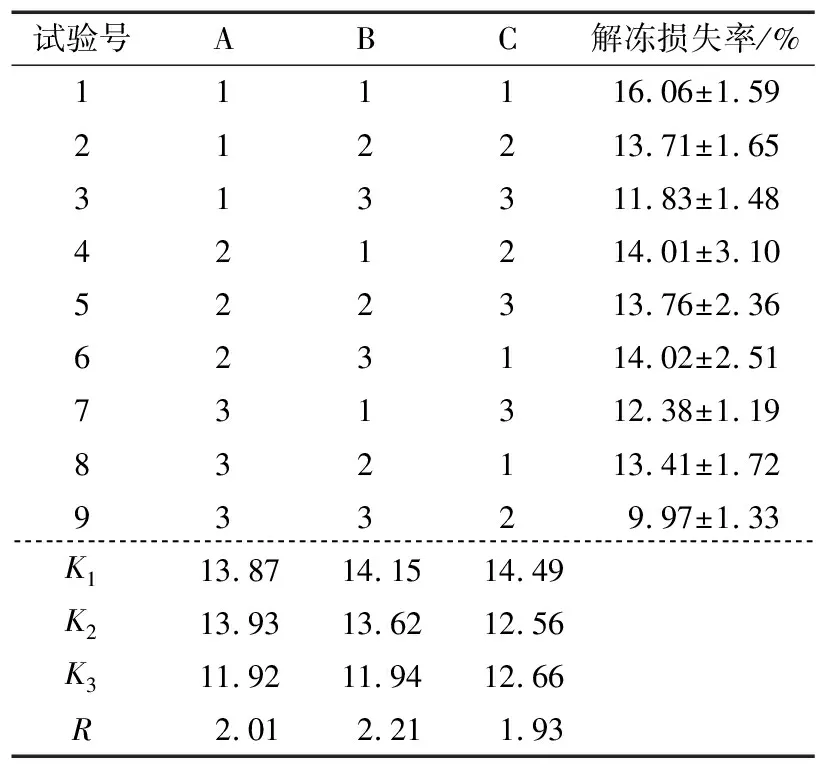
表2 正交试验结果

表3 方差分析表
为了验证正交试验所得配方的抗冻效果,以表2中试验9配方(1%复合磷酸盐+6%海藻糖+6%山梨糖醇)为基础,向其中添加少量的氯化钠与蔗糖作为试验组,以商业抗冻剂(4%蔗糖+4%山梨糖醇)为对照,测定各组的解冻损失率。由表4可知,相对于商业抗冻剂,4组复配抗冻剂的效果均较好,且无显著差异。向表2中试验9配方中加入少量氯化钠与蔗糖未能显著提高其抗冻效果,且综合市场行情,表2中试验9配方最为适合。

表4 验证实验结果†
2.8 抗冻剂对冻融过程中虾仁水分分布及核磁共振成像的影响
小龙虾的肌肉组织中水分的存在方式主要分3种,其对应的弛豫时间分别为T21、T22和T23。其中,T22(10~100 ms)对应的是不易流动水状态,最能反映肌肉组织保持水的能力[31]。由图7与表5可知,在冻融过程中,各组T22的信号强度均有所下降,且与空白组相比,抗冻剂组的变化幅度较小,冻融循环过程中冰晶的形成与增长会破坏小龙虾蛋白质的空间结构[4]。T22越短说明水分与肌肉结合越紧密,由表5可知,未浸泡过抗冻剂的新鲜虾仁的T22值为57.22 ms,而浸泡过抗冻剂的新鲜虾仁T22值显著小于这个值,说明使用复合磷酸盐、海藻糖与山梨糖醇浸泡的虾仁结合水的能力有所提高[2],而冻融3次后,虾仁的T22值与其峰面积比P22呈下降趋势,可能是因为虾仁的水分含量在冻融过程中逐渐减小[32]。复合磷酸盐组虾仁在冻融过程中T22与P22值下降,且P23值呈上升趋势,这种现象可能与磷酸盐保水的机制有关。磷酸盐可增加蛋白质之间的静电斥力,从而使肌原纤维蛋白质结构膨胀,截留更多的水分,水流动性的增加导致弛豫时间变长,使得部分水的弛豫时间大于100 ms[33]。海藻糖组与山梨糖醇可通过减少冻融过程中冰晶对虾仁组织结构的破坏,保持虾仁不易流动水的比例[14]。海藻糖与山梨糖醇组虾仁在第三次冻融后,T22值变长,但P22值却上升,这可能是肌原纤维的网状结构被破坏,水的流动性增加,部分结合水转变为不易流动水[34]。复配组在冻融循环中,低场核磁的信号强度变化幅度最小,且P22在5次冻融过程中,无显著变化,说明复配抗冻剂对小龙虾虾仁具有较佳的抗冻保水效果。
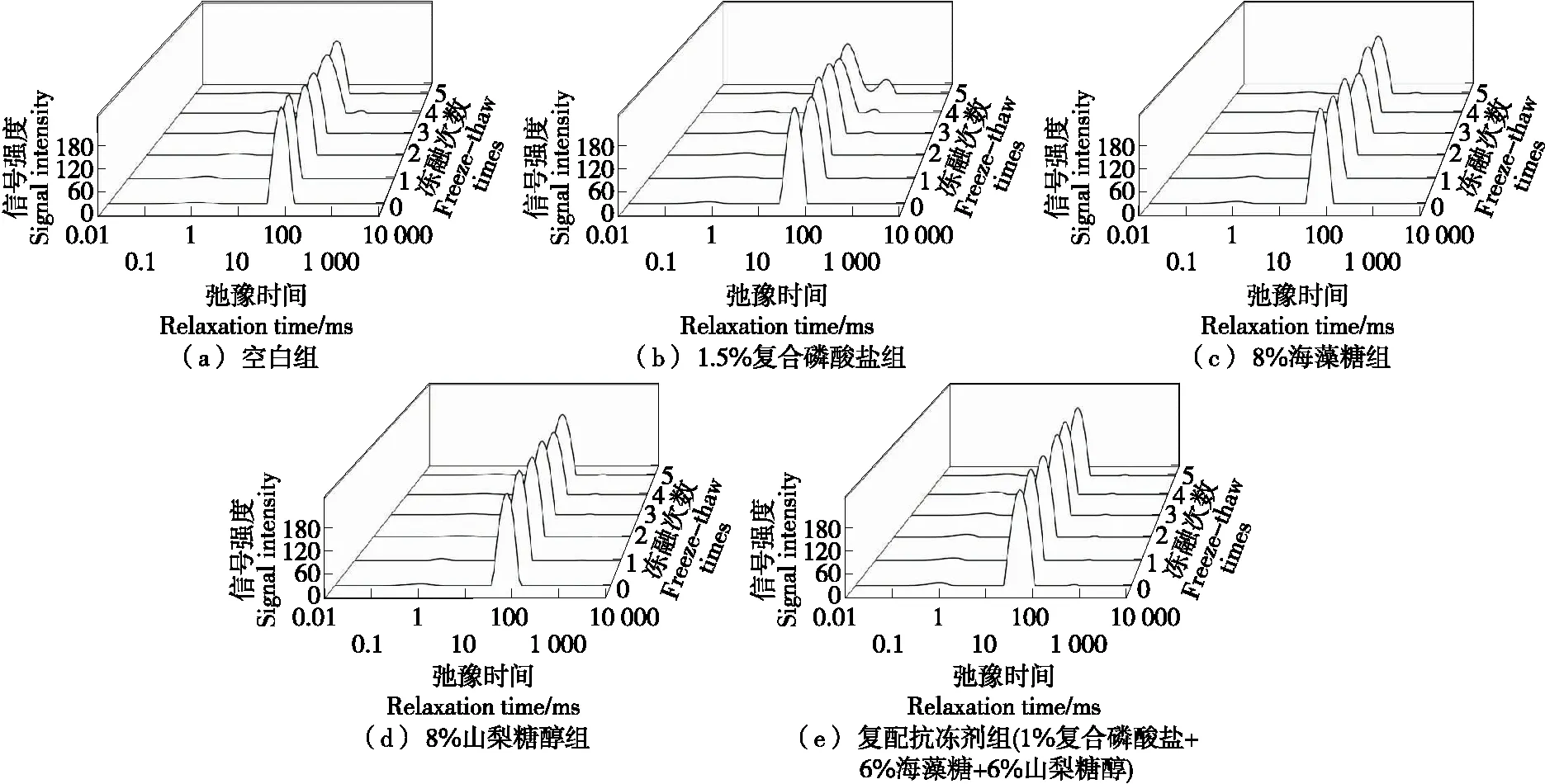
图7 经不同抗冻剂处理后虾仁在冻融过程中水分分布的变化
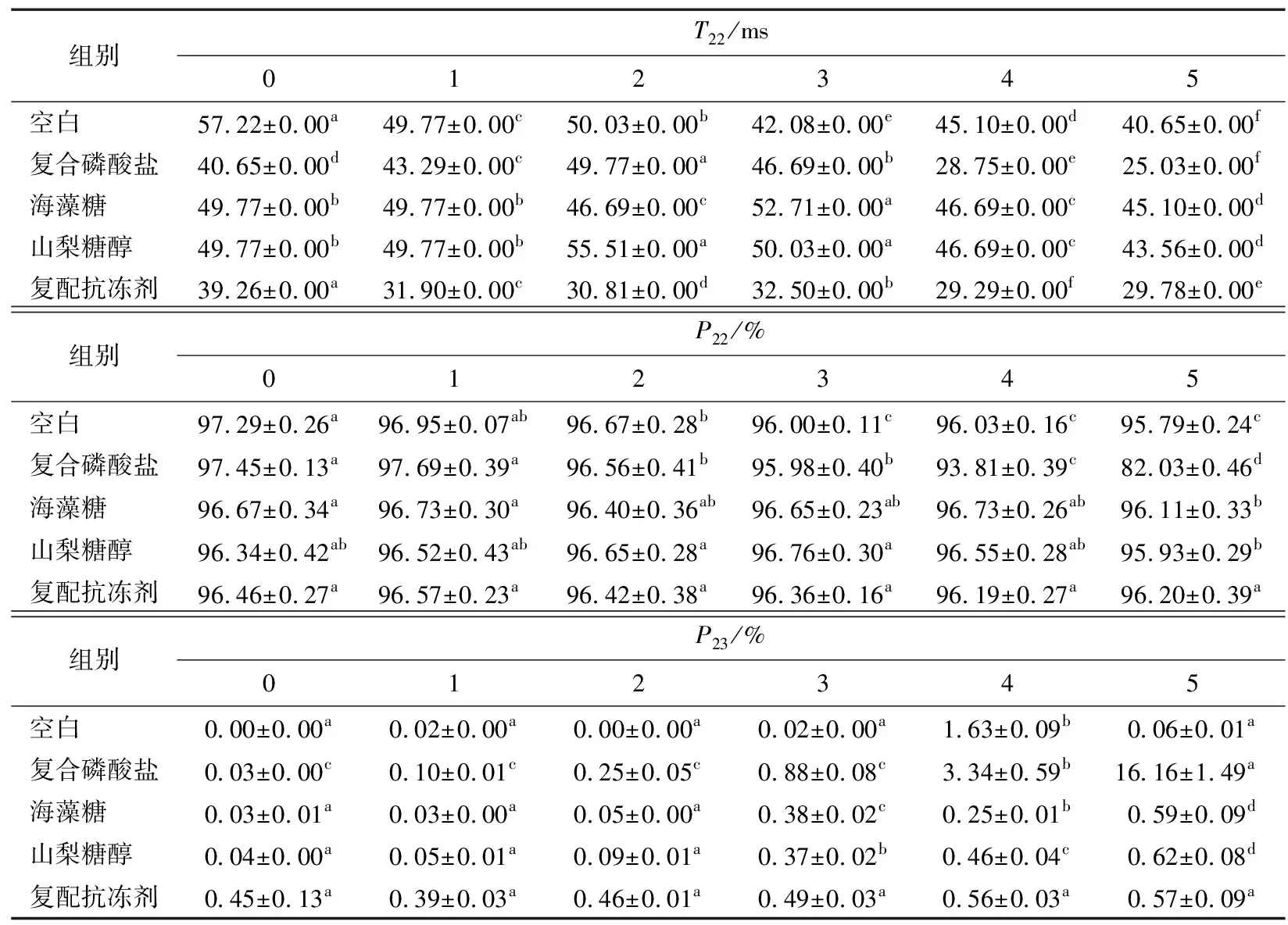
表5 冻融过程水分弛豫时间和峰面积比的变化†
2.9 抗冻剂对虾仁微观结构的影响
不同抗冻剂处理后的小龙虾在5次冻融循环后,小龙虾肌肉的横切面图像如图8所示:新鲜熟虾的肌肉结构较为完整,肌原纤维连接较为紧密,而经过冻融循环后,各组虾肉的结构均被破坏,肌肉结构呈现块状,且肌原纤维间出现缝隙,这可能是因为存在于肌原纤维附近的水分子在冷冻过程中形成冰晶,并不断生长,挤压肌原纤维,导致其结构破坏,出现缝隙[35]。与空白组相比,经过抗冻剂处理后的虾仁在冻融后,肌肉组织间的缝隙较小,其中复配抗冻剂处理的样品肌肉结构仍较为完整,且组织间紧密程度最接近新鲜虾仁。单一抗冻剂处理的虾仁中,复合磷酸盐组的肌原纤维缝隙较小,海藻糖与山梨糖醇组的差异较小,这与解冻损失率的结果一致。肌原纤维间的缝隙大小与肌肉的持水力有密切的关系[36],抗冻剂处理能显著减小冻融后虾肉组织的间隙,保持了肌肉的持水性。

白色箭头所指为肌原纤维间的间隙
3 结论
复合磷酸盐、海藻糖与山梨糖醇等抗冻剂对熟制的小龙虾虾仁仍然具有一定的抗冻保水效果。经1%复合磷酸盐、6%海藻糖、6%山梨糖醇浸泡后的虾仁具有较低的解冻损失,且冻融5次后,复配抗冻剂组的虾仁微观结构最接近新鲜组,抗冻剂可通过提高蛋白质与水的结合能力,显著改善小龙虾肌肉的持水能力,同时,抑制肌肉内部冰晶的形成与生长,防止了冻融过程中冰晶的移动,保持了肌肉结构的完整性。糖盐类抗冻剂应用较为广泛,但会对虾仁产品的风味造成一定的影响。后续可研究其他种类的抗冻剂(蛋白水解类、抗冻蛋白)对熟制小龙虾虾仁的抗冻保水效果,力求取代磷酸盐等抗冻剂在工业生产上的应用。

