在黑果腺肋花楸中共发酵里氏木霉和绿色木霉生产木聚糖酶
袁亚峰,姜秋实,程志强
(吉林农业大学 资源与环境学院,吉林 长春,130118)
木聚糖酶能够降解木聚糖,在造纸[1]、木质纤维材料生物转化以及果汁澄清[2]等方面有着广泛的应用。目前研究表明,除了动物和植物,许多细菌和真菌都可以产生木聚糖酶,但是不同微生物生产的木聚糖酶性质有所差别,细菌生产的主要是酸性木聚糖酶[3],真菌生产的大都是碱性木聚糖酶[4]。微生物发酵生产木聚糖酶具有经济性好,对生产设备、场地要求简单等诸多优势,因而是目前规模化生产木聚糖的主要方法。
木霉菌是能产生多种酶类的丝状真菌,其中最主要的是木聚糖酶[5]和纤维素酶[6]等。国内外对木霉菌发酵产生木聚糖酶的研究较多。里氏木霉和绿色木霉生长周期短,产木聚糖酶的时间短,对环境要求低,是规模化生产木聚糖酶的理想真菌。但是单一菌株生产木聚糖酶存在产酶时间长、酶系组成单一、产酶量低等问题。利用混合发酵可以有效地解决上述问题并提高酶的活力。GUTIERREZ-CORREA等[7]利用里氏木霉与黑曲霉或海枣曲霉共培养,在甘蔗渣上进行固体基质发酵生产木聚糖酶。邹水洋等[8]发现较单独培养康宁木霉相比,康宁木霉与米根霉混合培养形成了相互促进的共生关系,有效地提高了纤维素酶和木聚糖酶的酶活力。BALDRIAN[9]将哈茨木霉添加到白腐菌培养物中使漆酶活性增加40倍以上。但是真菌共发酵生产酶仍然面临许多挑战和尚未解决的问题,特别是真菌之间的分子相互作用以及由此产生的酶优化问题。但是目前共培养仍然是工业酶生产的一个发展领域,在实际应用之前,该技术的培养方面需要进一步改进。
木聚糖酶是一种诱导酶,选择适合的培养基和培养条件会促进木霉菌产木聚糖酶。目前,为了降低木聚糖酶的生产成本,一般都是利用秸秆[10]、麸皮、玉米芯、稻草[11]等农业废弃物作为主要基质,里氏木霉[12]、绿色木霉、哈茨木霉[13]等真菌进行发酵,多为固态发酵技术。由于固体发酵存在参数难控制,无法均匀混合,造成部分营养物质的浪费、回收成本高等问题,导致难以工业化生产木聚糖酶。农业废弃物作为原料,使用易于大量生产的液体发酵技术生产木聚糖酶的产量低[10]。为了提高农业废弃物生产木聚糖酶的产量,大都需要使用酸、碱等物质进行预处理,在提高木聚糖酶的产量的同时,预处理步骤提高了生产的成本,造成环境污染[14]。而以果渣作为碳源,使用液体发酵技术生产木聚糖酶产量高[4],同时还利用了废弃果渣,避免了资源的浪费。黑果腺肋花楸在东北地区生长范围广,产量高,主要在工业上加工成果汁[15],产生大量果渣。果渣质量分数占未加工生浆果的16%,其中纤维含量约为60 g/100 g,这些纤维大多是不溶性纤维,无法得到合理利用[16]。综上可知,黑果腺肋花楸果渣作为木霉菌发酵的碳源用于生产木聚糖酶是合理利用黑果腺肋花楸的有效途径。
本文在液体深层发酵条件下,以废弃的黑果腺肋花楸果渣作为基础培养基,利用黑果腺肋花楸果渣丰富的纤维素和木质素作为碳源,诱导里氏木霉和绿色木霉共发酵产木聚糖酶,并通过正交试验对基础培养基进行优化,促进木霉菌低成本发酵生产木聚糖酶,为工业化生产木聚糖酶提供有效的参考价值。
1 材料与方法
1.1 材料、试剂与培养基
1.1.1 菌种
里氏木霉(ATCC 24449),瑞楚生物科技有限公司微生物菌种保藏中心;绿色木霉(ACCC 30206),中国农业微生物菌种保藏管理中心;马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA),上海博微生物科技有限公司。
将绿色木霉和里氏木霉经过活化后分别接种PDA上,在28 ℃下培养3 d。用无菌水分别将PDA上的孢子冲洗下来后,得到里氏木霉孢子液和绿色木霉孢子液,分别使用血球计数法计数后,稀释到106CFU/mL,并于4 ℃储存,备用。
1.1.2 试剂
1.00%(质量分数)木聚糖溶液按照冯培勇等[17]的方法配制;DNS试剂参考MILLER等[18]的方法配制。
1.1.3 基础培养基
黑果腺肋花楸(长白山)的果实经采摘后烘干,打粉,并过50目筛,得到黑果腺肋花楸果渣(后称果渣),储存备用。果渣质量分数为25%,pH值自然(pH 3.56),置于锥形瓶中,121 ℃灭菌30 min。
10%(质量分数)绿色木霉和里氏木霉孢子混合液(1×106CFU/mL,里氏木霉与绿色木霉按1∶1混合)接入已灭菌的培养基,28 ℃空气浴摇床(160 r/min)培养1 d。
1.1.4 粗酶液的制备
通过液体深层发酵后,将培养基使用4层纱布初步过滤后,使用20 mL柠檬酸缓冲溶液冲洗后,得到的液体使用魏瑛等[19]的方法制备粗酶液。
1.2 测试方法
通过BAILEY等[20]的方法测定培养基中木聚糖酶的活性。将1.5 mL 1.00%木聚糖溶液置于50 ℃水浴锅中预热2 min,吸取0.5 mL使用柠檬酸缓冲溶液稀释后的粗酶液加入木聚糖溶液中,立即计时,准确反应30 min后,迅速加入3 mL DNS试剂终止反应。然后在沸水浴中显色5 min,取出后用去离子水定容到50 mL,摇匀,冷却,于550 nm测定吸光度值。空白对照:先向木聚糖溶液中加入DNS试剂,置于沸水浴中,随后加入稀释酶液,按上述方法测定。
1.3 不同培养条件对木聚糖酶产量的影响
在1.1.3所述基础培养基的条件下,通过单因素试验分别探究氮源、接种质量分数、里氏木霉和绿色木霉的质量比例、果渣质量分数、培养时间、培养基初始pH对木聚糖酶产量的影响。氮源包括赖氨酸、精氨酸、NaNO3、胰蛋白胨、NH4NO3、尿素、酵母提取物。绿色木霉接种质量分数设定为6%~16%,接种质量比例(里氏木霉与绿色木霉的质量比例)设定为5∶0,4∶1,3∶2,2∶3,1∶4,0∶5,果渣的质量分数为14%~24%,培养时间设定为1~7 d,酸碱度设定为4.00~6.50。
1.4 正交优化里氏木霉和绿色木霉共发酵的培养基
根据单因素试验结果,NH4NO3是里氏木霉和绿色木霉共发酵的培养基的最佳氮源;最佳培养时间为3 d;里氏木霉与绿色木霉的最佳质量比例为3∶2。对氮源质量浓度、果渣质量分数、接种质量分数、pH 4个培养条件进行四因素三水平L9(34)正交试验,并测定木聚糖酶的活性,以确定不同条件相互组合的效果,并确定里氏木霉和绿色木霉共发酵的最佳培养基,因素水平见表1。
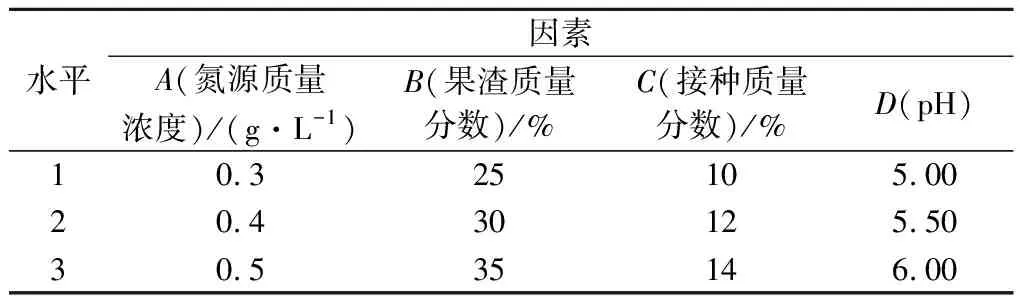
表1 培养条件正交试验因素水平Table 1 Orthogonal experiment factor level of culture conditions
1.5 无机离子对木聚糖酶产量的影响
为测定无机离子对木聚糖酶活性的影响,分别将MgSO4(0、3、6、9、12、15、18、21 mg/L)、FeSO4(0、3、6、9、12、15、18、21 mg/L)、MnSO4(1、1.4、1.8、2.2、2.6、3.0、3.4 mg/L)、ZnCl2(0.8、1.2、1.6、2.0、2.4、2.8、3.2、3.6 mg/L)、CoCl2(0、0.5、1.0、1.5、2.0、2.5、3.0、3.5 mg/L)添加到培养基中,里氏木霉和绿色木霉共发酵后测定培养基中木聚糖酶活性,探究无机离子对木聚糖酶产量的影响。
1.6 统计分析
数据采用单因素方差分析(analysis of variance,ANOVA)进行评估,图中不同字母表示显著差异(P<0.001)。每组实验3个重复。
2 结果与讨论
2.1 氮源种类对木聚糖酶活性的影响
氮源用于构成菌体细胞物质,木聚糖酶的合成受氮源种类和性质的影响非常大。本研究为了选取最适合木霉菌产木聚糖酶的氮源,在培养基中添加相同氮浓度的氮源。由图1-a可知,较未添加氮源的培养基相比,添加赖氨酸、精氨酸、NaNO3、胰蛋白胨、NH4NO3、尿素、酵母提取物7种氮源到培养基培养6 d后,木聚糖酶的活性显著增加(P<0.001)。添加酵母提取物、蛋白胨、NH4NO3后,培养基中木聚糖酶的活性最高,分别为83.30、83.35、84.19 U/mL。考虑到培养基的成本及木聚糖酶的产量,选择NH4NO3作为发酵的氮源。
2.2 培养时间对木聚糖酶活性的影响
两菌共发酵时,培养时间通常会对发酵结果造成一定的影响。图1-b反映了接入里氏木霉与绿色木霉后一周内粗酶液中木聚糖酶的活性变化情况。随着时间的增加,木聚糖酶的活性呈现先增加然后趋于平缓的趋势。发酵4 d及以后,随着时间的增加,木聚糖酶活性增加的不明显。所以,接种后培养4 d为里氏木霉与绿色木霉共发酵生产木聚糖酶的最佳培养时间,木聚糖酶活性为83.14 U/mL。
2.3 接种质量比例对木聚糖酶活性的影响
适合的接种质量比例有助于在共发酵培养基中促进里氏木霉和绿色木霉达到最佳共生状态,促进木聚糖酶的产生。如图1-c所示,里氏木霉和绿色木霉按照不同质量比接种后,发酵样品中木聚糖酶的活性显著变化(P<0.001)。当里氏木霉和绿色木霉接种质量比为3∶2时,溶液中木聚糖酶的活性最高,为85.36 U/mL。接种质量比例为5∶0,即只接种里氏木霉时,木聚糖酶活性为82.25 U/mL。而接种质量比例为4∶1时,培养基中里氏木霉在发酵初期吸收营养及繁殖的能力强于绿色木霉,会迅速成为优势菌种,进一步限制绿色木霉的生长和繁殖,不利于2种菌共同发挥作用促进木聚糖酶的产生,但是绿色木霉的加入在一定程度上也会增加木聚糖酶的产量。当里氏木霉和绿色木霉接种质量比为2∶3时,由于里氏木霉和绿色木霉对营养及氧气的竞争及2株菌之间的拮抗作用,导致里氏木霉和绿色木霉的生长缓慢,木聚糖酶的活性最小,为82.73 U/mL。而绿色木霉质量比例越来越高时,绿色木霉菌大量繁殖,不利于里氏木霉生长和代谢,所以溶液中木聚糖酶的活性增加,却少于接种质量比为3∶2时。综上,可能是由于里氏木霉和绿色木霉接种质量比为3∶2时,混合菌达到了一种良好的共生状态,相互促进彼此的生长,增加了木聚糖酶的产量。

a-氮源;b-培养时间;c-接种质量比图1 氮源、培养时间和接种质量比例对木聚糖酶活性的影响Fig.1 Effect of nitrogen source, culture time, and inoculated ratio on the xylanase activity
2.4 pH对木聚糖酶活性的影响
pH能够改变微生物细胞膜的电荷属性和培养基中营养物质的离子化程度,从而促进微生物吸收营养物质的能力发生改变,对里氏木霉与绿色木霉的生长和产木聚糖酶具有很大影响。图2-a反映了随着pH的增加(4.00~6.50),木聚糖酶活性呈现先增加后减少的趋势(P<0.001)。当培养基中pH为5.50时,培养基溶液中木聚糖酶活性最高,达到82.71 U/mL,与基础培养基相比,木聚糖酶产量增加了10.15%。当培养基中pH<5.50时,随着pH的增加,木聚糖酶的活性逐渐升高。pH>5.50后,木聚糖酶的活性随着pH值的升高而降低。XIANG等[21]的研究表明,pH值5~6能够有效地影响细胞膜所带的电荷,使培养基中有机化合物分子很容易地进入细胞,从而促进细胞对营养物质的吸收,加快木聚糖酶的合成,使木聚糖酶的活性较其他pH值条件下更稳定。

a-pH;b-氮源浓度;c-果渣质量分数;d-接种质量分数图2 培养条件对木聚糖酶活性的影响Fig.2 Effect of culture conditions on the xylanase activity
2.5 氮源浓度对木聚糖酶活性的影响
为了节约氮源的使用,提高木聚糖酶活性,测试了在培养基中加入不同质量浓度氮源对里氏木霉和绿色木霉共发酵产生木聚糖酶的影响(图2-b)。随着氮源质量浓度的增加,木聚糖酶活性先增加后减少(P<0.001),当氮源质量浓度为0.4 g/L时,木聚糖酶的活性最高,达95.31 U/mL,与基础培养基相比,木聚糖酶产量增加了26.93%。当氮源质量浓度<0.4 g/L时,木霉菌由于氮源不足,生长缓慢,不利于酶的合成。当氮源质量浓度过高,木霉菌快速生长,培养基中温度过高,导致木聚糖酶合成水平下降。
2.6 果渣质量分数对木聚糖酶活性的影响
如图2-c所示,随着果渣质量分数的增加,木聚糖酶的活性呈现先增加后减少的趋势(P<0.001)。当果渣质量分数为30%时,木聚糖酶活性最高,达到78.15 U/mL。当果渣质量分数较低时,培养基中碳源质量浓度太低导致木聚糖酶产量降低。当果渣质量分数较高时,培养基中水含量较少,里氏木霉和绿色木霉无法分散利用大量的碳源,且大量微生物聚集生长导致培养基中温度过高,溶解氧的浓度太低,菌体对水分及溶解氧的竞争,导致木聚糖酶产量降低。
2.7 接种质量分数对木聚糖酶活性的影响
如图2-d所示,随着接种质量分数的增加,木聚糖酶的活性表现为先增加后减少的趋势(P<0.001)。当接种质量分数为12%时,木聚糖酶的活性最高,达到78.00 U/mL。当接种质量分数<12%时,生物量过低,使产酶周期延长,产酶量降低。当接种质量分数>12%时,发酵前期菌体生长过快,造成培养基中溶解氧水平不足,且大量微生物生长导致培养基中局部温度过高,从而使产酶量下降。
2.8 正交优化里氏木霉和绿色木霉共发酵的培养基
里氏木霉和绿色木霉共发酵培养基的正交试验与方差分析结果见表2、表3。从表2中的极差分析可知,里氏木霉和绿色木霉共发酵的培养基最佳条件是A3B3C3D2,即氮源0.5 g/L,果渣质量分数35%,接种质量分数14%,pH 5.50。正交试验中最佳培养基条件为A3B1C3D2,即氮源0.5 g/L,果渣的质量分数25%,接种质量分数14%,pH 5.50。对A3B3C3D2和A3B1C3D2两组培养条件进行对比实验,结果表明A3B1C3D2条件下木聚糖酶的活性更高,为121.62 U/mL,与第7组实验结果相似(表2)。所以里氏木霉和绿色木霉共发酵的培养基最佳条件是氮源0.5 g/L,果渣质量分数25%,接种质量分数14%,pH 5.50。
对正交试验结果进行方差分析(表3),在里氏木霉和绿色木霉共发酵工艺正交试验所选择的因素和水平范围内,因素A、B、C和D的影响均达到了极显著性水平(P<0.001),即氮源质量浓度、果渣质量分数、接种质量分数和pH均对培养基中木聚糖酶的活性有显著影响。从表2的极差分析可知,各因素对里氏木霉和绿色木霉共发酵培养基溶液中木聚糖酶的活性影响的主次顺序为氮源质量浓度(A)>pH(D)>接种质量分数(C)>果渣质量分数(B)。
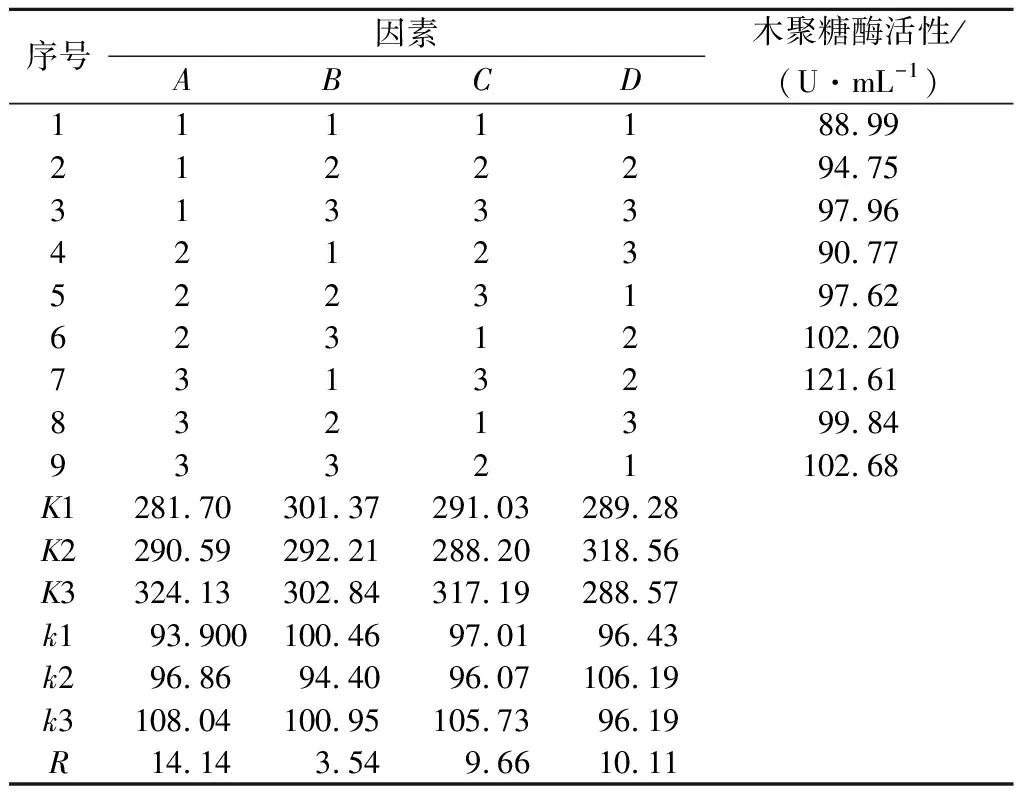
表2 培养基条件的正交试验结果Table 2 Orthogonal experimental results of the medium conditions
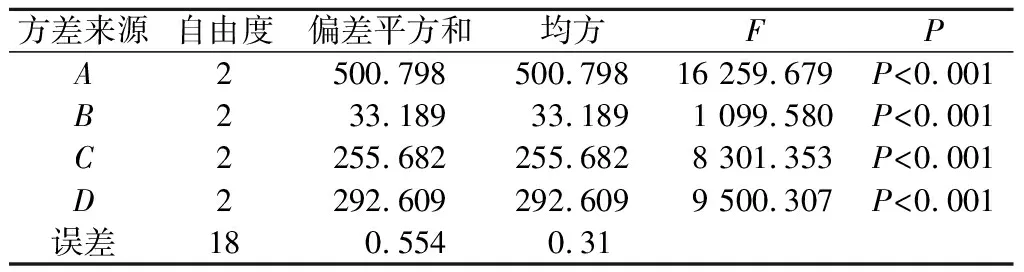
表3 方差分析结果Table 3 Analysis of variance results
2.9 无机离子对木聚糖酶产量的影响
如图3所示,添加CoCl2,FeSO4,MgSO4,MnSO4,ZnCl2后,随着无机离子浓度的增加,木聚糖酶活性均呈现先增加后减少的趋势。添加低浓度CoCl2后,木聚糖酶活性显著增加。当CoCl2质量浓度为1 mg/L时,木聚糖酶活性最高,为77.57 U/mL。继续添加CoCl2后,会抑制木聚糖酶的产生。只有FeSO4质量浓度为12~15 mg/L时,添加FeSO4才会提高木聚糖酶的产量,木聚糖酶活性分别为75.35和76.65 U/mL。FeSO4浓度太低或者太高时都会抑制木聚糖酶的活性。添加少量的MgSO4会促进木聚糖酶的产生,当MgSO4质量浓度为12 mg/L时,木聚糖酶的活性最高,为80.79 U/mL。当MgSO4质量浓度高于15 mg/L时,MgSO4的添加会抑制木聚糖酶的产生。当MnSO4质量浓度为1.4 mg/L时,木聚糖酶的活性最高,达84.74 U/mL。继续添加MnSO4,木聚糖酶活性逐渐降低,当MnSO4质量浓度高于3 mg/L时,MnSO4的添加会抑制木聚糖酶的产生。当ZnCl2质量浓度<1.6 mg/L时,培养基溶液中木聚糖酶的活性均高于未添加时木聚糖酶的活性,分别为75.27、75.87和76.56 U/mL。当ZnCl2质量浓度高于1.6 mg/L时,木聚糖酶的活性逐渐降低,且培养基溶液中木聚糖酶的活性均低于未添加ZnCl2时木聚糖酶的活性,ZnCl2的添加抑制了里氏木霉和绿色木霉共发酵产生木聚糖酶。由于MgSO4和MnSO4的添加对木聚糖酶产量的影响相对于其他3种离子的影响较大,为了节约资源以及简化实验,所以在培养基中添加12 mg/L MgSO4和1.4 mg/L MnSO4。
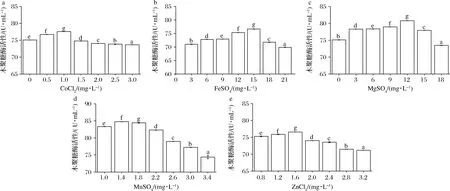
a-CoCl2;b-FeSO4;c-MgSO4;d-MnSO4;e-ZnCl2图3 无机离子对木聚糖酶活性的影响Fig.3 The effect of inorganic ions on the xylanase activity
结合正交试验的结果,里氏木霉和绿色木霉共发酵产生木聚糖酶的最佳培养基为氮源(NH4NO3)质量浓度0.5 g/L,果渣质量分数25%,里氏木霉与绿色木霉的质量比例3∶2,接种质量分数14%,pH 5.50,并添加12 mg/L MgSO4和1.4 mg/L MnSO4,28 ℃下培养4 d。在最优培养基条件下重复培养3次,培养基溶液中木聚糖酶活性达(127.25±0.09) U/mL,与基础培养基相比,木聚糖酶产量增加了69.46%。
3 结论
木聚糖酶为诱导性酶,选择合适培养基底物和最佳的培养基组成很关键。本实验以黑果腺肋花楸作为主要培养基原料,通过单因素试验和正交试验,优化了里氏木霉和绿色木霉共发酵黑果腺肋花楸生产木聚糖酶的培养基,并探究了添加无机离子对木聚糖酶产量的影响。
方差分析结果表明对木聚糖酶的活性影响的主次顺序为氮源浓度(A)>pH(D)>接种质量分数(C)>果渣质量分数(B)。极差分析表明最佳培养条件为A3B3C3D2,但正交试验中最佳条件是A3B1C3D2与极差分析结果不同。对A3B3C3D2和A3B1C3D2两组条件进行对比实验,A3B1C3D2条件下木聚糖酶的活性更高,为121.62 U/mL,所以里氏木霉和绿色木霉共发酵黑果腺肋花楸生产木聚糖酶的最佳培养条件为A3B1C3D2,即氮源(NH4NO3)质量浓度0.5 g/L,果渣质量分数25%,里氏木霉与绿色木霉的质量比例3∶2,接种质量分数14%,pH 5.50,培养4 d。CoCl2,FeSO4,MgSO4,MnSO4,ZnCl2分别在添加1、15、12、1.4和1.6 mg/L时效果最佳,过多或者过少的无机离子都会抑制木聚糖酶的产生。但是MgSO4和MnSO4对里氏木霉和绿色木霉共发酵产木聚糖酶的影响高于CoCl2,FeSO4和ZnCl2。为了降低实验成本以及简化实验步骤,选择添加量是MgSO4为12 mg/L和MnSO4为1.4 mg/L。在上述条件下28 ℃培养4 d后木聚糖酶的活性高达(127.25±0.09) U/mL,与基础培养基相比,木聚糖酶产量增加了69.46%。

