胃底腺来源腺癌的临床病理学特征及基因分析
张晓红 王玉娥 杨静 王烨 刘晓江 王志蕙 姚少波
1.山东省临沂市肿瘤医院病理科,山东临沂 276000;2.山东省临沂市肿瘤医院内镜中心,山东临沂 276000;3.山东省临沂市中医医院病理科,山东临沂 276000
2019 年世界卫生组织的消化系统肿瘤分类中,定义胃底腺型腺癌(gastric adenocarcinoma of fundic gland type,GA-FG)是一种罕见的低度异型性肿瘤,具有主细胞和/或壁细胞分化,常浸润黏膜下层[1],预后较好。而日本学者Ueyama等[2]发现,GA-FG 中另一种组织学类型——胃底腺黏膜型腺癌(gastric adenocarcinoma of fundic gland mucosa type,GA-FGM)同时具有胃底腺分化和小凹上皮分化的特点。本研究收集胃底腺来源腺癌患者资料,回顾性分析其临床病理学及基因特征的差异,旨在提高临床病理医师对此类肿瘤的认识。
1 资料与方法
1.1 一般资料
收集2017 年1 月至2022 年3 月山东省临沂市肿瘤医院病理科存档的胃底腺病变患者资料,由两位高年资病理医师重新阅片,共筛选出7 例胃底腺来源腺癌,另选择山东省临沂市中医院诊断的2 例GA-FG(患者因早癌筛查、体检或上腹部隐痛不适等行胃镜检查偶然发现)。本研究经医院伦理委员会批准(KY-2207)。
1.2 研究方法
采用日本Olympus CV-290 主机和GIF-H260Z内镜进行白光内镜检查。所有标本均经10%中性福尔马林溶液固定,石蜡包埋,3~5 μm 切片,常规苏木精-伊红染色。胃蛋白酶原Ⅰ(货号:PM-0341)、H+/K+-腺苷三磷酸酶(adenosine triphosphatase,ATPase)(货号:AR-0193)购自上海杰浩生物技术有限公司;黏蛋白(mucin,MUC)6(货号:MAB-0823)、MUC5AC(货号:MAB-0079)、MUC2(货号:MAB-0075)购自福州迈新生物技术开发有限公司;MLH1(货号:ZM-0154)、PMS2(货号:ZA-0542)、MSH2(货号:ZA-0622)、MSH6(货号:ZA-0541)、P53(货号:ZM-0408)、Ki-67(货号:ZM-0166)、Des(货号:ZA-0610)、CD31(货号:ZM-0044)、CD34(货号:ZM-0046)、D2-40(货号:ZM-0465)购自中杉金桥试剂有限公司。采用莱卡公司hMark XT 全自动免疫组织化学机进行染色。H+/K+-ATPase 定位于细胞膜,胃蛋白酶原Ⅰ、MUC5AC、MUC6、MUC2、D2-40、Des 定位于细胞质,MLH1、PMS2、MSH2、MSH6、P53、Ki-67 定位于细胞核,CD31、CD34 定位于细胞质或细胞膜。免疫组织化学评判标准:无染色为阴性,浅黄色为弱阳性,棕黄色为中等阳性,棕褐色为强阳性。所有患者均经两位经验丰富的病理医师阅片。
分子检测由杭州迪安医学检验中心检测完成。采用二代测序(next generation sequencing,NGS)检测相关基因:GNAS、KRAS、BRAF、NRAS、HRAS、RET、NOTCH、PIK3CA、APC、PTEN、TP53、NTRK、IDH1、MLH1、PMS2、MSH2、MSH6 等。
2 结果
2.1 临床资料及内镜特征
9 例患者临床资料见表1。内镜观察8 例GA-FG可见病灶呈黏膜下隆起样外观,等色调或轻度褪色,边界呈过渡性,表面轻度颗粒感,7 例可见扩张的树枝状血管。窄带成像技术联合放大内镜观察可见隐窝及隐窝间区拉长、增宽,呈不规则绒毛样或乳头样,隐窝间区内见紊乱的微血管。见图1A、B。1 例GA-FGM内镜下可见病灶呈息肉样外观,边界清晰,边界线内部表面结构明显紊乱,窄带成像技术联合放大观察可见隐窝扩张、拉长及融合,微血管扭曲、分布不规则。见图1C、D。

图1 胃底腺型腺癌和胃底腺黏膜型腺癌内镜下特点

表1 临床资料及内镜特征
2.2 病理镜检
8 例均诊断为GA-FG,其中4 例合并胃底腺息肉。肿瘤黏膜结构层次尚清,表面均被覆正常的胃小凹上皮,固有层见轻-中度异型腺体增生成角、分支状,甚至相互吻合呈筛状或迷路样,病变内常见2 种细胞混杂性生长:大部分为高度分化的柱状细胞,位于基底的圆形细胞核,嗜碱性胞浆,可见小核仁,类似于胃底腺主细胞;另一种细胞略大,胞浆嗜酸性,圆而深染的细胞核,类似于胃底腺壁细胞。见图2。其中5 例可见局灶破坏黏膜肌并浸润黏膜下层,6 例肿瘤细胞轻度异型性,2 例轻-中度异型性,单层或多层柱状细胞增生,部分核上移,偶见核分裂象。1 例诊断为GA-FGM,可见黏膜结构层次紊乱,表面被覆肿瘤性小凹上皮,其下见轻-中度异型腺体增生成角、分支状或相互吻合,局灶浸润黏膜下层。黏液细胞或嗜碱性细胞(类似于胃底腺的主细胞)单层或多层增生,部分形成乳头状结构,混杂少量嗜酸性细胞(类似胃底腺壁细胞),可见核分裂象。见图3。
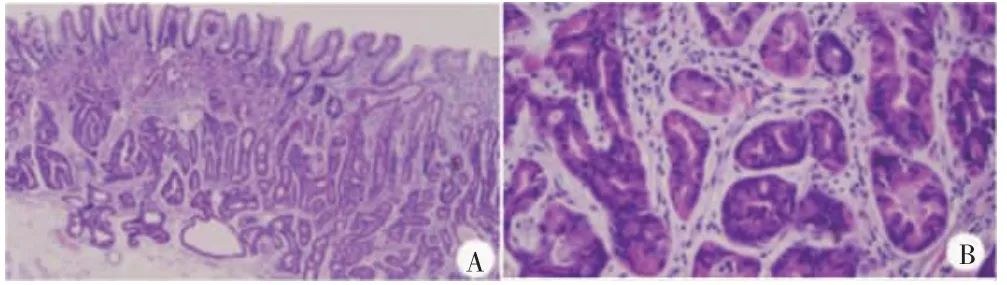
图2 胃底腺型腺癌病理特征(苏木精-伊红染色)

图3 胃底腺黏膜型腺癌病理特征(苏木精-伊红染色)
2.3 免疫组织化学染色
8 例GA-FG 可见MUC5AC 仅在表面正常小凹上皮中呈强阳性,瘤细胞阴性;6 例瘤细胞MUC6 呈弥漫强阳性;2 例MUC6 弥漫中等阳性;7 例胃蛋白酶原Ⅰ弥漫强阳性;1 例胃蛋白酶原Ⅰ散在中等阳性;7 例H+/K+-ATPase 散在中等阳性,1 例H+/K+-ATPase 散在弱阳性,8 例Ki-67 均<5%。见图4。1 例GA-FGM 瘤细胞MUC5AC、MUC6、胃蛋白酶原Ⅰ、H+/K+-ATPase均为阳性,Ki-67 约为20%。见图5。8 例GA-FG 及1 例GA-FGM 均显示P53 野生型表达,MUC2 阴性,微卫星稳定型(MLH1、PMS2、MSH2、MSH6 均阳性)。

图4 GA-FG 免疫组织化学染色(100×)
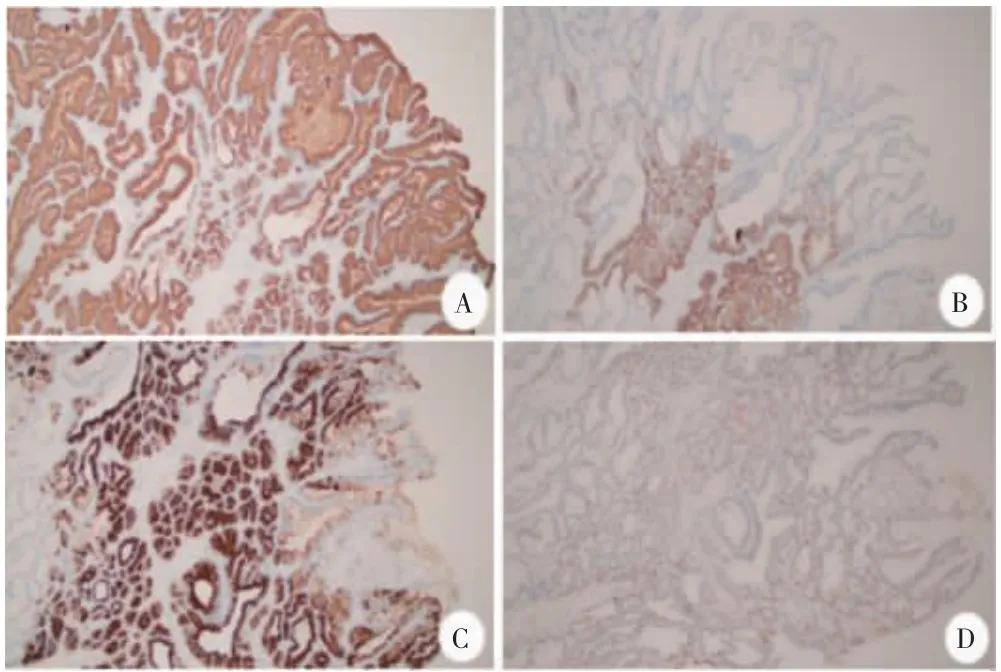
图5 GA-FGM 免疫组织化学染色(100×)
2.4 NGS 检测
7 例GA-FG 患者行NGS 检测,2 例显示GNAS 错义突变,其中1 例同时发生GNAS 错义突变和NCOR2整码插入变异,1 例同时发生GNAS、KMT2D 错义突变;另有1 例显示ZFHX3 整码缺失、KRAS、HRAS、PIK3CA 错义突变,1 例显示HRAS、TP53 错义突变。1 例GA-FGM 显示BRAF、TP53、KMT2A、ATM 错义突变。
3 讨论
胃底腺型腺癌是一种罕见的低度异型性腺癌,发病率<0.01%[3]。大多数无幽门螺杆菌感染,也可见于幽门螺杆菌根除治疗后或少数现症感染者[4-5]。随着公共医疗卫生的提高及幽门螺杆菌根除治疗的增加,GA-FG 发病率是否会呈增长趋势,还有待进一步研究。GA-FG 多见于36~87岁[6-7],男性略多于女性,少数患者可见胃食管反流的相关症状、上腹部不适或无症状等[8]。80%发生于胃上1/3 部分[9],直径0.3~8.5 cm(平均值约为1.0 cm)[10],单发为主,偶见多灶[11]。周围黏膜轻或中度慢性炎症,未见萎缩及肠上皮化生[12],少数可伴萎缩性胃炎及肠上皮化生。病灶多为0~Ⅱa 型,少数为0~Ⅱb 或0~Ⅱc型[5,13]。内镜如果发现胃底腺区域0~Ⅱa 或0~Ⅱb 型病灶,周围黏膜无萎缩、肠上皮化生及幽门螺杆菌感染,应高度警惕胃底腺肿瘤,并采用窄带成像技术放大观察病变的边界、微血管及隐窝结构等[14]。临床应谨慎取材并明确病变边界,为下一步治疗做准备。本研究中8 例GA-FG患者的病理特征与上述文献报道相符。
GA-FG 根据细胞类型分为主细胞为主型、壁细胞为主型或混合型[1,5,15]。镜下观察表面被覆非肿瘤性小凹上皮,其下见低异型腺体增生成角、分支,甚至互相吻合呈筛状或迷路样。大部分为高分化的柱状细胞(类似于胃底腺主细胞),另一种类似于胃底腺壁细胞。间质可见水肿或黏液样变,无促纤维结缔组织反应[5]。免疫组织化学染色结果可见,主细胞表达胃蛋白酶原Ⅰ,壁细胞表达H+/K+-ATPase,胃小凹上皮表达MUC5AC,颈黏液细胞及幽门腺细胞表达MUC6,杯状细胞表达MUC2。免疫组织化学标记可辅助区分细胞类型,本研究中8 例GA-FG 瘤细胞均表达胃蛋白酶原Ⅰ、MUC6、H+/K+-ATPase,而MUC5AC 仅在表面正常小凹上皮表达,且Ki-67<5%,提示肿瘤细胞生长缓慢,预后较好。Iwamuro等[16]随访10 个机构的116 例患者,仅2 例患者复发,推测可能与切除不净有关。
GA-FGM 既可以向胃小凹上皮和颈黏液细胞或幽门腺样黏液细胞分化[17-18],也可以向胃底腺的主细胞和壁细胞分化。目前国内外大多为个案报道,Ueyama等[18]总结25 例GA-FGM,23 例位于胃中上1/3 部分,0~Ⅱc 或0~Ⅱb 型略多,直径约2.1 cm,周围黏膜幽门螺杆菌感染率较低。与GA-FG 比较,GA-FGM 多见于0~Ⅱc 或0~Ⅱb 型,肿瘤直径更大,浸润黏膜下层更深,更易出现脉管侵犯[18]。
研究发现,CTNNB1、AXIN 等基因突变可导致Wnt/β-catenin 通路组成性激活,促进GA-FG 发生[19-20]。Nomura等[21]报道GA-FG 具有GNAS 突变(5/26 例),其中2 例同时存在GNAS、KRAS 突变。GNAS 突变可能是Wnt/β-catenin 信号通路激活的替代机制,KRAS 突变则激活ERK1/2-MARK 通路,促进肿瘤的发生[22]。刘蕾等[23]也发现,胃底腺肿瘤中GNAS 错义突变(7/12 例),其中2 例GNAS、KRAS 同时发生错义突变。Ueyama等[18]检测GA-FG 中GNAS、CDKN2A突变共存,GA-FGM 中GNAS、PIK3CA 突变共存。本研究中2 例GA-FG 显示GNAS 错义突变,其中1 例同时发生GNAS 错义突变和NCOR2 整码插入变异,1 例同时发生GNAS、KMT2D 错义突变。1 例GA-FGM显示BRAF、TP53、KMT2A、ATM 错义突变。
目前GA-FG 以内镜黏膜下剥离术或内镜下黏膜切除术治疗为主,随访大多数患者无复发、无转移,预后较好。对于浸润黏膜下层>500 μm 的病灶可联合腹腔镜和内镜切除[24]。GA-FGM 与GA-FG 比较,更易出现脉管侵犯及淋巴结转移,建议综合评估后选择合适手术方式。个别GA-FGM 因边界和深度不易判断,内镜下切除存在切缘阳性可能,Uchida等[25]报道了1 例GA-FGM 患者因切缘阳性而追加外科手术。
胃底腺来源腺癌的鉴别诊断主要包括①GA-FG、GA-FGM 两者的鉴别。②胃底腺腺瘤:由于欧美及日本诊断标准的不同,对其诊断一直存在争论。Ueyama等[18]发现,胃底腺腺瘤和GA-FG 除肿瘤浸润深度外,其余临床病理、内镜及分子生物学特征并没有显著差异,进一步支持胃底腺腺瘤是GA-FG 黏膜期的这一理论。③神经内分泌瘤:胃底腺来源腺癌和神经内分泌瘤均为低异型性肿瘤,但神经内分泌瘤多呈黄色且CgA、Syn、CD56 等阳性,可以明确鉴别。对于胃底腺腺瘤的诊断归类、幽门螺杆菌是否参与了胃底腺肿瘤的发生发展、GA-FG 和GA-FGM 病理组织学特点、预后及治疗差异等问题,还有待大宗数据的进一步研究。

