不同抗旱性狗牙根地上地下表型特征及内源激素对干旱胁迫的响应
张一龙,喻启坤,李雯,李培英,2,3,孙宗玖,2,3
(1. 新疆农业大学草业学院,新疆 乌鲁木齐 830052;2. 新疆草地资源与生态自治区重点实验室,新疆 乌鲁木齐 830052;3. 西部干旱区草地资源与生态教育部重点实验室,新疆 乌鲁木齐 830052)
水分是限制植物生长最重要的非生物因子之一,参与植物体内一切生理代谢过程和植株的形态建成,影响着植物的生存、生长发育乃至地理分布[1]。在干旱胁迫下,植物能够通过形态结构特征的可塑性来获取自身正常生长和发育所需的水分含量[2],并通过改变其形态建成以适应胁迫环境或者在胁迫压力下出现死亡[3]。叶片的形态结构主要朝着降低蒸腾和贮藏水分两方面发展[4],而根系则变得更加发达,根系分布较深,功能根的数目和长度增加,根冠比增大,这有利于根系吸取土壤深层的水分并提高利用率,保持体内水分平衡[5]。
内源激素是植物新陈代谢的调控者,干旱胁迫下,植物体内激素的形成、比值及运输等发生了相应的变化,这些变化将直接影响植物生长与代谢[6]。且内源激素和植物的应激反应与形态学的适应性变化关系相关。陈晓娜等[7]、张海燕等[8]研究表明,干旱胁迫下,叶片赤霉素(gibberellin A,GA)、吲哚乙酸(indole acetic acid,IAA)和玉米素核苷(zeatin riboside,ZR)含量下降,脱落酸(abscisic acid,ABA)含量增加导致叶片和茎生长减弱,使细胞代谢缓慢,从而减少水分过度消耗。王金强等[9]则研究表示ZR 通过直接控制根系分生组织的分化速度来影响根系的平均直径和根体积,ABA 通过影响IAA 的运输和信号传导来影响根的形成和分化,ZR 的下降和ABA 的增加导致甘薯(Dioscorea esculenta)根平均直径和总体积下降。另外干旱胁迫可诱导根中IAA/ABA 和ZR/ABA 降低,导致根系长度和体积减小,进而抑制根系的发育。Xu 等[10]研究也表明,干旱胁迫下积累在水稻(Oryza sativa)根尖的ABA 会调控生长素在根尖的运输,进而维持或促进主根的伸长。而番茄(Lycopersicon esculentum)根中独脚金内酯(strigolactone,SL)的合成降低可作为其地上和地下系统交通信号,导致地上部对ABA 敏感性增强,从而使气孔更快地关闭[11]。
目前,针对植物形态特征、内源激素水平响应干旱胁迫的研究较多[12-13],而对干旱下狗牙根(Cynodon dactylon)地上地下形态特征、内源激素协同适应的研究还较少,因此,本研究以不同抗旱性的狗牙根为材料,开展地上地下表型特征与内源激素响应干旱研究,旨在探讨干旱胁迫下不同抗旱性狗牙根形态特征、内源激素响应干旱的差异,挖掘狗牙根响应干旱的关键形态特征及内源激素,丰富狗牙根抗旱理论以及为生产实践中利用外源激素调控其抗旱性提供参考。
1 材料与方法
1.1 试验材料
以本课题组前期研究[14]筛选出的2 份抗旱和2 份敏旱狗牙根为供试材料、育成品种Tifway 为对照。采用单株扩繁,每周进行修剪,留茬高度4 cm,每周施等量尿素、除杂草等养护管理,促进其不断分蘖、扩繁,形成试验原始材料(表1)。
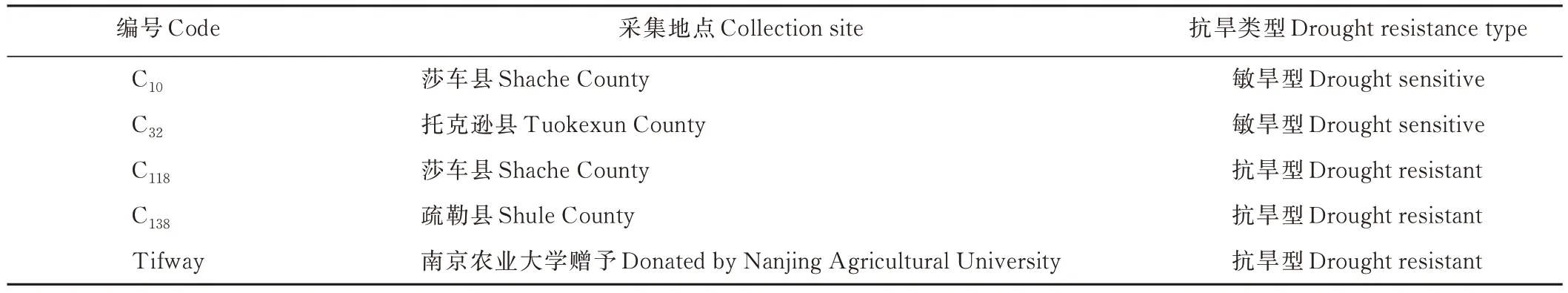
表1 供试材料基因型及相关信息Table 1 Genotype and related information of test materials
1.2 试验材料准备
从原始试验群体中移取直径5 cm 的草坪塞栽植至PVC 管(直径10 cm,深40 cm)中,地下保留5 cm 根系层,每个种质移栽16 根PVC 管,管内装入花土、蛭石和过2 mm 筛沙子的混合物(体积比=2∶1∶1),每管装土5.8 kg,进行育苗,混合土壤有机质含量为71.86 mg·kg-1,碱解氮含量为191.73 mg·kg-1,速效磷含量为10.54 mg·kg-1,速效钾含量为184.87 mg·kg-1,适应生长30 d 后开始进行干旱胁迫试验。
1.3 干旱处理
2021年8 月15 日在新疆农业大学草业学院室外试验地进行,试验设置3 个处理,即正常灌溉(土壤相对含水量为田间持水量的75%~80%,CK)、中度干旱胁迫(土壤相对含水量为田间持水量的45%~50%,MD)及重度干旱胁迫(土壤相对含水量为田间持水量的20%~30%,SD),每个水平3 次重复。对每管进行充分灌溉使其达到田间饱和持水量,使管内水分自然蒸散,待达到设定水分梯度时,每天称重补充损失的水分,使土壤含水量控制在设定的范围内。待重度干旱处理达到其设定值后,维持10 d 后进行指标测定。
1.4 测定指标与方法
体积土壤含水量(volume water content,VWC)采用MP508 土壤水分传感器测定,参考黄昌勇[15]的方法,利用土壤含水量(soil water content,SWC)与VWC 的拟合方程进行SWC 的计算。相对电导率(relative conductivity,REC)采用电导法[16]测定,相对含水量(relative water content,RWC)采用饱和称重法[16]测定,叶长(leaf length)、叶宽(leaf width)、叶面积(leaf area)采用智能叶面积测量仪(YMJ-CH,浙江),对狗牙根植株顶部向下第一片成熟完全展开叶进行测定,重复6 次。采用根系扫描仪(中晶MICROTEK Scan Maker i800plus,杭州)对供试狗牙根根部特征(总根长、根表面积、根体积、根平均直径)进行扫描,重复3 次。根系干重采用烘干法测定。最长根长采用精度为1 mm 的卷尺测量。根系活力(root activity)采用三苯基氯化四氮唑(triphenyte-trazoliumchloride,TTC)法[16]进行测定。选取本试验中抗旱差异较大的两份材料(抗旱C138、敏旱C32)进行ABA、IAA、ZR、GA3、油菜素内酯(brassinolide,Br)含量测定,参照中国农业大学酶联免疫试剂盒方法进行。
1.5 数据处理
采用Microsoft Excel 2016 进行数据预处理,采用SPSS 26.0 软件One-way ANOVA 进行不同干旱处理间及不同材料间指标的差异性分析,显著性水平的判断依据为P<0.05。利用Pearson 法分析各测定指标间的相关性,采用Origin 2018 制图。
2 结果与分析
2.1 干旱胁迫对狗牙根叶与根相对含水量的影响
随着干旱胁迫加剧,供试材料叶片相对含水量呈显著降低趋势(P<0.05)。正常灌溉各种质间无显著差异,为90.49%~92.65%;中度胁迫时,C32表现出相对较低的叶片相对含水量(54.64%,图1),其余材料则无显著差异;重度胁迫下,各材料的叶片相对含水量下降至21.19%~37.73%,且Tifway、C138的叶片相对含水量显著高于其他材料31.04%~78.03%。
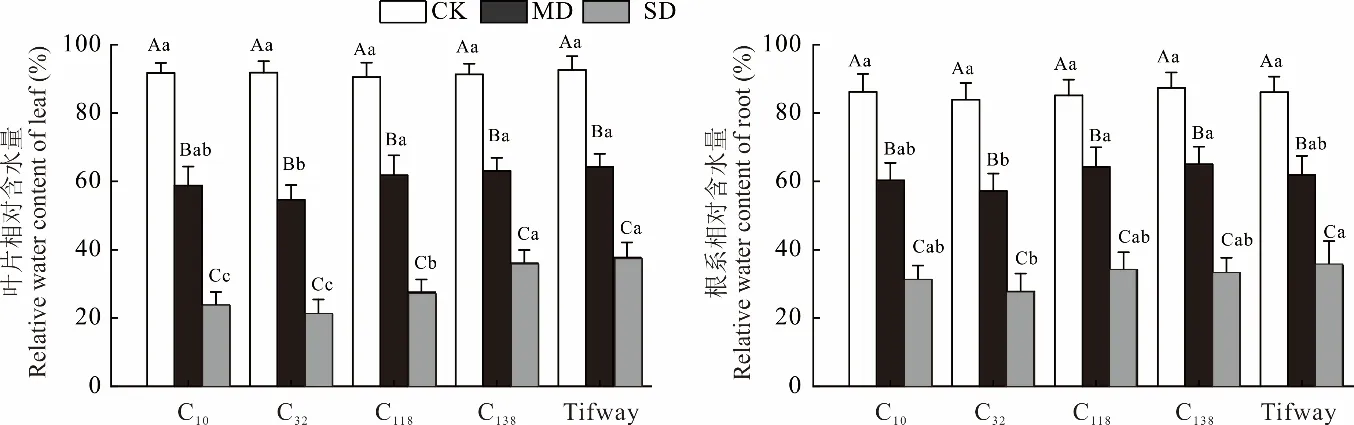
图1 干旱胁迫对狗牙根叶与根相对含水量的影响Fig.1 Effects of drought stress on relative water content between leaf and root of C. dactylon不同小写字母表示相同处理不同材料间差异显著(P<0.05),不同大写字母表示相同材料不同处理间差异显著(P<0.05)。CK:正常灌溉;MD:中度干旱胁迫;SD:重度干旱胁迫。下同。 Different lowercase letters indicate significant differences among different materials under the same treatment(P<0.05),and different capital letters indicate significant differences among different treatments of the same material(P<0.05). CK:Normal irrigation;MD:Moderate drought stress;SD:Severe drought stress.The same below.
较于叶片相对含水量,各材料的根系相对含水量在正常灌溉下相对较低,为83.95%~87.34%,且各材料间无显著差异;中度胁迫时各材料的根系相对含水量为57.15%~64.96%,C32的根系相对含水量低于其他材料;而至重度胁迫时,各材料的根系相对含水量降至27.80%~35.45%,且各材料较C32高12.33%~27.54%。
2.2 干旱胁迫对狗牙根叶与根相对电导率的影响
随着干旱胁迫程度加深,各材料的叶片相对电导率显著升高(图2)。正常灌溉下各材料间无显著差异,为8.19%~10.49%,而至中度胁迫各材料叶片相对电导率较CK 上升170.70%~247.00%,其中C32、C10显著高于其他材料;重度胁迫下各材料的叶片相对电导率升至峰值,为41.64%~65.92%,较中度胁迫各材料上升了57.29%~90.09%,且C32>C10>C118>Tifway>C138。
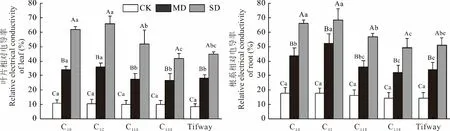
图2 干旱胁迫对狗牙根叶与根相对电导率的影响Fig.2 Effects of drought stress on relative electrical conductivity between leaf and root of C. dactylon
各材料的根系相对电导率在干旱处理下变化与叶片类似。正常灌溉下各材料间无显著差异,但高于叶片相对电导率,为14.10%~17.76%;中度胁迫下各材料的根系相对电导率较CK 上升了120.21%~194.28%,且C32显著高于其余材料;重度胁迫下,各材料的根系相对电导率上升至49.10%~68.37%,达到峰值,C32、C10显著高于其余材料15.95%~39.25%。
2.3 干旱胁迫对狗牙根叶部形态指标的影响
各供试狗牙根的叶长在不同处理下存在显著差异(P<0.05),并且随干旱加剧,各材料叶长呈降低趋势(图3)。正常灌溉下各种质的叶长最长,为76.94~146.66 mm,其中C138的叶长显著大于其余材料24.60%~90.61%;中度胁迫下,各材料的叶长较CK 降低7.58%~30.61%;重度胁迫下各材料叶长降至最低为48.37~112.11 mm,较中度胁迫降低8.07%~27.32%。
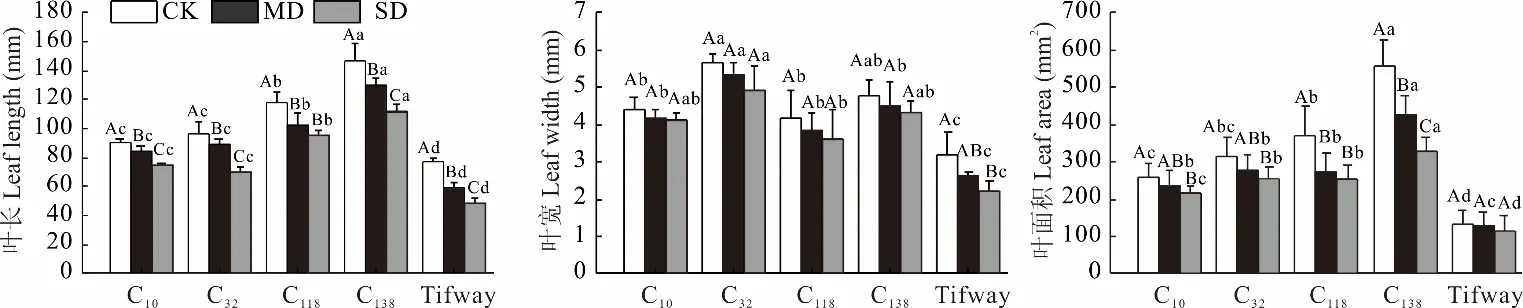
图3 干旱胁迫对狗牙根叶长、叶宽、叶面积的影响Fig.3 Effects of drought stress on leaf length,leaf width and leaf area of C. dactylon
各供试材料叶宽在干旱胁迫下呈下降趋势。在正常水分下仅Tifway 的叶宽(3.20 mm)显著低于其他材料(P<0.05);中度胁迫下各材料的叶宽下降5.55%~21.86%,而至重度胁迫下各材料叶宽较CK 降低6.29%~44.86%。胁迫期间,除Tifway 显著降低外,其余材料叶宽降低不显著。另外除C32外,其余材料中度胁迫叶宽降低幅度明显大于重度胁迫。
干旱胁迫使各材料的叶面积降低。正常水分下,各材料的叶面积存在显著差异(P<0.05),为131.72~555.58 mm2,C138的叶面积比其他材料大49.62%~321.80%;中度胁迫下各材料的叶面积较CK 降低了2.82%~36.56%;重度胁迫下各材料的叶面积降至最低,为111.19~327.47 mm2,C138的叶面积始终保持最大。
2.4 干旱胁迫对狗牙根根系形态指标的影响
由表2 可知,各供试材料的总根长、根表面积、根体积、最长根长、根干重均随干旱加剧呈增加趋势,根平均直径则呈降低趋势,根系活力呈先升后降趋势。较正常灌溉,中度干旱时各材料的总根长增加了6.77%~99.22%;根表面积增加了2.34%~82.78%;根体积增加了6.12%~47.74%;最长根长增加了6.92%~25.14%;根干重增加了6.97%~99.71%;根系活力上升了49.73%~72.14%,根平均直径降低了2.82%~7.35%。重度干旱时,各材料总根长、根表面积、根体积、最长根长、根干重较中度干旱上升了3.75%~9.01%、5.50%~13.05%、1.28%~17.70%、4.29%~14.98%、3.46%~23.07%;根平均直径、根系活力则下降了1.83%~8.29%、27.92%~136.69%。此外,各处理下,C138与Tifway 的总根长、根表面积、根体积、最长根长、根干重、根平均直径、根系活力均表现优秀,且大于敏旱材料C10、C32,而C118则居中,表明抗旱材料本身就具有发达的根系系统,在干旱下可通过延长根系深度、广度、活力,进一步加强水分吸收能力,从而减少植物受干旱胁迫危害(图4)。

图4 干旱胁迫下各供试狗牙根根部形态Fig.4 Root morphology of C. dactylon tested under drought stress
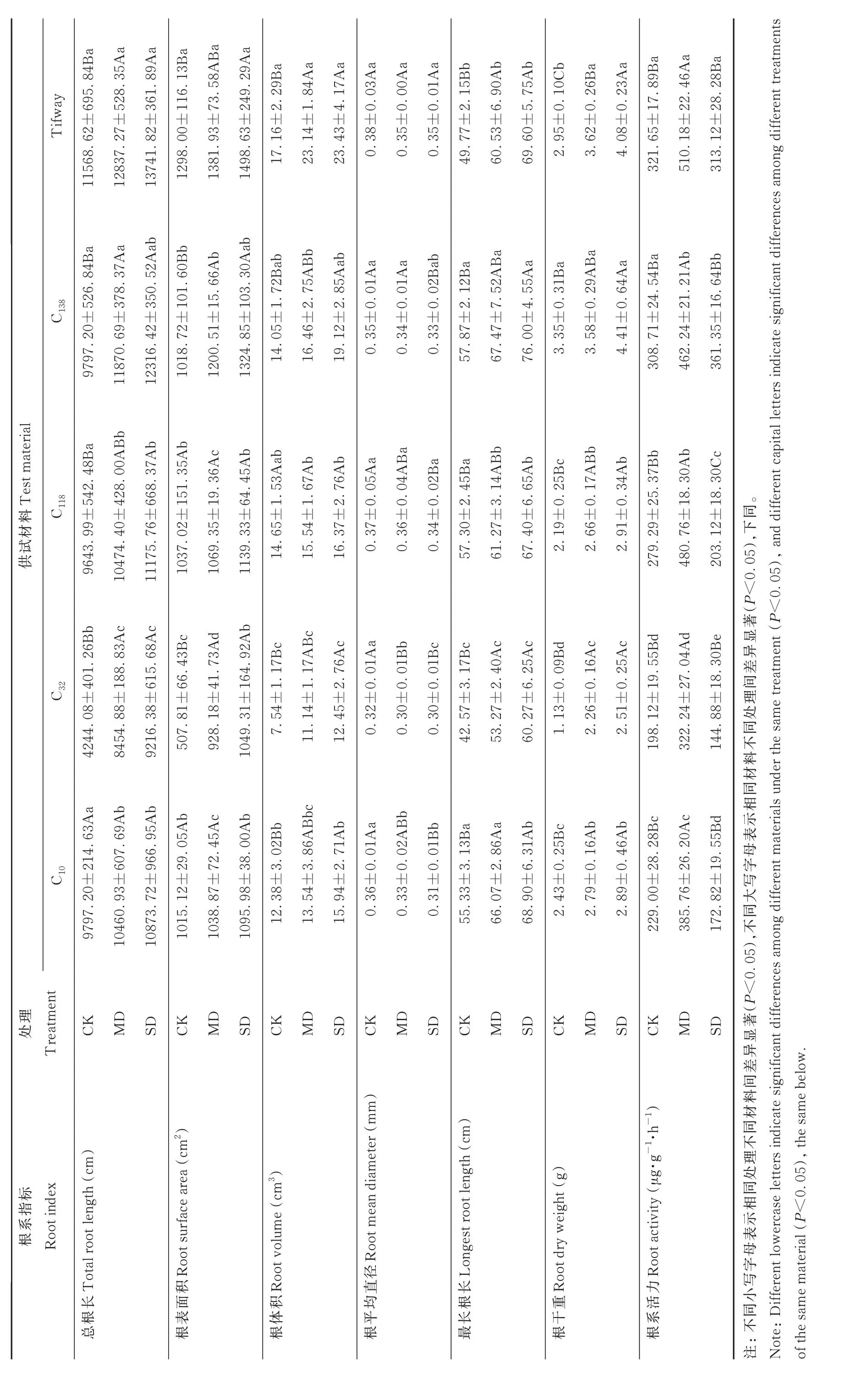
表2 干旱胁迫对各狗牙根根系指标的影响Table 2 Effects of drought stress on root indexes of C.dactylon
2.5 干旱胁迫对狗牙根叶及根中脱落酸含量的影响
两份材料在干旱胁迫下叶片ABA 变化趋势并不一致(图5),C32表现出持续显著增加,其叶片ABA 含量在中、重度胁迫较对照分别增加了39.55%、62.63%,而C138则表现出无显著性变化。正常灌溉下,C138叶片ABA 含量显著大于C32;中、重度胁迫时C32显著高于C138。
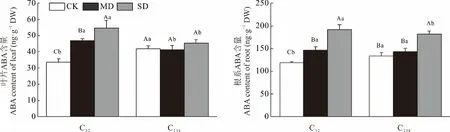
图5 干旱胁迫对狗牙根叶与根中脱落酸含量的影响Fig.5 Effects of drought stress on abscisic acid content in leaf and root of C. dactylon
相较于叶片,供试材料的根系ABA 含量总体较高。干旱胁迫下2 份材料根系ABA 含量均随干旱加剧呈逐渐增加趋势。抗旱材料C138的根系ABA 含量在正常灌溉下较敏旱材料C32显著增加12.19%(P<0.05);而至中度胁迫时,2 份材料间无显著差异(P>0.05),分别为143.85 和146.55 ng·g-1DW,且较CK 增加了22.69%和7.38%;重度胁迫下,2 份材料根系ABA 含量升至峰值,C32(192.39 ng·g-1DW)显 著 高 于C138(181.84 ng·g-1DW)。
2.6 干旱胁迫对狗牙根叶及根中吲哚乙酸含量的影响
C32叶片中IAA 含量随干旱加剧无显著变化,而C138表现为先降后增。且不同处理下均表现出C32叶片IAA 含量显著(P<0.05)低于C138(图6)。
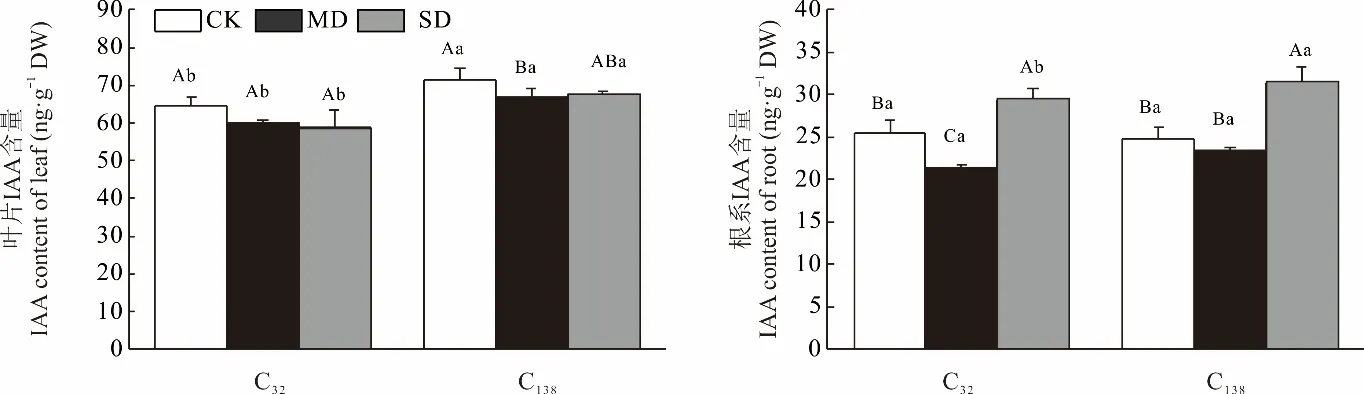
图6 干旱胁迫对狗牙根叶与根中吲哚乙酸含量的影响Fig.6 Effects of drought stress on the content of indole acetic acid in leaf and root of C. dactylon
对于根系而言,随干旱加剧,2 份材料IAA 含量均呈先降后增,且重度干旱下C138根系IAA 含量显著高于C32(P<0.05),其余处理间无显著差异。
2.7 干旱胁迫对狗牙根叶及根中玉米素核苷含量的影响
C32叶片ZR 含量随干旱加剧无显著变化,而C138呈先降后增。总体表现为C138叶片ZR 含量在正常灌溉及重度干旱下均显著高于C32(图7)。
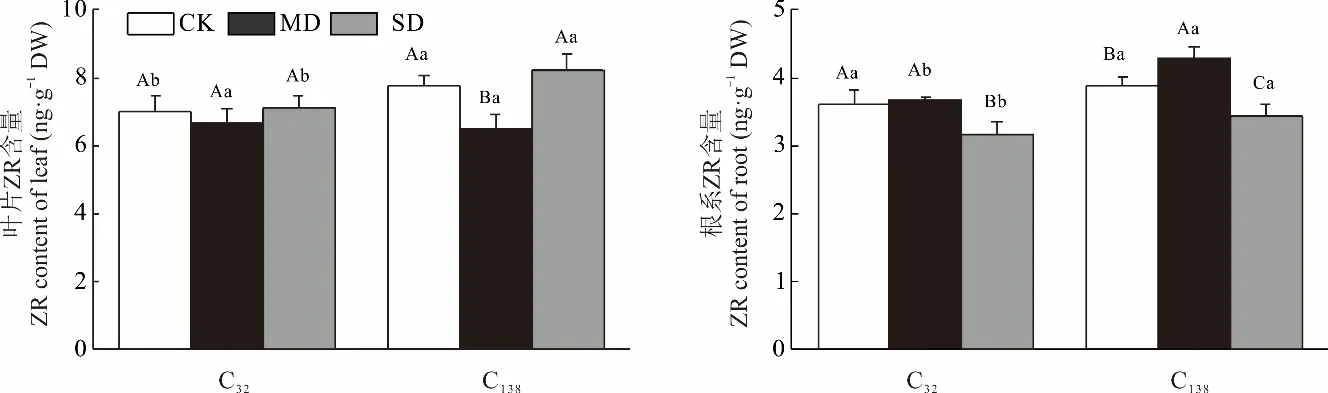
图7 干旱胁迫对狗牙根叶与根中玉米素核苷含量的影响Fig.7 Effects of drought stress on the content of zeatin riboside in leaf and root of C. dactylon
根系ZR 含量随干旱加剧基本呈先升后降趋势。较之CK,中度胁迫时两份材料根系ZR 含量上升了1.56%、9.97%;重度胁迫时,两份材料的ZR 含量较中度胁迫下降了16.06%、24.66%。正常灌溉下两份材料根系ZR 含量无显著差异;中、重度胁迫下,C138的根系ZR 含量较C32分别显著增加16.71%、8.66%。
2.8 干旱胁迫对狗牙根叶及根中赤霉素含量的影响
两份材料叶片GA3含量随干旱胁迫加剧变化不同,C32为基本不变,而C138则表现为重度胁迫下显著上升(图8)。正常灌溉下两份材料间无显著差异;中度胁迫时,C32的叶片GA3含量达到峰值且较C138显著增加22.35%;重度胁迫下,C138的叶片GA3含量达到峰值且较C32显著增加10.31%。
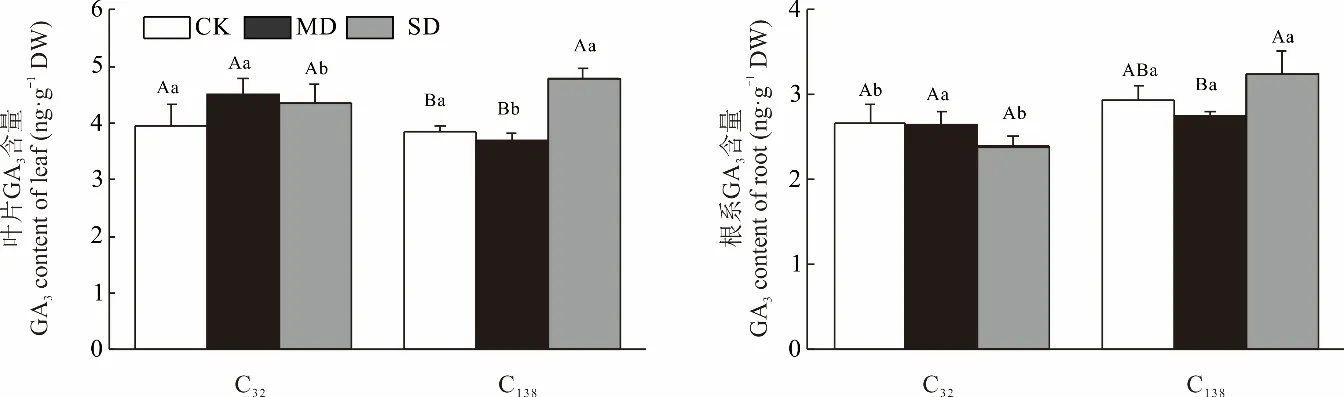
图8 干旱胁迫对狗牙根叶与根中赤霉素含量的影响Fig.8 Effects of drought stress on the content of gibberellin in leaf and root of C. dactylon
对于根系而言,C32的GA3含量随干旱加剧无显著变化,而C138则表现出先降后升趋势。正常灌溉下,C138根系GA3含量较C32显著增加9.89%,中度胁迫时,两份材料无显著差异;重度胁迫下,C32根系GA3含量降至最低,为2.36 ng·g-1DW,而C138则升至峰值,为3.32 ng·g-1DW。
2.9 干旱胁迫对狗牙根叶及根中油菜素内酯含量的影响
随干旱加剧,C32叶片Br 含量表现出递减趋势,而C138则是先降后升(图9)。正常灌溉及中度胁迫时,C32叶片Br 含量较C138分别显著增加20.61%、28.48%,而重度胁迫时两份材料间无显著差异。

图9 干旱胁迫对狗牙根叶与根中油菜素内酯含量的影响Fig.9 Effects of drought stress on the content of brassinolide in leaf and root of C. dactylon
相较于叶片,根系Br 含量总体较低,且两份材料Br 含量均随干旱加剧呈下降趋势。正常灌溉和中度胁迫时两份材料间无显著差异;重度胁迫时2 份材料Br 含量均降至最低值,但C138较C32仍显著增加20.82%。
2.1 0 干旱胁迫下狗牙根叶及根中内源激素比例间的关系变化
由表3 可以看出,两份材料叶片的IAA/ABA 随干旱加剧呈降低趋势。正常灌溉时C32显著大于C138;而中、重度胁迫下C138均显著高于C32,表明C32叶片干旱下IAA/ABA 降幅更大。就根系而言,两份材料的IAA/ABA 呈先降后升,正常灌溉时C32较C138高14.52%,但中度干旱下C138根系IAA/ABA 较CK 下降了13.90%,重度干旱时上升5.51%,而C32表现为中度胁迫较CK 下降45.59%及重度胁迫上升了4.58%,致使干旱下C138根系IAA/ABA也显著大于C32。总体表现为干旱下C138叶片、根系IAA/ABA 显著高于C32。
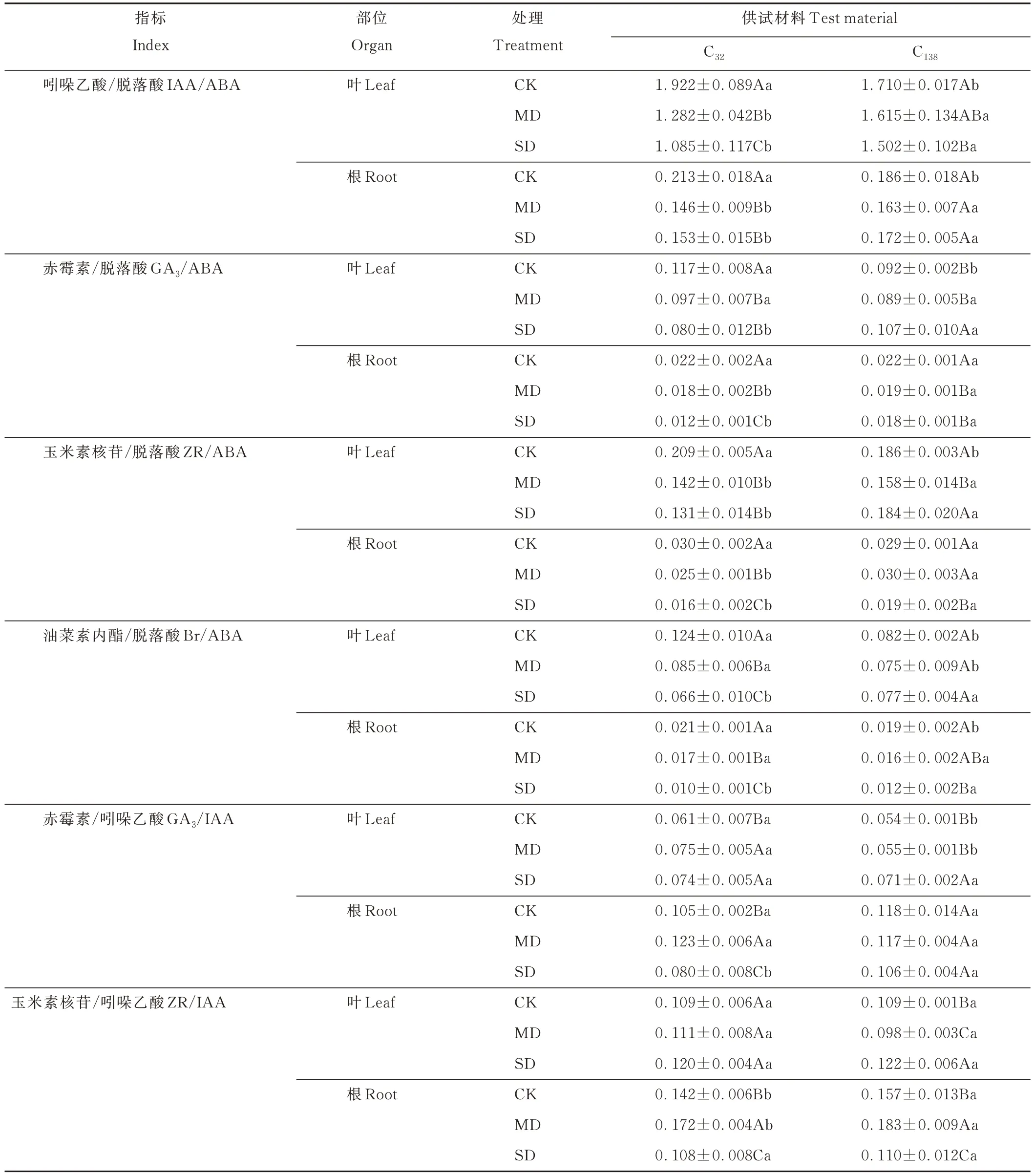
表3 干旱胁迫下不同抗旱性狗牙根叶与根中内源激素比例变化Table 3 Changes of endogenous hormone ratio in leaf and root of C. dactylon with different drought resistance under drought stress
C32叶、根GA3/ABA、ZR/ABA、Br/ABA 均随干旱加剧而降低,且根系降幅更大,C138叶的GA3/ABA 值呈先降3.02%后增19.48%,根系则降低12.44%、5.46%。另外干旱处理下C32的根GA3/ABA 均显著小于C138。C138叶的ZR/ABA 在干旱下呈先降17.95%后增16.68%,SD 与CK 间无显著差异。另外C138根的ZR/ABA 值呈先增后减趋势,在中、重度处理下比值均显著大于C32。对于C138叶、根Br/ABA 来讲,干旱处理同样降低了其比值,但降幅均显著小于C32,SD 时其叶、根的比值也显著大于C32。就GA3/IAA 来说,C32叶、根表现为先升后降,且根系在SD 时降幅更大,为53.55%,而C138叶比值为一直上升,CK 及MD 时比值尽管均显著小于C32,但在SD 时增加28.39%,且与C32无显著差异。C138根系比值呈下降趋势,但波动较小,处理间均无显著差异,SD 时显著大于C32。
对于ZR/IAA,叶的变化波动均小于根系,C32叶表现为上升,而C138叶为先降后升,两者根均表现为先升后降;两者叶的比值在各个时期均无显著差异,但根系表现出CK 及MD 时C138显著大于C32,SD 时无显著差异。
2.1 1 干旱胁迫下狗牙根叶及根形态指标与内源激素及其比例间的相关性分析
由表4 可知,叶长、叶面积与IAA、IAA/ABA 显著正相关,而与GA3/IAA 显著负相关,另外叶面积还与GA3、Br 显著负相关,叶宽则仅与Br 显著正相关。
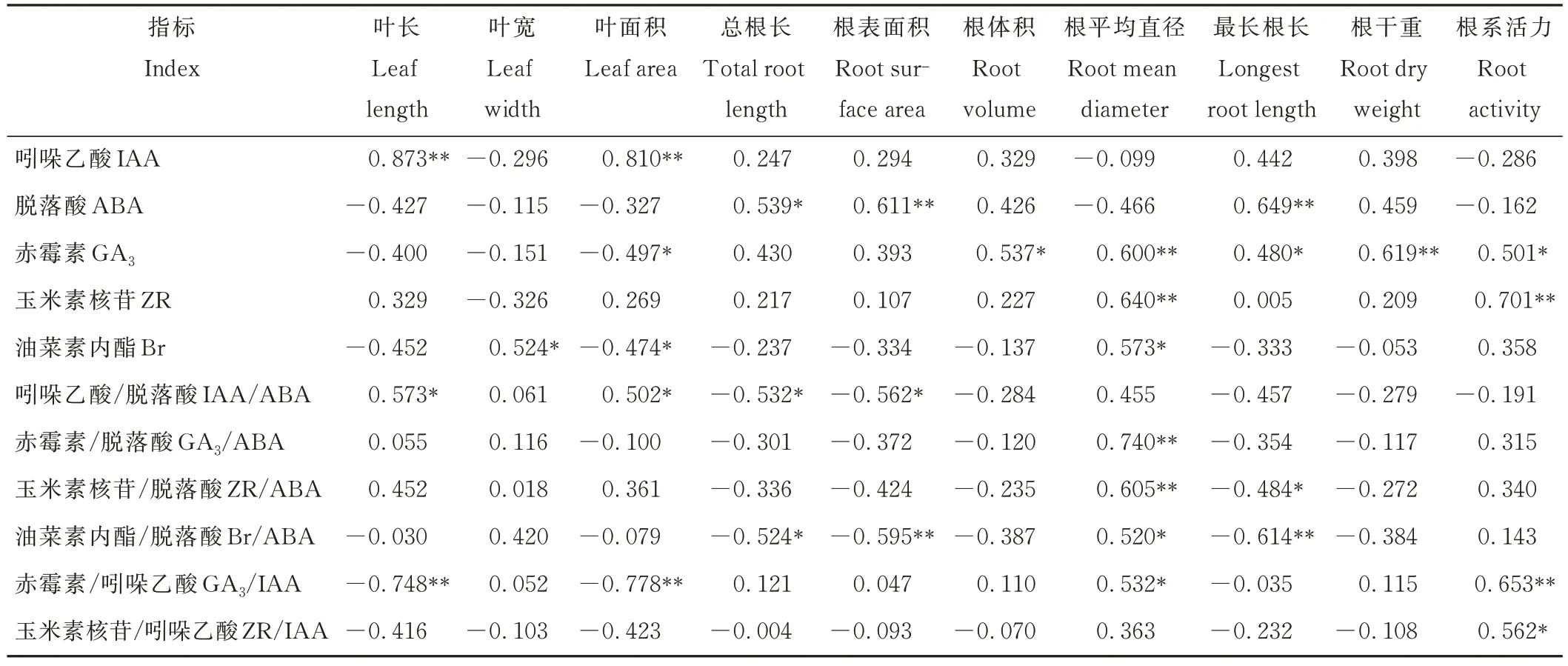
表4 干旱胁迫下狗牙根叶及根形态指标与内源激素及其比例间的相关关系Table 4 Correlation between morphological indexes of C. dactylon leaf and root and endogenous hormones and their proportion under drought stress
对根系形态指标来说,IAA 与根系指标均无显著关系,总根长、根表面积、最长根长与ABA 显著正相关,除了总根长、根表面积,GA3均与其他根系指标显著正相关,ZR 与根平均直径、根系活力显著正相关,Br 仅与根平均直径显著正相关,IAA/ABA 与根表面积、总根长显著负相关,GA3/ABA 仅与根平均直径显著正相关,ZR/ABA 与最长根长显著负相关,与根平均直径显著正相关;Br/ABA 与总根长、根表面积、最长根长显著负相关,与根平均直径显著正相关;GA3/IAA 与根平均直径、根系活力显著正相关;ZR/IAA 仅与根系活力显著正相关。
3 讨论
3.1 干旱胁迫对狗牙根形态建成的影响
植物可以通过改变其形态特征和功能器官对环境胁迫做出应答,这种行为通常被定义为表型可塑性[17],植物可塑性越强,对逆境的适应能力也越强[18]。而植物主要通过叶片进行水分散失,因此,水分亏缺对叶片威胁最大[19],同时,对干旱胁迫响应最直观的体现就是叶片外部形态特征。曹林青等[20]研究认为随着干旱胁迫程度的增加,油茶(Camellia oleifera)叶长、叶宽、叶面积变小,原因可能是干旱胁迫使之水分代谢受到影响,水分亏缺影响叶片细胞正常的生长和分裂,从而导致叶片生长受阻。本研究结果与上述研究结果相同,表现为不同抗旱性的狗牙根在干旱胁迫下其叶长、叶宽、叶面积呈不同程度下降,这是狗牙根为降低蒸腾速率,防止水分散失,更好地适应逆境而在形态上表现出来的反应。另外本研究发现,在干旱胁迫下Tifway 的叶宽无论在MD(21.86%)或是SD(18.88%)时均下降最多,这可能是其具有很强的表型可塑性的一种表现,李永华等[21]的研究也表示叶宽快速变化可降低植物总体水分损失量,还能增强植物叶片在低蒸腾水平下的降温能力。本研究还发现各供试狗牙根在MD 时叶长、叶宽、叶面积的降幅均大于SD,表明狗牙根在受到中等胁迫时,仍具有主动降低其叶面积,减少水分散失以提高水分利用率的能力,但在SD 时,其可能已经失去了主动权。Becklin 等[22]也表示一般在干旱胁迫发生时,植物叶片会首先通过改变形态特征去保持水分,尤其是在中度干旱胁迫下。张怀山等[23]研究表明,在旱作条件下不同苜蓿(Medicago sativa)品种的抗旱性与其叶面积大小有直接关系,叶面积越大其抗旱性越强。本研究结果与之相类似,抗旱材料C118、C138的叶面积均显著大于敏旱材料C10及C32。另外尽管Tifway 的叶面积最小,但其具有比较发达的地下根系系统使得其抗旱性与叶面积关联不大。
植物受到干旱胁迫时,根系首先感受胁迫并发出信号,使整个植株对干旱做出相应响应。当胁迫加剧或胁迫时间持续时,植物根系的形态特征和生理特性将产生变化以适应并缓解干旱,直至发生不可逆的死亡[24]。本研究结果表明,干旱胁迫下各供试狗牙根的总根长、根表面积、根体积、最长根长、根干重均随干旱程度加剧呈增加趋势,这表明干旱下狗牙根的根系可塑性更强,而叶片可塑性相对较弱,说明土壤水分降低刺激了狗牙根的根系发育,并且随着干旱加剧,生物量分配朝着增加根系分配、减小叶片分配的方向进行,这与根、叶形态特征的非对称响应有关[12]。黄海霞等[25]的研究也表明随着土壤水分的减少,植物会减少对非主要功能器官的干物质供给,提高对根系生物量的分配比例来增强对水分的竞争力。另外本研究发现根系平均直径随干旱加剧而下降,这可能是在干旱环境中,狗牙根得不到充足的水资源,光合作用被抑制,仅能获得有限的光合产物,且伸长需求大于增粗需求,故其根系直径减小,将有限的资源用于根系的分化生长,来提高对土壤资源的有效利用,以应对干旱。这与Jongrungklang 等[26]的研究结果一致。根系活力的大小反映根系吸收水分和矿质营养能力的强弱,水分胁迫时会影响根系的吸收能力[27]。本研究结果表明,中度干旱刺激了狗牙根根系活力增加,但在重度干旱时下降,这与王智威等[28]的研究结果一致。这主要是因为植物根系对干旱胁迫的忍耐能力是有限的,超过这个限度后就会对根系造成伤害[29]。另外,本研究发现抗旱、敏旱狗牙根地上地下表型特征对干旱胁迫的响应策略相似,均是以减少地上部生长,将更多的水分、营养分配给根系的生存策略。张翠梅等[30]的研究表明,不同抗旱性苜蓿品种响应策略具有阶段性和侧重点。本研究表明在干旱处理的各个时期,抗旱材料尤其是C138表现出更发达的根系特征,表明抗旱性越强,越离不开发达的根系形态结构。而敏旱材料C32尽管在处理各个时期根系指标值均相对较低,但其随干旱胁迫加剧,根系指标增量程度表现为最大,这可能是由于正常灌溉时,本身根系就不发达的C32可以得到充裕的水分,不用伸长根系去吸水,而干旱胁迫使表层土壤水分亏缺,导致根系不能满足水分需求,而在较湿润的深层土壤内根系生长速率会明显加快。
3.2 干旱胁迫对狗牙根内源激素的影响
植物内源激素是植物生长发育的重要调节物质,在受到干旱胁迫时,通过调控内源激素合成、运输及信号控制产生一系列生理反应,成为植物对干旱胁迫最为敏感的生理活性物质[31]。脱落酸(ABA)是一种胁迫激素,主要由根系产生,其生理作用主要是抑制生长,促进气孔关闭,从而调节植物对环境胁迫的适应[13]。本研究结果表明干旱胁迫增加了供试狗牙根叶片、根系ABA 含量,且敏旱材料C32的叶片、根系ABA 含量在干旱胁迫下尤其是重度胁迫时均显著高于抗旱材料C138,其原因可能是ABA 起初是作为信号分子,诱导和启动狗牙根对干旱胁迫的响应,而其后期效应(重度胁迫)则以促进机体衰老、脱落和抑制生长为主,导致其重度胁迫对C32生长抑制更强。另外,根系ABA 含量高于叶片,这是因为ABA 主要产生于根系。IAA 作为调控植物生长发育的促进类内源激素,在干旱胁迫下,其含量变化在不同植物中较为复杂[13],草地早熟禾(Poa pratensis)IAA 含量在干旱初期升高,随着干旱程度增加而下降[32],对于棉花(Gossypium)来说,干旱程度的增加促进了IAA 含量的积累[33],Man 等[34]则研究表示,干旱胁迫降低了高羊茅(Festuca elata)的IAA 含量。本研究结果显示,干旱胁迫下狗牙根叶片IAA含量无显著变化(C32)或轻微降低(C138),而根系IAA 含量呈增加趋势,表明狗牙根在干旱下通过提高根系IAA 含量促进根系生长,且抗旱材料通过降低叶片生长来适应干旱。对于ZR 含量而言,各处理下C32的叶片ZR 含量无显著变化,C138则在MD 显著下降,SD 又上升到与CK 无显著差异;而两份狗牙根根系ZR 含量总体呈先增后降趋势,但中、重度胁迫下C138含量显著高于C32,这与敖红等[35]的研究结果一致,表明由于根系受到胁迫,使得根系ZR合成减少,且C138在干旱下具有更强的细胞分裂能力,促进根系继续生长。GA3在促进植株的伸长生长、叶片分化等方面具有重要作用,但其在干旱下含量变化不一。Christine 等[36]研究发现干旱能引起GA3含量降低,满达等[37]则研究表示干旱胁迫下差巴嘎蒿(Artemisia halodendron)的GA3含量显著增加。本研究结果表明C32叶片GA3含量呈先增后减,根系GA3含量下降,而C138叶、根均呈先降后增趋势,且在SD 时C138叶、根GA3含量均显著大于C32。这表明,在重度缺水条件下,C32由于受害较重,叶片生长抑制显著,而C138因水分含量更高而还能维持一定的叶片生长能力。Br 属甾醇类植物激素,是被公认的活性强的植物生长调节类物质,在很低的浓度下就对植物表现出很强的生理生化效应[38],并且Br 能够促进细胞的伸长与分裂,提高植物的光合作用,增强抗旱性[39]。本研究结果显示,干旱胁迫降低了C32的叶、根Br 含量,且在SD 时下降尤为明显,而C138根系Br 含量尽管也呈下降趋势,但SD 时较C32显著增加20.82%,叶片Br 含量尽管在CK、MD 时显著低于C32,但在SD 上升,致使与C32叶片含量无差异。对C32来讲,干旱胁迫严重损伤了其机体,导致叶、根Br 含量严重下降,选择用降低光合作用、抑制生长来应对干旱,而C138在干旱下受害相对较轻,根系含量下降较少,且在SD 时激发了其叶片Br 含量增加,来提高光合速率,促进根系伸长、分化,加强水分吸收以抵御干旱。
另外,Lenoble 等[40]研究表明,植物受到干旱胁迫时,随着内源激素含量变化,内源激素间的比例也随之发生变化,即内源激素平衡被打破,并通过复杂的方式来应对干旱逆境。张世英等[41]研究显示中华金叶榆(Ulmus pumila)在干旱胁迫下较CK,其ZR/ABA、GA/ABA、IAA/ABA 逐渐降低,且降幅较大,表明中华金叶榆主要通过抑制自身生长发育来降低干旱胁迫伤害。本试验结果表明干旱胁迫下C32的叶、根ZR/ABA、GA3/ABA、IAA/ABA、Br/ABA 均逐渐降低,这与宋吉轩等[42]的研究结果一致。而C138的叶、根此类比值变化不一,有的降低,但降低的相对较少,有的先降低后增高,有的在干旱梯度下无显著变化。这表明随着干旱程度增加,C32通过增加叶、根中的ABA 含量去促进气孔关闭,减少蒸发,改变IAA、GA3含量促进地下部生长,抑制地上部生长,同时减少ZR 含量使得细胞分裂素向地上部分输送受阻,也会抑制地上部生长,另外降低Br 含量去抑制细胞分裂,降低光合作用,从而达到增强抗旱性的目的,所以这就导致此类比值逐渐降低,同时也表明C32在应对干旱胁迫时主要采用抑制自身生长发育来尽可能地降低干旱伤害。而C138的此类比值受干旱影响较小,甚至在SD 时叶片GA3/ABA、ZR/ABA 显著上升,表明重度干旱下其仍能通过增加GA3、ZR 含量来维持一定的地下地上生长及细胞分裂。另外,C138在MD,尤其是SD 时此类比值均显著大于C32,表明抗旱性强的狗牙根此类内源激素的比值相对较高。这与袁娅娟等[43]的研究结果相似,即IAA/ABA 降低越多越不利于根系生长发育、ZR/ABA 降低越多越不利于分蘖成活。
3.3 干旱胁迫下狗牙根表型特征与内源激素的关系
植物内源激素不仅能通过调节自身含量调控植物发育,同时也能通过不同激素间的比例平衡来影响植物的形态建成[44]。本研究结果显示,干旱下IAA、IAA/ABA 与叶长、叶面积密切相关,这与前人研究结果相似[45]。ABA 与总根长、根表面积、最长根长有显著正相关关系,这是由于ABA 主要是由根部产生,其生理作用不光是促进植物休眠、抑制生长,并且还起到促进气孔关闭和促进根系水分吸收的作用[46]。除总根长、根表面积外,GA3与其他根系指标均有显著正相关关系,表明干旱下根系加速分化,增强了吸水能力。陈晓娜等[7]研究也表明白刺(Nitraria tangutorum)根系体积与GA3呈显著正相关,而GA3与根表面积无显著关系。ZR 与根平均直径、根系活性显著正相关,SD 时,ZR 含量降低是导致根平均直径、根系活性减少的原因之一,这与王金强等[9]的研究结果相一致。Br 与叶宽、根平均直径显著正相关,这表明Br 不光有促进细胞伸长与分裂的作用,还很可能在狗牙根叶、根横向发育方面起着重要作用。IAA/ABA 与叶长、叶面积显著正相关,而与总根长、根表面积显著负相关,GA3/IAA 与叶长、叶面积显著负相关,而与根平均直径、根系活力显著正相关,这均从侧面表明了狗牙根叶、根在干旱胁迫下选择了相反的生存策略,即促进地下部生长,抑制地上部生长。GA3/ABA、ZR/ABA、Br/ABA 均与根平均直径显著正相关,ZR/IAA 仅与根系活力显著正相关,这是由于这些促进类激素与之存在密切的关系导致。
4 结论
1)干旱胁迫降低了供试狗牙根的叶长、叶宽、叶面积、根平均直径,促进了根部生长发育。抗旱性强的狗牙根表现出相对较大的叶面积、更发达的根系系统,吸水能力更强,适应干旱能力也越强。
2)干旱胁迫促进了狗牙根叶、根抑制类激素ABA 含量,降低了促进类激素IAA、GA3、ZR、Br 含量,抗旱材料在干旱下表现出相对较低的ABA 增量,以及相对较低的促进类激素减量,另外抗旱狗牙根具有相对较高的ZR/ABA、GA3/ABA、IAA/ABA、Br/ABA,表明狗牙根可通过改变内源激素间的比例来适应干旱胁迫环境。
3)ABA 与总根长、根表面积、最长根长显著正相关,表明ABA 含量越高,根系越发达,Br 与叶宽、根平均直径有显著正相关,可能在调节狗牙根叶、根横向发育方面起着重要作用,IAA/ABA、GA3/IAA 与叶长、叶面积呈显著正、负相关,而与总根长、根表面积指标呈负、正相关,表明了狗牙根叶、根在干旱胁迫下选择了相反的生存策略。

